人教版高中化学必修第一册第三章铁金属材料第二节第2课时物质的量在化学方程式计算中的应用课件(38页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第三章铁金属材料第二节第2课时物质的量在化学方程式计算中的应用课件(38页ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 09:11:20 | ||
图片预览











文档简介
(共38张PPT)
第2课时
物质的量在化学方程式计算中的应用
第三章 第二节 金属材料
学习目标
1.能从物质的量的角度认识物质的组成及化学变化,能运用物质的量与
其他物理量之间的换算关系进行有关计算。
2.能运用物质的量进行化学方程式中的相关计算。
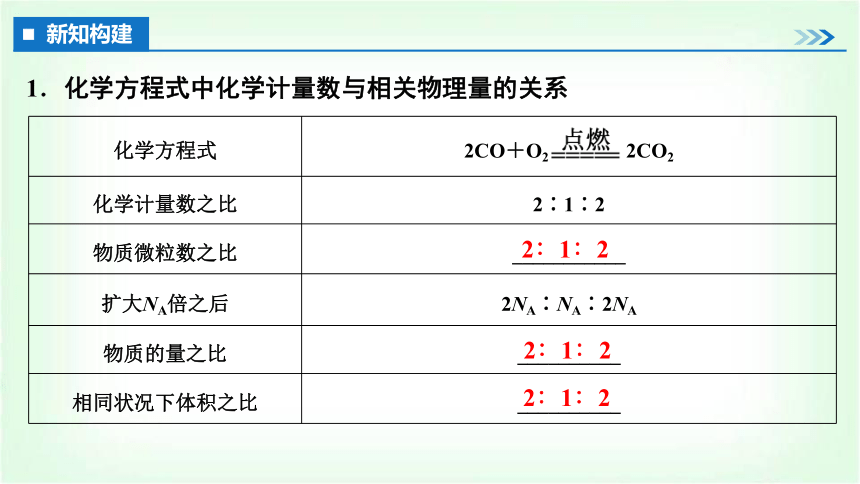
任务一 根据化学方程式计算
化学方程式 2CO+O2 2CO2
化学计量数之比 2∶1∶2
物质微粒数之比 ___________
扩大NA倍之后 2NA∶NA∶2NA
物质的量之比 __________
相同状况下体积之比 __________
新知构建
1.化学方程式中化学计量数与相关物理量的关系
2∶1∶2
2∶1∶2
2∶1∶2
归纳总结
1.化学方程式中各物质的化学计量数之比等于其粒子数目之比,
等于其物质的量之比。
2.对于有气体参加的反应,在同温同压下各气体的化学计量数之
比等于其体积之比。
2.构建“已知量、未知量均以物质的量”的解题模型
在标准状况下,5.4 g铝与足量NaOH溶液反应生成氢气的体积是
多少?
答:标准状况下生成氢气体积是6.72 L。
典例1
3.构建“已知量、未知量单位不一致”的解题模型
医疗上颇为流行的“理疗特效热”,就是利用铁缓慢氧化放出均匀、稳定的热,使患处保持温热状态。若56 g铁粉完全氧化成氧化铁,则需要消耗标准状况下氧气的体积为多少?
答:需要消耗标准状况下氧气的体积为16.8 L。
典例2
归纳总结
物质的量应用于化学方程式计算的基本步骤
典题应用
Fe和CuSO4溶液反应,若反应后溶液的体积为1 L,生成的铜的质量为32 g。
(1)计算反应消耗的Fe的质量。
答案:28 g;
反应消耗的Fe的质量m(Fe)=0.5 mol×56 g·mol-1=28 g;
(2)计算反应后溶液中FeSO4的物质的量浓度。
答案: 0.5 mol·L-1
特别提醒
1.书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
2.单位运用对应化:根据化学方程式计算时,如果题目所给的两个量单位不一致,要注意两个量的单位要“上下一致,左右
相当”。
返回
任务二 化学计算中的关系式法
新知构建
1.利用化学方程式构建关系式的解题模型
把一定量的CO还原Fe2O3生成的CO2通入到澄清石灰水中,得10 g沉淀,计算参加反应的CO的质量。
答:参加反应的CO的质量为2.8 g。
典例1
归纳总结
当已知量和未知量之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。
(1)根据化学方程式确定关系式:写出发生反应的化学方程式,根据量的关系写出关系式。
(2)根据原子守恒确定关系式。
2.利用“守恒”构建关系式的解题模型
模型 反应前后元素种类、质量、原子个数不变。
4.6 g钠在空气中久置,计算最终得到Na2CO3的质量。
解:钠在空气中最终转化为Na2CO3的过程中钠的原子个数不变,可得关系式:
2Na ~ Na2CO3
2×23 106
4.6 g m(Na2CO3)
答:最终得到Na2CO3的质量为10.6g。
典例2
返回
随堂达标演练
√
1.标准状况下,3.25 g锌与足量的盐酸反应生成x L氢气,下列比例式正确的是
A.Zn+2HCl===ZnCl2+H2↑
1 mol 1 mol
3.25 g x L
D.Zn+2HCl===ZnCl2+H2↑
65 g 1 mol
3.25 g x L
B.Zn+2HCl===ZnCl2+H2↑
65 g 1 L
3.25 g x L
C.Zn+2HCl===ZnCl2+H2↑
1 mol 22.4 L
0.05 mol x L
比例式应注意单位要“上下一致,左右对应”。
√
2.0.56 g氧化钙恰好与20 mL盐酸反应,则此盐酸的物质的量浓度是
A.0.10 mol·L-1 B.0.20 mol·L-1
C.0.50 mol·L-1 D.1.00 mol·L-1
3.向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,试计算:
(1)溶液中NaOH的物质的量浓度;
答:溶液中NaOH的物质的量浓度为0.8 mol·L-1;
(2)在标准状况下生成H2的体积。
答:在标准状况下生成H2的体积为13.44 L。
答:原饱和溶液中CuSO4的物质的量浓度为0.125 mol·L-1。
返回
课时测评
√
题点一 应用化学方程式计算
1.物质在发生化学反应时
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量之比等于方程式中化学计量数之比
D.它们的物质的量之比等于方程式中化学计量数之比
化学方程式中各物质的化学计量数之比等于其物质的量之比。
√
2.一块表面被氧化的钠的质量是10.8 g,投入水中,完全反应得到标准状况下的氢气 0.2 g,则原钠块中被氧化的钠的质量是
A.4.6 g B.6.2 g
C.7.8 g D.9.2 g
√
3.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液的浓度为
A.1.0 mol·L-1 B.2.0 mol·L-1
C.1.5 mol·L-1 D.3.0 mol·L-1
√
题点二 应用关系式法计算
4.向200 mL 0.1 mol·L-1的FeSO4溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为
A.4.36 g B.2.82 g C.1.6 g D.1.44 g
√
5.向Fe2O3和铁屑的混合物中加入足量的稀硫酸至固体完全溶解,所得溶液中不含Fe3+,而产生的Fe2+和H2的物质的量之比为4∶1,则原混合物中Fe2O3和Fe的物质的量之比为
A.1∶1 B.2∶1 C.1∶2 D.1∶3
设原混合物中含有x mol Fe,y mol Fe2O3,由化学方程式Fe2O3+3H2SO4===Fe2(SO4)3+3H2O和Fe2(SO4)3+Fe===3FeSO4得到Fe2O3~Fe2(SO4)3~Fe~3FeSO4,可见y mol的Fe2O3参加反应转化为3y mol FeSO4,同时消耗y mol的Fe;又由Fe+H2SO4===FeSO4+H2↑可知,(x-y) mol的Fe与硫酸反应产生(x-y) mol的FeSO4和(x-y) mol H2;则有[3y mol+(x-y) mol]∶(x-y) mol=4∶1,整理得y∶x=1∶2,故合理选项是C。
√
A.24.32 kg B.30.00 kg
C.25.30 kg D.4.08 kg
√
7.21 g铁粉与8 g硫粉混合加热,若不考虑其他损失,可生成硫化亚铁的质量为
A.33 g B.24 g C.29 g D.22 g
√
8.(2023·洛阳高一期末)标准状况下,将钠、镁各0.3 mol分别放入100 mL 1 mol·L-1的硫酸中,反应产生的气体体积之比是
A.1∶1 B.2∶3 C.3∶2 D.2∶1
钠能与H2SO4反应,也能与水反应放出H2,根据关系式:2Na~H2,则得到0.15 mol H2;镁与H2SO4反应放出H2,但与水不反应,根据关系式:Mg~H2~H2SO4,0.3 mol Mg与100 mL 1 mol·L-1 H2SO4反应,H2SO4不足,产生0.1 mol H2,则产生的H2的体积之比是0.15∶0.1=3∶2,故选C项。
√
9.(2023·成都高一月考)将1.12 g铁粉加入25 mL 2 mol·L-1氯化铁溶液中充分反应(忽略溶液体积变化),下列分析正确的是
A.铁粉有剩余
B.Cl-浓度减小
C.向溶液中滴入KSCN溶液,溶液变红色
D.溶液质量增加5.6 g
(1)原混合物中碳酸钠的质量是________ g。
10.6
(2)在剩余固体中,加入过量盐酸,反应后放出二氧化碳的体积(标准状况)为________ L。
3.36
2.24 L
7.3 g
返回
第2课时
物质的量在化学方程式计算中的应用
第三章 第二节 金属材料
学习目标
1.能从物质的量的角度认识物质的组成及化学变化,能运用物质的量与
其他物理量之间的换算关系进行有关计算。
2.能运用物质的量进行化学方程式中的相关计算。
任务一 根据化学方程式计算
化学方程式 2CO+O2 2CO2
化学计量数之比 2∶1∶2
物质微粒数之比 ___________
扩大NA倍之后 2NA∶NA∶2NA
物质的量之比 __________
相同状况下体积之比 __________
新知构建
1.化学方程式中化学计量数与相关物理量的关系
2∶1∶2
2∶1∶2
2∶1∶2
归纳总结
1.化学方程式中各物质的化学计量数之比等于其粒子数目之比,
等于其物质的量之比。
2.对于有气体参加的反应,在同温同压下各气体的化学计量数之
比等于其体积之比。
2.构建“已知量、未知量均以物质的量”的解题模型
在标准状况下,5.4 g铝与足量NaOH溶液反应生成氢气的体积是
多少?
答:标准状况下生成氢气体积是6.72 L。
典例1
3.构建“已知量、未知量单位不一致”的解题模型
医疗上颇为流行的“理疗特效热”,就是利用铁缓慢氧化放出均匀、稳定的热,使患处保持温热状态。若56 g铁粉完全氧化成氧化铁,则需要消耗标准状况下氧气的体积为多少?
答:需要消耗标准状况下氧气的体积为16.8 L。
典例2
归纳总结
物质的量应用于化学方程式计算的基本步骤
典题应用
Fe和CuSO4溶液反应,若反应后溶液的体积为1 L,生成的铜的质量为32 g。
(1)计算反应消耗的Fe的质量。
答案:28 g;
反应消耗的Fe的质量m(Fe)=0.5 mol×56 g·mol-1=28 g;
(2)计算反应后溶液中FeSO4的物质的量浓度。
答案: 0.5 mol·L-1
特别提醒
1.书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
2.单位运用对应化:根据化学方程式计算时,如果题目所给的两个量单位不一致,要注意两个量的单位要“上下一致,左右
相当”。
返回
任务二 化学计算中的关系式法
新知构建
1.利用化学方程式构建关系式的解题模型
把一定量的CO还原Fe2O3生成的CO2通入到澄清石灰水中,得10 g沉淀,计算参加反应的CO的质量。
答:参加反应的CO的质量为2.8 g。
典例1
归纳总结
当已知量和未知量之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。
(1)根据化学方程式确定关系式:写出发生反应的化学方程式,根据量的关系写出关系式。
(2)根据原子守恒确定关系式。
2.利用“守恒”构建关系式的解题模型
模型 反应前后元素种类、质量、原子个数不变。
4.6 g钠在空气中久置,计算最终得到Na2CO3的质量。
解:钠在空气中最终转化为Na2CO3的过程中钠的原子个数不变,可得关系式:
2Na ~ Na2CO3
2×23 106
4.6 g m(Na2CO3)
答:最终得到Na2CO3的质量为10.6g。
典例2
返回
随堂达标演练
√
1.标准状况下,3.25 g锌与足量的盐酸反应生成x L氢气,下列比例式正确的是
A.Zn+2HCl===ZnCl2+H2↑
1 mol 1 mol
3.25 g x L
D.Zn+2HCl===ZnCl2+H2↑
65 g 1 mol
3.25 g x L
B.Zn+2HCl===ZnCl2+H2↑
65 g 1 L
3.25 g x L
C.Zn+2HCl===ZnCl2+H2↑
1 mol 22.4 L
0.05 mol x L
比例式应注意单位要“上下一致,左右对应”。
√
2.0.56 g氧化钙恰好与20 mL盐酸反应,则此盐酸的物质的量浓度是
A.0.10 mol·L-1 B.0.20 mol·L-1
C.0.50 mol·L-1 D.1.00 mol·L-1
3.向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,试计算:
(1)溶液中NaOH的物质的量浓度;
答:溶液中NaOH的物质的量浓度为0.8 mol·L-1;
(2)在标准状况下生成H2的体积。
答:在标准状况下生成H2的体积为13.44 L。
答:原饱和溶液中CuSO4的物质的量浓度为0.125 mol·L-1。
返回
课时测评
√
题点一 应用化学方程式计算
1.物质在发生化学反应时
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量之比等于方程式中化学计量数之比
D.它们的物质的量之比等于方程式中化学计量数之比
化学方程式中各物质的化学计量数之比等于其物质的量之比。
√
2.一块表面被氧化的钠的质量是10.8 g,投入水中,完全反应得到标准状况下的氢气 0.2 g,则原钠块中被氧化的钠的质量是
A.4.6 g B.6.2 g
C.7.8 g D.9.2 g
√
3.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液的浓度为
A.1.0 mol·L-1 B.2.0 mol·L-1
C.1.5 mol·L-1 D.3.0 mol·L-1
√
题点二 应用关系式法计算
4.向200 mL 0.1 mol·L-1的FeSO4溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为
A.4.36 g B.2.82 g C.1.6 g D.1.44 g
√
5.向Fe2O3和铁屑的混合物中加入足量的稀硫酸至固体完全溶解,所得溶液中不含Fe3+,而产生的Fe2+和H2的物质的量之比为4∶1,则原混合物中Fe2O3和Fe的物质的量之比为
A.1∶1 B.2∶1 C.1∶2 D.1∶3
设原混合物中含有x mol Fe,y mol Fe2O3,由化学方程式Fe2O3+3H2SO4===Fe2(SO4)3+3H2O和Fe2(SO4)3+Fe===3FeSO4得到Fe2O3~Fe2(SO4)3~Fe~3FeSO4,可见y mol的Fe2O3参加反应转化为3y mol FeSO4,同时消耗y mol的Fe;又由Fe+H2SO4===FeSO4+H2↑可知,(x-y) mol的Fe与硫酸反应产生(x-y) mol的FeSO4和(x-y) mol H2;则有[3y mol+(x-y) mol]∶(x-y) mol=4∶1,整理得y∶x=1∶2,故合理选项是C。
√
A.24.32 kg B.30.00 kg
C.25.30 kg D.4.08 kg
√
7.21 g铁粉与8 g硫粉混合加热,若不考虑其他损失,可生成硫化亚铁的质量为
A.33 g B.24 g C.29 g D.22 g
√
8.(2023·洛阳高一期末)标准状况下,将钠、镁各0.3 mol分别放入100 mL 1 mol·L-1的硫酸中,反应产生的气体体积之比是
A.1∶1 B.2∶3 C.3∶2 D.2∶1
钠能与H2SO4反应,也能与水反应放出H2,根据关系式:2Na~H2,则得到0.15 mol H2;镁与H2SO4反应放出H2,但与水不反应,根据关系式:Mg~H2~H2SO4,0.3 mol Mg与100 mL 1 mol·L-1 H2SO4反应,H2SO4不足,产生0.1 mol H2,则产生的H2的体积之比是0.15∶0.1=3∶2,故选C项。
√
9.(2023·成都高一月考)将1.12 g铁粉加入25 mL 2 mol·L-1氯化铁溶液中充分反应(忽略溶液体积变化),下列分析正确的是
A.铁粉有剩余
B.Cl-浓度减小
C.向溶液中滴入KSCN溶液,溶液变红色
D.溶液质量增加5.6 g
(1)原混合物中碳酸钠的质量是________ g。
10.6
(2)在剩余固体中,加入过量盐酸,反应后放出二氧化碳的体积(标准状况)为________ L。
3.36
2.24 L
7.3 g
返回
