人教版高中化学必修第一册第三章铁金属材料专题突破四铁的“价—类”二维图课件(31页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第三章铁金属材料专题突破四铁的“价—类”二维图课件(31页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 09:14:21 | ||
图片预览











文档简介
(共31张PPT)
专题突破四 铁的“价—类”二维图
第三章 铁 金属材料
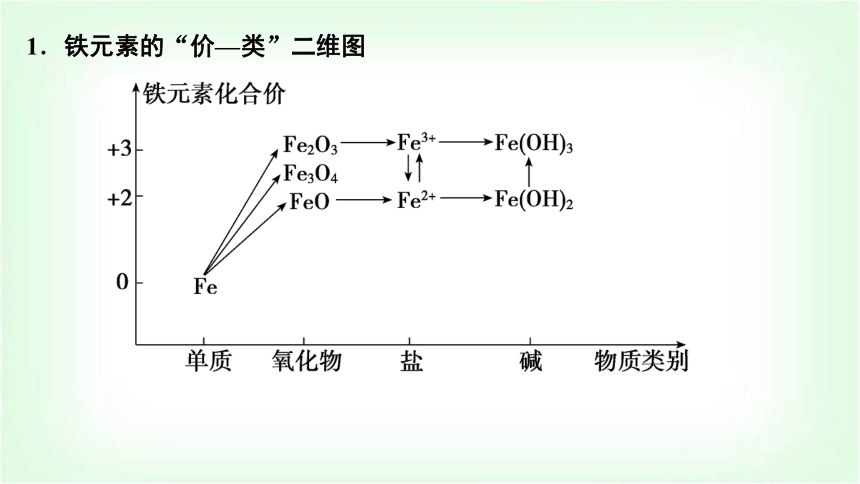
1.铁元素的“价—类”二维图
2.从物质分类的角度理解铁及其化合物的性质
(1)Fe2O3、FeO是____氧化物,分别溶于稀硫酸反应的离子方程式:
___________________________________;
___________________________________。
(2)Fe(OH)2和Fe(OH)3属于____,分别溶于稀盐酸反应的离子方程式:
_____________________________________;
_____________________________________。
(3)FeCl2、Fe2(SO4)3都属于__,能和碱发生反应生成氢氧化物沉淀。如:
FeCl2+2NaOH===_____________________;
Fe2(SO4)3+6NaOH===_________________________。
碱性
Fe2O3+6H+===2Fe3++3H2O
FeO+2H+===H2O+Fe2+
碱
Fe(OH)2+2H+===Fe2++2H2O
Fe(OH)3+3H+===Fe3++3H2O
盐
Fe(OH)2↓+2NaCl
2Fe(OH)3↓+3Na2SO4
氧化
针对练1.将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液含有的大量的阳离子是
A.Cu2+和Fe2+ B.H+和Cu2+
C.Fe3+和Fe2+ D.Fe2+和Mg2+
铁粉有剩余,说明一定没有Fe3+、Cu2+和氢离子,而溶液中的镁离子不会和铁单质发生反应,则溶液中含有的阳离子是Fe2+和Mg2+。
√
针对练2.物质类别和元素价态是学习元素及其化合物性质的重要认识视角。如图为铁及其化合物的“价—类”二维图。下列有关说法不正确的是
A.物质A与不同的氧化剂反应可能得到不同价态的含铁化合物
B.通过化合反应和置换反应都能生成Fe3O4
C.从物质类别来看,物质B属于碱性氧化物,能与水反应生成物质C
D.从元素价态来看,Fe2+既具有氧化性又具有还原性
√
课时测评
√
1.下列离子方程式正确的是
A.氧化铁与盐酸反应:Fe2O3+6H+===2Fe2++3H2O
B.Fe与FeCl3溶液反应:Fe+Fe3+===2Fe2+
C.Fe与盐酸反应:Fe+2H+===Fe2++H2↑
D.Fe与CuSO4溶液反应:Fe+Cu2+===Fe3++Cu
氧化铁与盐酸反应生成氯化铁和水,正确的离子方程式为Fe2O3+6H+===2Fe3++3H2O,故A错误;Fe与FeCl3溶液反应生成氯化亚铁,正确的离子方程式为Fe+2Fe3+===3Fe2+,故B错误;Fe与盐酸反应生成氯化亚铁和氢气,反应的离子方程式为Fe+2H+===Fe2++H2↑,故C正确;Fe与CuSO4溶液反应生成硫酸亚铁和铜,正确的离子方程式为Fe+Cu2+===Fe2++Cu,故D错误。
√
√
铁离子可以和碱之间反应生成氢氧化亚铁,生成的氢氧化亚铁极易被氧化,然后迅速变为氢氧化铁,所以向含有Fe2+的溶液中加入氢氧化钠溶液,先产生白色沉淀,后迅速变为灰绿色,最后变为红褐色,则溶液中一定含有Fe2+。
√
4.将适量铁粉放入氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比是
A.2∶3 B.3∶2 C.1∶2 D.1∶1
√
5.在Fe2(SO4)3溶液中,加入a g铜,完全溶解后,再加b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是
A.残余固体是铜和铁
B.最后得到的溶液中一定含有Cu2+
C.将残余固体加入到稀H2SO4中,有气泡产生
D.最后得到的溶液中可能含有Fe3+
6.为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是
选项 实验操作 实验现象 离子方程式 实验结论
A 在氯化亚铁溶液中滴加新制氯水 浅绿色溶液变成棕
黄色溶液 2Fe2++Cl2===2Fe3++2Cl- Fe2+具
有还原性
B 在氯化亚铁溶液中加入锌片 浅绿色溶液变成无
色溶液 Fe2++Zn===Fe+Zn2+ Fe2+具
有还原性
C 在氯化铁溶液中加入铁粉 棕黄色溶液变成浅
绿色溶液 Fe3++Fe===2Fe+ 铁单质具
有还原性
D 在氯化铁溶液中加入铜粉 蓝色溶液变成棕黄
色溶液 2Fe3++Cu===2Fe2++Cu2+ Fe3+具
有氧化性
√
氯气能够将Fe2+(浅绿色)氧化为Fe3+(棕黄色),A项正确;B项得到的结论应该是Fe2+具有氧化性;C项的离子方程式错误;D项的实验现象应该是铜粉逐渐溶解,溶液由棕黄色变为蓝色。
√
7.化合价和物质类别是整理元素及化合物知识的两个要素,可表示为“价—类”二维图。铁元素的“价—类”二维图如图所示,下列说法正确的是
A.维生素C能将Fe3+转化为Fe2+,该过程中维生素C被还原
B.Fe3O4中铁元素为+4价
C.工业上用CO还原Fe2O3炼铁,该反应为复分解反应
D.Fe(OH)2浊液露置于空气中,最终变成红褐色
将Fe3+转化为Fe2+,Fe元素发生还原反应,可知维生素C表现还原性,作还原剂,被氧化,故A错误;Fe3O4中铁的化合价有+2、+3价,由化合物中各元素化合价代数和为0可知Fe3O4中铁的化合价为两个铁原子显+3价,一个铁原子显+2价,故B错误;工业上用CO还原Fe2O3炼铁,反应中有元素的化合价变化,不是复分解反应,故C错误;Fe(OH)2浊液露置于空气中,白色迅速变为灰绿色,最后变为红褐色,故D正确。
√
还原性:I->Fe2+>Cl->Mn2+,A正确;还原性:I->Fe2+,故通入氯气时,碘离子先被氧化,即3Cl2+6FeI2===2FeCl3+4FeI3不能发生,B正确;还原性:I->Fe2+>Cl-,故要氧化I-而不氧化Fe2+和Cl-,可以加入FeCl3,C正确;由信息①可知,氯离子也可以被酸性高锰酸钾溶液氧化,使其褪色,故若紫色褪去,则溶液中也可能没有二价铁,可能含有氯离子,D错误。
√
9.已知A为常见的金属单质,根据如图所示的关系:
下列叙述正确的是
A.A为Fe,B为FeO
B.C→D溶液的颜色变化:由浅绿色到棕黄色
C.④的离子方程式:Fe+Fe3+===2Fe2+
D.⑤的离子方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3
√
10.裂解水制氢气的过程如下图所示。下列说法不正确的是
A.反应Ⅰ的化学方程式是Fe3O4+CO===3FeO+CO2
B.反应Ⅱ的化学方程式是3FeO+H2O(g)===Fe3O4+H2
C.总反应的化学方程式是C+2H2O(g)===CO2+2H2
D.铁的氧化物是裂解水的催化剂
反应Ⅰ的反应物是Fe3O4、CO,生成物是FeO、CO2,则根据得失电子守恒、原子守恒,可得该反应的化学方程式是Fe3O4+CO===3FeO+CO2,A正确;反应Ⅱ的反应物是FeO、H2O(g),生成物是Fe3O4、H2,则反应Ⅱ的化学方程式是3FeO+H2O(g)===Fe3O4+H2,B正确;反应Ⅲ的反应物是CO2、C,生成物是CO,反应方程式为CO2+C===2CO,将反应Ⅰ+Ⅱ+Ⅲ,整理可得化学方程式为:
C+H2O(g) CO+H2,C错误;铁的氧化物Fe3O4、FeO参与反应,但总反应为C+H2O(g) CO+H2,生成物没有Fe3O4、FeO,所以铁的氧化物是裂解水的催化剂,D正确。
11.(2023·山东聊城高一上期末)利用废旧镀锌铁皮制备Fe3O4胶体粒子的流程图如图,已知:Zn溶于强碱时生成可溶于水的[Zn(OH)4]2-。下列有关说法正确的是
A.Fe3O4是碱性氧化物,是具有磁性的黑色晶体
B.滤液中存在的离子有Na+、[Zn(OH)4]2-、OH-
C.“酸溶”的离子方程式为Fe(OH)3+3H+===Fe3++H2O
D.“氧化”的目的是将Fe2+全部氧化为Fe3+
√
Fe3O4是一种复杂的化合物,是具有磁性的黑色晶体,不是碱性氧化物,故A错误;Zn溶于强碱时生成可溶于水的[Zn(OH)4]2-,Fe与NaOH溶液不反应,则滤液含过量NaOH,存在的离子有Na+、[Zn(OH)4]2-、OH-,故B正确;“酸溶”的离子方程式为Fe+2H+===Fe2++H2↑,故C错误;由流程可知,过氧化氢只氧化部分亚铁离子,故D错误。
12.实验室有FeCl3、CuCl2、FeCl2的混合溶液,其中Fe3+、Cu2+和Fe2+的物质的量之比为3∶2∶1。
(1)现加入适量铁粉,请写出溶液中可能发生的离子反应:_____________
__________________________________。
3Fe2+、 Fe+Cu2+===Fe2++Cu
Fe+2Fe3+===
把Fe加入FeCl3、CuCl2、FeCl2的混合溶液中,可能发生两个反应:2Fe3++Fe===3Fe2+、Fe+Cu2+===Fe2++Cu。
(2)当向混合液中加入铁粉时,首先与铁粉发生反应的离子是________。
由于2Fe3++Cu===2Fe2++Cu2+,氧化性:Fe3+>Cu2+>Fe2+,加入铁粉后氧化性最强的Fe3+优先反应。
Fe3+
(3)加入适量铁粉后,最后溶液中Fe3+、Cu2+和Fe2+的物质的量之比变为1∶2∶4,则参加反应的铁粉与原溶液中Fe2+的物质的量之比为________。
Fe3+、Cu2+、Fe2+的物质的量之比由3∶2∶1变为1∶2∶4,显然Fe3+有剩余,Cu2+不参加反应。若Fe3+由3 mol变为1 mol,据2Fe3++Fe===3Fe2+可知参加反应的铁为1 mol,所以参加反应的铁粉与原溶液中的Fe2+的物质的量之比为1∶1。
1∶1
双氧水具有氧化性,酸性条件下能将Fe2+氧化为Fe3+,则②中反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。
13.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有_____(填离子符号)。
(2)操作②中反应的离子方程式:____________________________________。
Fe3+
2Fe2++H2O2+2H+===2Fe3++2H2O
(3)操作④中一系列处理的操作步骤:过滤、________、灼烧、_________
_________、称量。
步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,即过滤、洗涤、灼烧、冷却至室温、称量。
洗涤
至室温
冷却
(4)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为_______
_______________________________g(用含a的代数式表示)。
0.07a
专题突破四 铁的“价—类”二维图
第三章 铁 金属材料
1.铁元素的“价—类”二维图
2.从物质分类的角度理解铁及其化合物的性质
(1)Fe2O3、FeO是____氧化物,分别溶于稀硫酸反应的离子方程式:
___________________________________;
___________________________________。
(2)Fe(OH)2和Fe(OH)3属于____,分别溶于稀盐酸反应的离子方程式:
_____________________________________;
_____________________________________。
(3)FeCl2、Fe2(SO4)3都属于__,能和碱发生反应生成氢氧化物沉淀。如:
FeCl2+2NaOH===_____________________;
Fe2(SO4)3+6NaOH===_________________________。
碱性
Fe2O3+6H+===2Fe3++3H2O
FeO+2H+===H2O+Fe2+
碱
Fe(OH)2+2H+===Fe2++2H2O
Fe(OH)3+3H+===Fe3++3H2O
盐
Fe(OH)2↓+2NaCl
2Fe(OH)3↓+3Na2SO4
氧化
针对练1.将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液含有的大量的阳离子是
A.Cu2+和Fe2+ B.H+和Cu2+
C.Fe3+和Fe2+ D.Fe2+和Mg2+
铁粉有剩余,说明一定没有Fe3+、Cu2+和氢离子,而溶液中的镁离子不会和铁单质发生反应,则溶液中含有的阳离子是Fe2+和Mg2+。
√
针对练2.物质类别和元素价态是学习元素及其化合物性质的重要认识视角。如图为铁及其化合物的“价—类”二维图。下列有关说法不正确的是
A.物质A与不同的氧化剂反应可能得到不同价态的含铁化合物
B.通过化合反应和置换反应都能生成Fe3O4
C.从物质类别来看,物质B属于碱性氧化物,能与水反应生成物质C
D.从元素价态来看,Fe2+既具有氧化性又具有还原性
√
课时测评
√
1.下列离子方程式正确的是
A.氧化铁与盐酸反应:Fe2O3+6H+===2Fe2++3H2O
B.Fe与FeCl3溶液反应:Fe+Fe3+===2Fe2+
C.Fe与盐酸反应:Fe+2H+===Fe2++H2↑
D.Fe与CuSO4溶液反应:Fe+Cu2+===Fe3++Cu
氧化铁与盐酸反应生成氯化铁和水,正确的离子方程式为Fe2O3+6H+===2Fe3++3H2O,故A错误;Fe与FeCl3溶液反应生成氯化亚铁,正确的离子方程式为Fe+2Fe3+===3Fe2+,故B错误;Fe与盐酸反应生成氯化亚铁和氢气,反应的离子方程式为Fe+2H+===Fe2++H2↑,故C正确;Fe与CuSO4溶液反应生成硫酸亚铁和铜,正确的离子方程式为Fe+Cu2+===Fe2++Cu,故D错误。
√
√
铁离子可以和碱之间反应生成氢氧化亚铁,生成的氢氧化亚铁极易被氧化,然后迅速变为氢氧化铁,所以向含有Fe2+的溶液中加入氢氧化钠溶液,先产生白色沉淀,后迅速变为灰绿色,最后变为红褐色,则溶液中一定含有Fe2+。
√
4.将适量铁粉放入氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比是
A.2∶3 B.3∶2 C.1∶2 D.1∶1
√
5.在Fe2(SO4)3溶液中,加入a g铜,完全溶解后,再加b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是
A.残余固体是铜和铁
B.最后得到的溶液中一定含有Cu2+
C.将残余固体加入到稀H2SO4中,有气泡产生
D.最后得到的溶液中可能含有Fe3+
6.为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是
选项 实验操作 实验现象 离子方程式 实验结论
A 在氯化亚铁溶液中滴加新制氯水 浅绿色溶液变成棕
黄色溶液 2Fe2++Cl2===2Fe3++2Cl- Fe2+具
有还原性
B 在氯化亚铁溶液中加入锌片 浅绿色溶液变成无
色溶液 Fe2++Zn===Fe+Zn2+ Fe2+具
有还原性
C 在氯化铁溶液中加入铁粉 棕黄色溶液变成浅
绿色溶液 Fe3++Fe===2Fe+ 铁单质具
有还原性
D 在氯化铁溶液中加入铜粉 蓝色溶液变成棕黄
色溶液 2Fe3++Cu===2Fe2++Cu2+ Fe3+具
有氧化性
√
氯气能够将Fe2+(浅绿色)氧化为Fe3+(棕黄色),A项正确;B项得到的结论应该是Fe2+具有氧化性;C项的离子方程式错误;D项的实验现象应该是铜粉逐渐溶解,溶液由棕黄色变为蓝色。
√
7.化合价和物质类别是整理元素及化合物知识的两个要素,可表示为“价—类”二维图。铁元素的“价—类”二维图如图所示,下列说法正确的是
A.维生素C能将Fe3+转化为Fe2+,该过程中维生素C被还原
B.Fe3O4中铁元素为+4价
C.工业上用CO还原Fe2O3炼铁,该反应为复分解反应
D.Fe(OH)2浊液露置于空气中,最终变成红褐色
将Fe3+转化为Fe2+,Fe元素发生还原反应,可知维生素C表现还原性,作还原剂,被氧化,故A错误;Fe3O4中铁的化合价有+2、+3价,由化合物中各元素化合价代数和为0可知Fe3O4中铁的化合价为两个铁原子显+3价,一个铁原子显+2价,故B错误;工业上用CO还原Fe2O3炼铁,反应中有元素的化合价变化,不是复分解反应,故C错误;Fe(OH)2浊液露置于空气中,白色迅速变为灰绿色,最后变为红褐色,故D正确。
√
还原性:I->Fe2+>Cl->Mn2+,A正确;还原性:I->Fe2+,故通入氯气时,碘离子先被氧化,即3Cl2+6FeI2===2FeCl3+4FeI3不能发生,B正确;还原性:I->Fe2+>Cl-,故要氧化I-而不氧化Fe2+和Cl-,可以加入FeCl3,C正确;由信息①可知,氯离子也可以被酸性高锰酸钾溶液氧化,使其褪色,故若紫色褪去,则溶液中也可能没有二价铁,可能含有氯离子,D错误。
√
9.已知A为常见的金属单质,根据如图所示的关系:
下列叙述正确的是
A.A为Fe,B为FeO
B.C→D溶液的颜色变化:由浅绿色到棕黄色
C.④的离子方程式:Fe+Fe3+===2Fe2+
D.⑤的离子方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3
√
10.裂解水制氢气的过程如下图所示。下列说法不正确的是
A.反应Ⅰ的化学方程式是Fe3O4+CO===3FeO+CO2
B.反应Ⅱ的化学方程式是3FeO+H2O(g)===Fe3O4+H2
C.总反应的化学方程式是C+2H2O(g)===CO2+2H2
D.铁的氧化物是裂解水的催化剂
反应Ⅰ的反应物是Fe3O4、CO,生成物是FeO、CO2,则根据得失电子守恒、原子守恒,可得该反应的化学方程式是Fe3O4+CO===3FeO+CO2,A正确;反应Ⅱ的反应物是FeO、H2O(g),生成物是Fe3O4、H2,则反应Ⅱ的化学方程式是3FeO+H2O(g)===Fe3O4+H2,B正确;反应Ⅲ的反应物是CO2、C,生成物是CO,反应方程式为CO2+C===2CO,将反应Ⅰ+Ⅱ+Ⅲ,整理可得化学方程式为:
C+H2O(g) CO+H2,C错误;铁的氧化物Fe3O4、FeO参与反应,但总反应为C+H2O(g) CO+H2,生成物没有Fe3O4、FeO,所以铁的氧化物是裂解水的催化剂,D正确。
11.(2023·山东聊城高一上期末)利用废旧镀锌铁皮制备Fe3O4胶体粒子的流程图如图,已知:Zn溶于强碱时生成可溶于水的[Zn(OH)4]2-。下列有关说法正确的是
A.Fe3O4是碱性氧化物,是具有磁性的黑色晶体
B.滤液中存在的离子有Na+、[Zn(OH)4]2-、OH-
C.“酸溶”的离子方程式为Fe(OH)3+3H+===Fe3++H2O
D.“氧化”的目的是将Fe2+全部氧化为Fe3+
√
Fe3O4是一种复杂的化合物,是具有磁性的黑色晶体,不是碱性氧化物,故A错误;Zn溶于强碱时生成可溶于水的[Zn(OH)4]2-,Fe与NaOH溶液不反应,则滤液含过量NaOH,存在的离子有Na+、[Zn(OH)4]2-、OH-,故B正确;“酸溶”的离子方程式为Fe+2H+===Fe2++H2↑,故C错误;由流程可知,过氧化氢只氧化部分亚铁离子,故D错误。
12.实验室有FeCl3、CuCl2、FeCl2的混合溶液,其中Fe3+、Cu2+和Fe2+的物质的量之比为3∶2∶1。
(1)现加入适量铁粉,请写出溶液中可能发生的离子反应:_____________
__________________________________。
3Fe2+、 Fe+Cu2+===Fe2++Cu
Fe+2Fe3+===
把Fe加入FeCl3、CuCl2、FeCl2的混合溶液中,可能发生两个反应:2Fe3++Fe===3Fe2+、Fe+Cu2+===Fe2++Cu。
(2)当向混合液中加入铁粉时,首先与铁粉发生反应的离子是________。
由于2Fe3++Cu===2Fe2++Cu2+,氧化性:Fe3+>Cu2+>Fe2+,加入铁粉后氧化性最强的Fe3+优先反应。
Fe3+
(3)加入适量铁粉后,最后溶液中Fe3+、Cu2+和Fe2+的物质的量之比变为1∶2∶4,则参加反应的铁粉与原溶液中Fe2+的物质的量之比为________。
Fe3+、Cu2+、Fe2+的物质的量之比由3∶2∶1变为1∶2∶4,显然Fe3+有剩余,Cu2+不参加反应。若Fe3+由3 mol变为1 mol,据2Fe3++Fe===3Fe2+可知参加反应的铁为1 mol,所以参加反应的铁粉与原溶液中的Fe2+的物质的量之比为1∶1。
1∶1
双氧水具有氧化性,酸性条件下能将Fe2+氧化为Fe3+,则②中反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。
13.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有_____(填离子符号)。
(2)操作②中反应的离子方程式:____________________________________。
Fe3+
2Fe2++H2O2+2H+===2Fe3++2H2O
(3)操作④中一系列处理的操作步骤:过滤、________、灼烧、_________
_________、称量。
步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,即过滤、洗涤、灼烧、冷却至室温、称量。
洗涤
至室温
冷却
(4)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为_______
_______________________________g(用含a的代数式表示)。
0.07a
