人教版高中化学必修第一册第四章物质结构元素周期律第二节第1课时元素性质的周期性变化规律课件(49页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第四章物质结构元素周期律第二节第1课时元素性质的周期性变化规律课件(49页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 00:00:00 | ||
图片预览











文档简介
(共49张PPT)
第1课时 元素性质的周期性变化规律
第四章 第二节 元素周期律
1.了解元素原子核外电子排布、原子半径、主要化合价的周期性变化,认识元 素周期律并理解其实质。
2.会设计实验探究同周期元素性质的变化规律,会比较元素的金属性
或非金属 性的强弱,促进“证据推理与模型认知”化学核心
素养的发展。
学习目标
任务一 核外电子排布、原子半径和主要化合价的变化
新知构建
1.原子结构的周期性变化
(1)元素原子核外电子排布的周期性变化
同周期元素随着原子序数的递增,元素原子的核外电子排布呈现由__个到8个的周期性变化。
(2)元素原子半径的周期性变化
同周期元素随着原子序数的递增,元素原子半径呈现逐渐________的周期性
变化。
提醒:原子半径的递变规律指同一周期第ⅠA族~第ⅦA族之间的变化规律,不包括稀有气体元素。
1
减小
什么同周期元素的原子半径会随着原子序数的递增而逐渐减小呢?
交流研讨
提示:同一周期元素的原子电子层数相同,随着核电荷数的递增,原子核对核外电子的吸引力逐渐增强,故原子半径逐渐减小。
2.元素化合价的周期性变化
同周期元素随着原子序数的递增,元素的最高正价呈现由__________
(______无最高正价),最低负价呈现由ⅣA族的____价逐渐升高至ⅦA族的____价的周期性变化。
+1→+7
O和F
-4
-1
归纳总结
主族元素主要化合价的确定方法
1.最高正价=主族序数=最外层电子数(O、F除外)。
2.最低负价=最高正价-8(H、O、F除外)。
3.H的最高价为+1,最低价为-1;O无最高正价;F无正化合价。
1.正误判断,错误的说明原因。
(1)第二周期元素从左至右,最高正价从+1递增到+7:______________
__________________。
(2)除稀有气体元素的原子外,原子半径最小的元素是氢元素:______。
(3)主族元素的最低负价等于其族序数-8:____________________。
典题应用
错误。O无最高
正价,F无正化合价
正确
错误。H元素不符合
2.X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
A.HX B.H2X
C.XH4 D.XH3
X元素最高价氧化物对应水化物的化学式为H3XO4,根据化合物中正负化合价之和为0,则X的最高价为+5价,最低价为-3价,X对应的气态氢化物为XH3。
√
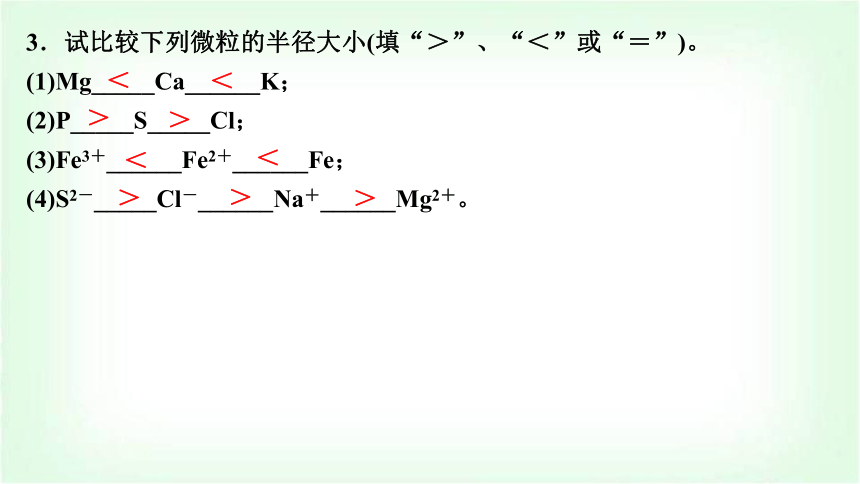
3.试比较下列微粒的半径大小(填“>”、“<”或“=”)。
(1)Mg_____Ca______K;
(2)P_____S_____Cl;
(3)Fe3+______Fe2+______Fe;
(4)S2-_____Cl-______Na+______Mg2+。
<
<
>
>
>
>
>
<
<
归纳总结
“三看法”比较微粒半径的大小
一看层,层多径大;
二看核,层同核多径小;
三看电子,层同核同电子多径大,如Cl->Cl、Fe2+>Fe3+。
返回
任务二 同周期元素金属性和非金属性的递变规律
新知构建
以第三周期元素为例探究元素性质的递变规律。
1.金属性的递变规律
交流研讨1
预测元素性质的递变规律
第三周期元素电子层数相同,由左向右核电荷数依次增多,原子半径依次____,失电子的能力依次____,得电子的能力依次____,它们的金属性依次____,非金属性依次____。
减小
减弱
增强
减弱
增强
(1)Na、Mg元素金属性强弱比较
实验探究
原理 金属与水反应置换出H2的难易程度
操作
现象 镁条表面附着少量气泡 有气泡产生,溶液变成浅红色
化学反应 — _________________________________
结论 Na与水反应置换H2比Mg_______,金属性:__________
Mg+2H2O===Mg(OH)2+H2↑
容易
Na>Mg
(2)Mg、Al元素金属性强弱比较
已知:元素的最高价氧化物对应水化物的碱性越强,元素的金属性越强
原理 元素的最高价氧化物对应水化物的碱性强弱
物质 Al(OH)3 Mg(OH)2
操作
现象 A中沉淀溶解,B中沉淀溶解 C中沉淀溶解,D中沉淀不溶解
试管中的离子方程式 A:_________________________________;
B:_________________________________ C:__________________________
__________;
D:________
结论 Al(OH)3是两性氢氧化物,其碱性弱于Mg(OH)2(中强碱),更弱于NaOH(强碱),则金属性:________________
Al(OH)3+3H+===Al3++3H2O
Al(OH)3+OH-===[Al(OH)4]-
+2H2O
Mg(OH)2+2H+===Mg2+
不反应
Na>Mg>Al
2.非金属性的递变规律
已知:元素最高价氧化物对应水化物的酸性越强,元素非金属性越强。
Si P S Cl
判断依据 与氢气化合 高温 磷蒸气与氢气反应 加热 光照或点燃
由易到难的顺序是_____________________
最高价氧化物对应的水化物(含氧酸)的酸性强弱 H2SiO3弱酸 H3PO4中强酸 H2SO4强酸 HClO4强酸 (酸性比
H2SO4强)
酸性:____________________________________________
结论 随着原子序数的递增,同周期的Si、P、S、Cl得电子的能力______,非金属性
______
HClO4>H2SO4>H3PO4>H2SiO3
增强
增强
Cl、S、P、Si
3.元素周期律
(1)内容:元素的性质随着原子序数的递增而呈周期性的变化。
(2)实质:元素性质的周期性变化是元素原子_______________周期性变化的必然结果。
交流研讨2
从原子结构角度解释同周期元素从左至右金属性逐渐减弱,非金属性逐渐增强的原因。
提示:在同一周期中,各元素的原子核外电子层数虽然相同,但从左至右,随核电荷数的增加,原子半径逐渐减小,原子核对最外层电子的吸引力逐渐增强,失电子能力逐渐减弱,金属性逐渐减弱,得电子能力逐渐增强,非金属性逐渐增强。
核外电子排布
1.正误判断,错误的说明原因。
(1)第三周期元素中,最高价氧化物对应水化物的酸性最强的为H2SO4:
__________________________。
(2)Al(OH)3是两性氢氧化物,与氨水、盐酸均可反应:_______________
_______________________________________________。
(3)盐酸可以与Na2CO3溶液反应生成CO2,可由此推出非金属性:Cl>C:
_______________________________________________________________
___________。
典题应用
错误。酸性最强的为HClO4
错误。Al(OH)3
是两性氢氧化物,与盐酸可反应,但与氨水不反应
错误。盐酸不属于Cl元素的最高价氧化物对应水化物,无法比较Cl、C的非金属性
2.(2023·广东佛山高一检测)下列事实不能说明氯的非金属性强于硫的是
A.酸性:HClO3>H2SO3
B.稳定性:HCl>H2S
C.3Cl2 +2Fe 2FeCl3和S+Fe FeS
D.Cl2+H2S===S↓+2HCl
HClO3和H2SO3不是最高价氧化物对应的水化物,故A不能说明氯的非金属性强于硫;氢化物越稳定,元素非金属性越强,故B能说明氯的非金属性强于硫;Cl2可将Fe氧化为+3价,而S只能将Fe氧化为+2价,故C能说明氯的非金属性强于硫;Cl2置换S,故D能说明氯的非金属性强于硫。
√
3.设元素为R,将R的气态氢化物、最高价氧化物、最高价氧化物对应水化物的化学式填入下表。
ⅣA ⅤA ⅥA ⅦA
氢化物
最高价氧化物
最高价氧化物对应的水化物
RH4
RH3
H2R
HR
RO2
R2O5
RO3
R2O7
H2RO3或H4RO4
H3RO4或HRO3
H2RO4
HRO4
返回
随堂达标演练
1.(2023·广东四会高一段考)某主族元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子数为
A.4 B.5
C.6 D.7
√
√
2.下图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示
A.电子层数 B.最外层电子数
C.最高化合价 D.原子半径
同主族自上而下金属性逐渐增强,A错误;同周期从左到右非金属性逐渐增强,同主族自下而上,最高价氧化物对应水化物的酸性逐渐增强,B、C错误;由同主族元素的最高价氧化物对应的水化物碱性递变规律可得:KOH>NaOH,由同周期元素的最高价氧化物对应的水化物碱性递变规律可得:NaOH>Mg(OH)2,则碱性:KOH>Mg(OH)2,D正确。
√
3.(2023·北京昌平高一练习)根据元素在周期表中的位置判断,下列正确的是
A.金属性:Na>K B.非金属性:S>Cl
C.酸性:H3PO4>HNO3 D.碱性:KOH>Mg(OH)2
4.(2023·重庆合川太和中学高一检测)X、Y、Z三种元素的电子层数相同,它们的最高价氧化物分别为酸性氧化物、碱性氧化物和两性氧化物,则三种元素的原子序数的大小顺序是
A.X>Y>Z B.Y>Z>X
C.X>Z>Y D.Z>X>Y
大多数金属氧化物属于碱性氧化物,大多数非金属氧化物属于酸性氧化物,电子层数相同的元素从左到右按照先金属、后非金属的顺序排列。即最高价氧化物从左向右依次是碱性氧化物、两性氧化物、酸性氧化物,所以X的原子序数最大,Y的原子序数最小。
√
5.元素A原子获得2个电子或元素B原子失去1个电子后形成的离子都与OH-具有相同的电子数,则:
(1)A是___________,B是___________。
氧(或O)
钠(或Na)
OH-电子数为10,故A原子核外电子数为8,B原子核外电子数为11,即A为O,B为Na。
返回
>
(2)离子半径大小:A2-________(填“>”、“<”或“=”)B+。
O2-与Na+具有相同电子层结构,则r(O2-)>r(Na+)。
(3)在由两种元素形成的化合物中,标出它们的化合价______________。
课时测评
√
题点一 1~18号元素性质的周期性变化规律
1.原子序数为3~10的元素,随着核电荷数的递增而逐渐增大的是
A.电子层数 B.核外电子数
C.原子半径 D.化合价
原子序数为3~10的元素,原子的电子层数都为2,A错误;除了10号稀有气体元素原子外,3~9号元素原子的核电荷数越大,原子半径越小,C错误;氧无最高正价、氟无正价,D错误。
√
2.下列原子半径大小顺序正确的是
A.Li>Na>K B.Na>Mg>Al
C.Na>F>Cl D.Cl>Na>Mg
Li、Na、K为同族元素,电子层数依次增多,则半径依次增大,则半径:Li<Na<K,故A错误;Na、Mg、Al三种原子的电子层数相同,核电荷数越大,半径越小,则半径:Na>Mg>Al,故B正确;Na、Cl有三个电子层,核电荷数Na小于Cl,F有两个电子层,则半径:Na>Cl>F,故C错误;Cl、Na、Mg三种原子均含有三个电子层,核电荷数越大,半径越小,则半径:Na>Mg>Cl,故D错误。
√
3.某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为
A.H2RO3 B.H2RO4
C.HRO3 D.H3RO4
由H2R知R元素最低价为-2价,则最高价为8-2=+6,故R的最高价氧化物对应水化物的化学式为H2RO4。
√
4.下列递变规律不正确的是
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.钠、镁、铝的还原性依次减弱
C.HCl、H2S、PH3的稳定性依次减弱
D.P、S、Cl三种元素的最高正化合价依次升高
非金属性:Cl>S>P,元素的非金属性越强,最高价氧化物对应水化物的酸性越强,则HClO4、H2SO4、H3PO4的酸性依次减弱,故A项错误;金属性:Na>Mg>Al,元素的金属性越强,对应的单质的还原性越强,则钠、镁、铝的还原性依次减弱,故B项正确;非金属性:Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,故C项正确;P、S、Cl三种元素原子的最外层电子数分别为5、6、7,最高正化合价分别为+5、+6、+7,故D项正确。
√
题点二 元素周期律
5.门捷列夫对化学这一学科发展的最大贡献在于发现了化学元素周期律。下列事实不能用元素周期律解释的只有
A.碱性:KOH>Ca(OH)2>Mg(OH)2
B.稳定性:H2O>H2S>H2Se
C.挥发性:HNO3>H3PO4>H2SO4
D.原子半径:P>S>Cl
元素的金属性越强,其原子失电子能力越强,其最高价氧化物对应的水化物碱性越强,金属性:K>Ca>Mg,则碱性:KOH>Ca(OH)2>Mg(OH)2,A可以;元素的非金属性越强,其对应的气态氢化物越稳定,同主族元素非金属性:O>S>Se,则稳定性:H2O>H2S>H2Se,B可以;挥发性与物质的结构无关,C不可以;同周期元素从左到右原子半径逐渐减小,D可以。
√
6.下表中的事实与推论不符的是
选项 事实 推论
A 与冷水反应,Na比Mg剧烈 金属性:Na>Mg
B Ca(OH)2的碱性强于Mg(OH)2 金属性:Ca>Mg
C H2SO3的酸性比H2CO3强 非金属性:S>C
D HCl热稳定性比H2S强 非金属性:Cl>S
用与水反应的剧烈程度判断元素金属性的强弱,与冷水反应,Na比Mg剧烈,说明Na的金属性比Mg强,A项正确;用对应碱的碱性判断元素金属性的强弱,Ca(OH)2的碱性强于Mg(OH)2,金属性:Ca>Mg,B项正确;亚硫酸不是最高价含氧酸,亚硫酸的酸性比碳酸的酸性强,不能说明S与C的非金属性的强弱,C项错误;用气态氢化物的热稳定性判断非金属性的强弱,热稳定性:HCl>H2S,说明非金属性:Cl>S,D项正确
√
7.A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,离子半径:A2->C-,B2+与C-具有相同的电子层结构,下列比较不正确的是
A.原子序数:A>B>C
B.原子半径:C>B>A
C.离子半径:A2->C->B2+
D.原子核外最外层电子数:C>A>B
根据“A、C的最低价离子分别为A2-、C-”可知,A位于ⅥA族,C位于ⅦA族;根据“A、B同周期”“B2+与C-具有相同的电子层结构”可知,A在C的左下方,B位于A的左侧。A、B、C的相对位置如图所示:
由图可知:原子半径的大小关系应该是B>A>C,B项错误。
C
B …… A
8.在第三周期元素中,除稀有气体元素外。
(1)原子半径最小的元素是_____ (填元素符号,下同)。
(2)金属性最强的元素是_____。
(3)最高价氧化物对应水化物酸性最强的是_________(填化学式,下同)。
(4)最不稳定的气态氢化物是________。
(5)最高价氧化物对应水化物碱性最强的是________。
(6)最高价氧化物中具有两性的是________。
Cl
Na
HClO4
SiH4
NaOH
Al2O3
9.下图中的曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质):
把与元素有关性质相符的曲线的字母填入相应位置:
(1)第ⅡA族元素原子的最外层电子数___。
B
第ⅡA族元素原子的最外层电子数均为2,故选B。
(2)第三周期元素的最高正化合价___。
C
第三周期元素的最高正价由+1~+7~0,故选C。
(3)F-、Na+、Mg2+、Al3+四种离子的离子半径___。
A
F-、Na+、Mg2+、Al3+四种离子的电子层结构相同,离子半径随着核电荷数增大而依次减小,故选A。
第二周期元素的原子半径从左到右依次减小,故选D。
(4)第二周期元素的原子半径(不包括稀有气体)____。
D
10.元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是七种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
(1)C元素在元素周期表中的位置是第_____周期第_____族。
元素代号 A B C D E F G
原子半径/nm 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要化合价 +1 +2 +3 +6、-2 +7、-1 -2 +5、-3
三
ⅢA
(2)B的原子结构示意图为____________。
(3)D、E气态氢化物的稳定性: _____________ (填化学式,下同)。
(4)上述七种元素的最高价氧化物对应水化物中酸性最强的是________。
元素代号 A B C D E F G
原子半径/nm 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要化合价 +1 +2 +3 +6、-2 +7、-1 -2 +5、-3
HCl>H2S
HClO4
11.哲学有云:万事万物的诞生发展运动变化都是有规律的,是严格按照事物运动发展变化的内部法则进行的,宇宙是一个整体,没有超越这个整体而独立存在的事物,这叫“诸行有常”。“诸行有常”的“诸”含义是“所有事物”,“行”指所有事物的运动变化,“常”指“常态”“规律”“法则”“轨迹”。元素性质存在周期性变化。
(1)短周期元素中最高价氧化物的水化物酸性最强的是_______ (填化学式)。
(2)元素C、Si、Cl非金属性强弱顺序为__________。
HClO4
Cl>C>Si
(3)如下实验_____________(填“能”或“不能”)证明上述结论,理由是___________________________________________________________________________________________________________________________________________________________________________________________。
不能
滴加盐酸后,碳酸钠溶液中产生气体,说明盐酸酸性强于碳酸,但不能证明Cl的非金属性强于C;盐酸挥发出的HCl与硅酸钠反应也产生沉淀,故不能说明碳酸的酸性强于硅酸,即不能证明C的非金属性强于Si
返回
第1课时 元素性质的周期性变化规律
第四章 第二节 元素周期律
1.了解元素原子核外电子排布、原子半径、主要化合价的周期性变化,认识元 素周期律并理解其实质。
2.会设计实验探究同周期元素性质的变化规律,会比较元素的金属性
或非金属 性的强弱,促进“证据推理与模型认知”化学核心
素养的发展。
学习目标
任务一 核外电子排布、原子半径和主要化合价的变化
新知构建
1.原子结构的周期性变化
(1)元素原子核外电子排布的周期性变化
同周期元素随着原子序数的递增,元素原子的核外电子排布呈现由__个到8个的周期性变化。
(2)元素原子半径的周期性变化
同周期元素随着原子序数的递增,元素原子半径呈现逐渐________的周期性
变化。
提醒:原子半径的递变规律指同一周期第ⅠA族~第ⅦA族之间的变化规律,不包括稀有气体元素。
1
减小
什么同周期元素的原子半径会随着原子序数的递增而逐渐减小呢?
交流研讨
提示:同一周期元素的原子电子层数相同,随着核电荷数的递增,原子核对核外电子的吸引力逐渐增强,故原子半径逐渐减小。
2.元素化合价的周期性变化
同周期元素随着原子序数的递增,元素的最高正价呈现由__________
(______无最高正价),最低负价呈现由ⅣA族的____价逐渐升高至ⅦA族的____价的周期性变化。
+1→+7
O和F
-4
-1
归纳总结
主族元素主要化合价的确定方法
1.最高正价=主族序数=最外层电子数(O、F除外)。
2.最低负价=最高正价-8(H、O、F除外)。
3.H的最高价为+1,最低价为-1;O无最高正价;F无正化合价。
1.正误判断,错误的说明原因。
(1)第二周期元素从左至右,最高正价从+1递增到+7:______________
__________________。
(2)除稀有气体元素的原子外,原子半径最小的元素是氢元素:______。
(3)主族元素的最低负价等于其族序数-8:____________________。
典题应用
错误。O无最高
正价,F无正化合价
正确
错误。H元素不符合
2.X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
A.HX B.H2X
C.XH4 D.XH3
X元素最高价氧化物对应水化物的化学式为H3XO4,根据化合物中正负化合价之和为0,则X的最高价为+5价,最低价为-3价,X对应的气态氢化物为XH3。
√
3.试比较下列微粒的半径大小(填“>”、“<”或“=”)。
(1)Mg_____Ca______K;
(2)P_____S_____Cl;
(3)Fe3+______Fe2+______Fe;
(4)S2-_____Cl-______Na+______Mg2+。
<
<
>
>
>
>
>
<
<
归纳总结
“三看法”比较微粒半径的大小
一看层,层多径大;
二看核,层同核多径小;
三看电子,层同核同电子多径大,如Cl->Cl、Fe2+>Fe3+。
返回
任务二 同周期元素金属性和非金属性的递变规律
新知构建
以第三周期元素为例探究元素性质的递变规律。
1.金属性的递变规律
交流研讨1
预测元素性质的递变规律
第三周期元素电子层数相同,由左向右核电荷数依次增多,原子半径依次____,失电子的能力依次____,得电子的能力依次____,它们的金属性依次____,非金属性依次____。
减小
减弱
增强
减弱
增强
(1)Na、Mg元素金属性强弱比较
实验探究
原理 金属与水反应置换出H2的难易程度
操作
现象 镁条表面附着少量气泡 有气泡产生,溶液变成浅红色
化学反应 — _________________________________
结论 Na与水反应置换H2比Mg_______,金属性:__________
Mg+2H2O===Mg(OH)2+H2↑
容易
Na>Mg
(2)Mg、Al元素金属性强弱比较
已知:元素的最高价氧化物对应水化物的碱性越强,元素的金属性越强
原理 元素的最高价氧化物对应水化物的碱性强弱
物质 Al(OH)3 Mg(OH)2
操作
现象 A中沉淀溶解,B中沉淀溶解 C中沉淀溶解,D中沉淀不溶解
试管中的离子方程式 A:_________________________________;
B:_________________________________ C:__________________________
__________;
D:________
结论 Al(OH)3是两性氢氧化物,其碱性弱于Mg(OH)2(中强碱),更弱于NaOH(强碱),则金属性:________________
Al(OH)3+3H+===Al3++3H2O
Al(OH)3+OH-===[Al(OH)4]-
+2H2O
Mg(OH)2+2H+===Mg2+
不反应
Na>Mg>Al
2.非金属性的递变规律
已知:元素最高价氧化物对应水化物的酸性越强,元素非金属性越强。
Si P S Cl
判断依据 与氢气化合 高温 磷蒸气与氢气反应 加热 光照或点燃
由易到难的顺序是_____________________
最高价氧化物对应的水化物(含氧酸)的酸性强弱 H2SiO3弱酸 H3PO4中强酸 H2SO4强酸 HClO4强酸 (酸性比
H2SO4强)
酸性:____________________________________________
结论 随着原子序数的递增,同周期的Si、P、S、Cl得电子的能力______,非金属性
______
HClO4>H2SO4>H3PO4>H2SiO3
增强
增强
Cl、S、P、Si
3.元素周期律
(1)内容:元素的性质随着原子序数的递增而呈周期性的变化。
(2)实质:元素性质的周期性变化是元素原子_______________周期性变化的必然结果。
交流研讨2
从原子结构角度解释同周期元素从左至右金属性逐渐减弱,非金属性逐渐增强的原因。
提示:在同一周期中,各元素的原子核外电子层数虽然相同,但从左至右,随核电荷数的增加,原子半径逐渐减小,原子核对最外层电子的吸引力逐渐增强,失电子能力逐渐减弱,金属性逐渐减弱,得电子能力逐渐增强,非金属性逐渐增强。
核外电子排布
1.正误判断,错误的说明原因。
(1)第三周期元素中,最高价氧化物对应水化物的酸性最强的为H2SO4:
__________________________。
(2)Al(OH)3是两性氢氧化物,与氨水、盐酸均可反应:_______________
_______________________________________________。
(3)盐酸可以与Na2CO3溶液反应生成CO2,可由此推出非金属性:Cl>C:
_______________________________________________________________
___________。
典题应用
错误。酸性最强的为HClO4
错误。Al(OH)3
是两性氢氧化物,与盐酸可反应,但与氨水不反应
错误。盐酸不属于Cl元素的最高价氧化物对应水化物,无法比较Cl、C的非金属性
2.(2023·广东佛山高一检测)下列事实不能说明氯的非金属性强于硫的是
A.酸性:HClO3>H2SO3
B.稳定性:HCl>H2S
C.3Cl2 +2Fe 2FeCl3和S+Fe FeS
D.Cl2+H2S===S↓+2HCl
HClO3和H2SO3不是最高价氧化物对应的水化物,故A不能说明氯的非金属性强于硫;氢化物越稳定,元素非金属性越强,故B能说明氯的非金属性强于硫;Cl2可将Fe氧化为+3价,而S只能将Fe氧化为+2价,故C能说明氯的非金属性强于硫;Cl2置换S,故D能说明氯的非金属性强于硫。
√
3.设元素为R,将R的气态氢化物、最高价氧化物、最高价氧化物对应水化物的化学式填入下表。
ⅣA ⅤA ⅥA ⅦA
氢化物
最高价氧化物
最高价氧化物对应的水化物
RH4
RH3
H2R
HR
RO2
R2O5
RO3
R2O7
H2RO3或H4RO4
H3RO4或HRO3
H2RO4
HRO4
返回
随堂达标演练
1.(2023·广东四会高一段考)某主族元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子数为
A.4 B.5
C.6 D.7
√
√
2.下图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示
A.电子层数 B.最外层电子数
C.最高化合价 D.原子半径
同主族自上而下金属性逐渐增强,A错误;同周期从左到右非金属性逐渐增强,同主族自下而上,最高价氧化物对应水化物的酸性逐渐增强,B、C错误;由同主族元素的最高价氧化物对应的水化物碱性递变规律可得:KOH>NaOH,由同周期元素的最高价氧化物对应的水化物碱性递变规律可得:NaOH>Mg(OH)2,则碱性:KOH>Mg(OH)2,D正确。
√
3.(2023·北京昌平高一练习)根据元素在周期表中的位置判断,下列正确的是
A.金属性:Na>K B.非金属性:S>Cl
C.酸性:H3PO4>HNO3 D.碱性:KOH>Mg(OH)2
4.(2023·重庆合川太和中学高一检测)X、Y、Z三种元素的电子层数相同,它们的最高价氧化物分别为酸性氧化物、碱性氧化物和两性氧化物,则三种元素的原子序数的大小顺序是
A.X>Y>Z B.Y>Z>X
C.X>Z>Y D.Z>X>Y
大多数金属氧化物属于碱性氧化物,大多数非金属氧化物属于酸性氧化物,电子层数相同的元素从左到右按照先金属、后非金属的顺序排列。即最高价氧化物从左向右依次是碱性氧化物、两性氧化物、酸性氧化物,所以X的原子序数最大,Y的原子序数最小。
√
5.元素A原子获得2个电子或元素B原子失去1个电子后形成的离子都与OH-具有相同的电子数,则:
(1)A是___________,B是___________。
氧(或O)
钠(或Na)
OH-电子数为10,故A原子核外电子数为8,B原子核外电子数为11,即A为O,B为Na。
返回
>
(2)离子半径大小:A2-________(填“>”、“<”或“=”)B+。
O2-与Na+具有相同电子层结构,则r(O2-)>r(Na+)。
(3)在由两种元素形成的化合物中,标出它们的化合价______________。
课时测评
√
题点一 1~18号元素性质的周期性变化规律
1.原子序数为3~10的元素,随着核电荷数的递增而逐渐增大的是
A.电子层数 B.核外电子数
C.原子半径 D.化合价
原子序数为3~10的元素,原子的电子层数都为2,A错误;除了10号稀有气体元素原子外,3~9号元素原子的核电荷数越大,原子半径越小,C错误;氧无最高正价、氟无正价,D错误。
√
2.下列原子半径大小顺序正确的是
A.Li>Na>K B.Na>Mg>Al
C.Na>F>Cl D.Cl>Na>Mg
Li、Na、K为同族元素,电子层数依次增多,则半径依次增大,则半径:Li<Na<K,故A错误;Na、Mg、Al三种原子的电子层数相同,核电荷数越大,半径越小,则半径:Na>Mg>Al,故B正确;Na、Cl有三个电子层,核电荷数Na小于Cl,F有两个电子层,则半径:Na>Cl>F,故C错误;Cl、Na、Mg三种原子均含有三个电子层,核电荷数越大,半径越小,则半径:Na>Mg>Cl,故D错误。
√
3.某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为
A.H2RO3 B.H2RO4
C.HRO3 D.H3RO4
由H2R知R元素最低价为-2价,则最高价为8-2=+6,故R的最高价氧化物对应水化物的化学式为H2RO4。
√
4.下列递变规律不正确的是
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.钠、镁、铝的还原性依次减弱
C.HCl、H2S、PH3的稳定性依次减弱
D.P、S、Cl三种元素的最高正化合价依次升高
非金属性:Cl>S>P,元素的非金属性越强,最高价氧化物对应水化物的酸性越强,则HClO4、H2SO4、H3PO4的酸性依次减弱,故A项错误;金属性:Na>Mg>Al,元素的金属性越强,对应的单质的还原性越强,则钠、镁、铝的还原性依次减弱,故B项正确;非金属性:Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,故C项正确;P、S、Cl三种元素原子的最外层电子数分别为5、6、7,最高正化合价分别为+5、+6、+7,故D项正确。
√
题点二 元素周期律
5.门捷列夫对化学这一学科发展的最大贡献在于发现了化学元素周期律。下列事实不能用元素周期律解释的只有
A.碱性:KOH>Ca(OH)2>Mg(OH)2
B.稳定性:H2O>H2S>H2Se
C.挥发性:HNO3>H3PO4>H2SO4
D.原子半径:P>S>Cl
元素的金属性越强,其原子失电子能力越强,其最高价氧化物对应的水化物碱性越强,金属性:K>Ca>Mg,则碱性:KOH>Ca(OH)2>Mg(OH)2,A可以;元素的非金属性越强,其对应的气态氢化物越稳定,同主族元素非金属性:O>S>Se,则稳定性:H2O>H2S>H2Se,B可以;挥发性与物质的结构无关,C不可以;同周期元素从左到右原子半径逐渐减小,D可以。
√
6.下表中的事实与推论不符的是
选项 事实 推论
A 与冷水反应,Na比Mg剧烈 金属性:Na>Mg
B Ca(OH)2的碱性强于Mg(OH)2 金属性:Ca>Mg
C H2SO3的酸性比H2CO3强 非金属性:S>C
D HCl热稳定性比H2S强 非金属性:Cl>S
用与水反应的剧烈程度判断元素金属性的强弱,与冷水反应,Na比Mg剧烈,说明Na的金属性比Mg强,A项正确;用对应碱的碱性判断元素金属性的强弱,Ca(OH)2的碱性强于Mg(OH)2,金属性:Ca>Mg,B项正确;亚硫酸不是最高价含氧酸,亚硫酸的酸性比碳酸的酸性强,不能说明S与C的非金属性的强弱,C项错误;用气态氢化物的热稳定性判断非金属性的强弱,热稳定性:HCl>H2S,说明非金属性:Cl>S,D项正确
√
7.A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,离子半径:A2->C-,B2+与C-具有相同的电子层结构,下列比较不正确的是
A.原子序数:A>B>C
B.原子半径:C>B>A
C.离子半径:A2->C->B2+
D.原子核外最外层电子数:C>A>B
根据“A、C的最低价离子分别为A2-、C-”可知,A位于ⅥA族,C位于ⅦA族;根据“A、B同周期”“B2+与C-具有相同的电子层结构”可知,A在C的左下方,B位于A的左侧。A、B、C的相对位置如图所示:
由图可知:原子半径的大小关系应该是B>A>C,B项错误。
C
B …… A
8.在第三周期元素中,除稀有气体元素外。
(1)原子半径最小的元素是_____ (填元素符号,下同)。
(2)金属性最强的元素是_____。
(3)最高价氧化物对应水化物酸性最强的是_________(填化学式,下同)。
(4)最不稳定的气态氢化物是________。
(5)最高价氧化物对应水化物碱性最强的是________。
(6)最高价氧化物中具有两性的是________。
Cl
Na
HClO4
SiH4
NaOH
Al2O3
9.下图中的曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质):
把与元素有关性质相符的曲线的字母填入相应位置:
(1)第ⅡA族元素原子的最外层电子数___。
B
第ⅡA族元素原子的最外层电子数均为2,故选B。
(2)第三周期元素的最高正化合价___。
C
第三周期元素的最高正价由+1~+7~0,故选C。
(3)F-、Na+、Mg2+、Al3+四种离子的离子半径___。
A
F-、Na+、Mg2+、Al3+四种离子的电子层结构相同,离子半径随着核电荷数增大而依次减小,故选A。
第二周期元素的原子半径从左到右依次减小,故选D。
(4)第二周期元素的原子半径(不包括稀有气体)____。
D
10.元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是七种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
(1)C元素在元素周期表中的位置是第_____周期第_____族。
元素代号 A B C D E F G
原子半径/nm 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要化合价 +1 +2 +3 +6、-2 +7、-1 -2 +5、-3
三
ⅢA
(2)B的原子结构示意图为____________。
(3)D、E气态氢化物的稳定性: _____________ (填化学式,下同)。
(4)上述七种元素的最高价氧化物对应水化物中酸性最强的是________。
元素代号 A B C D E F G
原子半径/nm 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要化合价 +1 +2 +3 +6、-2 +7、-1 -2 +5、-3
HCl>H2S
HClO4
11.哲学有云:万事万物的诞生发展运动变化都是有规律的,是严格按照事物运动发展变化的内部法则进行的,宇宙是一个整体,没有超越这个整体而独立存在的事物,这叫“诸行有常”。“诸行有常”的“诸”含义是“所有事物”,“行”指所有事物的运动变化,“常”指“常态”“规律”“法则”“轨迹”。元素性质存在周期性变化。
(1)短周期元素中最高价氧化物的水化物酸性最强的是_______ (填化学式)。
(2)元素C、Si、Cl非金属性强弱顺序为__________。
HClO4
Cl>C>Si
(3)如下实验_____________(填“能”或“不能”)证明上述结论,理由是___________________________________________________________________________________________________________________________________________________________________________________________。
不能
滴加盐酸后,碳酸钠溶液中产生气体,说明盐酸酸性强于碳酸,但不能证明Cl的非金属性强于C;盐酸挥发出的HCl与硅酸钠反应也产生沉淀,故不能说明碳酸的酸性强于硅酸,即不能证明C的非金属性强于Si
返回
