人教版高中化学必修第一册第一章物质及其变化第三节第1课时氧化还原反应课件(50页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第一章物质及其变化第三节第1课时氧化还原反应课件(50页ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 09:27:38 | ||
图片预览










文档简介
(共50张PPT)
第1课时 氧化还原反应
第一章 第三节 氧化还原反应
1. 能通过分析元素化合价的变化判断化学反应是否是氧化还原反应。
2. 知道氧化还原反应的本质是电子转移,能分析简单氧化还原反应中电子转移的方向和数目。
3. 理清氧化还原反应与四种基本反应类型之间的关系。
学习目标
任务一 从三个角度认识氧化还原反应
新知构建
1.从得、失氧的角度认识氧化还原反应
(1)一种物质_______氧发生氧化反应,必然有一种物质______氧发生还原反应。
(2)氧化反应和还原反应是在一个反应中同时发生,这种反应称为氧化还原反应。
得到
失去
交流研讨1
物质 反应物 发生的反应(选填“氧化反应”或“还原反应”)
得氧物质
失氧物质
C
氧化反应
CuO
还原反应
2.从元素化合价升降的角度认识氧化还原反应
(1)凡是有元素______________的反应都是氧化还原反应。
(2)物质所含元素化合价_______的反应称为氧化反应。
(3)物质所含元素化合价_______的反应称为还原反应。
(1)请标出反应2CuO+C 2Cu+CO2↑中各物质所含元素的化合价,比较反应前后价态有无变化。
提示:
交流研讨2
化合价变化
升高
降低
(2)在上述反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?请完成下列表格。
反应物 发生的反应
(“氧化反应”或“还原反应”) 元素化合价
C 氧化反应
CuO 还原反应
升高
降低
从元素化合价升降的角度分析反应Fe2O3+3CO 2Fe +3CO2是否属于氧化还原反应。若属于氧化还原反应,请分别指出发生氧化反应、还原反应的物质。
提示:
该反应属于氧化还原反应,CO发生氧化反应,Fe2O3发生还原反应。
交流研讨3
3.从电子转移的角度认识氧化还原反应
(1)氧化还原反应的实质:有_____________,包括____________或__________________。
(2)所含元素_____电子的物质发生_______反应,被_______。
(3)所含元素_____电子的物质发生_______反应,被_______。
【记忆口诀】 升—失—氧(氧化反应),降—得—还(还原反应)。
(1)从元素化合价升降的角度分析反应2Na+Cl2 2NaCl是否属于氧化还原反应。
提示:属于氧化还原反应。
交流研讨4
电子转移
电子得失
共用电子对偏移
失
氧化
氧化
得
还原
还原
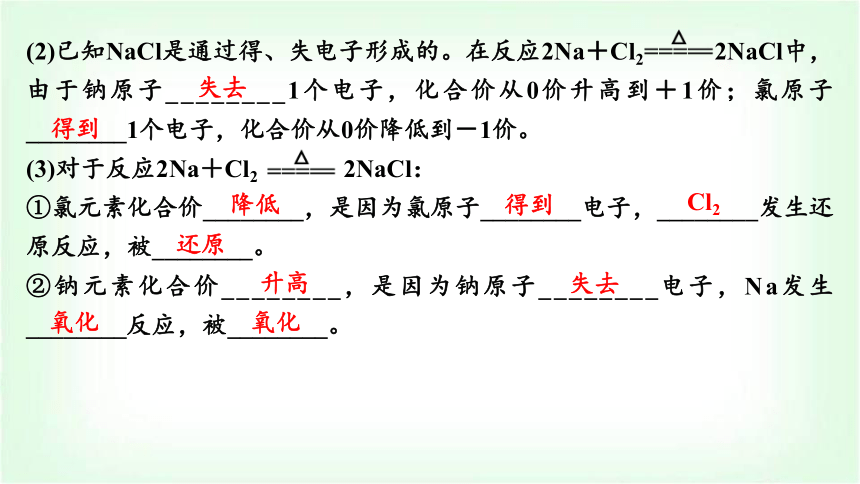
(2)已知NaCl是通过得、失电子形成的。在反应2Na+Cl2 2NaCl中,由于钠原子________1个电子,化合价从0价升高到+1价;氯原子________1个电子,化合价从0价降低到-1价。
(3)对于反应2Na+Cl2 2NaCl:
①氯元素化合价________,是因为氯原子________电子,________发生还原反应,被________。
②钠元素化合价________,是因为钠原子________电子,Na发生________反应,被________。
失去
得到
降低
得到
Cl2
还原
升高
失去
氧化
氧化
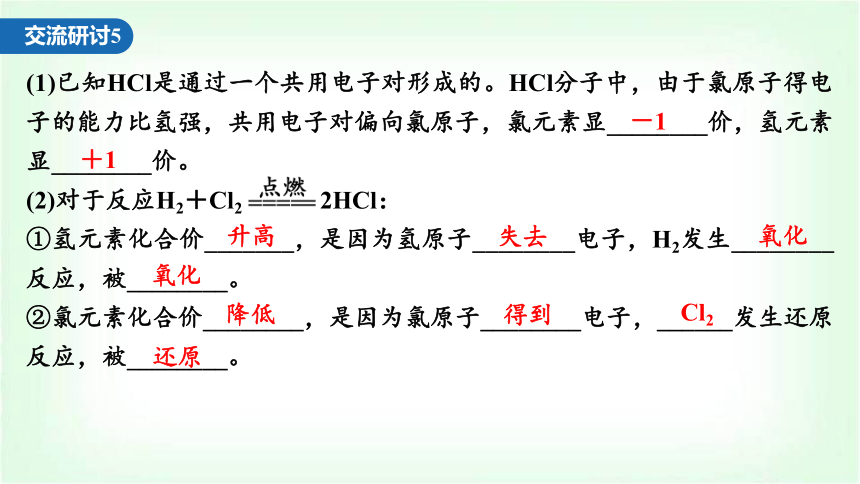
(1)已知HCl是通过一个共用电子对形成的。HCl分子中,由于氯原子得电子的能力比氢强,共用电子对偏向氯原子,氯元素显________价,氢元素显________价。
(2)对于反应H2+Cl2 2HCl:
①氢元素化合价_______,是因为氢原子________电子,H2发生________反应,被________。
②氯元素化合价________,是因为氯原子________电子,______发生还原反应,被________。
交流研讨5
-1
+1
升高
失去
氧化
氧化
降低
得到
Cl2
还原
(1)从化合价变化角度判断以下反应是不是氧化还原反应,并思考氧化还原反应与四种基本反应类型的关系。
交流研讨6
①②
⑤
⑥
③
(2)请用图表示氧化还原反应与四种基本反应类型的关系。
提示:
典题应用
(1)C+H2O(g) CO+H2中发生氧化反应的物质是_____,被还原的元素是_____。
(2)MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑中发生氧化反应的物质是_______,发生还原反应的物质是________,被氧化的元素是______,被还原的元素是_______。
C
H
HCl
MnO2
Cl
Mn
2.有以下5个反应:
其中:属于氧化还原反应但不属于四种基本反应类型的有____(填序号)。
②
返回
任务二 氧化还原反应中电子转移的表示方法
新知构建
1.双线桥法
(1)双线桥法:表示反应前后____________由反应物转化为生成物时电子转移的情况。
(2)注意事项
①箭尾、箭头必须对应化合价变化的同种元素的原子,从反应物指向生
成物。
②必须注明“得到”或“失去”。
③电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的__________,b表示每个原子_____________________,当a=1或b=1时,可省略。
④被还原的物质和被氧化的物质得失电子数相等。
同一元素
原子个数
得到或失去的电子数
交流研讨
尝试用双线桥法标出C+2CuO 2Cu+CO2↑电子转移的方向及数目。
提示:
2.单线桥法
(1)连单线:箭尾由反应物中_______电子元素的元素符号出发,箭头指向反应物中_______电子元素的元素符号。
(2)不需要标明“得到”或“失去”字样,只标明电子转移的________。
例如,用单线桥法标出反应C+2CuO 2Cu+CO2↑电子转移的方向及数目如下:
失去
得到
总数目
典题应用
1.标出变价元素的化合价,用双线桥法标出电子转移的方向及数目。
答案:
答案:
(3)2H2S+SO2===3S+2H2O
答案:
2.用单线桥法标出电子转移的方向及数目。
2H2S+SO2===3S+2H2O
答案:
返回
随堂达标演练
√
1.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理。下列成语中涉及氧化还原反应的是
A.木已成舟 B.蜡炬成灰
C.铁杵成针 D.滴水成冰
木已成舟、铁杵成针和滴水成冰都是形状的改变,没有新物质生成,不属于化学变化,更不涉及氧化还原反应;蜡炬成灰涉及“燃烧”,是氧气参与的氧化还原反应。
物质所含元素化合价升高的反应为氧化反应。
√
2.下列变化过程中,属于氧化反应的是
A.MnO2―→Mn2+ B.CuO―→CuCl2
C.Ag+―→Ag2O D.Sn2+―→Sn4+
√
3.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影3区域的是
阴影区域的反应必须属于氧化还原反应,且不属于化合、分解、置换反应。A项,该反应属于分解反应,又属于氧化还原反应;B项,该反应属于分解反应,不属于氧化还原反应;C项,该反应属于化合反应,又属于氧化还原反应;D项,该反应属于氧化还原反应,不属于化合、分解、置换反应中的任意一种,故属于阴影3区域。
4.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
(1)被氧化的元素是______(填元素符号,下同),被还原的元素是______。
(2)发生氧化反应的物质是______。
(3)用双线桥法表示反应电子得失的方向和数目:___________________。
Cu
N
Cu
由化学方程式可知铜元素化合价升高,从0价变为+2价,被氧化;氮元素化合价降低,从+5价变为+2价,被还原;铜发生氧化反应,硝酸发生还原反应。
返回
课时测评
√
题点一 氧化还原反应的概念
1.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是
A.铜制器具产生铜绿 B.铁制菜刀生锈
C.金属冶炼 D.醋酸除水垢
A、B项涉及金属铜铁被氧化的过程,属于氧化还原反应;C项中涉及金属元素的化合价降低,属于氧化还原反应;D项发生的是复分解反应,不属于氧化还原反应。
√
2.氧化还原反应的本质是
A.有氧元素参与反应 B.有电子转移
C.物质状态发生变化 D.质量保持不变
√
Fe与CuSO4反应,Fe失电子被氧化,Cu2+得电子被还原。
3.(2023·西安市长安区高一调研)如图为反应Fe+CuSO4===Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示
A.Fe、S B.Cu、S
C.Fe、O D.Fe、Cu
√
4.(2023·山东诸城高一检测)下列反应中,一定发生电子转移的是
发生电子转移的反应一定是氧化还原反应,判断反应是否是氧化还原反应的关键是分析反应前后元素的化合价是否发生变化。B项,锰元素的化合价由+7价降低为+6价和+4价,氧元素的化合价由-2价升高为0价,发生了电子转移,其他选项中元素的化合价均无变化。
√
5.下列关于氧化还原反应的说法中正确的是
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+―→Fe2+的变化过程一定是氧化反应
D.元素化合价升高的反应是还原反应
化合价有变化的反应一定是氧化还原反应,但不一定有氧的得失;化合价升高发生的是氧化反应;Fe3+转化为Fe2+,铁元素的化合价降低,发生的是还原反应。
题点二 氧化还原反应中电子的转移
6.下列氧化还原反应中电子转移方向和数目表示错误的是
√
7.(2023·宁波高一期中)下列化学反应中电子转移的表示方法正确的是
√
部分氯元素化合价由0价升高为+1价,部分氯元素化合价从0价降低为-1价,该反应中1个Cl2转化为Ca(ClO)2,失去2×e-,1个Cl2转化为CaCl2,得到2×e-,A错误;Cu元素化合价由0价升高为+2价,S元素化合价由+6价降低为+4价,箭头应指向浓硫酸中的S,C错误;NO中N元素化合价由+2价降低为0价,NH3中N元素化合价从-3价升高为0价,该反应中电子由NH3中的N转移到NO中的N,共转移12e-,D错误。
√
题点三 氧化还原反应与四种基本反应类型的关系
8.对于下列反应的反应类型的判断,不正确的是
√
9.(2023·杭州高一检测)下列类型的反应中,一定发生电子转移的是
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
化合反应中不一定有元素化合价的变化,如二氧化碳与水化合生成碳酸,则没有电子的转移,故A错误;分解反应中不一定有元素化合价的变化,如碳酸氢铵分解,则没有电子的转移,故B错误;置换反应中肯定有单质参加反应,有单质生成,则一定属于氧化还原反应,即一定有电子转移,故C正确;复分解反应中是物质相互交换成分,如盐酸与氢氧化钠发生中和反应,则一定没有化合价的变化,即一定没有电子转移,故D错误。
10.我国的古诗词或谚语中包含丰富的化学知识,请在古诗词或谚语后填入化学反应类型。
古诗词或谚语 包含的化学反应类型
熬胆矾铁釜,久之亦化为铜
千锤万凿出深山,烈火焚烧若等闲
春蚕到死丝方尽,蜡炬成灰泪始干
爆竹声中一岁除,春风送暖入屠苏
置换反应
分解反应
氧化还原反应
氧化还原反应(或其他合理答案)
“熬胆矾铁釜,久之亦化为铜”其原理为铁置换出胆矾中的铜,属于置换反应;“千锤万凿出深山,烈火焚烧若等闲”说的是石灰石的分解反应;“春蚕到死丝方尽,蜡炬成灰泪始干”说的是物质的燃烧,属于氧化还原反应;“爆竹声中一岁除,春风送暖入屠苏”说的是炸药的爆炸,属于氧化还原反应。
11.(2023·山东邹平高一检测)化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
A.3个 B.4个
C.5个 D.6个
√
①Na2Cr2O7中Cr显+6价,CrCl3中
Cr显+3价,Cr的化合价降低,属于
氧化还原反应;②中Cr的化合价都
显+3价,化合价没有发生变化,不
属于氧化还原反应;③中Cr的化合价都显+3价,没有化合价的改变,不属于氧化还原反应;④CrCl3中Cr显+3价,Na2CrO4中Cr显+6价,化合价发生改变,属于氧化还原反应;⑤Cr的价态都是+6价,没有化合价发生变化,不属于氧化还原反应;⑥Cr的化合价由+6价―→+3价,化合价降低,属于氧化还原反应,因此属于氧化还原反应的是①④⑥,故选项A正确。
12.下列氧化还原反应中电子转移的方向及数目表示正确的是
√
Mn元素的化合价由+4价降低为+2价,得到2e-,Cl元素的化合价由-1价升高为0价,失去2×e-,故A正确;硝酸铵中铵根的N元素的化合价由-3价升高为0价,失去5×3e-,硝酸铵中硝酸根的N元素的化合价由+5价降低为0价,得到3×5e-,故B错误;I元素的化合价由0价降低为-1价,得到2×e-,S元素的化合价由+4价升高为+6价,失去2e-,不是O元素失电子,故C错误;氯酸钾中的Cl元素的化合价由+5价降低为0价,得到5e-,HCl中Cl元素的化合价由-1价升高为0价,失去5×e-,故D错误。
置换反应全部属于氧化还原反应,部分属于离子反应,图乙中A表示氧化还原反应,B表示置换反应,C表示离子反应。
13.人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应的关系可用图甲表示。图乙表示离子反应、氧化还原反应和置换反应三者之间的关系,则C表示
A.离子反应 B.氧化还原反应
C.置换反应 D.三者中的任一反应
√
反应①过程中Fe元素化合价由+2价升高到+3价,Fe2+失电子被氧化生成Fe3+。
14.(2023·河北任丘高一检测)阅读下列材料后回答问题。
一个体重50 kg的健康人,体内约含有2 g铁,这2 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如FeSO4。服用维生素C,可使食物中的Fe3+变成Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+ Fe3+的转化,反应①中铁元素被________。
氧化
(2)“服用维生素C,可使食物中的Fe3+变成Fe2+”这句话指出,维生素C在这一反应中被________,Fe3+发生________反应。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为_________________________。
“服用维生素C,可使食物中的Fe3+变成Fe2+”,该过程中Fe3+被还原,则维生素C被氧化。
氧化
还原
Fe+2H+===Fe2++H2↑
胃酸的主要成分是盐酸,铁与盐酸反应生成氯化亚铁和氢气,离子方程式为Fe+2H+===Fe2++H2↑。
反应Fe+Fe2(SO4)3===3FeSO4中,单质Fe中Fe元素由0价变为+2价,失去2e-;Fe2(SO4)3中Fe元素由+3价降低到+2价,得到1e-,结合得失电子守恒标出电子转移的方向和数目。
(4)可利用铁粉与Fe2(SO4)3溶液反应制取FeSO4,请在下列化学方程式中用双线桥法标出电子转移的方向和数目:Fe+Fe2(SO4)3===3FeSO4。
返回
答案:
第1课时 氧化还原反应
第一章 第三节 氧化还原反应
1. 能通过分析元素化合价的变化判断化学反应是否是氧化还原反应。
2. 知道氧化还原反应的本质是电子转移,能分析简单氧化还原反应中电子转移的方向和数目。
3. 理清氧化还原反应与四种基本反应类型之间的关系。
学习目标
任务一 从三个角度认识氧化还原反应
新知构建
1.从得、失氧的角度认识氧化还原反应
(1)一种物质_______氧发生氧化反应,必然有一种物质______氧发生还原反应。
(2)氧化反应和还原反应是在一个反应中同时发生,这种反应称为氧化还原反应。
得到
失去
交流研讨1
物质 反应物 发生的反应(选填“氧化反应”或“还原反应”)
得氧物质
失氧物质
C
氧化反应
CuO
还原反应
2.从元素化合价升降的角度认识氧化还原反应
(1)凡是有元素______________的反应都是氧化还原反应。
(2)物质所含元素化合价_______的反应称为氧化反应。
(3)物质所含元素化合价_______的反应称为还原反应。
(1)请标出反应2CuO+C 2Cu+CO2↑中各物质所含元素的化合价,比较反应前后价态有无变化。
提示:
交流研讨2
化合价变化
升高
降低
(2)在上述反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?请完成下列表格。
反应物 发生的反应
(“氧化反应”或“还原反应”) 元素化合价
C 氧化反应
CuO 还原反应
升高
降低
从元素化合价升降的角度分析反应Fe2O3+3CO 2Fe +3CO2是否属于氧化还原反应。若属于氧化还原反应,请分别指出发生氧化反应、还原反应的物质。
提示:
该反应属于氧化还原反应,CO发生氧化反应,Fe2O3发生还原反应。
交流研讨3
3.从电子转移的角度认识氧化还原反应
(1)氧化还原反应的实质:有_____________,包括____________或__________________。
(2)所含元素_____电子的物质发生_______反应,被_______。
(3)所含元素_____电子的物质发生_______反应,被_______。
【记忆口诀】 升—失—氧(氧化反应),降—得—还(还原反应)。
(1)从元素化合价升降的角度分析反应2Na+Cl2 2NaCl是否属于氧化还原反应。
提示:属于氧化还原反应。
交流研讨4
电子转移
电子得失
共用电子对偏移
失
氧化
氧化
得
还原
还原
(2)已知NaCl是通过得、失电子形成的。在反应2Na+Cl2 2NaCl中,由于钠原子________1个电子,化合价从0价升高到+1价;氯原子________1个电子,化合价从0价降低到-1价。
(3)对于反应2Na+Cl2 2NaCl:
①氯元素化合价________,是因为氯原子________电子,________发生还原反应,被________。
②钠元素化合价________,是因为钠原子________电子,Na发生________反应,被________。
失去
得到
降低
得到
Cl2
还原
升高
失去
氧化
氧化
(1)已知HCl是通过一个共用电子对形成的。HCl分子中,由于氯原子得电子的能力比氢强,共用电子对偏向氯原子,氯元素显________价,氢元素显________价。
(2)对于反应H2+Cl2 2HCl:
①氢元素化合价_______,是因为氢原子________电子,H2发生________反应,被________。
②氯元素化合价________,是因为氯原子________电子,______发生还原反应,被________。
交流研讨5
-1
+1
升高
失去
氧化
氧化
降低
得到
Cl2
还原
(1)从化合价变化角度判断以下反应是不是氧化还原反应,并思考氧化还原反应与四种基本反应类型的关系。
交流研讨6
①②
⑤
⑥
③
(2)请用图表示氧化还原反应与四种基本反应类型的关系。
提示:
典题应用
(1)C+H2O(g) CO+H2中发生氧化反应的物质是_____,被还原的元素是_____。
(2)MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑中发生氧化反应的物质是_______,发生还原反应的物质是________,被氧化的元素是______,被还原的元素是_______。
C
H
HCl
MnO2
Cl
Mn
2.有以下5个反应:
其中:属于氧化还原反应但不属于四种基本反应类型的有____(填序号)。
②
返回
任务二 氧化还原反应中电子转移的表示方法
新知构建
1.双线桥法
(1)双线桥法:表示反应前后____________由反应物转化为生成物时电子转移的情况。
(2)注意事项
①箭尾、箭头必须对应化合价变化的同种元素的原子,从反应物指向生
成物。
②必须注明“得到”或“失去”。
③电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的__________,b表示每个原子_____________________,当a=1或b=1时,可省略。
④被还原的物质和被氧化的物质得失电子数相等。
同一元素
原子个数
得到或失去的电子数
交流研讨
尝试用双线桥法标出C+2CuO 2Cu+CO2↑电子转移的方向及数目。
提示:
2.单线桥法
(1)连单线:箭尾由反应物中_______电子元素的元素符号出发,箭头指向反应物中_______电子元素的元素符号。
(2)不需要标明“得到”或“失去”字样,只标明电子转移的________。
例如,用单线桥法标出反应C+2CuO 2Cu+CO2↑电子转移的方向及数目如下:
失去
得到
总数目
典题应用
1.标出变价元素的化合价,用双线桥法标出电子转移的方向及数目。
答案:
答案:
(3)2H2S+SO2===3S+2H2O
答案:
2.用单线桥法标出电子转移的方向及数目。
2H2S+SO2===3S+2H2O
答案:
返回
随堂达标演练
√
1.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理。下列成语中涉及氧化还原反应的是
A.木已成舟 B.蜡炬成灰
C.铁杵成针 D.滴水成冰
木已成舟、铁杵成针和滴水成冰都是形状的改变,没有新物质生成,不属于化学变化,更不涉及氧化还原反应;蜡炬成灰涉及“燃烧”,是氧气参与的氧化还原反应。
物质所含元素化合价升高的反应为氧化反应。
√
2.下列变化过程中,属于氧化反应的是
A.MnO2―→Mn2+ B.CuO―→CuCl2
C.Ag+―→Ag2O D.Sn2+―→Sn4+
√
3.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影3区域的是
阴影区域的反应必须属于氧化还原反应,且不属于化合、分解、置换反应。A项,该反应属于分解反应,又属于氧化还原反应;B项,该反应属于分解反应,不属于氧化还原反应;C项,该反应属于化合反应,又属于氧化还原反应;D项,该反应属于氧化还原反应,不属于化合、分解、置换反应中的任意一种,故属于阴影3区域。
4.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
(1)被氧化的元素是______(填元素符号,下同),被还原的元素是______。
(2)发生氧化反应的物质是______。
(3)用双线桥法表示反应电子得失的方向和数目:___________________。
Cu
N
Cu
由化学方程式可知铜元素化合价升高,从0价变为+2价,被氧化;氮元素化合价降低,从+5价变为+2价,被还原;铜发生氧化反应,硝酸发生还原反应。
返回
课时测评
√
题点一 氧化还原反应的概念
1.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是
A.铜制器具产生铜绿 B.铁制菜刀生锈
C.金属冶炼 D.醋酸除水垢
A、B项涉及金属铜铁被氧化的过程,属于氧化还原反应;C项中涉及金属元素的化合价降低,属于氧化还原反应;D项发生的是复分解反应,不属于氧化还原反应。
√
2.氧化还原反应的本质是
A.有氧元素参与反应 B.有电子转移
C.物质状态发生变化 D.质量保持不变
√
Fe与CuSO4反应,Fe失电子被氧化,Cu2+得电子被还原。
3.(2023·西安市长安区高一调研)如图为反应Fe+CuSO4===Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示
A.Fe、S B.Cu、S
C.Fe、O D.Fe、Cu
√
4.(2023·山东诸城高一检测)下列反应中,一定发生电子转移的是
发生电子转移的反应一定是氧化还原反应,判断反应是否是氧化还原反应的关键是分析反应前后元素的化合价是否发生变化。B项,锰元素的化合价由+7价降低为+6价和+4价,氧元素的化合价由-2价升高为0价,发生了电子转移,其他选项中元素的化合价均无变化。
√
5.下列关于氧化还原反应的说法中正确的是
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+―→Fe2+的变化过程一定是氧化反应
D.元素化合价升高的反应是还原反应
化合价有变化的反应一定是氧化还原反应,但不一定有氧的得失;化合价升高发生的是氧化反应;Fe3+转化为Fe2+,铁元素的化合价降低,发生的是还原反应。
题点二 氧化还原反应中电子的转移
6.下列氧化还原反应中电子转移方向和数目表示错误的是
√
7.(2023·宁波高一期中)下列化学反应中电子转移的表示方法正确的是
√
部分氯元素化合价由0价升高为+1价,部分氯元素化合价从0价降低为-1价,该反应中1个Cl2转化为Ca(ClO)2,失去2×e-,1个Cl2转化为CaCl2,得到2×e-,A错误;Cu元素化合价由0价升高为+2价,S元素化合价由+6价降低为+4价,箭头应指向浓硫酸中的S,C错误;NO中N元素化合价由+2价降低为0价,NH3中N元素化合价从-3价升高为0价,该反应中电子由NH3中的N转移到NO中的N,共转移12e-,D错误。
√
题点三 氧化还原反应与四种基本反应类型的关系
8.对于下列反应的反应类型的判断,不正确的是
√
9.(2023·杭州高一检测)下列类型的反应中,一定发生电子转移的是
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
化合反应中不一定有元素化合价的变化,如二氧化碳与水化合生成碳酸,则没有电子的转移,故A错误;分解反应中不一定有元素化合价的变化,如碳酸氢铵分解,则没有电子的转移,故B错误;置换反应中肯定有单质参加反应,有单质生成,则一定属于氧化还原反应,即一定有电子转移,故C正确;复分解反应中是物质相互交换成分,如盐酸与氢氧化钠发生中和反应,则一定没有化合价的变化,即一定没有电子转移,故D错误。
10.我国的古诗词或谚语中包含丰富的化学知识,请在古诗词或谚语后填入化学反应类型。
古诗词或谚语 包含的化学反应类型
熬胆矾铁釜,久之亦化为铜
千锤万凿出深山,烈火焚烧若等闲
春蚕到死丝方尽,蜡炬成灰泪始干
爆竹声中一岁除,春风送暖入屠苏
置换反应
分解反应
氧化还原反应
氧化还原反应(或其他合理答案)
“熬胆矾铁釜,久之亦化为铜”其原理为铁置换出胆矾中的铜,属于置换反应;“千锤万凿出深山,烈火焚烧若等闲”说的是石灰石的分解反应;“春蚕到死丝方尽,蜡炬成灰泪始干”说的是物质的燃烧,属于氧化还原反应;“爆竹声中一岁除,春风送暖入屠苏”说的是炸药的爆炸,属于氧化还原反应。
11.(2023·山东邹平高一检测)化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
A.3个 B.4个
C.5个 D.6个
√
①Na2Cr2O7中Cr显+6价,CrCl3中
Cr显+3价,Cr的化合价降低,属于
氧化还原反应;②中Cr的化合价都
显+3价,化合价没有发生变化,不
属于氧化还原反应;③中Cr的化合价都显+3价,没有化合价的改变,不属于氧化还原反应;④CrCl3中Cr显+3价,Na2CrO4中Cr显+6价,化合价发生改变,属于氧化还原反应;⑤Cr的价态都是+6价,没有化合价发生变化,不属于氧化还原反应;⑥Cr的化合价由+6价―→+3价,化合价降低,属于氧化还原反应,因此属于氧化还原反应的是①④⑥,故选项A正确。
12.下列氧化还原反应中电子转移的方向及数目表示正确的是
√
Mn元素的化合价由+4价降低为+2价,得到2e-,Cl元素的化合价由-1价升高为0价,失去2×e-,故A正确;硝酸铵中铵根的N元素的化合价由-3价升高为0价,失去5×3e-,硝酸铵中硝酸根的N元素的化合价由+5价降低为0价,得到3×5e-,故B错误;I元素的化合价由0价降低为-1价,得到2×e-,S元素的化合价由+4价升高为+6价,失去2e-,不是O元素失电子,故C错误;氯酸钾中的Cl元素的化合价由+5价降低为0价,得到5e-,HCl中Cl元素的化合价由-1价升高为0价,失去5×e-,故D错误。
置换反应全部属于氧化还原反应,部分属于离子反应,图乙中A表示氧化还原反应,B表示置换反应,C表示离子反应。
13.人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应的关系可用图甲表示。图乙表示离子反应、氧化还原反应和置换反应三者之间的关系,则C表示
A.离子反应 B.氧化还原反应
C.置换反应 D.三者中的任一反应
√
反应①过程中Fe元素化合价由+2价升高到+3价,Fe2+失电子被氧化生成Fe3+。
14.(2023·河北任丘高一检测)阅读下列材料后回答问题。
一个体重50 kg的健康人,体内约含有2 g铁,这2 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如FeSO4。服用维生素C,可使食物中的Fe3+变成Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+ Fe3+的转化,反应①中铁元素被________。
氧化
(2)“服用维生素C,可使食物中的Fe3+变成Fe2+”这句话指出,维生素C在这一反应中被________,Fe3+发生________反应。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为_________________________。
“服用维生素C,可使食物中的Fe3+变成Fe2+”,该过程中Fe3+被还原,则维生素C被氧化。
氧化
还原
Fe+2H+===Fe2++H2↑
胃酸的主要成分是盐酸,铁与盐酸反应生成氯化亚铁和氢气,离子方程式为Fe+2H+===Fe2++H2↑。
反应Fe+Fe2(SO4)3===3FeSO4中,单质Fe中Fe元素由0价变为+2价,失去2e-;Fe2(SO4)3中Fe元素由+3价降低到+2价,得到1e-,结合得失电子守恒标出电子转移的方向和数目。
(4)可利用铁粉与Fe2(SO4)3溶液反应制取FeSO4,请在下列化学方程式中用双线桥法标出电子转移的方向和数目:Fe+Fe2(SO4)3===3FeSO4。
返回
答案:
