人教版高中化学必修第一册第一章物质及其变化章末综合提升课件(66页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第一章物质及其变化章末综合提升课件(66页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 00:00:00 | ||
图片预览










文档简介
(共66张PPT)
章末综合提升
第一章 物质及其变化
概念梳理 构建体系
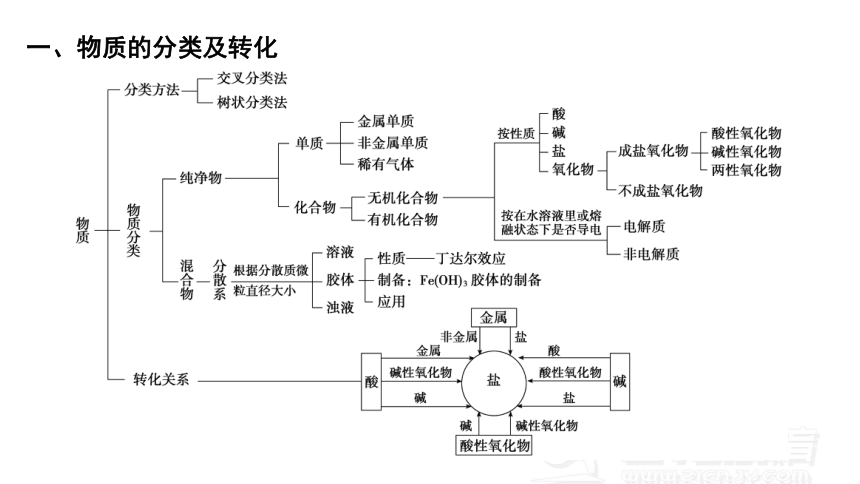
一、物质的分类及转化
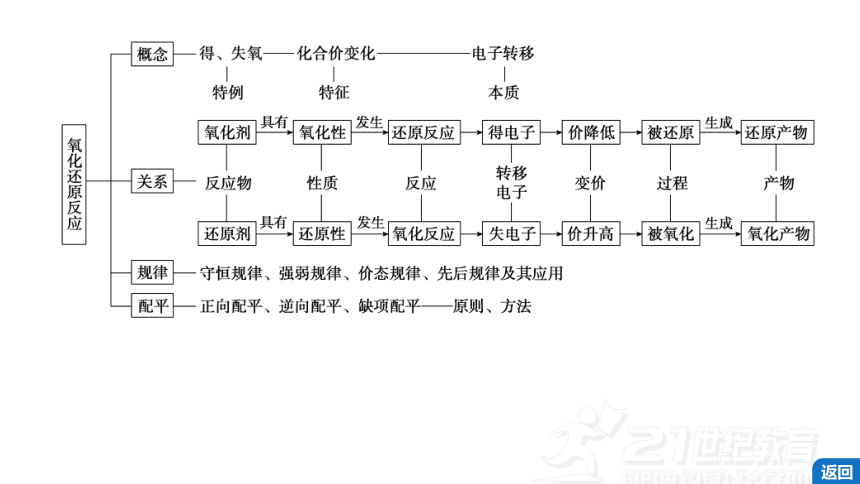
二、两类重要的化学反应
返回
分层突破 提升能力
一、溶液中离子能否大量共存的判断
1.溶液中离子能否大量共存的判断方法
判断溶液中的离子能否大量共存,事实上是看离子之间能否反应,若反应,则不能大量共存;若不反应,则能大量共存。
2.离子不能大量共存的五种情况
(5)“无色透明”溶液不能大量存在有色离子,例如:
针对练1. (2023·海淀区第五十七中学高一月考)下列各组离子能在水溶液中大量共存的是
√
针对练2. (2023·丰城市东煌学校高一月考)下列各组离子,能在溶液中大量共存的是
银离子和碘离子生成碘化银沉淀,故A错误;氢离子和碳酸根离子生成二氧化碳气体,故B错误;四种离子相互之间不反应,能共存,故C正确;Ba2+与SO 生成硫酸钡沉淀,不能大量共存,故D错误。
√
针对练3. 下列各组离子在指定溶液中一定能大量共存的是
√
二、信息型氧化还原反应方程式的书写
一判:根据题给信息,联想所学知识,判断主要的反应物、生成物。
若反应物、生成物中主要元素化合价不一致的,要考虑是否为氧化还原反应,就要写出氧化剂、还原剂、氧化产物、还原产物。
二平:根据质量守恒定律和氧化还原反应规律配平主要物质的化学计量数。
三补:根据溶液的介质条件以及电荷守恒补足反应物或生成物,一般酸性环境可以消耗或生成酸,碱性环境可以消耗或生成碱。
针对练4. (1)某反应的反应物与生成物有K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,写出并配平该化学方程式:_________________________________________________。
(2)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O 还原成Cr3+,该反应的离子方程式为__________________________________________。
K2Cr2O7+14HCl===3Cl2↑+2KCl+2CrCl3+7H2O
(3)在稀盐酸中,NaNO2会与Fe2+反应生成一种无色气体M,气体M对该反应有催化作用,其催化反应过程如图所示:
①反应过程Ⅱ中,铁元素的化合价未发生变化,则M的化学式为 ,过程Ⅱ的离子方程式为_________________________。
②根据图示信息,写出反应过程Ⅰ的离子方程式:____________________
________________________。
③写出在酸性条件下,O2氧化Fe2+的离子方程式: ___________________
_______________。
NO
Fe2++NO===Fe(NO)2+
O2+4Fe(NO)2++4H+
===4Fe3++4NO+2H2O
4Fe2++O2+4H+===
4Fe3++2H2O
返回
教考衔接 明确考向
√
1.(2020·浙江1月学业水平考试)下列分散系能产生“丁达尔效应”的是
A.氢氧化铁胶体 B.稀硫酸
C.食盐水 D.葡萄糖溶液
高锰酸钾溶液的有效成分为KMnO4,其在水溶液中电离出K+和MnO ,故KMnO4属于盐,A符合题意;过氧乙酸溶液的有效成分是CH3COOOH,在水溶液中电离出CH3COOO-和H+,即水溶液中的阳离子全部为H+,故其属于酸,B不符合题意;双氧水是由H和O组成的化合物,故其属于氧化物,C不符合题意;医用酒精的有效成分为CH3CH2OH,其属于有机物,不属于盐,D不符合题意。
√
2.(2022·浙江6月选考)下列消毒剂的有效成分属于盐的是
A.高锰酸钾溶液 B.过氧乙酸溶液
C.双氧水 D.医用酒精
CH4属于有机物,在水溶液中和熔融状态下均不导电的化合物,为非电解质,故A符合题意;KI属于盐,在水溶液中和熔融状态下能导电的化合物,为电解质,故B不符合题意;NaOH属于碱,在水溶液中和熔融状态下能导电的化合物,为电解质,故C不符合题意;CH3COOH属于酸,在水溶液中能电离出H+和CH3COO-,即CH3COOH是在水溶液中导电的化合物,为电解质,故D不符合题意。
√
3.(2022·浙江1月选考)下列物质属于非电解质的是
A.CH4 B.KI
C.NaOH D.CH3COOH
4.(2021·山东学业考试)下列离子在溶液中能大量共存的是
√
5.(2020·江苏卷,改编)常温下,下列各组离子在指定溶液中能大量共存的是
√
6.(2023·全国乙卷)下列应用中涉及到氧化还原反应的是
A.使用明矾对水进行净化 B.雪天道路上撒盐融雪
C.暖贴中的铁粉遇空气放热 D.荧光指示牌被照发光
√
明矾水解产生的Al(OH)3胶体能吸附水中的悬浮物,从而达到净水的目的,与氧化还原反应无关,A错误;撒盐可降低雪的熔点,使雪融化,未发生化学变化,与氧化还原反应无关,B错误;使用暖贴时,铁粉与空气中的O2发生氧化还原反应,C正确;荧光指示牌被照发光没有元素化合价的变化,与氧化还原反应无关,D错误。
7.(2021·1月选考,改编)关于反应8NH3+6NO2===7N2+12H2O,下列说法正确的是
A.NH3中H元素被氧化
B.NO2在反应过程中失去电子
C.还原剂与氧化剂的个数之比为3∶4
D.氧化产物与还原产物的质量之比为4∶3
√
NH3中H元素的化合价没有发生变化,故其未被氧化,被氧化的是N元素,A错误;NO2在反应过程中得到电子,B错误;该反应中,NH3是还原剂,NO2是氧化剂,由化学方程式可知,还原剂与氧化剂的个数之比为4∶3,C错误;该反应中氧化产物和还原产物均为N2。还原剂被氧化后得到氧化产物,氧化剂被还原后得到还原产物,还原剂与氧化剂的个数之比为4∶3,因此,氧化产物与还原产物的质量之比为4∶3 ,D正确。
8.(2022·湖南卷,改编)科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的NO转化为N2进入大气层,反应过程如图所示。
√
返回
单元检测卷
1.一种矿泉水标签上印有的主要矿物质成分及含量(单位为mg L-1)为Ca-48.00、K-39.00、Mg-3.10、Zn-0.08、F-0.02等,则对此矿泉水的叙述正确的是
A.该矿泉水不导电 B.该矿泉水能导电
C.该矿泉水是电解质 D.该矿泉水是非电解质
√
由题中信息知,该矿泉水不是纯净物,故该矿泉水既不是电解质也不是非电解质,C、D错误;该矿泉水中存在钙离子、钾离子、镁离子等,因此可以导电,A错误。
2.入春以来,我国不少地方多次出现大雾天气,致使高速公路关闭,航班停飞。雾中小水滴直径范围是
A.小于1 nm B.1~100 nm
C.大于100 nm D.无法确定
雾是胶体,胶体粒子直径在1~100 nm。
√
3.当光束通过下列分散系时,能观察到丁达尔效应的是
A.矿泉水 B.蔗糖溶液
C.Fe(OH)3胶体 D.稀H2SO4
矿泉水是溶液,不可能产生丁达尔效应,选项A错误;蔗糖溶液不可能产生丁达尔效应,选项B错误;当光束通过Fe(OH)3胶体时能观察到丁达尔效应,选项C正确;稀H2SO4是溶液,不可能产生丁达尔效应,选项D错误。
√
4.在碱性溶液中能大量共存,并且溶液为无色透明的组合是
Cu2+为有色离子,不满足溶液无色的条件,故A错误;Ba2+、Na+、NO 、Cl-之间不反应,都不与OH-反应,在溶液中可以大量共存,故B正确;Al3+与OH-反应,在碱性溶液中不能大量共存,故C错误;Mg2+与OH-反应,在碱性溶液中不能大量共存,故D错误。
√
5.实现下列变化需要加入氧化剂的是
氯元素由0价降低到-1价,需加入还原剂或Cl2自身歧化不需额外加还原剂来实现,A错误;硫元素的化合价由+4价升高到+6价,B正确;氮元素的化合价不变,C错误;碳元素的化合价不变,D错误。
√
6.工业上冶炼钛的反应如下:TiCl4+2Mg Ti+2MgCl2。下列有关该反应的说法正确的是
A.TiCl4是还原剂 B.Mg被氧化
C.TiCl4发生氧化反应 D.Mg得到电子
TiCl4中Ti的化合价由+4价变为0价,化合价降低,为氧化剂,发生还原反应;Mg失去电子,化合价升高,被氧化。
√
7.下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是
A.石灰水和稀盐酸混合
B.小苏打溶液和柠檬水混合制汽水
C.人工盐(含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾)溶液与BaCl2溶液混合
D.氯化钠溶液和蔗糖水的混合溶液可治疗腹泻
A项,发生了离子反应:OH-+H+===H2O,生成水,溶液总质量不变,符合题意;B项,HCO 与酸反应产生CO2气体,发生了离子反应,CO2逸出,使溶液总质量变小,不符合题意;C项,SO 与Ba2+反应生成BaSO4沉淀,发生了离子反应,溶液总质量变小,不符合题意;D项,NaCl与蔗糖不发生反应,不符合题意。
√
√
题干所给反应中,NH3中N元素的化合价升高,H元素的化合价不变,故NH3作还原剂。A项,NH3中N元素的化合价不变,H元素的化合价降低,故NH3作氧化剂;B项,NH3中N元素的化合价升高,H元素的化合价不变,故NH3作还原剂;C项中NH3中N、H两元素化合价没有变化;D项,NH3中N元素的化合价不变,H元素的化合价降低,故NH3作氧
化剂。
9.下列各组均为两种化合物溶于水时电离出的离子,其中按照仅由酸、碱、盐依次电离的是
酸中阳离子只有H+,②符合;碱中阴离子只有OH-,③符合;盐中既有金属阳离子又有酸根阴离子,④符合;①中可能由碱、盐组成,不符合题意。
√
10.分类法是化学学习中的一种重要方法,下列分类图正确的是
√
氧化物中CO既不是酸性氧化物,也不是碱性氧化物,A错误;纯净物中的化合物分为电解质和非电解质,单质也属于纯净物,但它既不是电解质,也不是非电解质,B错误;置换反应一定是氧化还原反应,而氧化还原反应不一定是置换反应,C正确;化学反应不仅仅包括四种基本反应类型,D错误。
11.下列有关物质分类的说法正确的是
A.二氧化硫、二氧化硅、一氧化碳均为酸性氧化物
B.雾、稀豆浆、氯化钠溶液均为胶体
C.分子中含三个氢原子的酸不一定是三元酸
D.烧碱、醋酸、稀硫酸均属于电解质
一氧化碳不是酸性氧化物,A错误。氯化钠溶液不是胶体,B错误。分子中含三个氢原子的酸不一定是三元酸,C正确。稀硫酸属于溶液,为混合物,不属于电解质,D错误。
√
12.下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是
A.Cu(OH)2和盐酸;Cu(OH)2和CH3COOH
B.BaCl2和Na2SO4;Ba(OH)2和CuSO4
C.NaHCO3和NaHSO4;Na2CO3和NaHSO4
D.NaHCO3(过量)和Ca(OH)2;Ca(HCO3)2和NaOH(过量)
盐酸是强酸,离子方程式中用离子表示;CH3COOH是弱酸,离子方程式中用化学式表示,不能用同一离子方程式表示,故A错误。BaCl2和Na2SO4反应生成的NaCl易溶于水,Ba(OH)2和CuSO4反应生成的Cu(OH)2难溶于水,不能用同一离子方程式表示,故B错误。
√
13.某溶液中含有较大量的Cl-、CO 、OH-三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来。下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
√
14.准确书写离子方程式是学好化学的基本素养之一,下列离子方程式书写正确的是
√
15.(14分)请回答下列问题:
(1)下图所示为按树状分类法对一组物质进行的分类。
①类别1 ,类别2 ,分类标准2 。
混合物
单质
元素种类
类别1中空气、氯化钠溶液都是由多种物质组成,属于混合物;类别2中氮气、铁均是仅由一种元素组成的纯净物,属于单质;化合物是由多种元素组成的纯净物,则分类标准2为元素种类。
②上述物质中属于电解质的是 ,属于非电解质的是 。
NaHSO4、Ba(OH)2
SO3
氢氧化钡是强碱,硫酸氢钠是酸式盐,属于电解质;三氧化硫属于
非电解质,单质和混合物既不是电解质也不是非电解质。
③向NaHSO4溶液中加Fe可产生气体,对应的离子方程式为____________
_____________。
Fe+2H+===
Fe2++H2↑
硫酸氢钠是强酸的酸式盐,和铁反应生成氢气、硫酸钠和硫酸亚铁,离子方程式为Fe+2H+===Fe2++H2↑。
④将NaHSO4溶液和Ba(OH)2溶液混合,恰好呈中性,对应的离子方程式为_____________________________________________。
+2H2O
将NaHSO4溶液和Ba(OH)2溶液混合,恰好呈中性时生成硫酸钠、硫酸钡和水,反应的离子方程式为2H++SO +Ba2++2OH-===BaSO4↓+2H2O。
(2)请对以下过程形成的分散系进行分类。
①花生油加入水中后充分搅拌;
②向蒸馏水中加入硝酸钾至恰好饱和;
③饱和氯化铁溶液中加入氢氧化钠溶液;
④氢氧化钡溶液中通入过量的CO2;
⑤用滤纸过滤氢氧化铁胶体后得到的滤液;
⑥将纳米材料分散在塑料中制备复合材料;
⑦碘和酒精的混合物。
属于溶液的是 (填序号,下同);属于胶体的是 。
②④⑦
⑤⑥
分散系可以分为浊液、胶体、溶液。①花生油加入水中后充分搅拌,形成乳浊液;③饱和氯化铁溶液中加入氢氧化钠溶液生成氢氧化铁沉淀,形成悬浊液;②向蒸馏水中加入硝酸钾至恰好饱和,得到硝酸钾溶液;④氢氧化钡溶液中通入过量的CO2,得到碳酸氢钡溶液;⑦碘和酒精的混合物是碘的酒精溶液;⑤用滤纸过滤氢氧化铁胶体后得到的滤液是氢氧化铁胶体;⑥将纳米材料分散在塑料中制备复合材料,纳米材料的粒子直径在胶体的粒子直径范围内,属于胶体。
(1)试分析原溶液中一定含有的离子是 ,一定不含有的阴离子是 ,可能含有的离子是 。
Mg2+、Cl-
Na+、K+
(2)有的同学认为实验③可以省略,你认为是否正确 (填“是”或“否”),说明理由:_____________________________________。
是
根据电中性原则原溶液中一定含有Cl-
(3)写出①中反应的离子方程式:_____________________________。
Mg2++2OH-===Mg(OH)2↓
17.(16分)酸和碱能发生中和反应,它
在日常生活和工农业生产中有着广泛的
应用。下图表示硫酸和氢氧化钠溶液发
生反应时烧杯中溶液的pH随加入液体体
积的变化曲线及相关的实验操作。请从
中获取信息,回答下列问题:
(1)烧杯中盛放的是 溶液。
(2)小明向氢氧化钠溶液中加入稀硫酸,该中和反应的实质是___________
_________________________________________。
氢氧化钠
氧根离子反应生成水(或H++OH-===H2O)
氢离子和氢
然后,对反应过程中废液的溶质进行了如下探究:
【提出问题】 氢氧化钠溶液和稀硫酸混合后,溶质是什么?
【查阅资料】 硫酸钠溶液呈中性。
【猜想假设】 猜想I :硫酸钠和氢氧化钠;
猜想II :硫酸钠和硫酸;
猜想III :___________。
硫酸钠
【设计实验】
【反思与评价】 小芳认为实验操作②得出的结论不成立,理由是_______
____________________________________。
可以改为向废液中加入少量 ,溶液变为红色,证明猜想II成立。
实验操作 实验现象 实验结论
①取少量废液于试管中,滴入几滴酚酞溶液 溶液无明显变化 猜想 不成立
②另取少量废液于试管中,滴入几滴氯化钡溶液 _________________ 猜想II成立
I
有白色沉淀生成
硫酸都能和氯化钡反应产生白色沉淀
硫酸钠、
石蕊溶液
18.(14分)(1)某化学反应的反应物和产物如下:KMnO4+KI+H2SO4―→MnSO4+I2+KIO3+K2SO4+H2O。
①该反应的氧化剂是 。
KMnO4
KMnO4+KI+H2SO4―→MnSO4+I2+KIO3+K2SO4+H2O反应中,Mn元素由+7价降低为+2价,锰元素被还原,还原产物是MnSO4,KMnO4是氧化剂。
②如果该反应方程式中I2和KIO3的化学计量数都是5。
a.KMnO4的化学计量数是 。
b.在下面的化学式上用单线桥法标出电子转移的方向和数目
KMnO4+KI+H2SO4→
8
答案:
在KMnO4+KI+H2SO4―→MnSO4+I2+KIO3+K2SO4+H2O中,KMnO4是氧化剂,KI作还原剂。I元素由-1价升高到0价和+5价,如果该反应方程式中I2和KIO3的化学计量数都是5,则10KI~5I2,5KI~5KIO3,反应中碘元素失去的电子总数为[0-(-1)]×10+[+5-(-1)]×5=40。Mn元素由+7价降低为+2价,根据氧化剂得到的电子总数等于还原剂失去的电子总数,则有8KMnO4~8MnSO4,故KMnO4的化学计量数为8。在氧化还原反应中,用单线桥法表示电子转移是从还原剂中变价的元素出发指向氧化剂中变价的
元素,因此该反应中电子转移的方向和数目可表示为 。
(2)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4(Cr元素的化合价为+6价)、Cr(OH)3(Cr元素的化合价为+3价)、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中的还原剂是 。
在H2O2→O2的过程中,氧元素的化合价由-1价升高到了0价,则H2O2是还原剂。
H2O2
②该反应中,发生还原反应的过程是 → 。
③写出该反应的化学方程式:______________________________________。
反应中Cr元素化合价降低,H2CrO4被还原生成Cr(OH)3,该过程即为发生还原反应的过程。
返回
H2CrO4
Cr(OH)3
2H2CrO4+3H2O2===2Cr(OH)3+3O2↑+2H2O
发生反应的化学方程式为2H2CrO4+3H2O2===2Cr(OH)3+3O2↑+2H2O。
章末综合提升
第一章 物质及其变化
概念梳理 构建体系
一、物质的分类及转化
二、两类重要的化学反应
返回
分层突破 提升能力
一、溶液中离子能否大量共存的判断
1.溶液中离子能否大量共存的判断方法
判断溶液中的离子能否大量共存,事实上是看离子之间能否反应,若反应,则不能大量共存;若不反应,则能大量共存。
2.离子不能大量共存的五种情况
(5)“无色透明”溶液不能大量存在有色离子,例如:
针对练1. (2023·海淀区第五十七中学高一月考)下列各组离子能在水溶液中大量共存的是
√
针对练2. (2023·丰城市东煌学校高一月考)下列各组离子,能在溶液中大量共存的是
银离子和碘离子生成碘化银沉淀,故A错误;氢离子和碳酸根离子生成二氧化碳气体,故B错误;四种离子相互之间不反应,能共存,故C正确;Ba2+与SO 生成硫酸钡沉淀,不能大量共存,故D错误。
√
针对练3. 下列各组离子在指定溶液中一定能大量共存的是
√
二、信息型氧化还原反应方程式的书写
一判:根据题给信息,联想所学知识,判断主要的反应物、生成物。
若反应物、生成物中主要元素化合价不一致的,要考虑是否为氧化还原反应,就要写出氧化剂、还原剂、氧化产物、还原产物。
二平:根据质量守恒定律和氧化还原反应规律配平主要物质的化学计量数。
三补:根据溶液的介质条件以及电荷守恒补足反应物或生成物,一般酸性环境可以消耗或生成酸,碱性环境可以消耗或生成碱。
针对练4. (1)某反应的反应物与生成物有K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,写出并配平该化学方程式:_________________________________________________。
(2)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O 还原成Cr3+,该反应的离子方程式为__________________________________________。
K2Cr2O7+14HCl===3Cl2↑+2KCl+2CrCl3+7H2O
(3)在稀盐酸中,NaNO2会与Fe2+反应生成一种无色气体M,气体M对该反应有催化作用,其催化反应过程如图所示:
①反应过程Ⅱ中,铁元素的化合价未发生变化,则M的化学式为 ,过程Ⅱ的离子方程式为_________________________。
②根据图示信息,写出反应过程Ⅰ的离子方程式:____________________
________________________。
③写出在酸性条件下,O2氧化Fe2+的离子方程式: ___________________
_______________。
NO
Fe2++NO===Fe(NO)2+
O2+4Fe(NO)2++4H+
===4Fe3++4NO+2H2O
4Fe2++O2+4H+===
4Fe3++2H2O
返回
教考衔接 明确考向
√
1.(2020·浙江1月学业水平考试)下列分散系能产生“丁达尔效应”的是
A.氢氧化铁胶体 B.稀硫酸
C.食盐水 D.葡萄糖溶液
高锰酸钾溶液的有效成分为KMnO4,其在水溶液中电离出K+和MnO ,故KMnO4属于盐,A符合题意;过氧乙酸溶液的有效成分是CH3COOOH,在水溶液中电离出CH3COOO-和H+,即水溶液中的阳离子全部为H+,故其属于酸,B不符合题意;双氧水是由H和O组成的化合物,故其属于氧化物,C不符合题意;医用酒精的有效成分为CH3CH2OH,其属于有机物,不属于盐,D不符合题意。
√
2.(2022·浙江6月选考)下列消毒剂的有效成分属于盐的是
A.高锰酸钾溶液 B.过氧乙酸溶液
C.双氧水 D.医用酒精
CH4属于有机物,在水溶液中和熔融状态下均不导电的化合物,为非电解质,故A符合题意;KI属于盐,在水溶液中和熔融状态下能导电的化合物,为电解质,故B不符合题意;NaOH属于碱,在水溶液中和熔融状态下能导电的化合物,为电解质,故C不符合题意;CH3COOH属于酸,在水溶液中能电离出H+和CH3COO-,即CH3COOH是在水溶液中导电的化合物,为电解质,故D不符合题意。
√
3.(2022·浙江1月选考)下列物质属于非电解质的是
A.CH4 B.KI
C.NaOH D.CH3COOH
4.(2021·山东学业考试)下列离子在溶液中能大量共存的是
√
5.(2020·江苏卷,改编)常温下,下列各组离子在指定溶液中能大量共存的是
√
6.(2023·全国乙卷)下列应用中涉及到氧化还原反应的是
A.使用明矾对水进行净化 B.雪天道路上撒盐融雪
C.暖贴中的铁粉遇空气放热 D.荧光指示牌被照发光
√
明矾水解产生的Al(OH)3胶体能吸附水中的悬浮物,从而达到净水的目的,与氧化还原反应无关,A错误;撒盐可降低雪的熔点,使雪融化,未发生化学变化,与氧化还原反应无关,B错误;使用暖贴时,铁粉与空气中的O2发生氧化还原反应,C正确;荧光指示牌被照发光没有元素化合价的变化,与氧化还原反应无关,D错误。
7.(2021·1月选考,改编)关于反应8NH3+6NO2===7N2+12H2O,下列说法正确的是
A.NH3中H元素被氧化
B.NO2在反应过程中失去电子
C.还原剂与氧化剂的个数之比为3∶4
D.氧化产物与还原产物的质量之比为4∶3
√
NH3中H元素的化合价没有发生变化,故其未被氧化,被氧化的是N元素,A错误;NO2在反应过程中得到电子,B错误;该反应中,NH3是还原剂,NO2是氧化剂,由化学方程式可知,还原剂与氧化剂的个数之比为4∶3,C错误;该反应中氧化产物和还原产物均为N2。还原剂被氧化后得到氧化产物,氧化剂被还原后得到还原产物,还原剂与氧化剂的个数之比为4∶3,因此,氧化产物与还原产物的质量之比为4∶3 ,D正确。
8.(2022·湖南卷,改编)科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的NO转化为N2进入大气层,反应过程如图所示。
√
返回
单元检测卷
1.一种矿泉水标签上印有的主要矿物质成分及含量(单位为mg L-1)为Ca-48.00、K-39.00、Mg-3.10、Zn-0.08、F-0.02等,则对此矿泉水的叙述正确的是
A.该矿泉水不导电 B.该矿泉水能导电
C.该矿泉水是电解质 D.该矿泉水是非电解质
√
由题中信息知,该矿泉水不是纯净物,故该矿泉水既不是电解质也不是非电解质,C、D错误;该矿泉水中存在钙离子、钾离子、镁离子等,因此可以导电,A错误。
2.入春以来,我国不少地方多次出现大雾天气,致使高速公路关闭,航班停飞。雾中小水滴直径范围是
A.小于1 nm B.1~100 nm
C.大于100 nm D.无法确定
雾是胶体,胶体粒子直径在1~100 nm。
√
3.当光束通过下列分散系时,能观察到丁达尔效应的是
A.矿泉水 B.蔗糖溶液
C.Fe(OH)3胶体 D.稀H2SO4
矿泉水是溶液,不可能产生丁达尔效应,选项A错误;蔗糖溶液不可能产生丁达尔效应,选项B错误;当光束通过Fe(OH)3胶体时能观察到丁达尔效应,选项C正确;稀H2SO4是溶液,不可能产生丁达尔效应,选项D错误。
√
4.在碱性溶液中能大量共存,并且溶液为无色透明的组合是
Cu2+为有色离子,不满足溶液无色的条件,故A错误;Ba2+、Na+、NO 、Cl-之间不反应,都不与OH-反应,在溶液中可以大量共存,故B正确;Al3+与OH-反应,在碱性溶液中不能大量共存,故C错误;Mg2+与OH-反应,在碱性溶液中不能大量共存,故D错误。
√
5.实现下列变化需要加入氧化剂的是
氯元素由0价降低到-1价,需加入还原剂或Cl2自身歧化不需额外加还原剂来实现,A错误;硫元素的化合价由+4价升高到+6价,B正确;氮元素的化合价不变,C错误;碳元素的化合价不变,D错误。
√
6.工业上冶炼钛的反应如下:TiCl4+2Mg Ti+2MgCl2。下列有关该反应的说法正确的是
A.TiCl4是还原剂 B.Mg被氧化
C.TiCl4发生氧化反应 D.Mg得到电子
TiCl4中Ti的化合价由+4价变为0价,化合价降低,为氧化剂,发生还原反应;Mg失去电子,化合价升高,被氧化。
√
7.下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是
A.石灰水和稀盐酸混合
B.小苏打溶液和柠檬水混合制汽水
C.人工盐(含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾)溶液与BaCl2溶液混合
D.氯化钠溶液和蔗糖水的混合溶液可治疗腹泻
A项,发生了离子反应:OH-+H+===H2O,生成水,溶液总质量不变,符合题意;B项,HCO 与酸反应产生CO2气体,发生了离子反应,CO2逸出,使溶液总质量变小,不符合题意;C项,SO 与Ba2+反应生成BaSO4沉淀,发生了离子反应,溶液总质量变小,不符合题意;D项,NaCl与蔗糖不发生反应,不符合题意。
√
√
题干所给反应中,NH3中N元素的化合价升高,H元素的化合价不变,故NH3作还原剂。A项,NH3中N元素的化合价不变,H元素的化合价降低,故NH3作氧化剂;B项,NH3中N元素的化合价升高,H元素的化合价不变,故NH3作还原剂;C项中NH3中N、H两元素化合价没有变化;D项,NH3中N元素的化合价不变,H元素的化合价降低,故NH3作氧
化剂。
9.下列各组均为两种化合物溶于水时电离出的离子,其中按照仅由酸、碱、盐依次电离的是
酸中阳离子只有H+,②符合;碱中阴离子只有OH-,③符合;盐中既有金属阳离子又有酸根阴离子,④符合;①中可能由碱、盐组成,不符合题意。
√
10.分类法是化学学习中的一种重要方法,下列分类图正确的是
√
氧化物中CO既不是酸性氧化物,也不是碱性氧化物,A错误;纯净物中的化合物分为电解质和非电解质,单质也属于纯净物,但它既不是电解质,也不是非电解质,B错误;置换反应一定是氧化还原反应,而氧化还原反应不一定是置换反应,C正确;化学反应不仅仅包括四种基本反应类型,D错误。
11.下列有关物质分类的说法正确的是
A.二氧化硫、二氧化硅、一氧化碳均为酸性氧化物
B.雾、稀豆浆、氯化钠溶液均为胶体
C.分子中含三个氢原子的酸不一定是三元酸
D.烧碱、醋酸、稀硫酸均属于电解质
一氧化碳不是酸性氧化物,A错误。氯化钠溶液不是胶体,B错误。分子中含三个氢原子的酸不一定是三元酸,C正确。稀硫酸属于溶液,为混合物,不属于电解质,D错误。
√
12.下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是
A.Cu(OH)2和盐酸;Cu(OH)2和CH3COOH
B.BaCl2和Na2SO4;Ba(OH)2和CuSO4
C.NaHCO3和NaHSO4;Na2CO3和NaHSO4
D.NaHCO3(过量)和Ca(OH)2;Ca(HCO3)2和NaOH(过量)
盐酸是强酸,离子方程式中用离子表示;CH3COOH是弱酸,离子方程式中用化学式表示,不能用同一离子方程式表示,故A错误。BaCl2和Na2SO4反应生成的NaCl易溶于水,Ba(OH)2和CuSO4反应生成的Cu(OH)2难溶于水,不能用同一离子方程式表示,故B错误。
√
13.某溶液中含有较大量的Cl-、CO 、OH-三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来。下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
√
14.准确书写离子方程式是学好化学的基本素养之一,下列离子方程式书写正确的是
√
15.(14分)请回答下列问题:
(1)下图所示为按树状分类法对一组物质进行的分类。
①类别1 ,类别2 ,分类标准2 。
混合物
单质
元素种类
类别1中空气、氯化钠溶液都是由多种物质组成,属于混合物;类别2中氮气、铁均是仅由一种元素组成的纯净物,属于单质;化合物是由多种元素组成的纯净物,则分类标准2为元素种类。
②上述物质中属于电解质的是 ,属于非电解质的是 。
NaHSO4、Ba(OH)2
SO3
氢氧化钡是强碱,硫酸氢钠是酸式盐,属于电解质;三氧化硫属于
非电解质,单质和混合物既不是电解质也不是非电解质。
③向NaHSO4溶液中加Fe可产生气体,对应的离子方程式为____________
_____________。
Fe+2H+===
Fe2++H2↑
硫酸氢钠是强酸的酸式盐,和铁反应生成氢气、硫酸钠和硫酸亚铁,离子方程式为Fe+2H+===Fe2++H2↑。
④将NaHSO4溶液和Ba(OH)2溶液混合,恰好呈中性,对应的离子方程式为_____________________________________________。
+2H2O
将NaHSO4溶液和Ba(OH)2溶液混合,恰好呈中性时生成硫酸钠、硫酸钡和水,反应的离子方程式为2H++SO +Ba2++2OH-===BaSO4↓+2H2O。
(2)请对以下过程形成的分散系进行分类。
①花生油加入水中后充分搅拌;
②向蒸馏水中加入硝酸钾至恰好饱和;
③饱和氯化铁溶液中加入氢氧化钠溶液;
④氢氧化钡溶液中通入过量的CO2;
⑤用滤纸过滤氢氧化铁胶体后得到的滤液;
⑥将纳米材料分散在塑料中制备复合材料;
⑦碘和酒精的混合物。
属于溶液的是 (填序号,下同);属于胶体的是 。
②④⑦
⑤⑥
分散系可以分为浊液、胶体、溶液。①花生油加入水中后充分搅拌,形成乳浊液;③饱和氯化铁溶液中加入氢氧化钠溶液生成氢氧化铁沉淀,形成悬浊液;②向蒸馏水中加入硝酸钾至恰好饱和,得到硝酸钾溶液;④氢氧化钡溶液中通入过量的CO2,得到碳酸氢钡溶液;⑦碘和酒精的混合物是碘的酒精溶液;⑤用滤纸过滤氢氧化铁胶体后得到的滤液是氢氧化铁胶体;⑥将纳米材料分散在塑料中制备复合材料,纳米材料的粒子直径在胶体的粒子直径范围内,属于胶体。
(1)试分析原溶液中一定含有的离子是 ,一定不含有的阴离子是 ,可能含有的离子是 。
Mg2+、Cl-
Na+、K+
(2)有的同学认为实验③可以省略,你认为是否正确 (填“是”或“否”),说明理由:_____________________________________。
是
根据电中性原则原溶液中一定含有Cl-
(3)写出①中反应的离子方程式:_____________________________。
Mg2++2OH-===Mg(OH)2↓
17.(16分)酸和碱能发生中和反应,它
在日常生活和工农业生产中有着广泛的
应用。下图表示硫酸和氢氧化钠溶液发
生反应时烧杯中溶液的pH随加入液体体
积的变化曲线及相关的实验操作。请从
中获取信息,回答下列问题:
(1)烧杯中盛放的是 溶液。
(2)小明向氢氧化钠溶液中加入稀硫酸,该中和反应的实质是___________
_________________________________________。
氢氧化钠
氧根离子反应生成水(或H++OH-===H2O)
氢离子和氢
然后,对反应过程中废液的溶质进行了如下探究:
【提出问题】 氢氧化钠溶液和稀硫酸混合后,溶质是什么?
【查阅资料】 硫酸钠溶液呈中性。
【猜想假设】 猜想I :硫酸钠和氢氧化钠;
猜想II :硫酸钠和硫酸;
猜想III :___________。
硫酸钠
【设计实验】
【反思与评价】 小芳认为实验操作②得出的结论不成立,理由是_______
____________________________________。
可以改为向废液中加入少量 ,溶液变为红色,证明猜想II成立。
实验操作 实验现象 实验结论
①取少量废液于试管中,滴入几滴酚酞溶液 溶液无明显变化 猜想 不成立
②另取少量废液于试管中,滴入几滴氯化钡溶液 _________________ 猜想II成立
I
有白色沉淀生成
硫酸都能和氯化钡反应产生白色沉淀
硫酸钠、
石蕊溶液
18.(14分)(1)某化学反应的反应物和产物如下:KMnO4+KI+H2SO4―→MnSO4+I2+KIO3+K2SO4+H2O。
①该反应的氧化剂是 。
KMnO4
KMnO4+KI+H2SO4―→MnSO4+I2+KIO3+K2SO4+H2O反应中,Mn元素由+7价降低为+2价,锰元素被还原,还原产物是MnSO4,KMnO4是氧化剂。
②如果该反应方程式中I2和KIO3的化学计量数都是5。
a.KMnO4的化学计量数是 。
b.在下面的化学式上用单线桥法标出电子转移的方向和数目
KMnO4+KI+H2SO4→
8
答案:
在KMnO4+KI+H2SO4―→MnSO4+I2+KIO3+K2SO4+H2O中,KMnO4是氧化剂,KI作还原剂。I元素由-1价升高到0价和+5价,如果该反应方程式中I2和KIO3的化学计量数都是5,则10KI~5I2,5KI~5KIO3,反应中碘元素失去的电子总数为[0-(-1)]×10+[+5-(-1)]×5=40。Mn元素由+7价降低为+2价,根据氧化剂得到的电子总数等于还原剂失去的电子总数,则有8KMnO4~8MnSO4,故KMnO4的化学计量数为8。在氧化还原反应中,用单线桥法表示电子转移是从还原剂中变价的元素出发指向氧化剂中变价的
元素,因此该反应中电子转移的方向和数目可表示为 。
(2)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4(Cr元素的化合价为+6价)、Cr(OH)3(Cr元素的化合价为+3价)、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中的还原剂是 。
在H2O2→O2的过程中,氧元素的化合价由-1价升高到了0价,则H2O2是还原剂。
H2O2
②该反应中,发生还原反应的过程是 → 。
③写出该反应的化学方程式:______________________________________。
反应中Cr元素化合价降低,H2CrO4被还原生成Cr(OH)3,该过程即为发生还原反应的过程。
返回
H2CrO4
Cr(OH)3
2H2CrO4+3H2O2===2Cr(OH)3+3O2↑+2H2O
发生反应的化学方程式为2H2CrO4+3H2O2===2Cr(OH)3+3O2↑+2H2O。
