2025年化学中考二轮专题复习课件:题型六 实验探究题(共48张PPT)
文档属性
| 名称 | 2025年化学中考二轮专题复习课件:题型六 实验探究题(共48张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-09 00:00:00 | ||
图片预览










文档简介
(共48张PPT)
2025年化学中考复习
题型六 实验探究题
第二部分 重点题型突破
考点要求
壹
1.能用语言、文字、图表、模型等方式表达探究的过程和结果;能对探究过程进行初步评价:
(1)实验原理是否可行;(2)原料的利用率;(3)实验方案是否简单方便;(4)有无环境污染(有无尾气处理);(5)有无控制变量;(6)有无进行多次实验减小误差或排除偶然性;(7)有无对照实验、所选实验变量是否相同、用于实验的反应物的量是否太少。
2.深耕教材,以教材为基础,挖掘教材中的探究题“原点”。
实验探究题是化学中考必考题型之一。考查主要以实验探究为主,结合对实验装置或方案的设计与评价。选取的内容往往来源于教材的实验,或者某一化学反应、某一实际情景,创设学生熟悉的情景,以考查学生设计实验、分析问题和解决实际问题的能力,综合性强,一般步骤包括提出问题→猜想与假设→查阅资料→设计方案→进行实验收集证据→解释和结
论→反思和评价。
1.判断猜想是否合理的依据:一是猜想的物质间本身是否可以反应 (共存);二是猜想的物质中是否含反应物中没有的元素 (是否违背质量守恒定律);三是猜想是否违背客观事实。
2.资料分析:探究题中所给的资料一般是探究过程中需用到的,而且在初中阶段的化学学习中未接触或不需掌握的,资料对解题非常重要,答案很多时候都可以从查阅资料中获得。资料内容一般涉及物质的性质、陌生的反应等具有明显的提示功能,甚至成为其中部分填空的答题依据。
3.实验现象与结论:实验过程中现象与结论互为条件,可根据实验操作和实验现象得出结论,也可根据实验操作和实验结论反推出实验现象。
4.实验方案设计:实验方案要求科学、经济、环保、可行、安全、简约,常涉及控制变量法、现象结论互推法。
5.方案评价:设问方式有方案正误判断及存在的问题分析、结论是否准确及其原因等。方案评价的角度是实验原理是否正确,实验步骤是否合理,操作是否正确,实验结果与实验目的是否一致,反应速率是否适中,实验中是否对环境造成污染等。
6.讨论与拓展:设问角度较广泛,常涉及实验中某一步骤的优化或分析,废水处理、物质保存方法等。
考点攻坚
叁
命题点1 物质性质及变化规律的探究
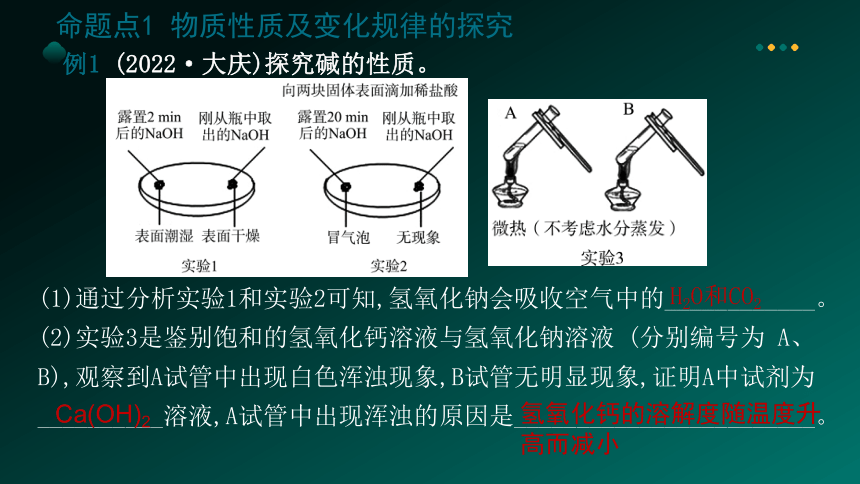
例1 (2022·大庆)探究碱的性质。
(1)通过分析实验1和实验2可知,氢氧化钠会吸收空气中的____________。
(2)实验3是鉴别饱和的氢氧化钙溶液与氢氧化钠溶液 (分别编号为 A、B),观察到A试管中出现白色浑浊现象,B试管无明显现象,证明A中试剂为 __________溶液,A试管中出现浑浊的原因是________________________。
H2O和CO2
Ca(OH)2
氢氧化钙的溶解度随温度升高而减小
(3)同学们看到盛有 NaOH 的试剂瓶上标注 “NaOH 含量不少于96.0%”,开始如下探究。
【提出问题】氢氧化钠中含有什么杂质
【查阅资料】工业制取NaOH的反应原理是2NaCl+2H2O 2NaOH+H2↑+Cl2↑
然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
【提出猜想】杂质为碳酸钠和氯化钠。
【实验探究】①甲同学取样溶于水,向溶液中滴加酚酞溶液,观察到液体变红色,认为杂质中含有碳酸钠。乙同学认为甲同学的实验不足以证明杂质中含有碳酸钠,理由是___________________________。
氢氧化钠也能使酚酞溶液变红
②乙同学重新设计实验如下。
【分析交流】步骤a中所得溶液中的溶质除 NaCl外,还有____________。
有气
泡产生
氯化钠
硝酸、硝酸钠
命题点2 反应条件及影响因素的探究
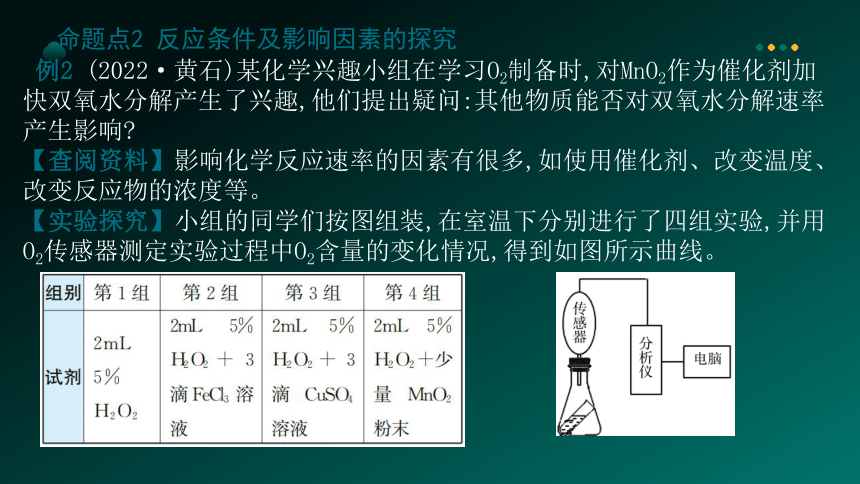
例2 (2022·黄石)某化学兴趣小组在学习O2制备时,对MnO2作为催化剂加快双氧水分解产生了兴趣,他们提出疑问:其他物质能否对双氧水分解速率产生影响
【查阅资料】影响化学反应速率的因素有很多,如使用催化剂、改变温度、改变反应物的浓度等。
【实验探究】小组的同学们按图组装,在室温下分别进行了四组实验,并用 O2传感器测定实验过程中O2含量的变化情况,得到如图所示曲线。
【实验结论】对比四条曲线,进行分析。
(1)FeCl3溶液、CuSO4溶液对H2O2的分解
______(填“有”或“无”)催化作用。
(2)几组实验中催化效果最佳的是_____。
(3)第1组实验的目的是____________。
有
对比
第4组
(4)小组的同学们不加催化剂,在不同温度下,用不同浓度的H2O2进行实验,记录实验现象如下表。据此可得出:升高温度或_____(填“增大”或“减小”)反应物浓度可加快H2O2的分解。
(5)实验需要30g10%的双氧水溶液,可用15%的双氧水溶液加______g蒸
馏水配制。
增大
10
命题点3 项目式学习探究
例3 (2022·南宁)纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。某化学兴趣小组对纯碱的制备、性质及用途等开展项目式学习。
任务一:了解纯碱的制备——“侯氏制碱法”、“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱。
(1)纯碱属于______(填“酸”、“碱”或“盐”)。
(2)饱和氯化钠溶液吸收的两种气体是______(填字母)。
A.Cl2 B.NH3 C.SO2 D.CO2
盐
BD
命题点3 项目式学习探究
例3 (2022·南宁)
任务二:探究纯碱的性质——Na2CO3溶液呈碱性
【查阅资料】①溶液呈碱性,是因为溶OH-。②Na2CO3在水中全部解离出 Na+和CO32-。③CaCl2溶液呈中性,Ca2+、Cl-对溶液的酸碱性没有影响。
【提出猜想】猜想一:H2O单独起作用,产生较多的OH-,使溶液呈碱性。
猜想二:Na+与H2O作用,产生较多的OH-,使溶液呈碱性。
猜想三:________________________________________________。
CO32- 与H2O作用,产生较多的OH- ,使溶液呈碱性
【解释与结论】同学们和老师交流,得知CO32-和H2O作用,产生较多的OH- 和另一种阴离子。
【拓展与延伸】结合任务二的所有信息和结论,运用初中化学所学知识,经过分析推理可得出,Na2CO3溶液中含有的阴离子是_______________。
【实验探究】
CO32- 、OH-
实验操作 实验现象 实验结论
(1)向试管中加入一定量的蒸馏水, 滴入2滴酚酞溶液 溶液无明显变化 猜想一不成立
(2)向试管中加入一定量的 NaCl溶液,滴入2滴酚酞溶液 溶液无明显变化 猜想二不成立
(3)①向试管中加入一定量的Na2CO3 溶液,滴入2滴酚酞溶液;②往①所得溶液中逐滴加入CaCl2溶液至过量 ①溶液由无色变红色;②____________ _______________ 猜想三成立
产生白色沉淀,溶液由红色变为无色
例3 任务三:探究纯碱的用途——用于生产洗涤剂
【查阅资料】Na2CO3可用于生产洗涤剂。Na2CO3溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的因素进行探究。用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如下表。
【解释与结论】(1)实验①②③对比,可得出的结论是____________________________。
(2)要证明Na2CO3溶液的溶质质量分数变化与pH变化关系,可选择的3个实验的编号是___。
【拓展与应用】下列物质可用于去油污的是______(填字母)。
A.NaCl B.NaOH C.K2CO3 D.CaCO3
温度越高,碳酸钠溶液碱性越强
①④⑦
BC
例4 (2022·徐州)含有铵根离子(NH4+)盐属于铵盐,兴趣小组对铵盐及相
关问题进行探究。
【了解组成】(1)一种常见铵盐的微观模型示意图为 ,则它表示的 物质是_________(填化学式)。
(2)碳酸氢铵的化学式为NH4HCO3,某种碳酸氢铵样品中氮元素的质量分数是21.8%,则该碳酸氢铵样品属于_______(填“纯净物”或“混合物”)。
【比较性质】(3)已知硝酸铵溶液显酸性,则该溶液中含有的阳离子有NH4+和_______(填离子符号)
命题点4 微型、创新实验探究
混合物
NH4Cl
H+
例4 (2022·徐州)
【比较性质】(4)常见的铵盐中,仅有碳酸氢铵在常温下就能分解,放出氨气,则常温下鉴别碳酸氢铵与硫酸铵的最简便方法是__________。
(5)铵盐与碱混合通常会放出氨气,因此,施肥时要避免铵态氮肥与碱性物质混用。写出加热条件下硫酸铵与烧碱反应的化学方程式:
____________________________________________。
【提出问题】氨气与氯化氢反应可以得到一种铵盐,该反应常用于探究微粒的运动性。那么,微粒运动速率与气体的相对分子质量有什么关系呢
【查阅资料】浓盐酸靠近浓氨水时,会出现大量的白烟。
命题点4 微型、创新实验探究
闻气味
(NH4)2SO4+2NaOH NNa2SO4+2NH3↑+2H2O
例4 (2022·徐州)
【进行实验】将一根玻璃管放在水平桌面上,
在左右两端同时塞入分别滴有浓盐酸、浓氨水
的脱脂棉,再塞紧橡皮塞。稍后,在靠近浓盐酸
的一端最先出现白烟,如图1。
(6)浓盐酸与浓氨水未直接接触就产生白烟,是因为浓盐酸和浓氨水都具有_________。
(7)由图1实验可知,相同条件下相对分子质量越小的气体,其微粒运动速率越_______。
命题点4 微型、创新实验探究
快
挥发性
例4 (2022·徐州)
【拓展延伸】再取一根 V 形玻璃管,开口向上竖直放置,在左右两端同时塞入分别滴有浓盐酸、浓氨水的脱脂棉,再塞紧橡皮塞。稍后,在靠近浓氨水的一端最先出现白烟,如图2。
(8)图2实验中,最先出现白烟的位置与图1实验相反,说明相同条件下
________________________________。
(9)实验中发现 V形玻璃管发热,其原因是__________。
命题点4 微型、创新实验探究
反应放热
氯化氢气体的密度大于氨气的密度
专项训练
肆
1.(2024·广安)“上善若水,水善利万物而不争”。我们应弘扬水之德,善用水之益。化学兴趣小组开展“水的净化”为主题的项目式学习。
任务一 咨询水处理过程
【咨询专家】同学们通过数字化平台,向水处理专家进行咨询。专家介绍了两种水处理技术:
①常规处理技术:天然水→加絮凝剂反应沉淀→过滤后加活性炭→加消毒剂→自来水。其中活性炭起____________作用。
②高分子膜分离技术
任务二 探究水处理中的消毒剂
【查阅资料】①Cl2通入H2O中,形成氯水,Cl2与H2O反应生成次氯酸(HClO)和HCl。
②次氯酸(HClO)具有强氧化性,可消毒杀菌。③次氯酸(HClO)不稳定,见光易分解。
吸附
【提出问题】久置的氯水是否可以用于消毒杀菌
【进行实验】在教师的指导下,同学们设计实验方案,利用下图装置探究新制氯水在光照下溶液的pH、氯离子浓度随时间的变化,通过实验,最终获得如图甲、乙所示数据。
【数据处理】
通过图甲、乙数据分
析,氯水在光照下pH变小
的原因是HClO见光分解生成
了_____________,使溶液酸性增强。
HCl
【得出结论】
通过讨论,同学们得出的结论是_____________________________。
【分享交流】
若将Cl2通入水中,再加入NaOH溶液,可制得一种新的消毒剂。其中次氯酸(HClO)与NaOH反应的化学方程式为________________________________。
任务三 自制纯净水
【设计制作】通过查阅资料,同学们设计
如下图所示装置对自来水再次净化获得纯
净水。当自来水通过如图所示阳离子、阴
离子交换柱后,与通入前相比,水分子数目将增多,简述其理由是
_______________________________________________________。
久置的氯水不可以用于消毒杀菌
HClO+NaOH==NaClO+H2O
自来水中的 OH- 和H+结合生成了水分子
2.(2023·广西)爱吃饼干的同学在查看饼干配料表时,发现有些饼干的膨松 剂含有碳酸氢钠,而有些饼干的膨松剂含有碳酸氢铵。同学们深感好奇,碳酸氢铵不是一种肥料吗 怎么也可以做膨松剂呢 为此,他们进行了如下的探究。
【查阅资料】
②通过控制碳酸氢铵的用量,不仅使残留在食品中的氨气含量符合食品安全标准,还能使食品具有独特的味道。
任务一 初识膨松剂
膨松剂能使食品变松软、蓬松。碳酸氢铵、碳酸氢钠常用作膨松剂。碳酸氢铵别名碳铵,碳酸氢钠俗名是_____________。
小苏打
任务二 比较膨松剂效果
通过以上实验发现,加入碳酸氢铵的
面团更大更松软,其原因是___________________________________________________________________。
任务三 测定膨松剂中碳酸氢铵的含量膨松剂中的其他成分受热不分解,为测定膨松剂中碳酸氢铵的含量,同学们分别设计了实验方案。
相等质量的碳酸氢钱和碳酸氢钠完全反应时,碳酸氢生成的气体比碳酸氢钠多
(1)甲同学提出,加热一定质量的膨松剂,使其完全分解,通过测定反应前后物质的质量差来算出碳酸氢铵的含量。
(2)乙同学认为,膨松剂中可能含有水分,会影响实验结果。他提出可以通过测定反应后生成氨气的质量来达到实验目的,故设计了右图所示实验装置及主要步骤。
①步骤4的具体操作是__________________________________________
________________________________________________________,若没有此操作,会使测量结果_________(填“偏大”或“偏小”)。
②装置C中发生化合反应,其反应的化学方程式是
_____________________________________________。
③装置D的作用是____________________________________________
(3)丙同学提出,将图中装置 B、C对调,也可以达到实验目的,其理由是________________________________________________________
___________________________________________________________。
再次从 m 端通入氮气
直至冷却至室温
偏小
2NH3十 H2SO4==(NH4)2SO4
防止空气中的水蒸气进入装置 C
对调后,装置C能够吸收氨气和水蒸气,装置B能够吸收二氧化碳,根据称量装置B反应前后质量变化计算碳酸氢的含量
3.(2024·广西)氢气是一种对环境友好的清洁能源,以水为原料制备氢气在新能源领域备受关注。某兴趣小组为此开展了电解水的实验探究。
任务一 探究电解水产生的气体
(1)兴趣小组向下图装置中加入蒸馏水,接通电源后,没有观察到明显现象。查阅课本后,兴趣小组向水中添加少量氢氧化钠溶液,a、b管很快出现了气泡,b管内的气体是_____。
任务二 探究物质对电解水产生氢气的速率的影响
资料:加入碳酸钠、硫酸钠、氢氧化钠都可以提高
水的电解效率。
氧气
(2)甲同学分别取等质量的碳酸钠、硫酸钠、氢氧化
钠溶液,溶质的质量分数均为12%,在相同条件下进行
实验,产生氢气的速率如图所示。由此可知,在相同
条件下,加入___________,产生氢气的速率最大。
(3)乙同学取不同质量分数的氢氧化钠溶液,在相同
条件下进行实验,其结果如下图所示,产生氢气速率
的变化趋势为_______________________________。
氢氧化钠
其他条件相同时,产生氢气速率随氢氧化钠溶质质量分数变大而先变大后减小,氢氧化钠溶质质量分数18%时产生氢气的速率最大
(4)丙同学从实验室取用了一瓶久置的氢氧化钠固体,在相同条件下进行实验,发现产生氢气的速率比乙同学的小。丙同学猜想速率变小的原因可能____________________________________________(用化学方程式解释)。
(5)为了验证猜想,丙同学设计了如图的实验装置。当他滴加稀硫酸时,观察
到饱和澄清石灰水变浑浊,他认为猜想正确。同学们讨论后发现,该设计方案不够严谨,其原因是_________________________________________,请你在该装置的基础上提出改进方法以达到验证
目的,该方法是________________________
_____________________________________。
2NaOH+CO2==Na2CO3+H2O
反应和溶解的放热使饱和氢氧化钙溶液升温结晶
把实验装置放入冰水之中 (或将
澄清石灰水换成紫色石蕊溶液)
(6)基于安全考虑,老师建议电解水时最好选用碳酸钠溶液,因为 NaOH具有____________。
腐蚀性
课堂练习
伍
1.(2024·山西)氢能作为极具发展潜力的多元化能源,在我国经济发展中具有重要的地位。某校实践小组的同学们对此产生了浓厚的兴趣,他们对氢气的制取方法、应用优势、储存手段和发展前景等展开了项目式问题探究。
任务一:调查氢能制取方法
【咨询专家】小组同学通过数字化平台向专家进行咨询,知道了氢气可用多种工艺过程制备,方法有电解水制氢和工业副产品制氢等。
【构建模型】用可再生能源电解水制氢,将是应用广泛、技术成熟的一种手段。过程如右图所示。
【交流讨论】
(1)近年来,能用来发电的可再生能源有______________________________________。
(2)化石燃料也可用于氢的制取,但不足之处有______________________________________。
任务二:探究氢能应用优势
【提出问题】氢气作为理想能源的原因是什么
【进行实验】
(3)设计纯净氢气与天然气燃烧的对比实验。
太阳能(合理即可)
会产生大量污染物
烧杯内壁均有水雾生成
氢气燃烧不生成二氧化碳,天然气燃烧生成二氧化碳
【反思评价】
(4)通过上述实验对比,氢气作为燃料的优点是________________________。
(5)在理想状态下,小组同学通过图1实验,将测
得的实验数据绘制成的图像如图2所示,分析图
像,可得出的结论是_______________________
_______________________________________。
任务三:调研氢能储存手段
【查阅资料】
(6)我国绿氢规模化储存是商业化应用的基本保障
,为了进行大量储存,通常将氢气转化为液氢,从微
观角度分析,发生改变的是
_________________________________________。
燃烧产物只有水,不会对环境造成污染
相同质量的可燃物,氢气燃烧的热值比天然气高
分子间的间隔
任务四:展望氢能发展前景
【市场调研】
(7)目前,氢燃料电池在公共交通中应用已较为成熟,其工作原理如图3所示,发生反应的化学方程式为_________________________________________,未来,氢能将在航空、航天、电力和建筑领域大力推广。
成果分享:通过问题探究,大家对氢能有了
较为全面的认识。氢气作为一种理想的新型能
源,其产业链包括“制—储—输—用”四个主
要环节。因此,降本增效、规模化发展,将是
我国经济增长和服务民生的一项重要举措。
2H2+O2==2H2O
催化剂
2.(2022·营口)同学们为进一步认知酸、碱、盐的化学性质,进行了如图所示的实验,请你来参与他们的探究活动,并回答下列问题。
(1)甲试管中发生中和反应的化学方程式为________________________。
(2)当观察到甲试管中溶液由__________恰好变为无色时,说明二者恰好完全反应。
(3)乙试管中两种溶液不能发生反应,理由是______________________
__________________________________________________。
HCI十NaOH==NaCl+H2O
红色
氯化钠与氯化相互交换成分后没有沉淀、气体或者水的生成
(4)实验结束后,同学们将乙、丙两支试管内的物质全部倒入同一个干净的小烧杯中,静置片刻,观察到白色沉淀明显增多。大家对得到的上层溶液的成分产生了兴趣,于是又进行了如下的实验探究。
【提出问题】小烧杯中上层溶液的溶质成分有哪些
【做出猜想】猜想一:NaCl、NaOH、
Na2CO3。
猜想二:NaCl、NaOH。
猜想三:____________________。
【设计实验】
【反思拓展】
(5)小烧杯中的白色沉淀成分是________________________(填化学式)。
NaCl、BaCl2、NaOH
无明显现象
Na2CO3或Na2SO4
产生白色沉淀
CaCO3、BaCO3
3.(2024·安徽)茶叶是我省重要的经济作物之一,茶园土壤的酸碱性会对茶叶品质产生重要影响。某兴趣小组测定了某地茶园土壤的酸碱性并提出改良方案。查阅资料:茶树最适宜生长在pH为5.0~5.5的土壤中。
【任务一】测定土壤酸碱性
(1)将土壤样品与蒸馏水按1∶5的质量比在烧杯中混合,充分搅拌后静置,测得上层清液的pH为4。用pH试纸测定该溶液pH的操作是在玻璃片上放一小片pH试纸,___________________________________________。
【任务二】调查土壤呈酸性的原因
(2)经调查发现,长期过量施用一些氮肥是土壤呈酸性的原因之一。请写出一种氮肥的化学式:_________。
用玻璃棒蘸取少量上层清液滴在干燥的pH试纸上,与标准比色卡比对
NH4Cl
【任务三】改良土壤酸碱性
(3)牛牛同学认为将适量熟石灰加入土壤,可中和其酸性。写出熟石灰与酸(以硫酸为例 )反应的化学方程式__________________________________。
(4)农业上常用白云石粉改良土壤酸碱性。为研究白云
石粉掩埋深度对土壤酸碱性的影响,该小组在同一块土
地的三个不同区域开展实验。50天后,测得等量白云石
粉掩埋深度与土壤 pH 的关系如下图所示。根据图中
信息,你认为茶农将白云石粉掩埋的最适宜深度是_____(填字母序号)。
A.0~10cm B.10~20cm C.20~30cm
H2SO4+Ca(OH)2==CaSO4↓+2H2O
C
4.(2022·山西)胜利中学与某沿海学校建立了“手拉手,结对子”的联盟校。今年,由于受到疫情影响,两所学校的同学无法实地交流,于是借助数字化平台进行了“云端”活动,他们对海洋中海水利用概况、海水处理技术、车间废水成分以及海洋发展前景等展开了项目化学习的探究。
任务一:调查海水利用概况。
【查阅资料】我国海水利用主要有海水直接利用、海水淡化、海水化学资源利用等。
【分析交流】两所学校的同学们共同获悉,海水里的化学资源有_________________________(填1种)。
氯化钠(合理即可)
任务二:咨询海水处理技术。
【咨询专家】同学们通过数字化平台,向海洋专家进行了咨询,专家介绍,海 水淡化使用了反渗透膜淡化技术,其工作原理如右图所示。
【小组讨论】同学们对以下两个问题,进行了网上交流并达成共识。
(1)海水通过反渗透膜,发生改变的是_________________________________________________。
(2)淡化后的海水可用于___________________________(填1种)。
含盐量降低或密度减小(合理即可)
生活用水或工业用水 (合理即可)
任务三:探究海水提取车间废水成分。
沿海学校的同学获得一瓶海水提取车间的废水,在 “云端”共同完成了如下探究。
【教师指导】①提取车间未经处理的废水含有酸性物质。
②BaSO4为难溶于水的白色沉淀。
【猜想假设】该强腐蚀性废水中可能含有硫酸和盐酸。
【进行实验】设计实验方案,探究废水成分。
紫色石蕊溶液变红
AgNO3溶液
【反思评价】(1)废水中不含碳酸根离子的原因是
_______________________________________________________________。
(2)步骤③中发生反应的化学方程式为______________________________。
任务四:展望海水发展前景。
【小组交流】同学们了解到随着海水农业技术创新和推广,富含碘、硒等微量元素的海水食物将为人类健康提供必要的保障,他们一致认为,经常食用可预防的疾病是_____________(填1种)。
【成果分享】通过“云端”合作,同学们知道了海洋作为人类重要的资源宝库,不仅可以提供丰富的自然资源,还可以通过科技手段推动再生资源的开发和利用。
碳酸根离子能与氢离子发生反应
AgNO3+HCl==AgCl↓+HNO3
甲状腺肿大
知 识 梳 理
巩 固 训
2025年化学中考复习
题型六 实验探究题
第二部分 重点题型突破
考点要求
壹
1.能用语言、文字、图表、模型等方式表达探究的过程和结果;能对探究过程进行初步评价:
(1)实验原理是否可行;(2)原料的利用率;(3)实验方案是否简单方便;(4)有无环境污染(有无尾气处理);(5)有无控制变量;(6)有无进行多次实验减小误差或排除偶然性;(7)有无对照实验、所选实验变量是否相同、用于实验的反应物的量是否太少。
2.深耕教材,以教材为基础,挖掘教材中的探究题“原点”。
实验探究题是化学中考必考题型之一。考查主要以实验探究为主,结合对实验装置或方案的设计与评价。选取的内容往往来源于教材的实验,或者某一化学反应、某一实际情景,创设学生熟悉的情景,以考查学生设计实验、分析问题和解决实际问题的能力,综合性强,一般步骤包括提出问题→猜想与假设→查阅资料→设计方案→进行实验收集证据→解释和结
论→反思和评价。
1.判断猜想是否合理的依据:一是猜想的物质间本身是否可以反应 (共存);二是猜想的物质中是否含反应物中没有的元素 (是否违背质量守恒定律);三是猜想是否违背客观事实。
2.资料分析:探究题中所给的资料一般是探究过程中需用到的,而且在初中阶段的化学学习中未接触或不需掌握的,资料对解题非常重要,答案很多时候都可以从查阅资料中获得。资料内容一般涉及物质的性质、陌生的反应等具有明显的提示功能,甚至成为其中部分填空的答题依据。
3.实验现象与结论:实验过程中现象与结论互为条件,可根据实验操作和实验现象得出结论,也可根据实验操作和实验结论反推出实验现象。
4.实验方案设计:实验方案要求科学、经济、环保、可行、安全、简约,常涉及控制变量法、现象结论互推法。
5.方案评价:设问方式有方案正误判断及存在的问题分析、结论是否准确及其原因等。方案评价的角度是实验原理是否正确,实验步骤是否合理,操作是否正确,实验结果与实验目的是否一致,反应速率是否适中,实验中是否对环境造成污染等。
6.讨论与拓展:设问角度较广泛,常涉及实验中某一步骤的优化或分析,废水处理、物质保存方法等。
考点攻坚
叁
命题点1 物质性质及变化规律的探究
例1 (2022·大庆)探究碱的性质。
(1)通过分析实验1和实验2可知,氢氧化钠会吸收空气中的____________。
(2)实验3是鉴别饱和的氢氧化钙溶液与氢氧化钠溶液 (分别编号为 A、B),观察到A试管中出现白色浑浊现象,B试管无明显现象,证明A中试剂为 __________溶液,A试管中出现浑浊的原因是________________________。
H2O和CO2
Ca(OH)2
氢氧化钙的溶解度随温度升高而减小
(3)同学们看到盛有 NaOH 的试剂瓶上标注 “NaOH 含量不少于96.0%”,开始如下探究。
【提出问题】氢氧化钠中含有什么杂质
【查阅资料】工业制取NaOH的反应原理是2NaCl+2H2O 2NaOH+H2↑+Cl2↑
然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
【提出猜想】杂质为碳酸钠和氯化钠。
【实验探究】①甲同学取样溶于水,向溶液中滴加酚酞溶液,观察到液体变红色,认为杂质中含有碳酸钠。乙同学认为甲同学的实验不足以证明杂质中含有碳酸钠,理由是___________________________。
氢氧化钠也能使酚酞溶液变红
②乙同学重新设计实验如下。
【分析交流】步骤a中所得溶液中的溶质除 NaCl外,还有____________。
有气
泡产生
氯化钠
硝酸、硝酸钠
命题点2 反应条件及影响因素的探究
例2 (2022·黄石)某化学兴趣小组在学习O2制备时,对MnO2作为催化剂加快双氧水分解产生了兴趣,他们提出疑问:其他物质能否对双氧水分解速率产生影响
【查阅资料】影响化学反应速率的因素有很多,如使用催化剂、改变温度、改变反应物的浓度等。
【实验探究】小组的同学们按图组装,在室温下分别进行了四组实验,并用 O2传感器测定实验过程中O2含量的变化情况,得到如图所示曲线。
【实验结论】对比四条曲线,进行分析。
(1)FeCl3溶液、CuSO4溶液对H2O2的分解
______(填“有”或“无”)催化作用。
(2)几组实验中催化效果最佳的是_____。
(3)第1组实验的目的是____________。
有
对比
第4组
(4)小组的同学们不加催化剂,在不同温度下,用不同浓度的H2O2进行实验,记录实验现象如下表。据此可得出:升高温度或_____(填“增大”或“减小”)反应物浓度可加快H2O2的分解。
(5)实验需要30g10%的双氧水溶液,可用15%的双氧水溶液加______g蒸
馏水配制。
增大
10
命题点3 项目式学习探究
例3 (2022·南宁)纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。某化学兴趣小组对纯碱的制备、性质及用途等开展项目式学习。
任务一:了解纯碱的制备——“侯氏制碱法”、“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱。
(1)纯碱属于______(填“酸”、“碱”或“盐”)。
(2)饱和氯化钠溶液吸收的两种气体是______(填字母)。
A.Cl2 B.NH3 C.SO2 D.CO2
盐
BD
命题点3 项目式学习探究
例3 (2022·南宁)
任务二:探究纯碱的性质——Na2CO3溶液呈碱性
【查阅资料】①溶液呈碱性,是因为溶OH-。②Na2CO3在水中全部解离出 Na+和CO32-。③CaCl2溶液呈中性,Ca2+、Cl-对溶液的酸碱性没有影响。
【提出猜想】猜想一:H2O单独起作用,产生较多的OH-,使溶液呈碱性。
猜想二:Na+与H2O作用,产生较多的OH-,使溶液呈碱性。
猜想三:________________________________________________。
CO32- 与H2O作用,产生较多的OH- ,使溶液呈碱性
【解释与结论】同学们和老师交流,得知CO32-和H2O作用,产生较多的OH- 和另一种阴离子。
【拓展与延伸】结合任务二的所有信息和结论,运用初中化学所学知识,经过分析推理可得出,Na2CO3溶液中含有的阴离子是_______________。
【实验探究】
CO32- 、OH-
实验操作 实验现象 实验结论
(1)向试管中加入一定量的蒸馏水, 滴入2滴酚酞溶液 溶液无明显变化 猜想一不成立
(2)向试管中加入一定量的 NaCl溶液,滴入2滴酚酞溶液 溶液无明显变化 猜想二不成立
(3)①向试管中加入一定量的Na2CO3 溶液,滴入2滴酚酞溶液;②往①所得溶液中逐滴加入CaCl2溶液至过量 ①溶液由无色变红色;②____________ _______________ 猜想三成立
产生白色沉淀,溶液由红色变为无色
例3 任务三:探究纯碱的用途——用于生产洗涤剂
【查阅资料】Na2CO3可用于生产洗涤剂。Na2CO3溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的因素进行探究。用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如下表。
【解释与结论】(1)实验①②③对比,可得出的结论是____________________________。
(2)要证明Na2CO3溶液的溶质质量分数变化与pH变化关系,可选择的3个实验的编号是___。
【拓展与应用】下列物质可用于去油污的是______(填字母)。
A.NaCl B.NaOH C.K2CO3 D.CaCO3
温度越高,碳酸钠溶液碱性越强
①④⑦
BC
例4 (2022·徐州)含有铵根离子(NH4+)盐属于铵盐,兴趣小组对铵盐及相
关问题进行探究。
【了解组成】(1)一种常见铵盐的微观模型示意图为 ,则它表示的 物质是_________(填化学式)。
(2)碳酸氢铵的化学式为NH4HCO3,某种碳酸氢铵样品中氮元素的质量分数是21.8%,则该碳酸氢铵样品属于_______(填“纯净物”或“混合物”)。
【比较性质】(3)已知硝酸铵溶液显酸性,则该溶液中含有的阳离子有NH4+和_______(填离子符号)
命题点4 微型、创新实验探究
混合物
NH4Cl
H+
例4 (2022·徐州)
【比较性质】(4)常见的铵盐中,仅有碳酸氢铵在常温下就能分解,放出氨气,则常温下鉴别碳酸氢铵与硫酸铵的最简便方法是__________。
(5)铵盐与碱混合通常会放出氨气,因此,施肥时要避免铵态氮肥与碱性物质混用。写出加热条件下硫酸铵与烧碱反应的化学方程式:
____________________________________________。
【提出问题】氨气与氯化氢反应可以得到一种铵盐,该反应常用于探究微粒的运动性。那么,微粒运动速率与气体的相对分子质量有什么关系呢
【查阅资料】浓盐酸靠近浓氨水时,会出现大量的白烟。
命题点4 微型、创新实验探究
闻气味
(NH4)2SO4+2NaOH NNa2SO4+2NH3↑+2H2O
例4 (2022·徐州)
【进行实验】将一根玻璃管放在水平桌面上,
在左右两端同时塞入分别滴有浓盐酸、浓氨水
的脱脂棉,再塞紧橡皮塞。稍后,在靠近浓盐酸
的一端最先出现白烟,如图1。
(6)浓盐酸与浓氨水未直接接触就产生白烟,是因为浓盐酸和浓氨水都具有_________。
(7)由图1实验可知,相同条件下相对分子质量越小的气体,其微粒运动速率越_______。
命题点4 微型、创新实验探究
快
挥发性
例4 (2022·徐州)
【拓展延伸】再取一根 V 形玻璃管,开口向上竖直放置,在左右两端同时塞入分别滴有浓盐酸、浓氨水的脱脂棉,再塞紧橡皮塞。稍后,在靠近浓氨水的一端最先出现白烟,如图2。
(8)图2实验中,最先出现白烟的位置与图1实验相反,说明相同条件下
________________________________。
(9)实验中发现 V形玻璃管发热,其原因是__________。
命题点4 微型、创新实验探究
反应放热
氯化氢气体的密度大于氨气的密度
专项训练
肆
1.(2024·广安)“上善若水,水善利万物而不争”。我们应弘扬水之德,善用水之益。化学兴趣小组开展“水的净化”为主题的项目式学习。
任务一 咨询水处理过程
【咨询专家】同学们通过数字化平台,向水处理专家进行咨询。专家介绍了两种水处理技术:
①常规处理技术:天然水→加絮凝剂反应沉淀→过滤后加活性炭→加消毒剂→自来水。其中活性炭起____________作用。
②高分子膜分离技术
任务二 探究水处理中的消毒剂
【查阅资料】①Cl2通入H2O中,形成氯水,Cl2与H2O反应生成次氯酸(HClO)和HCl。
②次氯酸(HClO)具有强氧化性,可消毒杀菌。③次氯酸(HClO)不稳定,见光易分解。
吸附
【提出问题】久置的氯水是否可以用于消毒杀菌
【进行实验】在教师的指导下,同学们设计实验方案,利用下图装置探究新制氯水在光照下溶液的pH、氯离子浓度随时间的变化,通过实验,最终获得如图甲、乙所示数据。
【数据处理】
通过图甲、乙数据分
析,氯水在光照下pH变小
的原因是HClO见光分解生成
了_____________,使溶液酸性增强。
HCl
【得出结论】
通过讨论,同学们得出的结论是_____________________________。
【分享交流】
若将Cl2通入水中,再加入NaOH溶液,可制得一种新的消毒剂。其中次氯酸(HClO)与NaOH反应的化学方程式为________________________________。
任务三 自制纯净水
【设计制作】通过查阅资料,同学们设计
如下图所示装置对自来水再次净化获得纯
净水。当自来水通过如图所示阳离子、阴
离子交换柱后,与通入前相比,水分子数目将增多,简述其理由是
_______________________________________________________。
久置的氯水不可以用于消毒杀菌
HClO+NaOH==NaClO+H2O
自来水中的 OH- 和H+结合生成了水分子
2.(2023·广西)爱吃饼干的同学在查看饼干配料表时,发现有些饼干的膨松 剂含有碳酸氢钠,而有些饼干的膨松剂含有碳酸氢铵。同学们深感好奇,碳酸氢铵不是一种肥料吗 怎么也可以做膨松剂呢 为此,他们进行了如下的探究。
【查阅资料】
②通过控制碳酸氢铵的用量,不仅使残留在食品中的氨气含量符合食品安全标准,还能使食品具有独特的味道。
任务一 初识膨松剂
膨松剂能使食品变松软、蓬松。碳酸氢铵、碳酸氢钠常用作膨松剂。碳酸氢铵别名碳铵,碳酸氢钠俗名是_____________。
小苏打
任务二 比较膨松剂效果
通过以上实验发现,加入碳酸氢铵的
面团更大更松软,其原因是___________________________________________________________________。
任务三 测定膨松剂中碳酸氢铵的含量膨松剂中的其他成分受热不分解,为测定膨松剂中碳酸氢铵的含量,同学们分别设计了实验方案。
相等质量的碳酸氢钱和碳酸氢钠完全反应时,碳酸氢生成的气体比碳酸氢钠多
(1)甲同学提出,加热一定质量的膨松剂,使其完全分解,通过测定反应前后物质的质量差来算出碳酸氢铵的含量。
(2)乙同学认为,膨松剂中可能含有水分,会影响实验结果。他提出可以通过测定反应后生成氨气的质量来达到实验目的,故设计了右图所示实验装置及主要步骤。
①步骤4的具体操作是__________________________________________
________________________________________________________,若没有此操作,会使测量结果_________(填“偏大”或“偏小”)。
②装置C中发生化合反应,其反应的化学方程式是
_____________________________________________。
③装置D的作用是____________________________________________
(3)丙同学提出,将图中装置 B、C对调,也可以达到实验目的,其理由是________________________________________________________
___________________________________________________________。
再次从 m 端通入氮气
直至冷却至室温
偏小
2NH3十 H2SO4==(NH4)2SO4
防止空气中的水蒸气进入装置 C
对调后,装置C能够吸收氨气和水蒸气,装置B能够吸收二氧化碳,根据称量装置B反应前后质量变化计算碳酸氢的含量
3.(2024·广西)氢气是一种对环境友好的清洁能源,以水为原料制备氢气在新能源领域备受关注。某兴趣小组为此开展了电解水的实验探究。
任务一 探究电解水产生的气体
(1)兴趣小组向下图装置中加入蒸馏水,接通电源后,没有观察到明显现象。查阅课本后,兴趣小组向水中添加少量氢氧化钠溶液,a、b管很快出现了气泡,b管内的气体是_____。
任务二 探究物质对电解水产生氢气的速率的影响
资料:加入碳酸钠、硫酸钠、氢氧化钠都可以提高
水的电解效率。
氧气
(2)甲同学分别取等质量的碳酸钠、硫酸钠、氢氧化
钠溶液,溶质的质量分数均为12%,在相同条件下进行
实验,产生氢气的速率如图所示。由此可知,在相同
条件下,加入___________,产生氢气的速率最大。
(3)乙同学取不同质量分数的氢氧化钠溶液,在相同
条件下进行实验,其结果如下图所示,产生氢气速率
的变化趋势为_______________________________。
氢氧化钠
其他条件相同时,产生氢气速率随氢氧化钠溶质质量分数变大而先变大后减小,氢氧化钠溶质质量分数18%时产生氢气的速率最大
(4)丙同学从实验室取用了一瓶久置的氢氧化钠固体,在相同条件下进行实验,发现产生氢气的速率比乙同学的小。丙同学猜想速率变小的原因可能____________________________________________(用化学方程式解释)。
(5)为了验证猜想,丙同学设计了如图的实验装置。当他滴加稀硫酸时,观察
到饱和澄清石灰水变浑浊,他认为猜想正确。同学们讨论后发现,该设计方案不够严谨,其原因是_________________________________________,请你在该装置的基础上提出改进方法以达到验证
目的,该方法是________________________
_____________________________________。
2NaOH+CO2==Na2CO3+H2O
反应和溶解的放热使饱和氢氧化钙溶液升温结晶
把实验装置放入冰水之中 (或将
澄清石灰水换成紫色石蕊溶液)
(6)基于安全考虑,老师建议电解水时最好选用碳酸钠溶液,因为 NaOH具有____________。
腐蚀性
课堂练习
伍
1.(2024·山西)氢能作为极具发展潜力的多元化能源,在我国经济发展中具有重要的地位。某校实践小组的同学们对此产生了浓厚的兴趣,他们对氢气的制取方法、应用优势、储存手段和发展前景等展开了项目式问题探究。
任务一:调查氢能制取方法
【咨询专家】小组同学通过数字化平台向专家进行咨询,知道了氢气可用多种工艺过程制备,方法有电解水制氢和工业副产品制氢等。
【构建模型】用可再生能源电解水制氢,将是应用广泛、技术成熟的一种手段。过程如右图所示。
【交流讨论】
(1)近年来,能用来发电的可再生能源有______________________________________。
(2)化石燃料也可用于氢的制取,但不足之处有______________________________________。
任务二:探究氢能应用优势
【提出问题】氢气作为理想能源的原因是什么
【进行实验】
(3)设计纯净氢气与天然气燃烧的对比实验。
太阳能(合理即可)
会产生大量污染物
烧杯内壁均有水雾生成
氢气燃烧不生成二氧化碳,天然气燃烧生成二氧化碳
【反思评价】
(4)通过上述实验对比,氢气作为燃料的优点是________________________。
(5)在理想状态下,小组同学通过图1实验,将测
得的实验数据绘制成的图像如图2所示,分析图
像,可得出的结论是_______________________
_______________________________________。
任务三:调研氢能储存手段
【查阅资料】
(6)我国绿氢规模化储存是商业化应用的基本保障
,为了进行大量储存,通常将氢气转化为液氢,从微
观角度分析,发生改变的是
_________________________________________。
燃烧产物只有水,不会对环境造成污染
相同质量的可燃物,氢气燃烧的热值比天然气高
分子间的间隔
任务四:展望氢能发展前景
【市场调研】
(7)目前,氢燃料电池在公共交通中应用已较为成熟,其工作原理如图3所示,发生反应的化学方程式为_________________________________________,未来,氢能将在航空、航天、电力和建筑领域大力推广。
成果分享:通过问题探究,大家对氢能有了
较为全面的认识。氢气作为一种理想的新型能
源,其产业链包括“制—储—输—用”四个主
要环节。因此,降本增效、规模化发展,将是
我国经济增长和服务民生的一项重要举措。
2H2+O2==2H2O
催化剂
2.(2022·营口)同学们为进一步认知酸、碱、盐的化学性质,进行了如图所示的实验,请你来参与他们的探究活动,并回答下列问题。
(1)甲试管中发生中和反应的化学方程式为________________________。
(2)当观察到甲试管中溶液由__________恰好变为无色时,说明二者恰好完全反应。
(3)乙试管中两种溶液不能发生反应,理由是______________________
__________________________________________________。
HCI十NaOH==NaCl+H2O
红色
氯化钠与氯化相互交换成分后没有沉淀、气体或者水的生成
(4)实验结束后,同学们将乙、丙两支试管内的物质全部倒入同一个干净的小烧杯中,静置片刻,观察到白色沉淀明显增多。大家对得到的上层溶液的成分产生了兴趣,于是又进行了如下的实验探究。
【提出问题】小烧杯中上层溶液的溶质成分有哪些
【做出猜想】猜想一:NaCl、NaOH、
Na2CO3。
猜想二:NaCl、NaOH。
猜想三:____________________。
【设计实验】
【反思拓展】
(5)小烧杯中的白色沉淀成分是________________________(填化学式)。
NaCl、BaCl2、NaOH
无明显现象
Na2CO3或Na2SO4
产生白色沉淀
CaCO3、BaCO3
3.(2024·安徽)茶叶是我省重要的经济作物之一,茶园土壤的酸碱性会对茶叶品质产生重要影响。某兴趣小组测定了某地茶园土壤的酸碱性并提出改良方案。查阅资料:茶树最适宜生长在pH为5.0~5.5的土壤中。
【任务一】测定土壤酸碱性
(1)将土壤样品与蒸馏水按1∶5的质量比在烧杯中混合,充分搅拌后静置,测得上层清液的pH为4。用pH试纸测定该溶液pH的操作是在玻璃片上放一小片pH试纸,___________________________________________。
【任务二】调查土壤呈酸性的原因
(2)经调查发现,长期过量施用一些氮肥是土壤呈酸性的原因之一。请写出一种氮肥的化学式:_________。
用玻璃棒蘸取少量上层清液滴在干燥的pH试纸上,与标准比色卡比对
NH4Cl
【任务三】改良土壤酸碱性
(3)牛牛同学认为将适量熟石灰加入土壤,可中和其酸性。写出熟石灰与酸(以硫酸为例 )反应的化学方程式__________________________________。
(4)农业上常用白云石粉改良土壤酸碱性。为研究白云
石粉掩埋深度对土壤酸碱性的影响,该小组在同一块土
地的三个不同区域开展实验。50天后,测得等量白云石
粉掩埋深度与土壤 pH 的关系如下图所示。根据图中
信息,你认为茶农将白云石粉掩埋的最适宜深度是_____(填字母序号)。
A.0~10cm B.10~20cm C.20~30cm
H2SO4+Ca(OH)2==CaSO4↓+2H2O
C
4.(2022·山西)胜利中学与某沿海学校建立了“手拉手,结对子”的联盟校。今年,由于受到疫情影响,两所学校的同学无法实地交流,于是借助数字化平台进行了“云端”活动,他们对海洋中海水利用概况、海水处理技术、车间废水成分以及海洋发展前景等展开了项目化学习的探究。
任务一:调查海水利用概况。
【查阅资料】我国海水利用主要有海水直接利用、海水淡化、海水化学资源利用等。
【分析交流】两所学校的同学们共同获悉,海水里的化学资源有_________________________(填1种)。
氯化钠(合理即可)
任务二:咨询海水处理技术。
【咨询专家】同学们通过数字化平台,向海洋专家进行了咨询,专家介绍,海 水淡化使用了反渗透膜淡化技术,其工作原理如右图所示。
【小组讨论】同学们对以下两个问题,进行了网上交流并达成共识。
(1)海水通过反渗透膜,发生改变的是_________________________________________________。
(2)淡化后的海水可用于___________________________(填1种)。
含盐量降低或密度减小(合理即可)
生活用水或工业用水 (合理即可)
任务三:探究海水提取车间废水成分。
沿海学校的同学获得一瓶海水提取车间的废水,在 “云端”共同完成了如下探究。
【教师指导】①提取车间未经处理的废水含有酸性物质。
②BaSO4为难溶于水的白色沉淀。
【猜想假设】该强腐蚀性废水中可能含有硫酸和盐酸。
【进行实验】设计实验方案,探究废水成分。
紫色石蕊溶液变红
AgNO3溶液
【反思评价】(1)废水中不含碳酸根离子的原因是
_______________________________________________________________。
(2)步骤③中发生反应的化学方程式为______________________________。
任务四:展望海水发展前景。
【小组交流】同学们了解到随着海水农业技术创新和推广,富含碘、硒等微量元素的海水食物将为人类健康提供必要的保障,他们一致认为,经常食用可预防的疾病是_____________(填1种)。
【成果分享】通过“云端”合作,同学们知道了海洋作为人类重要的资源宝库,不仅可以提供丰富的自然资源,还可以通过科技手段推动再生资源的开发和利用。
碳酸根离子能与氢离子发生反应
AgNO3+HCl==AgCl↓+HNO3
甲状腺肿大
知 识 梳 理
巩 固 训
同课章节目录
