2025年化学中考二轮专题复习课件:题型八 数字化实验(共28张PPT)
文档属性
| 名称 | 2025年化学中考二轮专题复习课件:题型八 数字化实验(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-09 21:35:12 | ||
图片预览







文档简介
(共28张PPT)
2025年化学中考复习
题型八 数字化实验
第二部分 重点题型突破
考点要求
壹
1.借助可视化的数据认识化学问题的本质。
2.培养多视角收集证据解决化学问题的能力。
数字化实验是通过 “传感器+数据采集器+计算机”定量采集数据得到曲线和数字的一种新型实验,初中化学常见的传感器如温度传感器、压强传感器、pH传感器、浓度传感器等,可以将化学反应和现象的本质转化为可检测的信号,常以坐标曲线图的形式呈现。考生需熟悉掌握影响温度、压强、pH、浓度变化的因素,将图形数据和所学知识点结合,解答问题。
1.分析题目中涉及的化学反应(或物理变化)。
2.对于只有一条变化曲线的图,直接读出坐标中的两个变量(横、纵坐标)之间的变化关系(关注起点、拐点、终点以及变化的趋势)。
3.挖掘题目信息,结合反应原理,思考影响温度变化、压强变化、pH变化、浓度变化、电导率变化的因素,分析曲线中每一段变化(或拐点变化)的原因,根据题干要求进行解答。
考点攻坚
叁
命题点1 温度传感
C
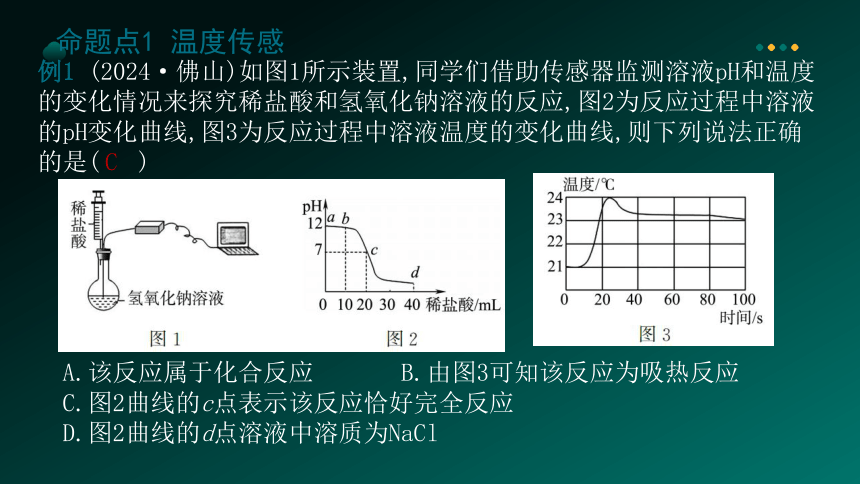
例1 (2024·佛山)如图1所示装置,同学们借助传感器监测溶液pH和温度的变化情况来探究稀盐酸和氢氧化钠溶液的反应,图2为反应过程中溶液的pH变化曲线,图3为反应过程中溶液温度的变化曲线,则下列说法正确的是( )
A.该反应属于化合反应 B.由图3可知该反应为吸热反应
C.图2曲线的c点表示该反应恰好完全反应
D.图2曲线的d点溶液中溶质为NaCl
A
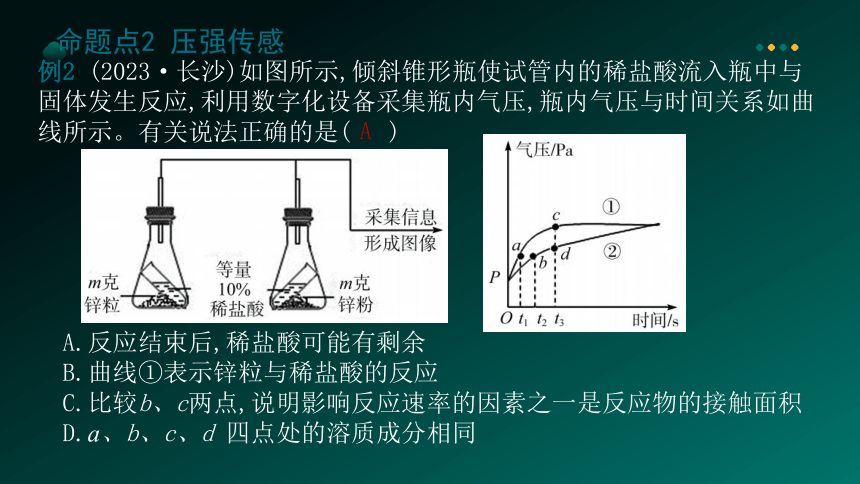
例2 (2023·长沙)如图所示,倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,利用数字化设备采集瓶内气压,瓶内气压与时间关系如曲线所示。有关说法正确的是( )
A.反应结束后,稀盐酸可能有剩余
B.曲线①表示锌粒与稀盐酸的反应
C.比较b、c两点,说明影响反应速率的因素之一是反应物的接触面积
D.a、b、c、d 四点处的溶质成分相同
命题点2 压强传感
例3 (2021·张家港)利用图1所示装置探究NaHCO3溶液与CaCl2溶液混合后发生的变化。常温下,向NaHCO3溶液中匀速滴加CaCl2溶液,pH传感器测得溶液的pH 随时间变化如图2所示。一段时间后,三颈烧瓶和试管中均有白色沉淀生成。已知CaCl2溶液呈中性。下列说法正确的是( )
A.NaHCO3溶液显酸性
B.30s时溶液显酸性的
原因是CaCl2过量
C.三颈烧瓶中生成的白
色沉淀为Ca(HCO3)2
D.实验表明:2NaHCO3+CaCl2
==CaCO3↓+CO2↑+2NaCl+H2O
命题点3 pH传感
D
命题点4 浓度传感
例4 (2024·苏州)某化学兴趣小组对课本实验“测定空气中氧气的含量”,实验完毕后集气瓶中是否还含有氧气产生怀疑,于是同学们设计了如图1装置来探究磷在空气中燃烧后氧气浓度的变化情况。
【提出问题】足量红磷在密闭的四颈平底瓶内燃烧熄灭后,容器中是否有氧气剩余
【做出猜想】猜想①:有氧气剩余;猜想②:无氧气剩余。
【实验验证】该小组同学按图1组装好实验装置,
利用高能激光笔照射燃烧匙上的红磷,红磷燃烧
直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。
【实验结论】根据上述实验现象,得出的结论是:
猜想____正确。
课本上用红磷燃烧的方法______(填 “能”或
“不能”)精确地测定空气中氧气的含量,理由
是______________________________。
①
不能
红磷不能把装置中的氧气耗尽
【拓展延伸】图2是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用传感器测量容器内氧气浓度变化的曲线图。
在图2中_____点时红磷燃烧熄灭;白磷开始燃烧至燃烧结束对应的曲线为______段(用图2中字母表示)。
C
DE
【反思与评价】兴趣小组分析对比曲线BC段
和DE段,得出了 “不同物质燃烧,需要的氧气
浓度不一样”的结论。同学们由此联想到课本
上的一个实验:________(填物质名称)在空气
中不能点燃,但在氧气中能点燃并剧烈燃烧。
命题点4 浓度传感
铁
命题点5 电导率传感
例5 电导率传感器可辅助探
究复分解反应的实质。相同条件下,离子浓
度越大,电导率越大,溶液导电性越强。将含
有酚酞的Ba(OH)2溶液平均分成两份置于两
个烧杯中并插入电导率传感器,往其中一份
滴加稀硫酸,往另一份滴加硫酸钠溶液,测得
溶液的电导率变化如图所示。
下列说法正确的是( )
A.乙曲线电导率减小过程中,溶液由红色变为无色
B.乙曲线对应的反应中四种离子数目都减少
C.甲曲线对应氢氧化钡与硫酸钠反应
D.甲曲线上的 M 点代表两种溶液恰好完全反应
D
专项训练
肆
B
1.(2023·十堰)某兴趣小组为探究影
响化学反应速率的因素,使用等量的同
种钙片和白醋开展四组实验,分别测得
产生的二氧化碳浓度随时间的变化曲
线如图所示。选取CO2的浓度从0~8%为
研究对象,下列实验结果的分析,错误
的是( )
A.对比①③,温度越高,反应速率越快
B.对比②③,反应物接触面积越小,反
应速率越慢
C.对比③④,反应物接触面积越大,反应速率越快
D.对比①②③④,④的反应速率最慢
2.(2023·银川)某实验小组将稀盐酸逐滴加入Na2CO3溶液中,观察到先无气泡,过一段时间后产生气泡。
【问题提出】为什么滴入稀盐酸没有立即产生气泡
【实验探究】借助数字化实验进行探究。一定温度下,用1.825%的稀盐酸与20mL饱和Na2CO3溶液反应,装置 如图1所示。随稀盐酸逐滴加入,充分搅拌,采集到溶液的pH随滴入稀盐酸体积的变化关系如图2所示。实验中发现 A~B段对应烧杯中无气泡产生,B点后逐渐有气泡冒出,C点后几乎无气泡。
【查阅资料】NaHCO3溶液的pH约为8.2。
【实验分析】
(1)图2中A点对应溶液的
颜色是____。
(2)“液滴数传感器”采集
的坐标数据
是______________。
红色
稀盐酸体积
(3)随着稀盐酸滴入,溶液pH_______(填“增大”“不变”或“减小”)。
(4)图2中D点对应溶液中含有的溶质有_____________________(填化学式)。
【实验结论】
(5)稀盐酸滴入Na2CO3溶液,反应分两段进行。
A~B段:反应的化学方程式是
_______________________________________。
B~C段:A~B段的生成物继续与稀盐酸反应转化
为CO2逸出。
减小
HCl、NaCl
Na2CO3+HCl==NaCl+NaHCO3
课堂练习
伍
1.(2023·伊春)用数字传感器探究稀盐酸与稀氢氧化钠溶液反应过程中温度和pH的变化,测定结果如下图所示。下列说法正确的是( )
A.该反应为吸热反应
B.反应过程中,溶液的酸性逐渐增强
C.该实验是向稀氢氧化钠溶液中加入
稀盐酸
D.45s时,稀盐酸与稀氢氧化钠溶液恰
好完全反应
D
2.(2022·运城)已知电导率传感器 用于测量溶液的导电性强弱。一定条件下,电导率的大小能反映离子浓度的大小。常温下将一定质量的氯化钠固体加入盛有 100mL蒸馏水烧杯中,测得的电导率数据如图所示。以下分析不正确的是( )
A.由图可知,a点对应的操作是向水
中加入氯化钠固体
B.c点的电导率不再变化,说明此时
溶液一定达到饱和状态
C.测定氯化钠溶液中不同位置的电导率,
数值相同,说明氯化钠溶液是均一的
D.由图可知,可通过测量液体电导率来区分蒸馏水和稀氯化钠溶液
B
3.(2024·洛阳)兴趣小组同学开展跨学科实践活动,进行了 “无形变有形”的创新实验(装置气密性良好,部分仪器省略)。
(1)图1中,打开塑料瓶瓶盖,同时打开氧气传感器开关,得到了氧气体积分数随时间变化的曲线。AB段氧气体积分数逐渐降低,从微观角度解释其原因是____________________________________________________,BC段氧气体积分数快速下降,BC段对应的实验操作是
_____________________________________________________(写一种)。
氧分子不断运动,部分氧分子运动到瓶外
双手贴在塑料瓶外壁上或将塑料瓶的瓶口朝下(合理即可)
(2)图2中,打开弹簧夹,向试管Ⅰ中加入一定量稀盐酸,关闭弹簧夹 (保持导管口在液面以下),观察到试管Ⅰ中有大量气泡产生且有液体流入试管Ⅱ中,产生此现象的原因是____________________________
___________________________________,反应结束后,试管Ⅱ中的溶液由红色变为无色且无沉淀生成,试管Ⅱ中发生反应的化学方程式为______________________________________,试管Ⅱ的溶液中一定含有的溶质____________________________(除酚酞以外)。
镁与盐酸反应生成氯化镁和氢气,试管Ⅰ中压强变大
HCl+NaOH==NaCl+H2O
NaCl和MgCl2
4.(2024·杭州)在三颈烧瓶中用排空气法收集CO2气体,然后将
三颈烧瓶与盛有盐酸、NaOH溶液的注射器和压强传感器密封连接(如图1)。检验气密性后,在t0时快速注入一种溶液,t2时快速注入第二种溶液,测得瓶内压强随时间变化曲线如图2。下列说法正确的是( )
A.t0时注入的溶液是盐酸
B.t1前压强减小对应的反应示意图如图3所示
C.t1~t2期间压强不变且大于0可证明收集的CO2气体不纯
D.t2后压强增大的原因是NaOH溶液与盐酸发生中和反应
图1
C
5.(2021·嘉兴)某校学生用盐酸和碳酸钙制备CO2,产生了大量废液。兴趣小组通过以下探究确定废液处理方案。
(1)废液成分的确定①写出制备CO2的化学方程式:
________________________________。
②推测废液所含溶质。
推测一:____________。
推测二:CaCl2和HCl。
③若要用一种药品验证哪种推测成立,可选择的有哪些 ____(填字母)。
A.石蕊溶液 B.AgNO3溶液 C.锌粒 D.CuO粉末
CaCO3+2HCl==CaCl2+H2O+CO2↑
CaCl2
ACD
(2)废液的处理实验表明废液中的溶质是CaCl2和HCl,小组决定用Na2CO3 除去它们。
【提出问题】如何估算Na2CO3固体的用量
【进行实验】取100mL废液样品于烧杯中,逐滴滴加5.3% 的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如下图所示。
【结果讨论】
①a→b阶段,观察到烧杯中的现象是
___________。
有气泡产生
②b点后曲线平缓阶段,反应的化学方程式为
_____________________________________。
③c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成,说明处理100mL废液,所需5.3%的Na2CO3溶液的体积______120mL(填“大于”“等于”或 “小于”)。
④将烧杯中的沉淀过滤、干燥、称重,质量为4g。若处理10L该废液,理论上需要Na2CO3固体____g。(实验所用Na2CO3溶液的密度近似看作1g/cm3)
Na2CO3+CaCl2==CaCO3 ↓ +2NaCl
小于
530
知 识 梳 理
巩 固 训
2025年化学中考复习
题型八 数字化实验
第二部分 重点题型突破
考点要求
壹
1.借助可视化的数据认识化学问题的本质。
2.培养多视角收集证据解决化学问题的能力。
数字化实验是通过 “传感器+数据采集器+计算机”定量采集数据得到曲线和数字的一种新型实验,初中化学常见的传感器如温度传感器、压强传感器、pH传感器、浓度传感器等,可以将化学反应和现象的本质转化为可检测的信号,常以坐标曲线图的形式呈现。考生需熟悉掌握影响温度、压强、pH、浓度变化的因素,将图形数据和所学知识点结合,解答问题。
1.分析题目中涉及的化学反应(或物理变化)。
2.对于只有一条变化曲线的图,直接读出坐标中的两个变量(横、纵坐标)之间的变化关系(关注起点、拐点、终点以及变化的趋势)。
3.挖掘题目信息,结合反应原理,思考影响温度变化、压强变化、pH变化、浓度变化、电导率变化的因素,分析曲线中每一段变化(或拐点变化)的原因,根据题干要求进行解答。
考点攻坚
叁
命题点1 温度传感
C
例1 (2024·佛山)如图1所示装置,同学们借助传感器监测溶液pH和温度的变化情况来探究稀盐酸和氢氧化钠溶液的反应,图2为反应过程中溶液的pH变化曲线,图3为反应过程中溶液温度的变化曲线,则下列说法正确的是( )
A.该反应属于化合反应 B.由图3可知该反应为吸热反应
C.图2曲线的c点表示该反应恰好完全反应
D.图2曲线的d点溶液中溶质为NaCl
A
例2 (2023·长沙)如图所示,倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,利用数字化设备采集瓶内气压,瓶内气压与时间关系如曲线所示。有关说法正确的是( )
A.反应结束后,稀盐酸可能有剩余
B.曲线①表示锌粒与稀盐酸的反应
C.比较b、c两点,说明影响反应速率的因素之一是反应物的接触面积
D.a、b、c、d 四点处的溶质成分相同
命题点2 压强传感
例3 (2021·张家港)利用图1所示装置探究NaHCO3溶液与CaCl2溶液混合后发生的变化。常温下,向NaHCO3溶液中匀速滴加CaCl2溶液,pH传感器测得溶液的pH 随时间变化如图2所示。一段时间后,三颈烧瓶和试管中均有白色沉淀生成。已知CaCl2溶液呈中性。下列说法正确的是( )
A.NaHCO3溶液显酸性
B.30s时溶液显酸性的
原因是CaCl2过量
C.三颈烧瓶中生成的白
色沉淀为Ca(HCO3)2
D.实验表明:2NaHCO3+CaCl2
==CaCO3↓+CO2↑+2NaCl+H2O
命题点3 pH传感
D
命题点4 浓度传感
例4 (2024·苏州)某化学兴趣小组对课本实验“测定空气中氧气的含量”,实验完毕后集气瓶中是否还含有氧气产生怀疑,于是同学们设计了如图1装置来探究磷在空气中燃烧后氧气浓度的变化情况。
【提出问题】足量红磷在密闭的四颈平底瓶内燃烧熄灭后,容器中是否有氧气剩余
【做出猜想】猜想①:有氧气剩余;猜想②:无氧气剩余。
【实验验证】该小组同学按图1组装好实验装置,
利用高能激光笔照射燃烧匙上的红磷,红磷燃烧
直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。
【实验结论】根据上述实验现象,得出的结论是:
猜想____正确。
课本上用红磷燃烧的方法______(填 “能”或
“不能”)精确地测定空气中氧气的含量,理由
是______________________________。
①
不能
红磷不能把装置中的氧气耗尽
【拓展延伸】图2是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用传感器测量容器内氧气浓度变化的曲线图。
在图2中_____点时红磷燃烧熄灭;白磷开始燃烧至燃烧结束对应的曲线为______段(用图2中字母表示)。
C
DE
【反思与评价】兴趣小组分析对比曲线BC段
和DE段,得出了 “不同物质燃烧,需要的氧气
浓度不一样”的结论。同学们由此联想到课本
上的一个实验:________(填物质名称)在空气
中不能点燃,但在氧气中能点燃并剧烈燃烧。
命题点4 浓度传感
铁
命题点5 电导率传感
例5 电导率传感器可辅助探
究复分解反应的实质。相同条件下,离子浓
度越大,电导率越大,溶液导电性越强。将含
有酚酞的Ba(OH)2溶液平均分成两份置于两
个烧杯中并插入电导率传感器,往其中一份
滴加稀硫酸,往另一份滴加硫酸钠溶液,测得
溶液的电导率变化如图所示。
下列说法正确的是( )
A.乙曲线电导率减小过程中,溶液由红色变为无色
B.乙曲线对应的反应中四种离子数目都减少
C.甲曲线对应氢氧化钡与硫酸钠反应
D.甲曲线上的 M 点代表两种溶液恰好完全反应
D
专项训练
肆
B
1.(2023·十堰)某兴趣小组为探究影
响化学反应速率的因素,使用等量的同
种钙片和白醋开展四组实验,分别测得
产生的二氧化碳浓度随时间的变化曲
线如图所示。选取CO2的浓度从0~8%为
研究对象,下列实验结果的分析,错误
的是( )
A.对比①③,温度越高,反应速率越快
B.对比②③,反应物接触面积越小,反
应速率越慢
C.对比③④,反应物接触面积越大,反应速率越快
D.对比①②③④,④的反应速率最慢
2.(2023·银川)某实验小组将稀盐酸逐滴加入Na2CO3溶液中,观察到先无气泡,过一段时间后产生气泡。
【问题提出】为什么滴入稀盐酸没有立即产生气泡
【实验探究】借助数字化实验进行探究。一定温度下,用1.825%的稀盐酸与20mL饱和Na2CO3溶液反应,装置 如图1所示。随稀盐酸逐滴加入,充分搅拌,采集到溶液的pH随滴入稀盐酸体积的变化关系如图2所示。实验中发现 A~B段对应烧杯中无气泡产生,B点后逐渐有气泡冒出,C点后几乎无气泡。
【查阅资料】NaHCO3溶液的pH约为8.2。
【实验分析】
(1)图2中A点对应溶液的
颜色是____。
(2)“液滴数传感器”采集
的坐标数据
是______________。
红色
稀盐酸体积
(3)随着稀盐酸滴入,溶液pH_______(填“增大”“不变”或“减小”)。
(4)图2中D点对应溶液中含有的溶质有_____________________(填化学式)。
【实验结论】
(5)稀盐酸滴入Na2CO3溶液,反应分两段进行。
A~B段:反应的化学方程式是
_______________________________________。
B~C段:A~B段的生成物继续与稀盐酸反应转化
为CO2逸出。
减小
HCl、NaCl
Na2CO3+HCl==NaCl+NaHCO3
课堂练习
伍
1.(2023·伊春)用数字传感器探究稀盐酸与稀氢氧化钠溶液反应过程中温度和pH的变化,测定结果如下图所示。下列说法正确的是( )
A.该反应为吸热反应
B.反应过程中,溶液的酸性逐渐增强
C.该实验是向稀氢氧化钠溶液中加入
稀盐酸
D.45s时,稀盐酸与稀氢氧化钠溶液恰
好完全反应
D
2.(2022·运城)已知电导率传感器 用于测量溶液的导电性强弱。一定条件下,电导率的大小能反映离子浓度的大小。常温下将一定质量的氯化钠固体加入盛有 100mL蒸馏水烧杯中,测得的电导率数据如图所示。以下分析不正确的是( )
A.由图可知,a点对应的操作是向水
中加入氯化钠固体
B.c点的电导率不再变化,说明此时
溶液一定达到饱和状态
C.测定氯化钠溶液中不同位置的电导率,
数值相同,说明氯化钠溶液是均一的
D.由图可知,可通过测量液体电导率来区分蒸馏水和稀氯化钠溶液
B
3.(2024·洛阳)兴趣小组同学开展跨学科实践活动,进行了 “无形变有形”的创新实验(装置气密性良好,部分仪器省略)。
(1)图1中,打开塑料瓶瓶盖,同时打开氧气传感器开关,得到了氧气体积分数随时间变化的曲线。AB段氧气体积分数逐渐降低,从微观角度解释其原因是____________________________________________________,BC段氧气体积分数快速下降,BC段对应的实验操作是
_____________________________________________________(写一种)。
氧分子不断运动,部分氧分子运动到瓶外
双手贴在塑料瓶外壁上或将塑料瓶的瓶口朝下(合理即可)
(2)图2中,打开弹簧夹,向试管Ⅰ中加入一定量稀盐酸,关闭弹簧夹 (保持导管口在液面以下),观察到试管Ⅰ中有大量气泡产生且有液体流入试管Ⅱ中,产生此现象的原因是____________________________
___________________________________,反应结束后,试管Ⅱ中的溶液由红色变为无色且无沉淀生成,试管Ⅱ中发生反应的化学方程式为______________________________________,试管Ⅱ的溶液中一定含有的溶质____________________________(除酚酞以外)。
镁与盐酸反应生成氯化镁和氢气,试管Ⅰ中压强变大
HCl+NaOH==NaCl+H2O
NaCl和MgCl2
4.(2024·杭州)在三颈烧瓶中用排空气法收集CO2气体,然后将
三颈烧瓶与盛有盐酸、NaOH溶液的注射器和压强传感器密封连接(如图1)。检验气密性后,在t0时快速注入一种溶液,t2时快速注入第二种溶液,测得瓶内压强随时间变化曲线如图2。下列说法正确的是( )
A.t0时注入的溶液是盐酸
B.t1前压强减小对应的反应示意图如图3所示
C.t1~t2期间压强不变且大于0可证明收集的CO2气体不纯
D.t2后压强增大的原因是NaOH溶液与盐酸发生中和反应
图1
C
5.(2021·嘉兴)某校学生用盐酸和碳酸钙制备CO2,产生了大量废液。兴趣小组通过以下探究确定废液处理方案。
(1)废液成分的确定①写出制备CO2的化学方程式:
________________________________。
②推测废液所含溶质。
推测一:____________。
推测二:CaCl2和HCl。
③若要用一种药品验证哪种推测成立,可选择的有哪些 ____(填字母)。
A.石蕊溶液 B.AgNO3溶液 C.锌粒 D.CuO粉末
CaCO3+2HCl==CaCl2+H2O+CO2↑
CaCl2
ACD
(2)废液的处理实验表明废液中的溶质是CaCl2和HCl,小组决定用Na2CO3 除去它们。
【提出问题】如何估算Na2CO3固体的用量
【进行实验】取100mL废液样品于烧杯中,逐滴滴加5.3% 的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如下图所示。
【结果讨论】
①a→b阶段,观察到烧杯中的现象是
___________。
有气泡产生
②b点后曲线平缓阶段,反应的化学方程式为
_____________________________________。
③c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成,说明处理100mL废液,所需5.3%的Na2CO3溶液的体积______120mL(填“大于”“等于”或 “小于”)。
④将烧杯中的沉淀过滤、干燥、称重,质量为4g。若处理10L该废液,理论上需要Na2CO3固体____g。(实验所用Na2CO3溶液的密度近似看作1g/cm3)
Na2CO3+CaCl2==CaCO3 ↓ +2NaCl
小于
530
知 识 梳 理
巩 固 训
同课章节目录
