人教版 高中物理选择性必修第三册 4.4 玻尔的原子模型 课件(共23张PPT)
文档属性
| 名称 | 人教版 高中物理选择性必修第三册 4.4 玻尔的原子模型 课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 730.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2025-03-10 10:43:25 | ||
图片预览





文档简介
(共23张PPT)
人教版选修3-5
第四章 原子结构和波粒二象性
第4节 玻尔的原子模型
一、理论背景:
?
核外电子做怎样的运动?
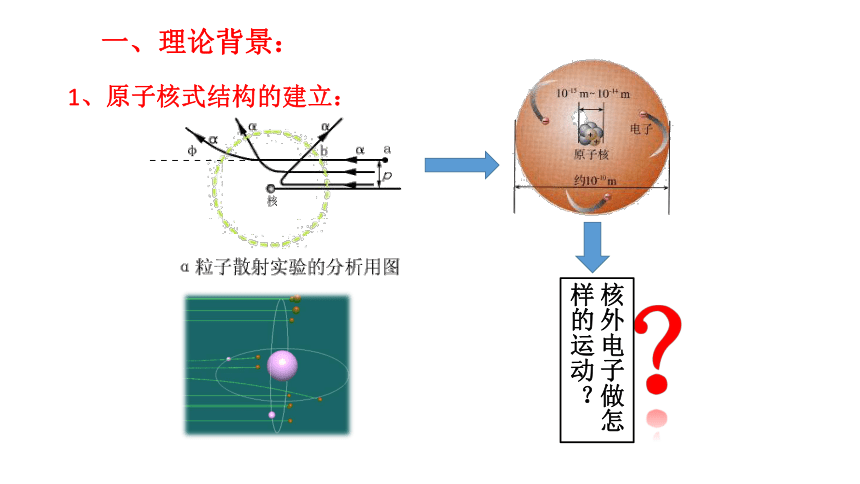
1、原子核式结构的建立:
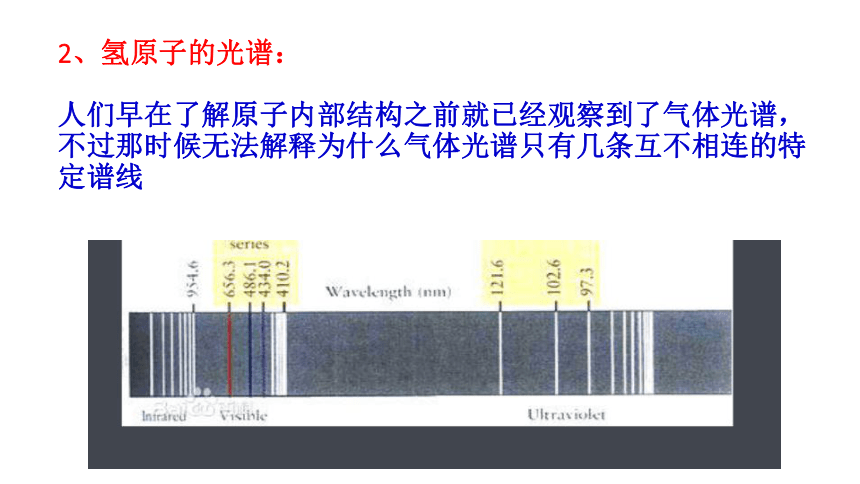
2、氢原子的光谱:
人们早在了解原子内部结构之前就已经观察到了气体光谱,不过那时候无法解释为什么气体光谱只有几条互不相连的特定谱线
1、解释要点:由于电子轨道的变化是连续的,辐射电磁波的频率也会连续变化.
二、经典理论的解析:
2、困顿:事实上,原子是稳定的,辐射电磁波的频率也只是某些确定的值。
1、理论渊源:适用于宏观物理的经典理论在解释原子世界的现象时,遇到了不可调和的矛盾。为了解决这一矛盾,1913年,玻尔在普朗克的量子论和爱因斯坦的光子概念的启发下,将分立值的观念应用到原子系统,提出了自己的原子结构假说。
玻尔
三、玻尔的原子理论:
玻尔简介:(详见配套导学案)
丹麦物理学家,1922年获得诺贝尔物理学奖。
1911年开始,先在剑桥J.J.汤姆孙主持的卡文迪许实验室,后参加了曼彻斯特大学以E.卢瑟福为首的科学集体,从此和卢瑟福建立了长期的密切关系。
1912年,玻尔考察了金属中的电子运动,并明确意识到经典理论在阐明微观现象方面的严重缺陷,赞赏普朗克和爱因斯坦在电磁理论方面引入的量子学说,创造性地把普朗克的量子说和卢瑟福的原子核概念结合了起来。
1913年提出了量子不连续性,成功地解释了氢原子和类氢原子的结构和性质,提出了原子结构的玻尔模型。
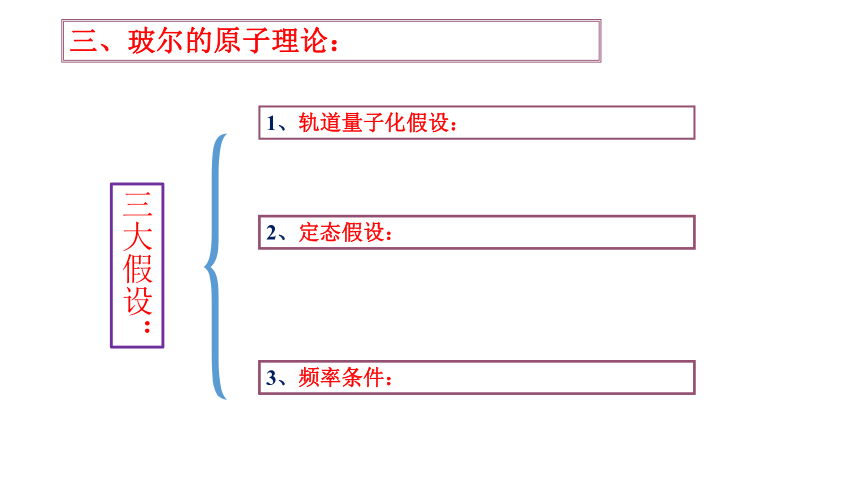
1、轨道量子化假设:
2、定态假设:
3、频率条件:
三、玻尔的原子理论:
三大假设:
三、玻尔的原子理论之轨道量子化假设:
1、轨道量子化假设:(针对原子核式模型提出,是能级假设的补充)
围绕原子核运动的电子轨道半径只能是某些分立的数值,这个条件叫做轨道量子化条件;
(1)原子中的电子在库仑引力的作用下,绕原子核做圆周运动;
(2)电子绕核运动的轨道是不连续的;
(3)电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射。
2、定态假设:(本假设是针对原子稳定性提出的)
不同的轨道对应着不同的状态,在这些状态中,尽管电子在做变速运动,却不辐射能量,因此这些状态是稳定的;
(1)当电子在不同轨道上运动时,原子处于不同的状态中,具有不同的能量,即原子的能量是量子化的,这些量子化的能量值叫作能级。
(2)原子中这些具有确定能量的稳定状态,称为定态。能量最低的状态叫作基态,其他的能量状态叫作激发态。
三、玻尔的原子理论之定态假设:
3、频率条件:(本假设针对线状谱提出)
原子从一种定态跃迁到另一种定态时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即hν=Em-En, (h是普朗克常量,h=6.63×10-34 J·s) 。可见,电子如果从一个轨道到另一个轨道,不是以螺旋线的形式改变半径大小的,而是从一个轨道上“跳跃”到另一个轨道上。玻尔将这种现象叫作电子的跃迁。
高能级Em 低能级En
三、玻尔的原子理论之频率条件:
(1)氢原子的能级图:
(2)氢原子的能级公式:
=E1/n2 (n=1,2,3,…),其中E1为___________,其数值为E1=-13.6 eV.
基态能量
1、计算了氢原子的能级:
四、玻尔原子理论对氢光谱的解释:
2.解释了巴耳末公式
(1)按照玻尔理论,原子从高能级(如从Em)跃迁到低能级(如到E2)时辐射的光子的能量为hν=Em-E2。
(2)巴耳末公式中的正整数n和2正好代表能级跃迁之前和之后所处的定态轨道的量子数n和2。并且理论上的计算和实验测量的里德伯常量符合得很好。
四、玻尔原子理论对氢光谱的解释:
3.解释了气体导电发光现象:
处于基态的原子受到电子的撞击,可以跃迁到激发态,处于激发态的原子是不稳定的,会自发地向能量较低的能级跃迁,放出光子,最终回到基态。
4.解释了氢原子光谱的不连续性
原子从较高能级向低能级跃迁时放出光子的能量等于前后两能级差,由于原子的能级是分立的,所以放出的光子的能量也是分立的,因此原子的发射光谱只有一些分立的亮线。
5.解释了不同(类氢)原子具有不同的特征谱线
不同的原子具有不同的结构,能级各不相同,因此辐射(或吸收)的光子频率也不相同。
四、玻尔原子理论对氢光谱的解释:
本节课要弄清的前3个问题,你清楚了吗?
1、玻尔理论提出的历史背景是怎样的?
2、玻尔理论要解决什么问题?
3、玻尔理论是怎样解决所面对的问题的?
4、玻尔理论的成功和局限分别有哪些?
五、玻尔理论的成功与局限性:
1.玻尔理论的成功之处:玻尔的原子理论第一次将量子观念引入原子领域,提出了定态和跃迁的概念,成功地解释了氢原子光谱的实验规律。轨道量子化假设把量子观念引入原子理论,这是玻尔的原子理论之所以成功的根本原因
2.玻尔理论的局限性:对更复杂的原子发光,玻尔理论却无法解释,它过多地保留了经典粒子的概念。把电子运动看成是经典力学描述下的轨道运动。
3.电子云:根据量子观念,核外电子的运动服从统计规律,而没有固定的轨道,我们只能知道它们在核外某处出现的概率大小,画出来的图像就像云雾一样,稠密的地方就是电子出现概率大的地方,把它形象地称作电子云。
关于氢原子的电子云:
图2表示2p态磁量子数m=0的电子云,一定范围内的概率密度(用百分数表示)形成不同颜色环,颜色深的地方表示点数浓度大,概率密度也大.
多学一点:
1、氢原子的电离:
所以至少要13.6eV能量的光子或电子
多学一点:
2、使原子能级跃迁的两种粒子——光子与实物粒子
(1)原子若是吸收光子的能量而被激发,其光子的能量必须等于两能级的能量差,否则不被吸收。
(2)原子还可吸收实物粒子(如自由电子)的能量而被激发,由于实物粒子的动能可部分地被原子吸收,所以只要入射粒子的能量大于两能级的能量差值,就可使原子发生能级跃迁。
六、本节小结:
电子是原子的组成部分,是更基本的单元
电子是原子的组成部分,是更基本的单元
原子结构的完整建立:
本章知识结构:
人教版选修3-5
第四章 原子结构和波粒二象性
第4节 玻尔的原子模型
一、理论背景:
?
核外电子做怎样的运动?
1、原子核式结构的建立:
2、氢原子的光谱:
人们早在了解原子内部结构之前就已经观察到了气体光谱,不过那时候无法解释为什么气体光谱只有几条互不相连的特定谱线
1、解释要点:由于电子轨道的变化是连续的,辐射电磁波的频率也会连续变化.
二、经典理论的解析:
2、困顿:事实上,原子是稳定的,辐射电磁波的频率也只是某些确定的值。
1、理论渊源:适用于宏观物理的经典理论在解释原子世界的现象时,遇到了不可调和的矛盾。为了解决这一矛盾,1913年,玻尔在普朗克的量子论和爱因斯坦的光子概念的启发下,将分立值的观念应用到原子系统,提出了自己的原子结构假说。
玻尔
三、玻尔的原子理论:
玻尔简介:(详见配套导学案)
丹麦物理学家,1922年获得诺贝尔物理学奖。
1911年开始,先在剑桥J.J.汤姆孙主持的卡文迪许实验室,后参加了曼彻斯特大学以E.卢瑟福为首的科学集体,从此和卢瑟福建立了长期的密切关系。
1912年,玻尔考察了金属中的电子运动,并明确意识到经典理论在阐明微观现象方面的严重缺陷,赞赏普朗克和爱因斯坦在电磁理论方面引入的量子学说,创造性地把普朗克的量子说和卢瑟福的原子核概念结合了起来。
1913年提出了量子不连续性,成功地解释了氢原子和类氢原子的结构和性质,提出了原子结构的玻尔模型。
1、轨道量子化假设:
2、定态假设:
3、频率条件:
三、玻尔的原子理论:
三大假设:
三、玻尔的原子理论之轨道量子化假设:
1、轨道量子化假设:(针对原子核式模型提出,是能级假设的补充)
围绕原子核运动的电子轨道半径只能是某些分立的数值,这个条件叫做轨道量子化条件;
(1)原子中的电子在库仑引力的作用下,绕原子核做圆周运动;
(2)电子绕核运动的轨道是不连续的;
(3)电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射。
2、定态假设:(本假设是针对原子稳定性提出的)
不同的轨道对应着不同的状态,在这些状态中,尽管电子在做变速运动,却不辐射能量,因此这些状态是稳定的;
(1)当电子在不同轨道上运动时,原子处于不同的状态中,具有不同的能量,即原子的能量是量子化的,这些量子化的能量值叫作能级。
(2)原子中这些具有确定能量的稳定状态,称为定态。能量最低的状态叫作基态,其他的能量状态叫作激发态。
三、玻尔的原子理论之定态假设:
3、频率条件:(本假设针对线状谱提出)
原子从一种定态跃迁到另一种定态时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即hν=Em-En, (h是普朗克常量,h=6.63×10-34 J·s) 。可见,电子如果从一个轨道到另一个轨道,不是以螺旋线的形式改变半径大小的,而是从一个轨道上“跳跃”到另一个轨道上。玻尔将这种现象叫作电子的跃迁。
高能级Em 低能级En
三、玻尔的原子理论之频率条件:
(1)氢原子的能级图:
(2)氢原子的能级公式:
=E1/n2 (n=1,2,3,…),其中E1为___________,其数值为E1=-13.6 eV.
基态能量
1、计算了氢原子的能级:
四、玻尔原子理论对氢光谱的解释:
2.解释了巴耳末公式
(1)按照玻尔理论,原子从高能级(如从Em)跃迁到低能级(如到E2)时辐射的光子的能量为hν=Em-E2。
(2)巴耳末公式中的正整数n和2正好代表能级跃迁之前和之后所处的定态轨道的量子数n和2。并且理论上的计算和实验测量的里德伯常量符合得很好。
四、玻尔原子理论对氢光谱的解释:
3.解释了气体导电发光现象:
处于基态的原子受到电子的撞击,可以跃迁到激发态,处于激发态的原子是不稳定的,会自发地向能量较低的能级跃迁,放出光子,最终回到基态。
4.解释了氢原子光谱的不连续性
原子从较高能级向低能级跃迁时放出光子的能量等于前后两能级差,由于原子的能级是分立的,所以放出的光子的能量也是分立的,因此原子的发射光谱只有一些分立的亮线。
5.解释了不同(类氢)原子具有不同的特征谱线
不同的原子具有不同的结构,能级各不相同,因此辐射(或吸收)的光子频率也不相同。
四、玻尔原子理论对氢光谱的解释:
本节课要弄清的前3个问题,你清楚了吗?
1、玻尔理论提出的历史背景是怎样的?
2、玻尔理论要解决什么问题?
3、玻尔理论是怎样解决所面对的问题的?
4、玻尔理论的成功和局限分别有哪些?
五、玻尔理论的成功与局限性:
1.玻尔理论的成功之处:玻尔的原子理论第一次将量子观念引入原子领域,提出了定态和跃迁的概念,成功地解释了氢原子光谱的实验规律。轨道量子化假设把量子观念引入原子理论,这是玻尔的原子理论之所以成功的根本原因
2.玻尔理论的局限性:对更复杂的原子发光,玻尔理论却无法解释,它过多地保留了经典粒子的概念。把电子运动看成是经典力学描述下的轨道运动。
3.电子云:根据量子观念,核外电子的运动服从统计规律,而没有固定的轨道,我们只能知道它们在核外某处出现的概率大小,画出来的图像就像云雾一样,稠密的地方就是电子出现概率大的地方,把它形象地称作电子云。
关于氢原子的电子云:
图2表示2p态磁量子数m=0的电子云,一定范围内的概率密度(用百分数表示)形成不同颜色环,颜色深的地方表示点数浓度大,概率密度也大.
多学一点:
1、氢原子的电离:
所以至少要13.6eV能量的光子或电子
多学一点:
2、使原子能级跃迁的两种粒子——光子与实物粒子
(1)原子若是吸收光子的能量而被激发,其光子的能量必须等于两能级的能量差,否则不被吸收。
(2)原子还可吸收实物粒子(如自由电子)的能量而被激发,由于实物粒子的动能可部分地被原子吸收,所以只要入射粒子的能量大于两能级的能量差值,就可使原子发生能级跃迁。
六、本节小结:
电子是原子的组成部分,是更基本的单元
电子是原子的组成部分,是更基本的单元
原子结构的完整建立:
本章知识结构:
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
