湖南省株洲市炎陵县2024-2025学年高二下学期开学考试化学试题(含答案)
文档属性
| 名称 | 湖南省株洲市炎陵县2024-2025学年高二下学期开学考试化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 433.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 00:00:00 | ||
图片预览




文档简介
炎陵县 2025 年上期高二 化学 入学检测卷
分值:100 时间:75 分钟
可能用到的相对原子质量:Fe---56
一、单选题(每题 3 分,共 42 分)
1.新质生产力涵盖创新材料、新能源、生物医药等产业链。下列说法错误的是( )
A.具有储氢潜力的新型材料碳纳米管属于单质
B.创新药氢溴酸氘瑞米德韦片中所含氘与氕互为同位素
C.可精确控制硬化过程的可编程水泥属于无机非金属材料
D.具有独特光学、电学性能的纳米半导体 CdTe 量子点属于胶体
2.能正确表示下列变化的离子方程式是( )
A.甲醇碱性燃料电池负极方程式:CH3OH﹣6e﹣+H2O═CO2↑+6H+
B.铁粉与过量稀硝酸反应:Fe 4H+═Fe3++NO↑+2H2O
C.亚硫酸氢钠的水解: H2O H3O+
D.硫酸铜溶液中通入硫化氢:Cu2++S2﹣═CuS↓
3.设阿伏加德罗常数的值为 NA,则下列说法正确的是( )
A.标准状况下,16.8LCH4 与足量氯气在光照下反应生成 CH3Cl 分子数目小于 0.75NA
B.常温常压下,56gFe 和足量浓盐酸反应转移电子数为 3NA
C.1.05molNa2O2 分别与足量 CO2、SO2 反应,转移的电子数目均为 1.05NA
D.将 50mL、18mol/L 的浓硫酸与足量铜粉共热,产生的 SO2 分子数为 0.45NA
4.实验室用含有少量铁、氧化铁杂质的废铜粉制取无水硫酸铜的实验步骤如图:
下列有关说法正确的是( )
A.溶解废铜粉的“过量酸”是指稀硝酸
B.气体 A 是 Cl2,将亚铁离子氧化为铁离子
C.生成沉淀 D 的离子方程式可能是 3CuO+2Fe3++3H2O=2Fe(OH)3↓+3Cu2+
D.从溶液中得到的无水硫酸铜的方法是冷却结晶
5.打开分液漏斗活塞和玻璃塞,进行如图所示的探究实验,对实验现象分析正确的是( )
第 1页(共 10页)
A.试管中产生大量气泡,说明 Na2SO3 被氧化产生 SO2
B.试管内 CCl4 层溶液褪色,说明 Br2 具有还原性
C.试管中浸有品红溶液的棉球褪色,说明 SO2 具有氧化性
D.一段时间后试管内有白色沉淀,说明有 生成
6.主族元素 W、X、Y、Z 原子序数依次增大,X、Y 的价电子数相等,Z 的价电子所在能层
有 16 个轨道,4 种元素形成的化合物如图。下列说法正确的是( )
A.电负性:W>Y
B.酸性:W2YX3>W2YX4
C.基态原子的未成对电子数:W>X
D.氧化物溶于水所得溶液的 pH:Z>Y
7.化合物 Z 是一种药物的重要中间体,部分合成路线如图:
下列说法正确的是( )
A.X 分子中所有碳原子共平面
B.1mol Y 最多能与 1mol H2 发生加成反应
C.Z 不能与 Br2 的 CCl4 溶液反应
D.Y、Z 均能使酸性 KMnO4 溶液褪色
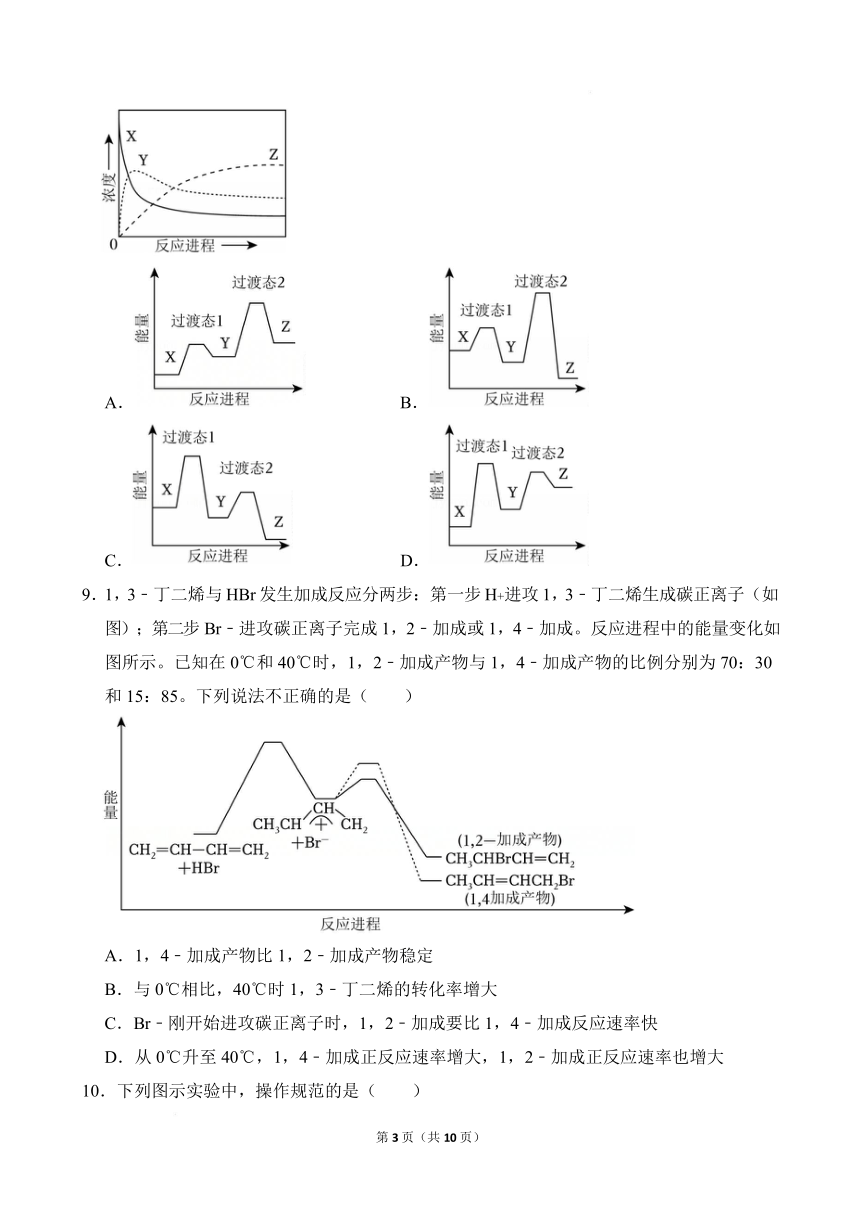
8.某温度下,在密闭容器中充入一定量的 X(g),发生下列反应:X(g) Y(g)(ΔH1
<0),Y(g) Z(g)(ΔH2<0),测得各气体浓度与反应时间的关系如图所示。下列反
应进程示意图符合题意的是( )
第 2页(共 10页)
A. B.
C. D.
9.1,3﹣丁二烯与 HBr 发生加成反应分两步:第一步 H+进攻 1,3﹣丁二烯生成碳正离子(如
图);第二步 Br﹣进攻碳正离子完成 1,2﹣加成或 1,4﹣加成。反应进程中的能量变化如
图所示。已知在 0℃和 40℃时,1,2﹣加成产物与 1,4﹣加成产物的比例分别为 70:30
和 15:85。下列说法不正确的是( )
A.1,4﹣加成产物比 1,2﹣加成产物稳定
B.与 0℃相比,40℃时 1,3﹣丁二烯的转化率增大
C.Br﹣刚开始进攻碳正离子时,1,2﹣加成要比 1,4﹣加成反应速率快
D.从 0℃升至 40℃,1,4﹣加成正反应速率增大,1,2﹣加成正反应速率也增大
10.下列图示实验中,操作规范的是( )
第 3页(共 10页)
A.调控滴定速度 B.用 pH 试纸测定 C.加热试管中的 D.向试管中滴加
溶液 pH 液体 溶液
A.A B.B C.C D.D
11.以不同材料修饰的 Pt 为电极,一定浓度的 NaBr 溶液为电解液,采用电解和催化相结合
的循环方式,可实现高效制 H2 和 O2。装置如图所示。下列说法错误的是( )
A.电极 a 连接电源负极
B.加入 Y 的目的是补充 NaBr
C.电解总反应式为 Br﹣+3H2O 3H2 ↑
D.催化阶段反应产物物质的量之比 n(Z):n(Br﹣)=3:2
12.下列说法正确的是( )
A.p﹣pσ键电子云轮廓图
B.基态铜原子的价层电子排布图:
C.Fe3+的离子结构示意图为:
D.某原子核外电子排布式为 ns2np7,它违背了泡利原理
13.NH4ClO4 是火箭固体燃料重要的氧载体,与某些易燃物作用可全部生成气态产物,如:
NH4ClO4+2C═NH3↑+2CO2↑+HCl↑。下列有关化学用语或表述正确的是( )
A.HCl 的形成过程可表示为
B.NH4ClO4 中的阴、阳离子有相同的 VSEPR 模型和空间结构
第 4页(共 10页)
C.在 C60、石墨、金刚石中,碳原子有 sp,sp2 和 sp3 三种杂化方式
D.NH3 和 CO2 都能作制冷剂是因为它们有相同类型的分子间作用力
14.常温下,将 0.1mol L﹣1NaOH 溶液滴加到 20mL0.1mol L﹣1 二元弱酸 H2A 溶液中,混合
溶液的 pH 随 NaOH 溶液滴入量的关系如图所示。下列叙述不正确的是( )
A.Ka1(H2A)≈10﹣3
B.b 处溶质为 NaHA,所以促进水的电离
C.b 点时溶液中存在 c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(H2A)
D.c 点时溶液中存在 c(Na+)﹣c(HA﹣)﹣2c(A2﹣)=10﹣4.5﹣10﹣9.5
二、非选择题(共 4 小题,每空 2 分,共 58 分)
15.(14 分)完成下列问题
(1)在一个容积不变的密闭容器中发生反应:CO2(g)+H2(g)=CO(g)+H2O(g),
其平衡常数(K)和温度(t)的关系如表所示。
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
请填写下列空白:
①该反应的平衡常数表达式为 ,该反应为 反应(填“吸
热”或“放热”)。
②若 1200℃时,在某时刻反应混合物中 CO2、H2、CO、H2O 的浓度分别为 2mol L
﹣1、
2mol L﹣1、4mol L﹣1、4mol L
﹣1,则此时上述反应的平衡移动方向为 (填
“正反应方向”或“逆反应方向”或“不移动”)。
③将 2.0mol CO2 和 3.0mol H2 通入容积为 3L 的恒容密闭容器中,在一定条件下发生反应,
测得 H2 的平衡转化率与温度的关系如图所示。
第 5页(共 10页)
100℃时反应达到平衡所需的时间为 5min,则反应从起始至 5min 内,用 H2 表示该反应的
平均反应速率为 mol L﹣1 min ﹣1。100℃时,反应的平衡常数 K= 。
(2)火箭发射时常出现红棕色气体,原因为 N2O4(g) 2NO2(g),当温度升高时气体
颜色变深。现将 1mol N2O4 充入一个恒压的密闭容器中,下列示意图正确且能说明反应达
到平衡状态的是 。
若在相同温度下,上述反应改在容积为 1L 的恒容密闭容器中进行,平衡常数
将 (填“增大”或“不变”或“减小”)。
16.(14 分)2022 年 9 月,中国科学家首次在嫦娥五号带回的月壤中发现新矿物,并命名
为“嫦娥石”。“嫦娥石”属于陨磷钠镁钙石族,其中一种物质的化学式为 Ca9NaMg(PO4)7
。请回答下列问题:
(1)钠在火焰上灼烧的黄光是一种 (填字母)。
a.吸收光谱 b.发射光谱
( 2) P 原 子 最 高 能 级 电 子 的 电 子 云 轮 廓 形 状 为 , 其 价 电 子 排 布 式
为 ,电负性 P O(填“>”或“<”)。
(3)PCl3 分子空间结构为 ,PCl3 与 Cl2 反应生成 PCl5,PCl5 结构为
,PCl5 是 分子(填“极性”或“非极性”),其中P 原子的杂化类型是 (填
字母序号)。
a.sp b.sp2 c.sp3 d.sp3d
第 6页(共 10页)
17.(14 分)根据要求,回答下列问题:
(1)某温度下,纯水中的 c(H+)=2.0×10﹣7mol L﹣1,则该温度时的水的离子积 Kw=
。保持温度不变,滴入稀盐酸使溶液中的 c(H+)=5.0×10﹣6mol L﹣1,
则溶液中的 c(OH﹣)为 mol L﹣1。
( 2) 常 温 时 , K2CO3 的 水 溶 液 pH 大 于 7, 原 因 是 ( 用 离 子 方 程 式 表
示): 。
(3)将 AlCl3 溶液蒸干、灼烧,最后所得的固体的主要成分是 。
(4)物质的量浓度相同的三种盐 NaX、NaY、NaZ 的溶液,其 pH 依次为 8、9、10,则 HX、
HY、HZ 的酸性由强到弱的顺序是 。
(5)已知:
a.Ksp[Zn(OH)2]=10﹣17,Ksp[Cu(OH)2]=10﹣20,Ksp(ZnS)=10﹣25,Ksp(CuS)=10﹣30
b.pH>11 时,Zn2+会转化为[Zn(OH)4]2﹣
c.离子浓度≤10﹣5mol/L,即认为其完全沉淀
①若加入 Na2S 来沉淀 Zn2+和 Cu2+,当溶液中 ZnS 和 CuS 共存时, 。
② 若 加 入 NaOH 溶 液 来 调 节 pH,使 Zn2+和 Cu2+完 全 沉 淀 ,pH 应 满 足 的 条 件 为
。
18. (16 分)HDS 催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧——水
浸取法从 HDS 废催化剂(主要成分为 MoS、NiS、V2O5、Al2O3)中提取贵重金属钒和钼,
其工艺流程如图所示。
已知:Ⅰ.MoO3、V2O5、Al2O3 均可与纯碱反应生成对应的钠盐,而 NiO 不行。
Ⅱ.高温下,NH4VO3 易分解产生 N2 和一种含氮元素的气体。
Ⅲ.Ksp(CuS)=6×10﹣36;K1(H2S)=1×10﹣7、K2(H2S)=6×10﹣15。
请回答下列问题:
(1)请写出“气体”中属于最高价氧化物的电子式: 。
第 7页(共 10页)
(2)请写出“焙烧”过程中 Al2O3 与纯碱反应的化学方程式: 。
(3)“浸渣”的成分为 (填化学式);“滤液 2”中的成分除了 Na2MoO4 外,
还含有 (填化学式)。
(4)“沉钒”时提钒率随初始钒的浓度及氯化铵的加入量的关系如图所示,则选择的初始
钒的浓度和 NH4Cl 的加入量分别为 、 。
( 5)“ 沉 钒 ” 时 生 成 NH4VO3 沉 淀 , 请 写 出 “ 煅 烧 ” 中 发 生 反 应 的 化 学 方 程
式: 。
(6)在实际的工业生产中,“沉钼”前要加入 NH4HS 进行“除杂”,除掉溶液中微量的 Cu2
+,则反应 Cu2++HS﹣=CuS+H+的 K= 。
第 8页(共 10页)
参考答案
一、单选题(每题 3 分,共 42 分)
题号 1 2 3 4 5 6 7 8 9 10 11
答案 D B A C D D D B B A B
题号 12 13 14
答案 D B B
二、非选择题(共 4 小题,每空 2 分,共 58 分)
15.
(1)①K ;吸热; ②逆反应方向;③0.1;3;
(2)ac;不变。
16.(1)b
(2)哑铃形;3s23p3;<;
(4)三角锥形;非极性;d。
17.(1)4.0×10﹣14;8×10﹣9;
(2)CO32﹣+H2O HCO3﹣+OH﹣;
(3)Al2O3;
(4)HX>HY>HZ;
(5)105;②8~11。
18.(1) ;
(2)Al2O3+Na2CO3 2NaAlO2+CO2↑;
(3)NiO;NaVO3、NaHCO3;
(4)20g L﹣1;10g L﹣1;
(5)6NH4VO3 3V2O3+2N2↑+2NH3↑+9H2O;
(6)1021。
第 9页(共 10页)
第 10页(共 10页)
分值:100 时间:75 分钟
可能用到的相对原子质量:Fe---56
一、单选题(每题 3 分,共 42 分)
1.新质生产力涵盖创新材料、新能源、生物医药等产业链。下列说法错误的是( )
A.具有储氢潜力的新型材料碳纳米管属于单质
B.创新药氢溴酸氘瑞米德韦片中所含氘与氕互为同位素
C.可精确控制硬化过程的可编程水泥属于无机非金属材料
D.具有独特光学、电学性能的纳米半导体 CdTe 量子点属于胶体
2.能正确表示下列变化的离子方程式是( )
A.甲醇碱性燃料电池负极方程式:CH3OH﹣6e﹣+H2O═CO2↑+6H+
B.铁粉与过量稀硝酸反应:Fe 4H+═Fe3++NO↑+2H2O
C.亚硫酸氢钠的水解: H2O H3O+
D.硫酸铜溶液中通入硫化氢:Cu2++S2﹣═CuS↓
3.设阿伏加德罗常数的值为 NA,则下列说法正确的是( )
A.标准状况下,16.8LCH4 与足量氯气在光照下反应生成 CH3Cl 分子数目小于 0.75NA
B.常温常压下,56gFe 和足量浓盐酸反应转移电子数为 3NA
C.1.05molNa2O2 分别与足量 CO2、SO2 反应,转移的电子数目均为 1.05NA
D.将 50mL、18mol/L 的浓硫酸与足量铜粉共热,产生的 SO2 分子数为 0.45NA
4.实验室用含有少量铁、氧化铁杂质的废铜粉制取无水硫酸铜的实验步骤如图:
下列有关说法正确的是( )
A.溶解废铜粉的“过量酸”是指稀硝酸
B.气体 A 是 Cl2,将亚铁离子氧化为铁离子
C.生成沉淀 D 的离子方程式可能是 3CuO+2Fe3++3H2O=2Fe(OH)3↓+3Cu2+
D.从溶液中得到的无水硫酸铜的方法是冷却结晶
5.打开分液漏斗活塞和玻璃塞,进行如图所示的探究实验,对实验现象分析正确的是( )
第 1页(共 10页)
A.试管中产生大量气泡,说明 Na2SO3 被氧化产生 SO2
B.试管内 CCl4 层溶液褪色,说明 Br2 具有还原性
C.试管中浸有品红溶液的棉球褪色,说明 SO2 具有氧化性
D.一段时间后试管内有白色沉淀,说明有 生成
6.主族元素 W、X、Y、Z 原子序数依次增大,X、Y 的价电子数相等,Z 的价电子所在能层
有 16 个轨道,4 种元素形成的化合物如图。下列说法正确的是( )
A.电负性:W>Y
B.酸性:W2YX3>W2YX4
C.基态原子的未成对电子数:W>X
D.氧化物溶于水所得溶液的 pH:Z>Y
7.化合物 Z 是一种药物的重要中间体,部分合成路线如图:
下列说法正确的是( )
A.X 分子中所有碳原子共平面
B.1mol Y 最多能与 1mol H2 发生加成反应
C.Z 不能与 Br2 的 CCl4 溶液反应
D.Y、Z 均能使酸性 KMnO4 溶液褪色
8.某温度下,在密闭容器中充入一定量的 X(g),发生下列反应:X(g) Y(g)(ΔH1
<0),Y(g) Z(g)(ΔH2<0),测得各气体浓度与反应时间的关系如图所示。下列反
应进程示意图符合题意的是( )
第 2页(共 10页)
A. B.
C. D.
9.1,3﹣丁二烯与 HBr 发生加成反应分两步:第一步 H+进攻 1,3﹣丁二烯生成碳正离子(如
图);第二步 Br﹣进攻碳正离子完成 1,2﹣加成或 1,4﹣加成。反应进程中的能量变化如
图所示。已知在 0℃和 40℃时,1,2﹣加成产物与 1,4﹣加成产物的比例分别为 70:30
和 15:85。下列说法不正确的是( )
A.1,4﹣加成产物比 1,2﹣加成产物稳定
B.与 0℃相比,40℃时 1,3﹣丁二烯的转化率增大
C.Br﹣刚开始进攻碳正离子时,1,2﹣加成要比 1,4﹣加成反应速率快
D.从 0℃升至 40℃,1,4﹣加成正反应速率增大,1,2﹣加成正反应速率也增大
10.下列图示实验中,操作规范的是( )
第 3页(共 10页)
A.调控滴定速度 B.用 pH 试纸测定 C.加热试管中的 D.向试管中滴加
溶液 pH 液体 溶液
A.A B.B C.C D.D
11.以不同材料修饰的 Pt 为电极,一定浓度的 NaBr 溶液为电解液,采用电解和催化相结合
的循环方式,可实现高效制 H2 和 O2。装置如图所示。下列说法错误的是( )
A.电极 a 连接电源负极
B.加入 Y 的目的是补充 NaBr
C.电解总反应式为 Br﹣+3H2O 3H2 ↑
D.催化阶段反应产物物质的量之比 n(Z):n(Br﹣)=3:2
12.下列说法正确的是( )
A.p﹣pσ键电子云轮廓图
B.基态铜原子的价层电子排布图:
C.Fe3+的离子结构示意图为:
D.某原子核外电子排布式为 ns2np7,它违背了泡利原理
13.NH4ClO4 是火箭固体燃料重要的氧载体,与某些易燃物作用可全部生成气态产物,如:
NH4ClO4+2C═NH3↑+2CO2↑+HCl↑。下列有关化学用语或表述正确的是( )
A.HCl 的形成过程可表示为
B.NH4ClO4 中的阴、阳离子有相同的 VSEPR 模型和空间结构
第 4页(共 10页)
C.在 C60、石墨、金刚石中,碳原子有 sp,sp2 和 sp3 三种杂化方式
D.NH3 和 CO2 都能作制冷剂是因为它们有相同类型的分子间作用力
14.常温下,将 0.1mol L﹣1NaOH 溶液滴加到 20mL0.1mol L﹣1 二元弱酸 H2A 溶液中,混合
溶液的 pH 随 NaOH 溶液滴入量的关系如图所示。下列叙述不正确的是( )
A.Ka1(H2A)≈10﹣3
B.b 处溶质为 NaHA,所以促进水的电离
C.b 点时溶液中存在 c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(H2A)
D.c 点时溶液中存在 c(Na+)﹣c(HA﹣)﹣2c(A2﹣)=10﹣4.5﹣10﹣9.5
二、非选择题(共 4 小题,每空 2 分,共 58 分)
15.(14 分)完成下列问题
(1)在一个容积不变的密闭容器中发生反应:CO2(g)+H2(g)=CO(g)+H2O(g),
其平衡常数(K)和温度(t)的关系如表所示。
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
请填写下列空白:
①该反应的平衡常数表达式为 ,该反应为 反应(填“吸
热”或“放热”)。
②若 1200℃时,在某时刻反应混合物中 CO2、H2、CO、H2O 的浓度分别为 2mol L
﹣1、
2mol L﹣1、4mol L﹣1、4mol L
﹣1,则此时上述反应的平衡移动方向为 (填
“正反应方向”或“逆反应方向”或“不移动”)。
③将 2.0mol CO2 和 3.0mol H2 通入容积为 3L 的恒容密闭容器中,在一定条件下发生反应,
测得 H2 的平衡转化率与温度的关系如图所示。
第 5页(共 10页)
100℃时反应达到平衡所需的时间为 5min,则反应从起始至 5min 内,用 H2 表示该反应的
平均反应速率为 mol L﹣1 min ﹣1。100℃时,反应的平衡常数 K= 。
(2)火箭发射时常出现红棕色气体,原因为 N2O4(g) 2NO2(g),当温度升高时气体
颜色变深。现将 1mol N2O4 充入一个恒压的密闭容器中,下列示意图正确且能说明反应达
到平衡状态的是 。
若在相同温度下,上述反应改在容积为 1L 的恒容密闭容器中进行,平衡常数
将 (填“增大”或“不变”或“减小”)。
16.(14 分)2022 年 9 月,中国科学家首次在嫦娥五号带回的月壤中发现新矿物,并命名
为“嫦娥石”。“嫦娥石”属于陨磷钠镁钙石族,其中一种物质的化学式为 Ca9NaMg(PO4)7
。请回答下列问题:
(1)钠在火焰上灼烧的黄光是一种 (填字母)。
a.吸收光谱 b.发射光谱
( 2) P 原 子 最 高 能 级 电 子 的 电 子 云 轮 廓 形 状 为 , 其 价 电 子 排 布 式
为 ,电负性 P O(填“>”或“<”)。
(3)PCl3 分子空间结构为 ,PCl3 与 Cl2 反应生成 PCl5,PCl5 结构为
,PCl5 是 分子(填“极性”或“非极性”),其中P 原子的杂化类型是 (填
字母序号)。
a.sp b.sp2 c.sp3 d.sp3d
第 6页(共 10页)
17.(14 分)根据要求,回答下列问题:
(1)某温度下,纯水中的 c(H+)=2.0×10﹣7mol L﹣1,则该温度时的水的离子积 Kw=
。保持温度不变,滴入稀盐酸使溶液中的 c(H+)=5.0×10﹣6mol L﹣1,
则溶液中的 c(OH﹣)为 mol L﹣1。
( 2) 常 温 时 , K2CO3 的 水 溶 液 pH 大 于 7, 原 因 是 ( 用 离 子 方 程 式 表
示): 。
(3)将 AlCl3 溶液蒸干、灼烧,最后所得的固体的主要成分是 。
(4)物质的量浓度相同的三种盐 NaX、NaY、NaZ 的溶液,其 pH 依次为 8、9、10,则 HX、
HY、HZ 的酸性由强到弱的顺序是 。
(5)已知:
a.Ksp[Zn(OH)2]=10﹣17,Ksp[Cu(OH)2]=10﹣20,Ksp(ZnS)=10﹣25,Ksp(CuS)=10﹣30
b.pH>11 时,Zn2+会转化为[Zn(OH)4]2﹣
c.离子浓度≤10﹣5mol/L,即认为其完全沉淀
①若加入 Na2S 来沉淀 Zn2+和 Cu2+,当溶液中 ZnS 和 CuS 共存时, 。
② 若 加 入 NaOH 溶 液 来 调 节 pH,使 Zn2+和 Cu2+完 全 沉 淀 ,pH 应 满 足 的 条 件 为
。
18. (16 分)HDS 催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧——水
浸取法从 HDS 废催化剂(主要成分为 MoS、NiS、V2O5、Al2O3)中提取贵重金属钒和钼,
其工艺流程如图所示。
已知:Ⅰ.MoO3、V2O5、Al2O3 均可与纯碱反应生成对应的钠盐,而 NiO 不行。
Ⅱ.高温下,NH4VO3 易分解产生 N2 和一种含氮元素的气体。
Ⅲ.Ksp(CuS)=6×10﹣36;K1(H2S)=1×10﹣7、K2(H2S)=6×10﹣15。
请回答下列问题:
(1)请写出“气体”中属于最高价氧化物的电子式: 。
第 7页(共 10页)
(2)请写出“焙烧”过程中 Al2O3 与纯碱反应的化学方程式: 。
(3)“浸渣”的成分为 (填化学式);“滤液 2”中的成分除了 Na2MoO4 外,
还含有 (填化学式)。
(4)“沉钒”时提钒率随初始钒的浓度及氯化铵的加入量的关系如图所示,则选择的初始
钒的浓度和 NH4Cl 的加入量分别为 、 。
( 5)“ 沉 钒 ” 时 生 成 NH4VO3 沉 淀 , 请 写 出 “ 煅 烧 ” 中 发 生 反 应 的 化 学 方 程
式: 。
(6)在实际的工业生产中,“沉钼”前要加入 NH4HS 进行“除杂”,除掉溶液中微量的 Cu2
+,则反应 Cu2++HS﹣=CuS+H+的 K= 。
第 8页(共 10页)
参考答案
一、单选题(每题 3 分,共 42 分)
题号 1 2 3 4 5 6 7 8 9 10 11
答案 D B A C D D D B B A B
题号 12 13 14
答案 D B B
二、非选择题(共 4 小题,每空 2 分,共 58 分)
15.
(1)①K ;吸热; ②逆反应方向;③0.1;3;
(2)ac;不变。
16.(1)b
(2)哑铃形;3s23p3;<;
(4)三角锥形;非极性;d。
17.(1)4.0×10﹣14;8×10﹣9;
(2)CO32﹣+H2O HCO3﹣+OH﹣;
(3)Al2O3;
(4)HX>HY>HZ;
(5)105;②8~11。
18.(1) ;
(2)Al2O3+Na2CO3 2NaAlO2+CO2↑;
(3)NiO;NaVO3、NaHCO3;
(4)20g L﹣1;10g L﹣1;
(5)6NH4VO3 3V2O3+2N2↑+2NH3↑+9H2O;
(6)1021。
第 9页(共 10页)
第 10页(共 10页)
同课章节目录
