人教版高中化学选择性必修2第三章晶体结构与性质专题突破(四)关于晶胞结构的三个常考点学案
文档属性
| 名称 | 人教版高中化学选择性必修2第三章晶体结构与性质专题突破(四)关于晶胞结构的三个常考点学案 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 00:00:00 | ||
图片预览




文档简介
一、晶胞参数及相关计算
晶胞参数:晶胞的形状和大小可以用6个参数来表示,包括晶胞的3组棱长a、b、c和3组棱相互间的夹角α、β、γ,此即晶格特征参数,简称晶胞参数。
1.晶胞参数的计算方法
2.晶体密度的计算方法
若1个晶胞中含有n个微粒,则1 mol该晶胞中含有n mol微粒,其质量为nM g(M为微粒的相对分子质量);又1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρa3NA g,因此有nM=ρa3NA。
1.一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为(0,0,0)、,下列说法错误的是( )
A.该晶体的化学式为CuInTe2
B.C点原子的分数坐标为
C.晶胞中四面体空隙的占有率为50%
D.晶胞中C、D间距离d= pm
答案:D
解析:A.晶胞中位于顶点、面上和体内的Cu原子个数=8×+4×+1×1=4,位于面上、棱上的In原子个数=6×+4×=4,位于体内的Te原子个数=8×1=8,则Cu、In、Te的原子个数比为4∶4∶8=1∶1∶2,晶体的化学式为CuInTe2,A正确;B.由位于顶点A点和体心B点原子的分数坐标分别为(0,0,0)、可知,晶胞边长为1,则位于体对角线处、面对角线处的C原子的分数坐标为,B正确;C.由晶胞结构可知,In原子形成的四面体空隙有8个,形成的八面体空隙有8个,则四面体空隙的占有率为×100%=50%,C正确;D.由晶胞中C、D形成的直角三角形的边长为 pm、 pm可知,C、D间距离d== pm,D错误;答案选D。
2. 73号元素钽(Ta)与砷(As)形成的晶体在室温下拥有超高的空穴迁移率和较低的电子迁移率,其长方体晶胞结构如图所示。下列说法错误的是( )
A.基态As原子核外N层有4种空间运动状态不同的电子
B.该晶胞中As的配位数为4
C.该晶体的化学式为TaAs
D.TaAs的晶体密度ρ= g·cm-3
答案:B
解析:A.基态As原子的价层电子排布式为4s24p3,一个原子轨道即为一种空间运动状态,N层电子共4种空间运动状态,A项正确;B.该晶胞中As的配位数为6,B项错误;C.由晶胞结构可知,该晶体的化学式为TaAs,C项正确;D.m(晶胞)=ρa2b×10-21 g= g,则ρ=×1021 g·cm-3,D项正确;故选B。
3. M原子的价层电子排布式为3s23p5,与铜形成化合物的晶胞如图所示(黑点代表铜原子)。
(1)该晶体的化学式为________。
(2)已知该晶体的密度为d g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为________________cm(只写计算式)。
答案:(1)CuCl
(2)×
解析:(1)根据价层电子排布式判断出M原子为Cl原子,由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子处于顶点与面心上,晶胞中含有Cl原子数目为8×+6×=4,故化学式为CuCl。(2)一个晶胞的质量为 g,晶胞体积为 cm3,晶胞的边长为 cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的,而体对角线为晶胞边长的倍,所以铜原子和M原子之间的最短距离为× cm。
4. 某离子晶体晶胞的结构如图所示。X(·)位于立方体顶点,Y()位于立方体中心。试分析:
(1)晶体的化学式为________。
(2)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是________。
(3)设该晶体的摩尔质量为M g/mol,晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X之间的距离为________cm。
答案:(1)XY2(或Y2X) (2)109°28′
(3)×
解析:(1)晶胞中,X的个数=4×=,Y在体内,个数是1个,则X与Y的个数比是1∶2。
(2)若将4个X连接,构成1个正四面体,Y位于正四面体的中心,可联系CH4的键角,知∠XYX=109°28′。
(3)摩尔质量是指单位物质的量的物质的质量,数值上等于该物质的相对分子(或原子)质量。由题意知,该晶胞中含有个XY2或Y2X,设晶胞的边长为a cm,则有ρa3NA=M,a= ,则晶体中两个距离最近的X之间的距离为× cm。
二、晶胞中坐标系的构建及原子坐标的确定方法
1.构建坐标原点、坐标轴和单位长度立体模型
(1)最简单的晶胞——简单立方堆积的晶胞模型,坐标系的构建。
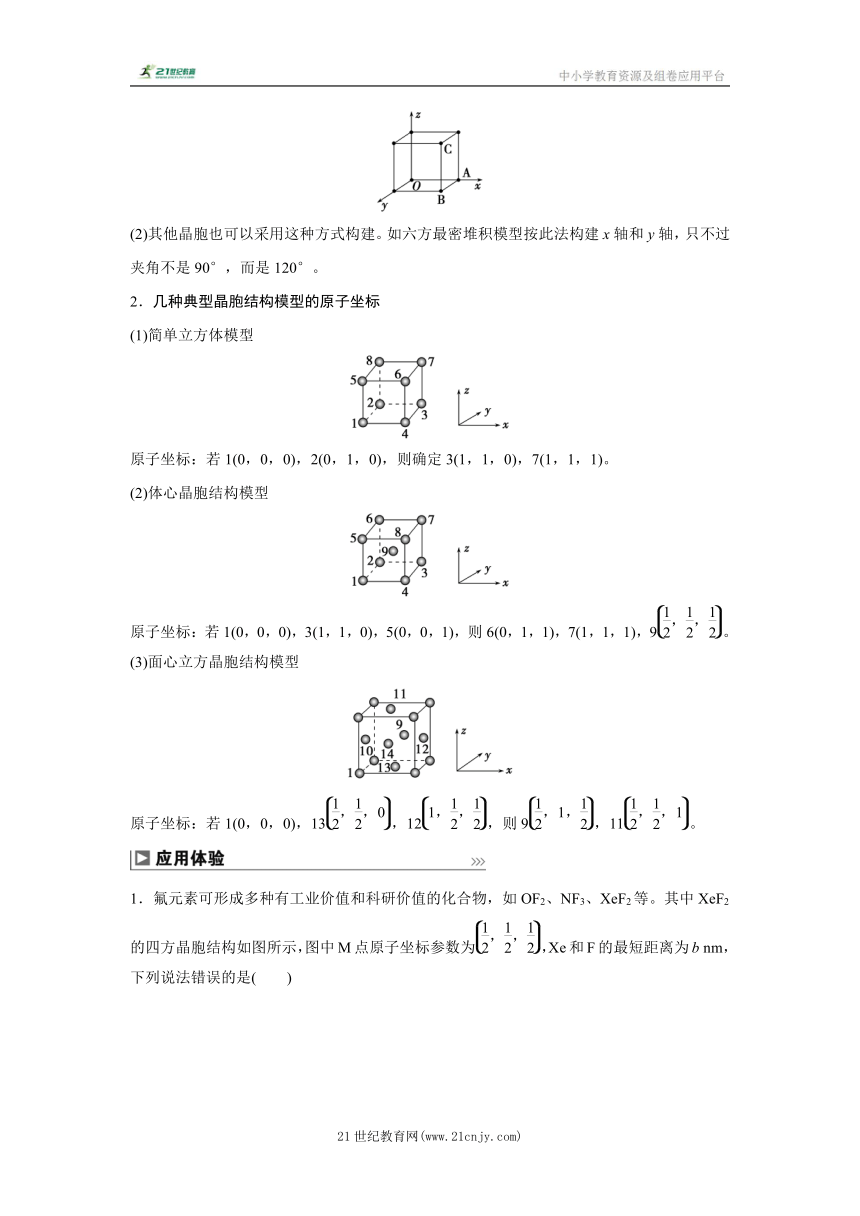
简单立方堆积的晶胞中8个顶点的微粒是完全一致的,因此可以任意选择一个原子为坐标原点,以立方体的三个棱延长线构建坐标轴,以晶胞边长为1个单位长度,由此可得如图所示的坐标系。
(2)其他晶胞也可以采用这种方式构建。如六方最密堆积模型按此法构建x轴和y轴,只不过夹角不是90°,而是120°。
2.几种典型晶胞结构模型的原子坐标
(1)简单立方体模型
原子坐标:若1(0,0,0),2(0,1,0),则确定3(1,1,0),7(1,1,1)。
(2)体心晶胞结构模型
原子坐标:若1(0,0,0),3(1,1,0),5(0,0,1),则6(0,1,1),7(1,1,1),9。
(3)面心立方晶胞结构模型
原子坐标:若1(0,0,0),13,12,则9,11。
1.氟元素可形成多种有工业价值和科研价值的化合物,如OF2、NF3、XeF2等。其中XeF2的四方晶胞结构如图所示,图中M点原子坐标参数为,Xe和F的最短距离为b nm,下列说法错误的是( )
A.OF2分子中键角小于NF3分子中的
B.XeF2中Xe的杂化方式为sp
C.基态N、F原子核外电子均有5种空间运动状态
D.Q点原子坐标参数为
答案:B
解析:A.OF2中O原子有2个孤电子对,NF3中N原子有1个孤电子对,孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力,故OF2分子中键角小于NF3分子中的,A正确;B.XeF2中Xe的价层电子对数为5,不可能为sp杂化,B错误;C.基态N、F原子核外电子均占据5个原子轨道,故均有5种空间运动状态,C正确;D.由信息,Q点原子坐标参数为,D正确;故答案为B。
2.氮化钛晶体的立方晶胞结构如图所示,该晶胞中N、N之间的最近距离为a pm,以晶胞边长为单位长度建立坐标系,原子A的坐标参数为(0,0,0),下列说法错误的是( )
A.原子B的坐标参数为
B.晶胞边长是 a pm
C.该物质的化学式为TiN
D.Ti的配位数为6
答案:A
解析:A.原子B在x、y、z轴上坐标分别为1、1、,则坐标参数为,A错误;B.晶胞中N、N之间的最近距离为面对角线的二分之一,为a pm,则N与Ti的最近距离是a pm,则晶胞边长为a pm,B正确;C.该晶胞中,Ti(黑球)的个数为1+12×=4,N(灰球)的个数为8×+6×=4,则Ti和N的个数比为1∶1,该物质的化学式为TiN,C正确;D.以体心钛为例,与Ti距离相等且最近的N有6个,则Ti的配位数为6,D正确;答案选A。
3.钛(Ti)被誉为“21世纪金属”,Ti的部分晶体结构如图Ⅰ所示,原子坐标可用图Ⅱ表示。设图Ⅱ原子坐标系中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),则B点原子的坐标为____________。
答案:
解析:由各原子坐标参数可知A处于x轴,C处于y轴,D处于z轴,B处于晶胞中三棱锥的中心位置,距离上、下底面距离相等,则B的参数z的值为;B在底面投影B′处于AC连线上且AB′长度为AC长度的,则B′到左侧面距离为C的,即为参数y=×1=;则B′到后平面距离为A的,即为参数x=×1=,故B的坐标参数为。
4. 以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为,则原子2和3的坐标分别为____________、____________。
答案:
解析:原子2位于底面面心,其坐标为;原子3位于棱上,其坐标为。
三、俯视图有关的晶体分析
从晶体正上方向下看可得晶胞的俯视图
如:(1)的俯视图为。
(2)的俯视图为。
例如:BaFe2As2的晶胞结构如图1所示。图2是该晶胞的俯视图,将图补充完整。
答案:
1.砷化镓与金刚石结构相似,其晶胞结构如下图甲所示,砷化镓的晶胞参数为x pm,密度为ρ g·cm-3。下列说法错误的是( )
A.晶胞中离As原子距离最近且相等的As原子有8个
B.Ga和As的最近距离是x pm
C.沿体对角线a→b方向投影图如题图乙,若c在11处,则As的位置为7、9、11、13
D.1 mol砷化镓中配位键的数目是NA
答案:A
解析:A.根据晶胞结构可知,晶胞中离As原子距离最近且相等的As原子有12个,A错误;B.由砷化镓晶胞结构可知,Ga和As的最近距离为晶胞体对角线的,Ga和As的最近距离是x pm,B正确;C.由砷化镓晶胞结构可知,c位于侧面的面心,沿体对角线a→b方向投影图如题图乙,则As的位置为7、9、11、13,C正确;D.由甲可知砷化镓的化学式为GaAs,砷化镓中砷提供孤电子对,镓提供空轨道形成配位键,平均1个GaAs配位键的数目为1,则1 mol砷化镓中配位键的数目是NA,D正确;故选A。
2.某钒、镓合金的晶胞结构及其晶胞沿x轴投影图如下,已知:晶胞参数为a pm,NA为阿伏加德罗常数的值,其中原子坐标参数甲,乙。下列说法错误的是( )
A.该合金的化学式为GaV3
B.丙原子的坐标参数
C.与V距离最近且相等的Ga有4个
D.该合金的密度为×1030 g·cm-3
答案:B
解析:A.Ga位于顶点和体心,V位于面上,结合晶胞均摊计算知该晶胞中含1+8×=2个Ga、12×=6个V,所以该合金的化学式为GaV3,A正确;B.由信息可知丙原子的坐标参数,B错误;C.晶胞中距离Ga最近且相等的V有12个,距离V最近且相等的Ga有4个,C正确;D.根据晶胞体积和晶胞质量可知该合金的密度为×1030 g·cm-3,D正确;故选B。
3.Fe的一种晶体的晶胞结构如甲、乙所示,若按甲中虚线方向切乙,得到的切面图正确的是________(填字母)。
答案:A
解析:图甲中Fe位于顶点和体心,乙由8个甲组成,按虚线方向切乙形成的截面边长不等,排除B、D,由于每个小立方体的体心有一个铁原子,故A正确。
4.立方氮化硼晶体的晶胞如图1所示,图2是该晶胞的俯视投影图,则该图中表示硼原子相对位置的是________(填序号)。
答案:3
解析:4个B在底面上的投影分别位于面对角线处,该图中表示硼原子相对位置的是3。
1.锑—钾合金可用作钾离子电池的电极材料,图a为其晶胞结构,图b为晶胞的一部分,下列有关说法正确的是( )
A.晶胞密度为 g·cm-3
B.Sb原子的配位数为6
C.最邻近的Sb原子构成的最小空间结构为正四面体
D.从电子排布推断,K的第一电离能比Sb大
答案:C
解析:A.根据“均摊法”,晶胞中含8×+6×=4个Sb、12×+9=12个K,则晶体密度为×1030 g·cm-3=×1030 g·cm-3,A错误;B.以底面Sb原子为例,距其等距且最近的K原子上下层各有4个,故配位数为8,B错误;C.由图b可知,最邻近的Sb原子构成的最小空间结构为正四面体,C正确;D.同一周期随着原子序数变大,第一电离能呈增大的趋势,K的第一电离能比Sb小,D错误;故选C。
2.钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为。下列说法错误的是( )
A.化合物中Co2+价层电子排布式为3d7
B.钴的周围有6个等距且最近的O2-
C.C点的原子坐标参数为
D.该物质的化学式为TiCoO2
答案:D
解析:化合物中Co2+价电子数为7,价层电子排布式为3d7,A正确;由晶胞结构图可知,钴周围有6个等距且最近的O2-,B正确;C点的原子处于体心,坐标参数为,C正确;此晶胞中氧原子数为6×=3,钛原子数为8×=1,钴原子数为1,该物质的化学式为TiCoO3,D错误。
3. 某氧化物超导材料钙钛矿晶胞结构如图所示,已知正方体的边长为a pm,该晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值可表示为________(用含a、ρ的式子表示)。
答案:
解析:某氧化物超导材料钙钛矿晶胞结构如题图所示,则晶胞中钛位于体心,数目为1,氧位于面心,数目为6×=3,钙位于顶点,数目为8×=1,已知正方体的边长为a pm=a×10-10 cm,该晶体的密度为ρ g·cm-3,则有==ρ,则阿伏加德罗常数的值可表示为。
课时测评16 关于晶胞结构的三个常考点
(本栏目内容,在学生用书中以独立形式分册装订!)
题点一 晶胞计算
1. (2023·浙江诸暨中学高二期中)某晶体的晶胞如图所示,这种晶体中A、B、C三种粒子数目之比是( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
答案:B
解析:由图示可知该晶体晶胞的上下两面为正三角形,因此处于顶点的粒子为12个晶胞共用,故晶胞中A粒子的数目为6×;处于上下棱上的粒子为4个晶胞共用,处于侧棱上的粒子为6个晶胞共用,故晶胞中B粒子的数目为3×+6×=2;C粒子完全属于晶胞。由此可见,A、B、C三种粒子的数目之比为∶2∶1=1∶4∶2。
2.下列各项是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中:—X,●—Y,—Z。其中对应的化学式不正确的是( )
答案:B
解析:A图中X、Y原(离)子的位置、数目完全等同,化学式XY正确;B图化学式应为XY,错误;C图中X的数目为4×+1=,Y的数目为4×=,化学式X3Y正确;D图中X的数目为8×=1,Y的数目为6×=3,Z位于内部,数目为1,化学式XY3Z正确。
3. (2023·广东中学高二阶段练习)纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面粒子数与总粒子数的比值为( )
A.7∶8 B.13∶14
C.1∶1 D.26∶27
答案:D
解析:表面粒子数=8+6+12=26,总粒子数=表面粒子数+中心粒子数=26+1=27,D项正确。
4.认真观察下列示意图,有关叙述不正确的是( )
A.图1表示由Li、Al、Si构成的某三元化合物固态晶体结构,该化合物化学式可表示为LiAlSi
B.图2表示某蓝色晶体[MxFey(CN)6]的阴离子的最小结构单元,该晶体的化学式为MFe2(CN)6,M呈+2价
C.图3表示金属镍与镧(La)形成的合金晶胞结构,该合金的化学式为LaNi5
D.图4表示某种铁化合物的晶胞(硫原子均在晶胞内),该物质化学式为CuFeS2
答案:B
解析:A项,该晶胞中Li的个数为12×+1=4,Al的个数为8×+6×=4,Si的个数为4,原子个数比为1∶1∶1,则该化合物化学式可表示为LiAlSi,A正确;B项,由图可推出晶体中阴离子的最小结构单元中含Fe2+个数为:4×=,同样可推出含Fe3+个数也为,CN-为12×=3,因此阴离子为[Fe2(CN)6]-,则该晶体的化学式只能为MFe2(CN)6,由阴、阳离子形成的晶体为离子晶体,M的化合价为+1价,B错误;C项,由图示可以看出,La原子均在晶体的8个顶点上,而Ni原子有1个在中心,另外的8个在面上,故La原子个数=8×=1,Ni原子个数=1+8×=5,故化学式为LaNi5,C正确;D项,晶胞中:Cu个数为8×+4×+1=4,Fe个数为6×+4×=4,S原子个数为8个,Fe、Cu、S个数比为4∶4∶8=1∶1∶2,D正确。
题点二 晶胞坐标计算
5.(2023·辽宁沈阳二中校考模拟预测)一种可用于配制无机防锈颜料的复合氧化物的晶胞结构如图,下列说法中不正确的是( )
A.该复合氧化物的化学式为CaCrO3
B.若图中A的原子坐标为,则B的原子坐标为
C.若该晶体密度为ρ g·cm-3,钙和氧的最近距离为a nm,则阿伏加德罗常数NA= mol-1
D.由晶胞结构可知,与1个钙原子等距离且最近的氧原子有8个
答案:D
解析:A.Ca位于顶点,个数为8×=1,Cr位于体内,个数为1,O位于面上,个数为6×=3,化学式为CaCrO3,A正确;B.根据晶胞图可知,B位于面心,因此B的坐标为(0,0.5,0.5),B正确;C.钙和氧最近的距离是面对角线的一半,面对角线长为2a nm,即晶胞边长为a nm,晶胞的体积为(a×10-7)3 cm3,根据A选项分析,晶胞的质量为× g,则晶胞密度为 g/cm3,阿伏加德罗常数NA= mol-1,C正确;D.以顶点Ca为标准,离Ca最近的氧原子在面心,共有12个,D错误;答案选D。
6.(2023·吉林长春高二校考期末)原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶晶胞,其中原子坐标参数A为(0,0,0),B为,C为。则D原子的坐标参数为( )
A. B.
C. D.
答案:A
解析:根据各个原子的相对位置可知,D在各个方向的处,则D原子的坐标参数为;答案选A。
7.砷化镓是继硅之后研究最深入、应用最广泛的半导体材料,其晶胞结构如下图1所示,图2为晶胞沿z轴的1∶1平面投影图,已知图中球的原子坐标参数为(0,0,0),球为(1,1,1),下列说法错误的是( )
A.该晶体的化学式为GaAs
B.晶胞参数为2a pm
C.晶胞中离Ga原子距离最近且相等的Ga原子有8个
D.晶胞中离球距离最远的黑球的坐标参数为
答案:C
解析:A.根据均摊法,晶胞中Ga原子的个数为8×+6×=4,As原子的个数为4,所以化学式为GaAs,A正确;B.图中白球与黑球的投影距离为a pm,即面对角线的为a pm,所以晶胞参数为2a pm,B正确;C.以顶面面心Ga原子为例,晶胞中离Ga原子距离最近且相等的Ga原子共有12个(同层4个,上层4个,下层4个),C错误;D.根据各个原子的相对位置可知,晶胞中离球距离最远的黑球即和球直接相连的黑球,其坐标参数为 ,D正确;综上所述答案为C。
题点三 晶胞投影
8. 钙钛矿类杂化材料甲胺铅碘[(CH3NH3)PbI3]是新型太阳能电池的敏化剂;其晶胞结构如图1所示。已知(CH3NH3)PbI3的摩尔质量为M g·mol-1,下列说法中错误的是( )
A.若B代表Pb2+,则C代表I-
B.距离A最近且等距离的C有3个
C.NA为阿伏加德罗常数的值,则该晶体的密度为 g·cm-3
D.若沿z轴向xy平面投影,则其投影图如图2所示
答案:B
解析:A.若B代表Pb2+,C位于面心,有6×=3个,则C代表I-,故A正确;B.距离A最近且等距离的C在面心,一个横截面有4个,三个横截面,因此共有12个,故B错误;C.根据图中信息该晶胞有1个(CH3NH3)PbI3,根据NA为阿伏加德罗常数的值,则该晶体的密度为ρ === g·cm-3,故C正确;D.若沿z轴向xy平面投影,晶胞的八个顶点在图2的四边形四个角,晶胞的上面、下面面心在图2的中心,晶胞的四个侧面面心在图2的四个边的中点,因此其投影图如图2所示,故D正确。综上所述,答案为B。
9.XeF2晶体属四方晶系,晶胞结构如图所示,晶胞棱边夹角均为90°。以晶胞棱边为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(0,0,0),B点原子的分数坐标为。已知Xe—F键键长为r pm,则C点原子的分数坐标为________。
答案:
解析:因A点原子的分数坐标为(0,0,0),B点原子的分数坐标为,则C点原子z方向的分数坐标为=-,故C点的分数坐标为。
10.KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。分别用、·表示H2PO和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO、K+在晶胞xz面、yz面上的位置:
(1)若晶胞底边的边长均为a pm、高为c pm,阿伏加德罗常数的值为NA,晶体的密度为________ g·cm-3(写出表达式)。
(2)晶胞在x轴方向的投影图为________(填字母)。
答案:(1) (2)B
解析:(1)由晶胞结构可知,H2PO位于晶胞的顶点、面上和体心,顶点上有8个、面上有4个,体心有1个,故晶胞中H2PO的数目为8×+4×+1=4;K+位于面上和棱上,面上有6个,棱上有4个,故晶胞中K+的数目为6×+4×=4,平均每个晶胞中占有的H2PO和K+的数目均为4,若晶胞底边的边长均为a pm、高为c pm,则晶胞的体积为10-30a2c cm3,阿伏加德罗常数的值为NA,晶体的密度为 g·cm-3。
(2)由图(a)、(b)、(c)可知,晶胞在x轴方向的投影图为B。
11.我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是________,晶胞参数为a pm、a pm、c pm,该晶体密度为________g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=____________________(用x表达)。
答案:8 2-x
解析:以晶胞中右侧面心的Zr4+为例,同一晶胞中与Zr4+连接最近且等距的O2-数为4,同理可知右侧晶胞中有4个O2-与Zr4+相连,因此Zr4+离子在晶胞中的配位数是4+4=8;1个晶胞中含有4个ZrO2微粒,1个晶胞的质量m= g,1个晶胞的体积为(a×10-10 cm)×(a×10-10 cm)×(c×10-10 cm)=a2c×10-30 cm3,因此该晶体密度===g·cm-3;在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,其中Zn元素为+2价,Zr为+4价,O元素为-2价,根据化合物中正负化合价之和为0可知2x+4×(1-x)=2y,解得y=2-x。
12.(1)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为________,该功能陶瓷的化学式为________。
(2)有一种钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为________(填字母)。
A.Ti14C13 B.TiC
C.Ti14C4 D.Ti4C3
答案:(1)2 BN (2)A
解析:(1)每个氮化硼晶胞中白球表示的原子个数为8×+1=2,灰球表示的原子个数为1+4×=2,所以每个晶胞中含有N原子和B原子各2个;N的电负性大于B,所以该陶瓷的化学式为BN。
(2)由题意知该物质是气态团簇分子,故题目中图示应是该物质的一个完整的分子,由14个Ti原子和13个C原子构成。选项A正确。
13.(1)一个Cu2O晶胞(见图1)中,Cu原子的数目为________。
(2)一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图2所示,该金属间化合物的化学式为____________________。
(3)室温下,[Cu(NH3)4](NO3)2与液氨混合并加入Cu可制得一种黑绿色晶体。黑绿色晶体的晶胞如图3所示,写出该晶体的化学式________________________________________________________________________。
(4)如图4是Mn和Bi形成的某种晶体的结构示意图(白球均在六棱柱内),则该晶体物质的化学式可表示为__________。
答案:(1)4 (2)Pt3Co (3)Cu3N (4)MnBi
解析:(1)白球位于顶点和内部,属于该晶胞的个数8×+1=2,黑球全部位于晶胞内部,属于该晶胞的个数为4,化学式为Cu2O,因此白球为O原子,黑球为Cu原子,即Cu原子的数目为4。
(2)由图可知,Pt位于面心,该晶胞中Pt的数目为3,Co位于顶点,该晶胞中Co的数目为1,所以化学式为Pt3Co。
(3)由晶胞图可知,该晶胞中含Cu原子个数为12×=3,含N原子个数为8×=1,则N、Cu原子个数之比为1∶3,故该晶体化学式为Cu3N。
(4)由晶体的结构示意图可知:白球代表Bi原子,且均在六棱柱内,所以Bi为6个。黑球代表Mn原子,个数为12×+2×+1+6×=6(个),二者的原子个数比为1∶1,则该晶体物质的化学式可表示为MnBi。
14.一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图。A中Fe、Sn位置互换即为B。
(1)该硫化物的化学式为________,晶胞中Sn的配位数与Cu的配位数之比为________。
(2)立方体A、B棱长均为a pm,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。晶胞中部分原子的分数坐标为S、Fe,则晶胞中Sn原子的分数坐标为________;晶胞中Sn原子和Cu原子间的最短距离为________pm。
答案:(1)Cu2FeSnS4 1∶1
(2)、 a
解析:(1)根据题意分析该晶胞是一个面心立方晶胞,S原子位于晶胞的顶点和面心,Cu、Fe、Sn分别位于体对角线上,因此用均摊法算出:S:4,Cu:2,Fe:1,Sn:1,因此该硫化物的化学式为Cu2FeSnS4;晶胞中Sn和Cu最近的是位于顶点的S都是一个,因此二者配位数之比为1∶1;(2)根据图示可以确定Sn原子的分数坐标,;晶胞中Sn原子和Cu原子间的最短距离为面对角线的一半。
21世纪教育网(www.21cnjy.com)
晶胞参数:晶胞的形状和大小可以用6个参数来表示,包括晶胞的3组棱长a、b、c和3组棱相互间的夹角α、β、γ,此即晶格特征参数,简称晶胞参数。
1.晶胞参数的计算方法
2.晶体密度的计算方法
若1个晶胞中含有n个微粒,则1 mol该晶胞中含有n mol微粒,其质量为nM g(M为微粒的相对分子质量);又1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρa3NA g,因此有nM=ρa3NA。
1.一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为(0,0,0)、,下列说法错误的是( )
A.该晶体的化学式为CuInTe2
B.C点原子的分数坐标为
C.晶胞中四面体空隙的占有率为50%
D.晶胞中C、D间距离d= pm
答案:D
解析:A.晶胞中位于顶点、面上和体内的Cu原子个数=8×+4×+1×1=4,位于面上、棱上的In原子个数=6×+4×=4,位于体内的Te原子个数=8×1=8,则Cu、In、Te的原子个数比为4∶4∶8=1∶1∶2,晶体的化学式为CuInTe2,A正确;B.由位于顶点A点和体心B点原子的分数坐标分别为(0,0,0)、可知,晶胞边长为1,则位于体对角线处、面对角线处的C原子的分数坐标为,B正确;C.由晶胞结构可知,In原子形成的四面体空隙有8个,形成的八面体空隙有8个,则四面体空隙的占有率为×100%=50%,C正确;D.由晶胞中C、D形成的直角三角形的边长为 pm、 pm可知,C、D间距离d== pm,D错误;答案选D。
2. 73号元素钽(Ta)与砷(As)形成的晶体在室温下拥有超高的空穴迁移率和较低的电子迁移率,其长方体晶胞结构如图所示。下列说法错误的是( )
A.基态As原子核外N层有4种空间运动状态不同的电子
B.该晶胞中As的配位数为4
C.该晶体的化学式为TaAs
D.TaAs的晶体密度ρ= g·cm-3
答案:B
解析:A.基态As原子的价层电子排布式为4s24p3,一个原子轨道即为一种空间运动状态,N层电子共4种空间运动状态,A项正确;B.该晶胞中As的配位数为6,B项错误;C.由晶胞结构可知,该晶体的化学式为TaAs,C项正确;D.m(晶胞)=ρa2b×10-21 g= g,则ρ=×1021 g·cm-3,D项正确;故选B。
3. M原子的价层电子排布式为3s23p5,与铜形成化合物的晶胞如图所示(黑点代表铜原子)。
(1)该晶体的化学式为________。
(2)已知该晶体的密度为d g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为________________cm(只写计算式)。
答案:(1)CuCl
(2)×
解析:(1)根据价层电子排布式判断出M原子为Cl原子,由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子处于顶点与面心上,晶胞中含有Cl原子数目为8×+6×=4,故化学式为CuCl。(2)一个晶胞的质量为 g,晶胞体积为 cm3,晶胞的边长为 cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的,而体对角线为晶胞边长的倍,所以铜原子和M原子之间的最短距离为× cm。
4. 某离子晶体晶胞的结构如图所示。X(·)位于立方体顶点,Y()位于立方体中心。试分析:
(1)晶体的化学式为________。
(2)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是________。
(3)设该晶体的摩尔质量为M g/mol,晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X之间的距离为________cm。
答案:(1)XY2(或Y2X) (2)109°28′
(3)×
解析:(1)晶胞中,X的个数=4×=,Y在体内,个数是1个,则X与Y的个数比是1∶2。
(2)若将4个X连接,构成1个正四面体,Y位于正四面体的中心,可联系CH4的键角,知∠XYX=109°28′。
(3)摩尔质量是指单位物质的量的物质的质量,数值上等于该物质的相对分子(或原子)质量。由题意知,该晶胞中含有个XY2或Y2X,设晶胞的边长为a cm,则有ρa3NA=M,a= ,则晶体中两个距离最近的X之间的距离为× cm。
二、晶胞中坐标系的构建及原子坐标的确定方法
1.构建坐标原点、坐标轴和单位长度立体模型
(1)最简单的晶胞——简单立方堆积的晶胞模型,坐标系的构建。
简单立方堆积的晶胞中8个顶点的微粒是完全一致的,因此可以任意选择一个原子为坐标原点,以立方体的三个棱延长线构建坐标轴,以晶胞边长为1个单位长度,由此可得如图所示的坐标系。
(2)其他晶胞也可以采用这种方式构建。如六方最密堆积模型按此法构建x轴和y轴,只不过夹角不是90°,而是120°。
2.几种典型晶胞结构模型的原子坐标
(1)简单立方体模型
原子坐标:若1(0,0,0),2(0,1,0),则确定3(1,1,0),7(1,1,1)。
(2)体心晶胞结构模型
原子坐标:若1(0,0,0),3(1,1,0),5(0,0,1),则6(0,1,1),7(1,1,1),9。
(3)面心立方晶胞结构模型
原子坐标:若1(0,0,0),13,12,则9,11。
1.氟元素可形成多种有工业价值和科研价值的化合物,如OF2、NF3、XeF2等。其中XeF2的四方晶胞结构如图所示,图中M点原子坐标参数为,Xe和F的最短距离为b nm,下列说法错误的是( )
A.OF2分子中键角小于NF3分子中的
B.XeF2中Xe的杂化方式为sp
C.基态N、F原子核外电子均有5种空间运动状态
D.Q点原子坐标参数为
答案:B
解析:A.OF2中O原子有2个孤电子对,NF3中N原子有1个孤电子对,孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力,故OF2分子中键角小于NF3分子中的,A正确;B.XeF2中Xe的价层电子对数为5,不可能为sp杂化,B错误;C.基态N、F原子核外电子均占据5个原子轨道,故均有5种空间运动状态,C正确;D.由信息,Q点原子坐标参数为,D正确;故答案为B。
2.氮化钛晶体的立方晶胞结构如图所示,该晶胞中N、N之间的最近距离为a pm,以晶胞边长为单位长度建立坐标系,原子A的坐标参数为(0,0,0),下列说法错误的是( )
A.原子B的坐标参数为
B.晶胞边长是 a pm
C.该物质的化学式为TiN
D.Ti的配位数为6
答案:A
解析:A.原子B在x、y、z轴上坐标分别为1、1、,则坐标参数为,A错误;B.晶胞中N、N之间的最近距离为面对角线的二分之一,为a pm,则N与Ti的最近距离是a pm,则晶胞边长为a pm,B正确;C.该晶胞中,Ti(黑球)的个数为1+12×=4,N(灰球)的个数为8×+6×=4,则Ti和N的个数比为1∶1,该物质的化学式为TiN,C正确;D.以体心钛为例,与Ti距离相等且最近的N有6个,则Ti的配位数为6,D正确;答案选A。
3.钛(Ti)被誉为“21世纪金属”,Ti的部分晶体结构如图Ⅰ所示,原子坐标可用图Ⅱ表示。设图Ⅱ原子坐标系中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),则B点原子的坐标为____________。
答案:
解析:由各原子坐标参数可知A处于x轴,C处于y轴,D处于z轴,B处于晶胞中三棱锥的中心位置,距离上、下底面距离相等,则B的参数z的值为;B在底面投影B′处于AC连线上且AB′长度为AC长度的,则B′到左侧面距离为C的,即为参数y=×1=;则B′到后平面距离为A的,即为参数x=×1=,故B的坐标参数为。
4. 以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为,则原子2和3的坐标分别为____________、____________。
答案:
解析:原子2位于底面面心,其坐标为;原子3位于棱上,其坐标为。
三、俯视图有关的晶体分析
从晶体正上方向下看可得晶胞的俯视图
如:(1)的俯视图为。
(2)的俯视图为。
例如:BaFe2As2的晶胞结构如图1所示。图2是该晶胞的俯视图,将图补充完整。
答案:
1.砷化镓与金刚石结构相似,其晶胞结构如下图甲所示,砷化镓的晶胞参数为x pm,密度为ρ g·cm-3。下列说法错误的是( )
A.晶胞中离As原子距离最近且相等的As原子有8个
B.Ga和As的最近距离是x pm
C.沿体对角线a→b方向投影图如题图乙,若c在11处,则As的位置为7、9、11、13
D.1 mol砷化镓中配位键的数目是NA
答案:A
解析:A.根据晶胞结构可知,晶胞中离As原子距离最近且相等的As原子有12个,A错误;B.由砷化镓晶胞结构可知,Ga和As的最近距离为晶胞体对角线的,Ga和As的最近距离是x pm,B正确;C.由砷化镓晶胞结构可知,c位于侧面的面心,沿体对角线a→b方向投影图如题图乙,则As的位置为7、9、11、13,C正确;D.由甲可知砷化镓的化学式为GaAs,砷化镓中砷提供孤电子对,镓提供空轨道形成配位键,平均1个GaAs配位键的数目为1,则1 mol砷化镓中配位键的数目是NA,D正确;故选A。
2.某钒、镓合金的晶胞结构及其晶胞沿x轴投影图如下,已知:晶胞参数为a pm,NA为阿伏加德罗常数的值,其中原子坐标参数甲,乙。下列说法错误的是( )
A.该合金的化学式为GaV3
B.丙原子的坐标参数
C.与V距离最近且相等的Ga有4个
D.该合金的密度为×1030 g·cm-3
答案:B
解析:A.Ga位于顶点和体心,V位于面上,结合晶胞均摊计算知该晶胞中含1+8×=2个Ga、12×=6个V,所以该合金的化学式为GaV3,A正确;B.由信息可知丙原子的坐标参数,B错误;C.晶胞中距离Ga最近且相等的V有12个,距离V最近且相等的Ga有4个,C正确;D.根据晶胞体积和晶胞质量可知该合金的密度为×1030 g·cm-3,D正确;故选B。
3.Fe的一种晶体的晶胞结构如甲、乙所示,若按甲中虚线方向切乙,得到的切面图正确的是________(填字母)。
答案:A
解析:图甲中Fe位于顶点和体心,乙由8个甲组成,按虚线方向切乙形成的截面边长不等,排除B、D,由于每个小立方体的体心有一个铁原子,故A正确。
4.立方氮化硼晶体的晶胞如图1所示,图2是该晶胞的俯视投影图,则该图中表示硼原子相对位置的是________(填序号)。
答案:3
解析:4个B在底面上的投影分别位于面对角线处,该图中表示硼原子相对位置的是3。
1.锑—钾合金可用作钾离子电池的电极材料,图a为其晶胞结构,图b为晶胞的一部分,下列有关说法正确的是( )
A.晶胞密度为 g·cm-3
B.Sb原子的配位数为6
C.最邻近的Sb原子构成的最小空间结构为正四面体
D.从电子排布推断,K的第一电离能比Sb大
答案:C
解析:A.根据“均摊法”,晶胞中含8×+6×=4个Sb、12×+9=12个K,则晶体密度为×1030 g·cm-3=×1030 g·cm-3,A错误;B.以底面Sb原子为例,距其等距且最近的K原子上下层各有4个,故配位数为8,B错误;C.由图b可知,最邻近的Sb原子构成的最小空间结构为正四面体,C正确;D.同一周期随着原子序数变大,第一电离能呈增大的趋势,K的第一电离能比Sb小,D错误;故选C。
2.钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为。下列说法错误的是( )
A.化合物中Co2+价层电子排布式为3d7
B.钴的周围有6个等距且最近的O2-
C.C点的原子坐标参数为
D.该物质的化学式为TiCoO2
答案:D
解析:化合物中Co2+价电子数为7,价层电子排布式为3d7,A正确;由晶胞结构图可知,钴周围有6个等距且最近的O2-,B正确;C点的原子处于体心,坐标参数为,C正确;此晶胞中氧原子数为6×=3,钛原子数为8×=1,钴原子数为1,该物质的化学式为TiCoO3,D错误。
3. 某氧化物超导材料钙钛矿晶胞结构如图所示,已知正方体的边长为a pm,该晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值可表示为________(用含a、ρ的式子表示)。
答案:
解析:某氧化物超导材料钙钛矿晶胞结构如题图所示,则晶胞中钛位于体心,数目为1,氧位于面心,数目为6×=3,钙位于顶点,数目为8×=1,已知正方体的边长为a pm=a×10-10 cm,该晶体的密度为ρ g·cm-3,则有==ρ,则阿伏加德罗常数的值可表示为。
课时测评16 关于晶胞结构的三个常考点
(本栏目内容,在学生用书中以独立形式分册装订!)
题点一 晶胞计算
1. (2023·浙江诸暨中学高二期中)某晶体的晶胞如图所示,这种晶体中A、B、C三种粒子数目之比是( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
答案:B
解析:由图示可知该晶体晶胞的上下两面为正三角形,因此处于顶点的粒子为12个晶胞共用,故晶胞中A粒子的数目为6×;处于上下棱上的粒子为4个晶胞共用,处于侧棱上的粒子为6个晶胞共用,故晶胞中B粒子的数目为3×+6×=2;C粒子完全属于晶胞。由此可见,A、B、C三种粒子的数目之比为∶2∶1=1∶4∶2。
2.下列各项是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中:—X,●—Y,—Z。其中对应的化学式不正确的是( )
答案:B
解析:A图中X、Y原(离)子的位置、数目完全等同,化学式XY正确;B图化学式应为XY,错误;C图中X的数目为4×+1=,Y的数目为4×=,化学式X3Y正确;D图中X的数目为8×=1,Y的数目为6×=3,Z位于内部,数目为1,化学式XY3Z正确。
3. (2023·广东中学高二阶段练习)纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面粒子数与总粒子数的比值为( )
A.7∶8 B.13∶14
C.1∶1 D.26∶27
答案:D
解析:表面粒子数=8+6+12=26,总粒子数=表面粒子数+中心粒子数=26+1=27,D项正确。
4.认真观察下列示意图,有关叙述不正确的是( )
A.图1表示由Li、Al、Si构成的某三元化合物固态晶体结构,该化合物化学式可表示为LiAlSi
B.图2表示某蓝色晶体[MxFey(CN)6]的阴离子的最小结构单元,该晶体的化学式为MFe2(CN)6,M呈+2价
C.图3表示金属镍与镧(La)形成的合金晶胞结构,该合金的化学式为LaNi5
D.图4表示某种铁化合物的晶胞(硫原子均在晶胞内),该物质化学式为CuFeS2
答案:B
解析:A项,该晶胞中Li的个数为12×+1=4,Al的个数为8×+6×=4,Si的个数为4,原子个数比为1∶1∶1,则该化合物化学式可表示为LiAlSi,A正确;B项,由图可推出晶体中阴离子的最小结构单元中含Fe2+个数为:4×=,同样可推出含Fe3+个数也为,CN-为12×=3,因此阴离子为[Fe2(CN)6]-,则该晶体的化学式只能为MFe2(CN)6,由阴、阳离子形成的晶体为离子晶体,M的化合价为+1价,B错误;C项,由图示可以看出,La原子均在晶体的8个顶点上,而Ni原子有1个在中心,另外的8个在面上,故La原子个数=8×=1,Ni原子个数=1+8×=5,故化学式为LaNi5,C正确;D项,晶胞中:Cu个数为8×+4×+1=4,Fe个数为6×+4×=4,S原子个数为8个,Fe、Cu、S个数比为4∶4∶8=1∶1∶2,D正确。
题点二 晶胞坐标计算
5.(2023·辽宁沈阳二中校考模拟预测)一种可用于配制无机防锈颜料的复合氧化物的晶胞结构如图,下列说法中不正确的是( )
A.该复合氧化物的化学式为CaCrO3
B.若图中A的原子坐标为,则B的原子坐标为
C.若该晶体密度为ρ g·cm-3,钙和氧的最近距离为a nm,则阿伏加德罗常数NA= mol-1
D.由晶胞结构可知,与1个钙原子等距离且最近的氧原子有8个
答案:D
解析:A.Ca位于顶点,个数为8×=1,Cr位于体内,个数为1,O位于面上,个数为6×=3,化学式为CaCrO3,A正确;B.根据晶胞图可知,B位于面心,因此B的坐标为(0,0.5,0.5),B正确;C.钙和氧最近的距离是面对角线的一半,面对角线长为2a nm,即晶胞边长为a nm,晶胞的体积为(a×10-7)3 cm3,根据A选项分析,晶胞的质量为× g,则晶胞密度为 g/cm3,阿伏加德罗常数NA= mol-1,C正确;D.以顶点Ca为标准,离Ca最近的氧原子在面心,共有12个,D错误;答案选D。
6.(2023·吉林长春高二校考期末)原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶晶胞,其中原子坐标参数A为(0,0,0),B为,C为。则D原子的坐标参数为( )
A. B.
C. D.
答案:A
解析:根据各个原子的相对位置可知,D在各个方向的处,则D原子的坐标参数为;答案选A。
7.砷化镓是继硅之后研究最深入、应用最广泛的半导体材料,其晶胞结构如下图1所示,图2为晶胞沿z轴的1∶1平面投影图,已知图中球的原子坐标参数为(0,0,0),球为(1,1,1),下列说法错误的是( )
A.该晶体的化学式为GaAs
B.晶胞参数为2a pm
C.晶胞中离Ga原子距离最近且相等的Ga原子有8个
D.晶胞中离球距离最远的黑球的坐标参数为
答案:C
解析:A.根据均摊法,晶胞中Ga原子的个数为8×+6×=4,As原子的个数为4,所以化学式为GaAs,A正确;B.图中白球与黑球的投影距离为a pm,即面对角线的为a pm,所以晶胞参数为2a pm,B正确;C.以顶面面心Ga原子为例,晶胞中离Ga原子距离最近且相等的Ga原子共有12个(同层4个,上层4个,下层4个),C错误;D.根据各个原子的相对位置可知,晶胞中离球距离最远的黑球即和球直接相连的黑球,其坐标参数为 ,D正确;综上所述答案为C。
题点三 晶胞投影
8. 钙钛矿类杂化材料甲胺铅碘[(CH3NH3)PbI3]是新型太阳能电池的敏化剂;其晶胞结构如图1所示。已知(CH3NH3)PbI3的摩尔质量为M g·mol-1,下列说法中错误的是( )
A.若B代表Pb2+,则C代表I-
B.距离A最近且等距离的C有3个
C.NA为阿伏加德罗常数的值,则该晶体的密度为 g·cm-3
D.若沿z轴向xy平面投影,则其投影图如图2所示
答案:B
解析:A.若B代表Pb2+,C位于面心,有6×=3个,则C代表I-,故A正确;B.距离A最近且等距离的C在面心,一个横截面有4个,三个横截面,因此共有12个,故B错误;C.根据图中信息该晶胞有1个(CH3NH3)PbI3,根据NA为阿伏加德罗常数的值,则该晶体的密度为ρ === g·cm-3,故C正确;D.若沿z轴向xy平面投影,晶胞的八个顶点在图2的四边形四个角,晶胞的上面、下面面心在图2的中心,晶胞的四个侧面面心在图2的四个边的中点,因此其投影图如图2所示,故D正确。综上所述,答案为B。
9.XeF2晶体属四方晶系,晶胞结构如图所示,晶胞棱边夹角均为90°。以晶胞棱边为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(0,0,0),B点原子的分数坐标为。已知Xe—F键键长为r pm,则C点原子的分数坐标为________。
答案:
解析:因A点原子的分数坐标为(0,0,0),B点原子的分数坐标为,则C点原子z方向的分数坐标为=-,故C点的分数坐标为。
10.KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。分别用、·表示H2PO和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO、K+在晶胞xz面、yz面上的位置:
(1)若晶胞底边的边长均为a pm、高为c pm,阿伏加德罗常数的值为NA,晶体的密度为________ g·cm-3(写出表达式)。
(2)晶胞在x轴方向的投影图为________(填字母)。
答案:(1) (2)B
解析:(1)由晶胞结构可知,H2PO位于晶胞的顶点、面上和体心,顶点上有8个、面上有4个,体心有1个,故晶胞中H2PO的数目为8×+4×+1=4;K+位于面上和棱上,面上有6个,棱上有4个,故晶胞中K+的数目为6×+4×=4,平均每个晶胞中占有的H2PO和K+的数目均为4,若晶胞底边的边长均为a pm、高为c pm,则晶胞的体积为10-30a2c cm3,阿伏加德罗常数的值为NA,晶体的密度为 g·cm-3。
(2)由图(a)、(b)、(c)可知,晶胞在x轴方向的投影图为B。
11.我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是________,晶胞参数为a pm、a pm、c pm,该晶体密度为________g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=____________________(用x表达)。
答案:8 2-x
解析:以晶胞中右侧面心的Zr4+为例,同一晶胞中与Zr4+连接最近且等距的O2-数为4,同理可知右侧晶胞中有4个O2-与Zr4+相连,因此Zr4+离子在晶胞中的配位数是4+4=8;1个晶胞中含有4个ZrO2微粒,1个晶胞的质量m= g,1个晶胞的体积为(a×10-10 cm)×(a×10-10 cm)×(c×10-10 cm)=a2c×10-30 cm3,因此该晶体密度===g·cm-3;在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,其中Zn元素为+2价,Zr为+4价,O元素为-2价,根据化合物中正负化合价之和为0可知2x+4×(1-x)=2y,解得y=2-x。
12.(1)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为________,该功能陶瓷的化学式为________。
(2)有一种钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为________(填字母)。
A.Ti14C13 B.TiC
C.Ti14C4 D.Ti4C3
答案:(1)2 BN (2)A
解析:(1)每个氮化硼晶胞中白球表示的原子个数为8×+1=2,灰球表示的原子个数为1+4×=2,所以每个晶胞中含有N原子和B原子各2个;N的电负性大于B,所以该陶瓷的化学式为BN。
(2)由题意知该物质是气态团簇分子,故题目中图示应是该物质的一个完整的分子,由14个Ti原子和13个C原子构成。选项A正确。
13.(1)一个Cu2O晶胞(见图1)中,Cu原子的数目为________。
(2)一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图2所示,该金属间化合物的化学式为____________________。
(3)室温下,[Cu(NH3)4](NO3)2与液氨混合并加入Cu可制得一种黑绿色晶体。黑绿色晶体的晶胞如图3所示,写出该晶体的化学式________________________________________________________________________。
(4)如图4是Mn和Bi形成的某种晶体的结构示意图(白球均在六棱柱内),则该晶体物质的化学式可表示为__________。
答案:(1)4 (2)Pt3Co (3)Cu3N (4)MnBi
解析:(1)白球位于顶点和内部,属于该晶胞的个数8×+1=2,黑球全部位于晶胞内部,属于该晶胞的个数为4,化学式为Cu2O,因此白球为O原子,黑球为Cu原子,即Cu原子的数目为4。
(2)由图可知,Pt位于面心,该晶胞中Pt的数目为3,Co位于顶点,该晶胞中Co的数目为1,所以化学式为Pt3Co。
(3)由晶胞图可知,该晶胞中含Cu原子个数为12×=3,含N原子个数为8×=1,则N、Cu原子个数之比为1∶3,故该晶体化学式为Cu3N。
(4)由晶体的结构示意图可知:白球代表Bi原子,且均在六棱柱内,所以Bi为6个。黑球代表Mn原子,个数为12×+2×+1+6×=6(个),二者的原子个数比为1∶1,则该晶体物质的化学式可表示为MnBi。
14.一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图。A中Fe、Sn位置互换即为B。
(1)该硫化物的化学式为________,晶胞中Sn的配位数与Cu的配位数之比为________。
(2)立方体A、B棱长均为a pm,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。晶胞中部分原子的分数坐标为S、Fe,则晶胞中Sn原子的分数坐标为________;晶胞中Sn原子和Cu原子间的最短距离为________pm。
答案:(1)Cu2FeSnS4 1∶1
(2)、 a
解析:(1)根据题意分析该晶胞是一个面心立方晶胞,S原子位于晶胞的顶点和面心,Cu、Fe、Sn分别位于体对角线上,因此用均摊法算出:S:4,Cu:2,Fe:1,Sn:1,因此该硫化物的化学式为Cu2FeSnS4;晶胞中Sn和Cu最近的是位于顶点的S都是一个,因此二者配位数之比为1∶1;(2)根据图示可以确定Sn原子的分数坐标,;晶胞中Sn原子和Cu原子间的最短距离为面对角线的一半。
21世纪教育网(www.21cnjy.com)
