第一节 原子的构成(33张PPT)
文档属性
| 名称 | 第一节 原子的构成(33张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-05-13 16:01:35 | ||
图片预览











文档简介
课件33张PPT。第三节 原子的构成1、写出电解水的表达式:
2、用分子原子的观点描述水电解的过程:复习旧知识:复习旧知识:水是由水 构成的,通电后水分子被分裂为氧 和氢 ,每两个氧 结合成一个氧 ,每两个氢 结合成一个氢 。大量的氧 聚集成为氧气,大量的氢 聚集为氢气。 分子分子分子分子分子原子原子原子原子 在电解水的过程中,发生变化的粒子
是 ,保持不变的粒子是 ,
生成的新粒子是 ,该实验
证明在化学反应中 可分,而 不
可分.即原子是化学变化中的 .复习旧知识:水分子氢原子氧原子分子原子最小粒子氢分子氧分子原子能不能再分呢?原子是由什么构成的呢?1、原子结构发展史(1)我国古代的哲学家墨子以及古希腊哲学家德谟克利特等人认为 :万物是由大量的 不可分割的微粒 构成的,即由原子构成的。 原子的结构(2) 19世纪初,近代化学之父——英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。道尔顿原子模型(3)1897年,英国科学家汤姆森发现了电子。证明原子是可以再分的。他提出原子是一个平均分布着正电荷的粒子,其中镶嵌着许多带负电荷的电子。汤姆森原子模型
“葡萄干布丁”模型英国物理学家汤姆森英国科学家卢瑟福
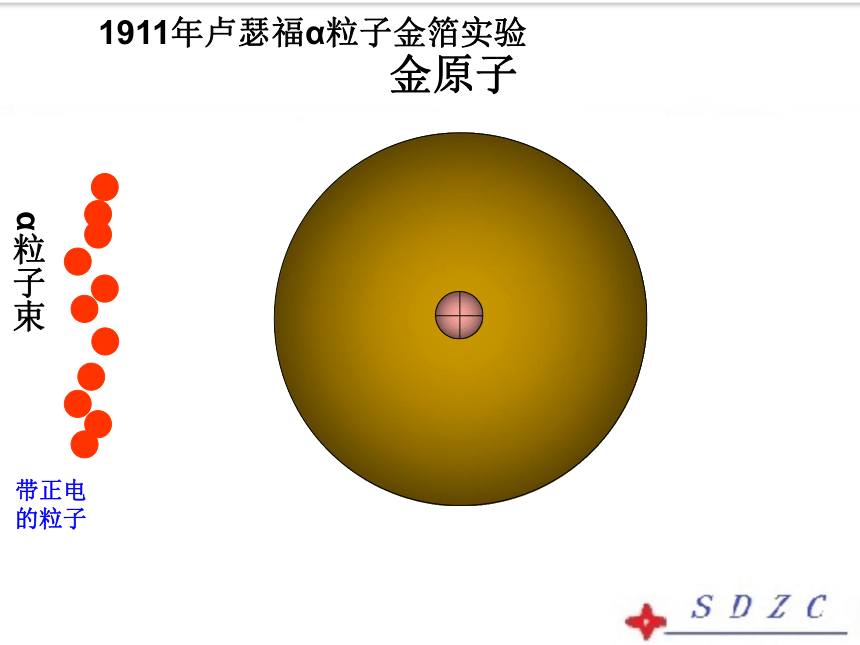
(1871~1937)(4)α粒子散射实验(1911年)卢瑟福和他的助手做了著名α粒子散射实验金原子α粒子束带正电的粒子1911年卢瑟福α粒子金箔实验原子α粒子束α 粒子束现象:1绝大多数α粒子能穿过金箔不改变原来方向,2一小部分改变了方向,3极少数粒子被反弹了回来.带两个正电荷的氦原子为什么绝大多数的α粒子能够顺利穿过金箔,只有一小部分发生偏转,还有极少数被反弹回来?
交流共享 绝大部分α粒子没有或遇到极小的阻力,从原子之间的间隙或者原子内部的空隙中穿过;而极少数α粒子被反弹回来是因为它们和金原子中某种极为坚硬密实的核发生了碰撞。这就是原子核。如果当时你在场,发现了这一现象后,
你会怎样想呢?卢瑟福提出了一个更完整的原子行星模型:
原子是由原子核和核外电子构成的,电子在核外“很大”的空间里运动。卢瑟福的原子结构模型英国科学家卢瑟福
(1871~1937)原子原子核原子核有多小?原子原子核核外电子质子中子(每个电子带一个单位的负电荷)注:质子和中子的质量差不多,都比电子的质量大得多,约为电子质量的1836倍,原子的质量主要集中在原子核上。(带正电)(不显电性)2、原子的结构原子核所带的正电荷数目叫做核电荷数,在数值上等于质子的个数。核电荷数 = 质子数(每个质子带一个单位正电荷)(不带电)(带负电)= 核外电子数注意从以下几方面理解原子结构:
(1)位置:原子核位于原子的中心,电子在核外运动。
(2)体积:原子的体积很小,而原子核的半径约为原子半径的几万分之一,因此相对来说,原子里有很大空间,电子就在这个空间内作高速运动。(3)数目:一个原子只有一个原子核,但电子的数目≥1,中子的数目≥0,可见原子核、质子、电子是一个原子中必有的粒子,中子不一定有,如氢原子核内只有一个质子,没有中子。多识一点(4)电性:原子核带正电,电子带负电,质子带正电,中子不带电,整个原子不显电性。(5)电量:原子核所带正电荷数叫核电荷数,每个质子带一个单位的正电荷。每个电子带一个单位负电荷。由于原子核所带电量与核外电子所带电量相等,电性相反,所以整个原子不显电性。(6)质量:在原子中,质子和中子的质量大约相等,而电子仅相当于质子(或中子)质量的1/1836,因此原子的质量主要集中在原子核上。
从原子结构可以看出,原子不是最小的粒子,还可再分。下表列出几种原子的基本构成,请你分析表中信息,看看能得出那些结论?活动天地 1、在原子里,核电荷数= = 。
2、质子数 中子数
3、原子中 含有中子
4、不同的原子其 不同。
5、不同的原子其核内所含的 不同。
6、同一类原子 相同
… …核内质子数核外电子数不一定等于不一定核内质子数(即核电荷数)质子数和中子数质子数3、原子的特征(1)、原子是构成物质的一种基本粒子。例如金、金刚石、其它一些金属等物质都是由它们的原子直接构成的。
(2)、原子也可以构成分子,由分子构成物质。例如氢原子和氧原子构成水分子,大量水分子构成水。
(3)、原子具有微观粒子的一般性质。如质量和体积很小、有间隔和相互作用,总在不断运动等。4、分子与原子的比较
1、在分子、原子、原子核、质子、中子、电子中,找出符合条件的粒子,填在相应的横线上。
⑴带正电荷的粒子是 ;
⑵质量最小的粒子是 ;
⑶不显电性的粒子是 ;
⑷在同一类原子中数目相等的是 ;
⑸化学变化中可分的粒子是 ,不可分的粒子是 ;
⑹能保持物质化学性质的粒子是 。
原子核、质子电子分子、原子、中子质子、电子分子分子、原子原子在线测试
2.组成一切原子所不可缺少的粒子( )
A 电子
B 质子、电子
C 质子、中子、电子
D 质子、中子
B3、月球土壤含有大量氦-3原子,它可能成为未来核能的重要原料。氦-3原子核内有2个质子和1个中子。氦-3原子中的电子数为( )
A、1 B、2 C、3 D、4 B4、原子和分子的本质区别是( )
A、体积大小不同 B、质量不同
C、分子能独立存在,原子不能
D、在化学反应中分子可分,原子不可分
5、原子里的质子数等于( )
A、中子数 B、电子数
C、中子数和电子数之和 D、核电荷数DBD6. 下列有关原子构成的叙述不正确的是( ) A、原子不显电性 B、相对于原子的体积来说,原子核的体积 小到几乎可以忽略不计 C、原子核是不可分割的实心球体 D、原子的质量主要集中在原子核上C一个碳原子的质量是:
0.00000000000000000000000001993千克
即1.993×10-26千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个铁原子的质量是:
0.00000000000000000000000009288千克
即9.288×10-26千克原子的质量很小,记忆、计算都很不方便,怎么办?原子的质量测定值 相对原子质量就是以一种碳原子质量的1/12(1.66×10-27 kg)为标准,其他原子的质量跟它相比较所得到的比。 一个碳12原子的质量×1/12Ar=二、原子质量的计量找规律:阅读上表,你能得到什么信息?核电荷数=核内质子数=核外电子数跟质子、中子相比,电子质量很小,通常忽略不计,原子的质量主要集中在原子核上。质子和中子的质量跟相对原子质量标准相比较,均约等于1相对原子质量 ≈ 质子数 + 中子数几种原子的相对原子质量1.填表:2.氧原子的相对原子质量为( )
A.16 g B.16 C.2.657×10-26 kg D.16 g
3.最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为 ,中子数为 ,核外电子数为 。 B114175114 1 0 12 26 30 1 1 12 12 26 课堂练习我的收获:1、这节课你学到了哪些知识?相对原子质量==质子数 + 中子数质子数=核电荷数=核外电子数再 见!
2、用分子原子的观点描述水电解的过程:复习旧知识:复习旧知识:水是由水 构成的,通电后水分子被分裂为氧 和氢 ,每两个氧 结合成一个氧 ,每两个氢 结合成一个氢 。大量的氧 聚集成为氧气,大量的氢 聚集为氢气。 分子分子分子分子分子原子原子原子原子 在电解水的过程中,发生变化的粒子
是 ,保持不变的粒子是 ,
生成的新粒子是 ,该实验
证明在化学反应中 可分,而 不
可分.即原子是化学变化中的 .复习旧知识:水分子氢原子氧原子分子原子最小粒子氢分子氧分子原子能不能再分呢?原子是由什么构成的呢?1、原子结构发展史(1)我国古代的哲学家墨子以及古希腊哲学家德谟克利特等人认为 :万物是由大量的 不可分割的微粒 构成的,即由原子构成的。 原子的结构(2) 19世纪初,近代化学之父——英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。道尔顿原子模型(3)1897年,英国科学家汤姆森发现了电子。证明原子是可以再分的。他提出原子是一个平均分布着正电荷的粒子,其中镶嵌着许多带负电荷的电子。汤姆森原子模型
“葡萄干布丁”模型英国物理学家汤姆森英国科学家卢瑟福
(1871~1937)(4)α粒子散射实验(1911年)卢瑟福和他的助手做了著名α粒子散射实验金原子α粒子束带正电的粒子1911年卢瑟福α粒子金箔实验原子α粒子束α 粒子束现象:1绝大多数α粒子能穿过金箔不改变原来方向,2一小部分改变了方向,3极少数粒子被反弹了回来.带两个正电荷的氦原子为什么绝大多数的α粒子能够顺利穿过金箔,只有一小部分发生偏转,还有极少数被反弹回来?
交流共享 绝大部分α粒子没有或遇到极小的阻力,从原子之间的间隙或者原子内部的空隙中穿过;而极少数α粒子被反弹回来是因为它们和金原子中某种极为坚硬密实的核发生了碰撞。这就是原子核。如果当时你在场,发现了这一现象后,
你会怎样想呢?卢瑟福提出了一个更完整的原子行星模型:
原子是由原子核和核外电子构成的,电子在核外“很大”的空间里运动。卢瑟福的原子结构模型英国科学家卢瑟福
(1871~1937)原子原子核原子核有多小?原子原子核核外电子质子中子(每个电子带一个单位的负电荷)注:质子和中子的质量差不多,都比电子的质量大得多,约为电子质量的1836倍,原子的质量主要集中在原子核上。(带正电)(不显电性)2、原子的结构原子核所带的正电荷数目叫做核电荷数,在数值上等于质子的个数。核电荷数 = 质子数(每个质子带一个单位正电荷)(不带电)(带负电)= 核外电子数注意从以下几方面理解原子结构:
(1)位置:原子核位于原子的中心,电子在核外运动。
(2)体积:原子的体积很小,而原子核的半径约为原子半径的几万分之一,因此相对来说,原子里有很大空间,电子就在这个空间内作高速运动。(3)数目:一个原子只有一个原子核,但电子的数目≥1,中子的数目≥0,可见原子核、质子、电子是一个原子中必有的粒子,中子不一定有,如氢原子核内只有一个质子,没有中子。多识一点(4)电性:原子核带正电,电子带负电,质子带正电,中子不带电,整个原子不显电性。(5)电量:原子核所带正电荷数叫核电荷数,每个质子带一个单位的正电荷。每个电子带一个单位负电荷。由于原子核所带电量与核外电子所带电量相等,电性相反,所以整个原子不显电性。(6)质量:在原子中,质子和中子的质量大约相等,而电子仅相当于质子(或中子)质量的1/1836,因此原子的质量主要集中在原子核上。
从原子结构可以看出,原子不是最小的粒子,还可再分。下表列出几种原子的基本构成,请你分析表中信息,看看能得出那些结论?活动天地 1、在原子里,核电荷数= = 。
2、质子数 中子数
3、原子中 含有中子
4、不同的原子其 不同。
5、不同的原子其核内所含的 不同。
6、同一类原子 相同
… …核内质子数核外电子数不一定等于不一定核内质子数(即核电荷数)质子数和中子数质子数3、原子的特征(1)、原子是构成物质的一种基本粒子。例如金、金刚石、其它一些金属等物质都是由它们的原子直接构成的。
(2)、原子也可以构成分子,由分子构成物质。例如氢原子和氧原子构成水分子,大量水分子构成水。
(3)、原子具有微观粒子的一般性质。如质量和体积很小、有间隔和相互作用,总在不断运动等。4、分子与原子的比较
1、在分子、原子、原子核、质子、中子、电子中,找出符合条件的粒子,填在相应的横线上。
⑴带正电荷的粒子是 ;
⑵质量最小的粒子是 ;
⑶不显电性的粒子是 ;
⑷在同一类原子中数目相等的是 ;
⑸化学变化中可分的粒子是 ,不可分的粒子是 ;
⑹能保持物质化学性质的粒子是 。
原子核、质子电子分子、原子、中子质子、电子分子分子、原子原子在线测试
2.组成一切原子所不可缺少的粒子( )
A 电子
B 质子、电子
C 质子、中子、电子
D 质子、中子
B3、月球土壤含有大量氦-3原子,它可能成为未来核能的重要原料。氦-3原子核内有2个质子和1个中子。氦-3原子中的电子数为( )
A、1 B、2 C、3 D、4 B4、原子和分子的本质区别是( )
A、体积大小不同 B、质量不同
C、分子能独立存在,原子不能
D、在化学反应中分子可分,原子不可分
5、原子里的质子数等于( )
A、中子数 B、电子数
C、中子数和电子数之和 D、核电荷数DBD6. 下列有关原子构成的叙述不正确的是( ) A、原子不显电性 B、相对于原子的体积来说,原子核的体积 小到几乎可以忽略不计 C、原子核是不可分割的实心球体 D、原子的质量主要集中在原子核上C一个碳原子的质量是:
0.00000000000000000000000001993千克
即1.993×10-26千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个铁原子的质量是:
0.00000000000000000000000009288千克
即9.288×10-26千克原子的质量很小,记忆、计算都很不方便,怎么办?原子的质量测定值 相对原子质量就是以一种碳原子质量的1/12(1.66×10-27 kg)为标准,其他原子的质量跟它相比较所得到的比。 一个碳12原子的质量×1/12Ar=二、原子质量的计量找规律:阅读上表,你能得到什么信息?核电荷数=核内质子数=核外电子数跟质子、中子相比,电子质量很小,通常忽略不计,原子的质量主要集中在原子核上。质子和中子的质量跟相对原子质量标准相比较,均约等于1相对原子质量 ≈ 质子数 + 中子数几种原子的相对原子质量1.填表:2.氧原子的相对原子质量为( )
A.16 g B.16 C.2.657×10-26 kg D.16 g
3.最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为 ,中子数为 ,核外电子数为 。 B114175114 1 0 12 26 30 1 1 12 12 26 课堂练习我的收获:1、这节课你学到了哪些知识?相对原子质量==质子数 + 中子数质子数=核电荷数=核外电子数再 见!
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
