人教版高中化学必修第一册第三章铁金属材料第一节第1课时铁的单质、氧化物和氢氧化物学案
文档属性
| 名称 | 人教版高中化学必修第一册第三章铁金属材料第一节第1课时铁的单质、氧化物和氢氧化物学案 |

|
|
| 格式 | docx | ||
| 文件大小 | 889.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-12 17:23:28 | ||
图片预览




文档简介
第一节 铁及其化合物
第1课时 铁的单质、氧化物和氢氧化物
[学习目标] 1.结合生活中铁制品的应用,了解单质铁、铁的氧化物的性质及用途。
2.通过探究实验,认识铁单质与水蒸气的反应。 3.通过实验掌握Fe(OH)2、Fe(OH)3的制备原理及化学性质。
任务一 铁的单质
1.铁的存在和冶炼
(1)存在
自然界中可以以单质形态(陨铁)存在,但主要以+2价和+3价化合物的形态存在,地壳中含量居第四位,仅次于氧、硅和铝。
(2)冶炼
工业炼铁的原理是用还原法把铁从铁矿石中提炼出来,化学方程式(以Fe2O3为例):3CO+Fe2O32Fe+3CO2。
2.铁的物理性质
铁有延展性、导热性、导电性,但其导电性不如铜和铝,铁还能被磁体吸引。
[交流研讨1] 为什么铁片是银白色,而铁粉却是黑色?
提示:金属小颗粒能反射光线。小颗粒的分布是非常混乱的,所以不能像镜面一样把入射光线定向地反射回去。入射光线进到金属小颗粒中,就像进了“迷魂阵”,从一个小颗粒反射到另一个小颗粒,这样反射过来又反射回去,光线越来越弱,很少按入射方向返回去,因此看上去是黑色的。
3.铁的化学性质
(1)与酸的反应:Fe+2H+===Fe2++H2↑。
(2)与硫酸铜溶液的反应:Fe+Cu2+===Fe2++Cu。
(3)与非金属反应
①Fe与O2:3Fe+2O2Fe3O4(剧烈燃烧、火星四射、放出大量的热、生成黑色固体)。
②Fe与Cl2:2Fe+3Cl22FeCl3(产生棕黄色的烟)。
(4)实验探究铁粉与水蒸气的反应
用燃着的火柴去点肥皂泡,观察到的现象是肥皂泡燃烧,听到爆鸣声,证明生成了H2,则该反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2。上述实验装置中,湿棉花的作用是受热时提供反应所需的水蒸气。
[交流研讨2] 用下列实验装置也可以探究铁粉与水蒸气的反应。
反应开始时,应先点燃________处的酒精灯,其目的是_____________________________,
若点燃顺序反了,可能有两个后果①____________________________________________;
②________________________________________________________________________。
提示:b 用水蒸气排出装置内的空气 ①Fe与O2生成了Fe3O4,无法与水蒸气反应 ②Fe与水蒸气反应生成H2,在高温下与空气中的O2反应可能发生爆炸
1.正误判断,错误的说明原因。
(1)由于铁单质性质比较活泼,所以自然界中没有游离态的铁单质:_____________________。
(2)铁与AgNO3、ZnCl2等盐溶液均能发生反应生成Fe2+:_______________________________。
(3)分离铁粉与铜粉的混合物时,只能用化学方法:__________________________________
_______________________________________________________________________________。
(4)由于钠与水反应生成NaOH和H2,所以铁与水蒸气反应生成Fe(OH)3和H2:______________________________________________________________________________。
答案:(1)错误。陨石中含有游离态的铁单质
(2)错误。铁与ZnCl2溶液不能发生反应
(3)错误。用磁铁也可以分离铁粉与铜粉的混合物
(4)错误。铁与水蒸气在高温下反应只能生成Fe3O4和H2
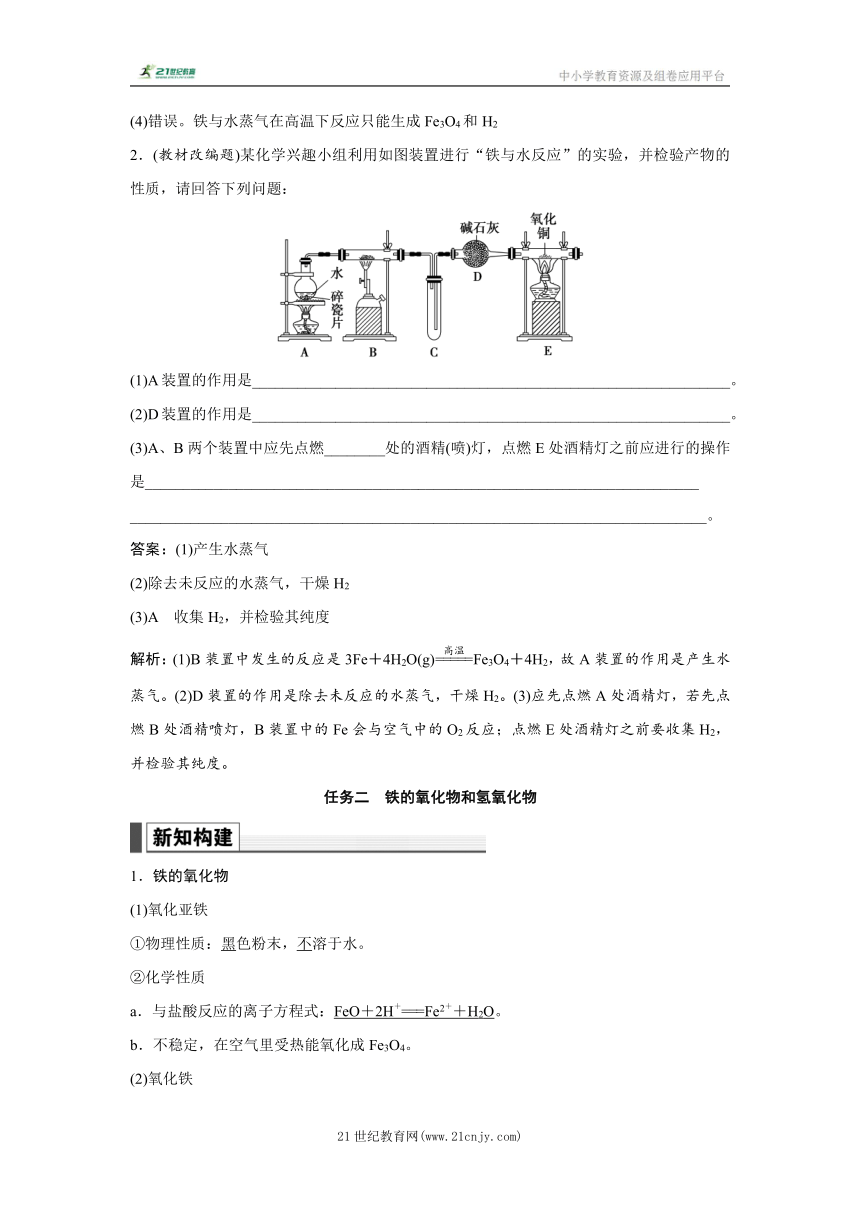
2.(教材改编题)某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是_______________________________________________________________。
(2)D装置的作用是_______________________________________________________________。
(3)A、B两个装置中应先点燃________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是_________________________________________________________________________
____________________________________________________________________________。
答案:(1)产生水蒸气
(2)除去未反应的水蒸气,干燥H2
(3)A 收集H2,并检验其纯度
解析:(1)B装置中发生的反应是3Fe+4H2O(g)Fe3O4+4H2,故A装置的作用是产生水蒸气。(2)D装置的作用是除去未反应的水蒸气,干燥H2。(3)应先点燃A处酒精灯,若先点燃B处酒精喷灯,B装置中的Fe会与空气中的O2反应;点燃E处酒精灯之前要收集H2,并检验其纯度。
任务二 铁的氧化物和氢氧化物
1.铁的氧化物
(1)氧化亚铁
①物理性质:黑色粉末,不溶于水。
②化学性质
a.与盐酸反应的离子方程式:FeO+2H+===Fe2++H2O。
b.不稳定,在空气里受热能氧化成Fe3O4。
(2)氧化铁
①物理性质:俗称铁红,红棕色粉末,不溶于水。
②化学性质
与盐酸反应的离子方程式:Fe2O3+6H+===2Fe3++3H2O。
③用途:Fe2O3常用作红色颜料,赤铁矿(主要成分是Fe2O3)是炼铁的原料。
(3)四氧化三铁
是一种复杂的化合物,是具有磁性的黑色晶体,俗称磁性氧化铁。
2.铁的氢氧化物的性质
(1)物理性质
氢氧化亚铁:白色固体,不溶于水;
氢氧化铁:红褐色固体,不溶于水。
(2)化学性质
①与酸的反应
以盐酸为例,写出反应的离子方程式。
Fe(OH)2:Fe(OH)2+2H+===Fe2++2H2O。
Fe(OH)3:Fe(OH)3+3H+===Fe3++3H2O。
②不稳定性
Fe(OH)2FeO+H2O(隔绝空气),2Fe(OH)3Fe2O3+3H2O。
在空气中Fe(OH)2极易转化为Fe(OH)3,其化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。
3.铁的氢氧化物的实验室制备
Fe(OH)2 Fe(OH)3
操作
现象 产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色沉淀 生成红褐色沉淀
结论 在空气中,Fe(OH)2很不稳定,极易转化为Fe(OH)3
制备Fe(OH)2的离子方程式是Fe2++2OH-===Fe(OH)2↓;
制备Fe(OH)3的离子方程式是Fe3++3OH-===Fe(OH)3↓。
[交流研讨] 如图是制备氢氧化亚铁的改进装置,思考并回答下列问题:
(1)配制NaOH和FeSO4溶液的蒸馏水要经过________,目的是__________________________
_____________________________________________________________________________。
(2)在FeSO4溶液表面覆盖一层苯(一种有机溶剂,难溶于水,密度比水小)的作用是_____________________________________________________________________________
_______________________________________________________________________________。
(3)将吸有NaOH溶液的长滴管伸入FeSO4溶液液面以下,其目的是______________________
_______________________________________________________________________________。
提示:(1)加热煮沸 赶走溶解的氧气
(2)隔绝空气,防止生成的氢氧化亚铁被氧化
(3)防止滴加NaOH溶液时带入空气氧化Fe(OH)2
1.正误判断,错误的说明原因。
(1)Fe3O4中铁的化合价有+2和+3价,是一种混合物:_______________________________。
(2)Fe(OH)3不能利用化合反应生成:_______________________________________________
_______________________________________________________________________________。
(3)因为Fe(OH)2易被氧化,所以在制备时要隔绝空气:_______________________________。
答案:(1)错误。Fe3O4中铁的化合价有+2和+3价,是一种纯净物
(2) 错误。Fe(OH)3可以利用化合反应生成:4Fe(OH)2+O2+2H2O===4Fe(OH)3
(3)正确
2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制得的Fe(OH)2沉淀能较长时间保持白色。
(1)在试管Ⅰ里加入的试剂是____________。在试管Ⅱ里加入的试剂是____________。
(2)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是______________________________________________________________________________
______________________________________________________________________________。
(3)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是____________________________
____________________________________________________________________________________________________________________________________________________________。
答案:(1)稀H2SO4、铁屑 NaOH溶液
(2)打开止水夹a,待Ⅰ中反应生成的氢气排净装置中的空气后,再关闭止水夹a
(3)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
制备Fe(OH)2实验装置的改进
1.下列关于铁的叙述错误的是( )
A.纯净的铁是光亮的银白色金属
B.铁能被磁体吸引
C.铁是地壳中含量最多的金属元素
D.铁具有延展性和导热性,可制作炊具
答案:C
2.下列有关铁的说法不正确的是( )
A.铁与水蒸气的反应中铁为还原剂
B.铁和稀硫酸反应的离子方程式为2Fe+6H+===2Fe3++3H2↑
C.铁在纯氧中燃烧生成Fe3O4
D.工业上用CO在高温条件下还原含Fe2O3的矿石炼铁
答案:B
解析:铁和稀硫酸反应的离子方程式应为Fe+2H+===Fe2++H2↑。
3.铁与水蒸气反应实验改进前后的装置如图所示:
下列说法错误的是( )
A.将湿棉花改为浸水的尿不湿,酒精灯由单头改为双头,可提供足量的水蒸气
B.用具支试管可将试管口附近冷凝的水导出
C.将肥皂液改为吹泡泡水,收集H2的效果更好,点燃效果更明显
D.改进后,悬挂的磁铁能吸引铁粉,实验过程中,我们能看到具支试管中有黑色固体不断落下
答案:D
4.下列有关铁的化合物的说法不正确的是( )
A.Fe(OH)2不稳定,具有较强的氧化性
B.FeO、Fe2O3均为碱性氧化物,均可与盐酸反应
C.Fe(OH)3可通过化合反应得到,Fe(OH)2则不能
D.Fe3O4为磁性氧化铁,其中铁的化合价为+2和+3
答案:A
5.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是_______________________________________________________________________
_____________________________________________________________________________。
(2)实验开始时先将止水夹E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程:________________________________________________
_____________________________________________________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:___________________
______________________________________________________________________________。
答案:(1)铁屑 Fe+2H+===Fe2++H2↑
(2)打开 H2
(3)关闭止水夹E,使FeSO4溶液压入B瓶中进行反应
(4)4Fe(OH)2+O2+2H2O===4Fe(OH)3
解析:实验开始时先打开E,让H2把A、B装置中的空气排出,让Fe(OH)2在H2气氛中生成,以便较长时间观察Fe(OH)2的颜色。H2充满B后关闭E,A中的FeSO4溶液沿竖直长导管进入B瓶,与NaOH反应。空气进入装置B后,Fe(OH)2被氧化为Fe(OH)3。
课时测评22 铁的单质、氧化物和氢氧化物
(本栏目内容在学生用书中以活页形式分册装订!)
题点一 铁的单质
1.(2023·东莞高一调研)我国宋代《开宝本草》中记载了中药材铁华粉的制作方法:“取钢煅作叶,如笏或团,平面磨错令光、净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”下列说法错误的是( )
A.“取钢煅作叶,如笏或团”说明金属铁有较好的延展性
B.“平面磨错令光、净”的目的是除去表面的铁锈
C.“铁上衣生”的原因是铁被氧气氧化
D.中药材铁华粉的主要成分是醋酸亚铁
答案:C
解析:把钢煅作或长或圆的叶子形状,说明金属铁有良好的延展性,故A正确;中药材铁华粉的主要成分是醋酸亚铁,故开始要除去铁锈,防止三价铁影响产物纯度,故B正确;金属铁在醋瓮中密封保存,隔绝空气,不能与氧气反应,故C错误;隔绝空气,铁与醋酸反应生成醋酸亚铁,故D正确。
2.(2023·福州高一检测)常温下,将铁片放入下列溶液中,不发生反应的是( )
A.稀硫酸 B.氯水
C.氢氧化钠溶液 D.硫酸铜溶液
答案:C
解析:铁与稀硫酸反应:Fe+H2SO4===FeSO4+H2↑;氯水呈酸性、强氧化性,可以和铁反应;铁与硫酸铜发生置换反应:Fe+CuSO4===FeSO4+Cu;铁与氢氧化钠溶液不发生反应,C项符合题意。
3.(教材改编题)下列变化通过一步反应不能直接完成的是( )
A.Fe―→Fe3O4 B.Na―→Na2CO3
C.Na2O2―→NaOH D.Na―→Na2O2
答案:B
解析:A项反应为3Fe+4H2O(g)Fe3O4+4H2;B项Na性质活泼,但不能通过一步反应直接转化为Na2CO3;C项反应为2Na2O2+2H2O===4NaOH+O2↑;D项反应为2Na+O2Na2O2。
4.铁粉在高温条件下可与水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )
A.0.5 mol B.1 mol
C.1.5 mol D.2 mol
答案:C
解析:3Fe+4H2O(g)Fe3O4+4H2 Δm(固体)
3 mol 64 g
n(Fe) 32 g
解得n(Fe)=1.5 mol。
题点二 铁的氧化物
5.(2023·福建闽清高一检测)北宋沈括的《梦溪笔谈》对指南针已有详细记载:“方家以磁石磨针锋,则能指南。”磁石的主要成分是( )
A.FeO B.Fe2O3 C.Fe3O4 D.CuFeS2
答案:C
解析:Fe3O4叫磁性氧化铁,具有磁性,制指南针的磁石的主要成分是Fe3O4。
6.(2023·东莞高一检测)下列说法正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.Fe2O3为碱性氧化物,可与水反应生成Fe(OH)3
C.铁锈的主要成分是Fe2O3
D.Fe3O4中铁元素有+2价和+3价,Fe3O4是混合物
答案:C
解析:赤铁矿、铁锈的主要成分均是Fe2O3,A错误,C正确;Fe2O3为碱性氧化物,但不与水反应,B错误;Fe3O4为化合物是纯净物,不是混合物,D错误。
题点三 铁的氢氧化物
7.(2023·河北定州高一检测)在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述中不正确的是( )
A.生成物为氢氧化铁
B.该反应是化合反应
C.该反应是氧化还原反应
D.氢氧化亚铁做氧化剂
答案:D
解析:氢氧化亚铁易与氧气、水反应生成氢氧化铁,该反应既是化合反应,又是氧化还原反应,氢氧化亚铁是还原剂,氧气是氧化剂。
8.(2023·山东海阳高一段考)下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是( )
答案:D
解析:B项中CCl4密度大,应在下层,不能长时间观察到白色沉淀;D项中的操作可防止氧气氧化Fe(OH)2,能较长时间观察到白色沉淀。
9.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣。上述沉淀和残渣分别是( )
A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
答案:B
解析:铁与稀硫酸反应生成FeSO4,再与过量氨水反应生成白色沉淀Fe(OH)2,在空气中加热Fe(OH)2,铁元素被氧化为+3 价,最后所得红棕色残渣为Fe2O3。
10.(2023·山东莱阳一中高一检测)某学生以铁丝和Cl2为原料进行下列三个实验。从分类角度分析,下列说法正确的是( )
A.实验①②所涉及的物质均为电解质
B.实验①③发生的均为离子反应
C.实验②③均未发生氧化还原反应
D.实验①③反应制得的物质均为纯净物
答案:C
解析:实验①中铁与氯气都是单质,不是电解质,故A错误;实验①中铁与氯气反应生成氯化铁,不是离子间发生的反应,不属于离子反应,故B错误;实验②中氯化铁溶于水为物理变化,实验③中氯化铁水解生成氢氧化铁胶体,没有化合价变化,不属于氧化还原反应,故C正确;实验③得到氢氧化铁胶体,属于混合物,故D错误。
11.(2023·湖北松滋高一段考)铁有+2价和+3价两种价态,下列有关反应中不涉及铁元素价态变化的是( )
A.铁与稀硫酸反应
B.铁在氧气中燃烧,其产物溶于盐酸中可得到两种盐
C.氢氧化亚铁是白色固体,在空气中迅速变成灰绿色,最终变成红褐色
D.氢氧化铁受热分解
答案:D
解析:Fe与稀硫酸反应生成FeSO4和H2,铁元素的化合价由0价升至+2价,涉及铁元素价态变化,A不符合题意。Fe在氧气中燃烧生成Fe3O4,铁元素的化合价发生变化,B不符合题意。白色氢氧化亚铁固体在空气中迅速变成灰绿色,最终变成红褐色,发生反应:4Fe(OH)2+O2+2H2O===4Fe(OH)3,铁元素的化合价由+2价升至+3价,C不符合题意。氢氧化铁受热分解生成Fe2O3和水,反应前后铁元素的化合价均为+3价,不涉及铁元素价态变化,D符合题意。
12.(2023·安徽长丰一中高一段考)A~J都是初中化学中的常见物质,其中D、E对维持自然界生命活动至关重要,A、B为黑色固体,C是红色金属单质,H为气体,它们的相互转化关系如下图所示。
请回答下列问题:
(1)写出下列物质的化学式:B______;I______。
(2)反应①②③④中属于置换反应的是________(填序号)。
(3)写出反应④的化学方程式:__________________________________________________
_____________________________________________________________________________。
答案:(1)CuO FeSO4 (2)① (3)3CO+Fe2O32Fe+3CO2
解析:根据A~J都是初中化学中的常见物质,D、E对维持自然界生命活动至关重要,所以D、E可能是水、氧气或二氧化碳中的一种,C是红色的金属单质,所以C是铜,A、B为黑色固体,高温会生成铜和D,A在足量的E中可以燃烧,所以A是木炭,B就是氧化铜,D就是二氧化碳,木炭和氧气反应会生成二氧化碳,所以E是氧气,二氧化碳和木炭会生成一氧化碳,所以F是一氧化碳,二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,所以J是碳酸钙,一氧化碳和氧化铁会生成铁和二氧化碳,G是铁,铁和稀硫酸反应会生成硫酸亚铁和氢气,H是一种气体,所以H是氢气,I是硫酸亚铁。
13.已知Fe3O4是一种复杂的化合物,其化学式可改写为FeO·Fe2O3。对于Fe与水蒸气反应后的黑色物质,有三个学习小组提出了三种不同的猜想,以下是小组同学进行的实验猜想与探究,请你根据小组的思路与提示完成相关空白。
实验之前查阅资料得知Fe3+的盐溶液遇到KSCN溶液时,溶液变成红色,而Fe2+遇KSCN溶液无明显变化。
【猜想】甲组:黑色物质是FeO;
乙组:黑色物质是Fe3O4;
丙组:________________________________________________________________________。
【实验探究】
丙组认为一种简单定性的方法即可判断甲组的正误:取生成的黑色物质少许于烧杯中,加稀盐酸使其完全溶解,再加________溶液以检验Fe3+,观察到溶液有无出现________现象即可判断。
答案:黑色物质是FeO和Fe3O4的混合物 KSCN 红色
解析:Fe的氧化物有FeO、Fe2O3、Fe3O4,其中Fe2O3是红棕色固体,FeO、Fe3O4是黑色物质;黑色物质若为纯净物,可能为FeO,也可能为Fe3O4,若是混合物,则为FeO和Fe3O4的混合物。 Fe3+遇SCN-,溶液变为红色,所以向溶液中加入KSCN溶液,若观察到溶液无红色现象出现,即可判断无Fe3+,即原黑色物质为FeO。
21世纪教育网(www.21cnjy.com)
第1课时 铁的单质、氧化物和氢氧化物
[学习目标] 1.结合生活中铁制品的应用,了解单质铁、铁的氧化物的性质及用途。
2.通过探究实验,认识铁单质与水蒸气的反应。 3.通过实验掌握Fe(OH)2、Fe(OH)3的制备原理及化学性质。
任务一 铁的单质
1.铁的存在和冶炼
(1)存在
自然界中可以以单质形态(陨铁)存在,但主要以+2价和+3价化合物的形态存在,地壳中含量居第四位,仅次于氧、硅和铝。
(2)冶炼
工业炼铁的原理是用还原法把铁从铁矿石中提炼出来,化学方程式(以Fe2O3为例):3CO+Fe2O32Fe+3CO2。
2.铁的物理性质
铁有延展性、导热性、导电性,但其导电性不如铜和铝,铁还能被磁体吸引。
[交流研讨1] 为什么铁片是银白色,而铁粉却是黑色?
提示:金属小颗粒能反射光线。小颗粒的分布是非常混乱的,所以不能像镜面一样把入射光线定向地反射回去。入射光线进到金属小颗粒中,就像进了“迷魂阵”,从一个小颗粒反射到另一个小颗粒,这样反射过来又反射回去,光线越来越弱,很少按入射方向返回去,因此看上去是黑色的。
3.铁的化学性质
(1)与酸的反应:Fe+2H+===Fe2++H2↑。
(2)与硫酸铜溶液的反应:Fe+Cu2+===Fe2++Cu。
(3)与非金属反应
①Fe与O2:3Fe+2O2Fe3O4(剧烈燃烧、火星四射、放出大量的热、生成黑色固体)。
②Fe与Cl2:2Fe+3Cl22FeCl3(产生棕黄色的烟)。
(4)实验探究铁粉与水蒸气的反应
用燃着的火柴去点肥皂泡,观察到的现象是肥皂泡燃烧,听到爆鸣声,证明生成了H2,则该反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2。上述实验装置中,湿棉花的作用是受热时提供反应所需的水蒸气。
[交流研讨2] 用下列实验装置也可以探究铁粉与水蒸气的反应。
反应开始时,应先点燃________处的酒精灯,其目的是_____________________________,
若点燃顺序反了,可能有两个后果①____________________________________________;
②________________________________________________________________________。
提示:b 用水蒸气排出装置内的空气 ①Fe与O2生成了Fe3O4,无法与水蒸气反应 ②Fe与水蒸气反应生成H2,在高温下与空气中的O2反应可能发生爆炸
1.正误判断,错误的说明原因。
(1)由于铁单质性质比较活泼,所以自然界中没有游离态的铁单质:_____________________。
(2)铁与AgNO3、ZnCl2等盐溶液均能发生反应生成Fe2+:_______________________________。
(3)分离铁粉与铜粉的混合物时,只能用化学方法:__________________________________
_______________________________________________________________________________。
(4)由于钠与水反应生成NaOH和H2,所以铁与水蒸气反应生成Fe(OH)3和H2:______________________________________________________________________________。
答案:(1)错误。陨石中含有游离态的铁单质
(2)错误。铁与ZnCl2溶液不能发生反应
(3)错误。用磁铁也可以分离铁粉与铜粉的混合物
(4)错误。铁与水蒸气在高温下反应只能生成Fe3O4和H2
2.(教材改编题)某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是_______________________________________________________________。
(2)D装置的作用是_______________________________________________________________。
(3)A、B两个装置中应先点燃________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是_________________________________________________________________________
____________________________________________________________________________。
答案:(1)产生水蒸气
(2)除去未反应的水蒸气,干燥H2
(3)A 收集H2,并检验其纯度
解析:(1)B装置中发生的反应是3Fe+4H2O(g)Fe3O4+4H2,故A装置的作用是产生水蒸气。(2)D装置的作用是除去未反应的水蒸气,干燥H2。(3)应先点燃A处酒精灯,若先点燃B处酒精喷灯,B装置中的Fe会与空气中的O2反应;点燃E处酒精灯之前要收集H2,并检验其纯度。
任务二 铁的氧化物和氢氧化物
1.铁的氧化物
(1)氧化亚铁
①物理性质:黑色粉末,不溶于水。
②化学性质
a.与盐酸反应的离子方程式:FeO+2H+===Fe2++H2O。
b.不稳定,在空气里受热能氧化成Fe3O4。
(2)氧化铁
①物理性质:俗称铁红,红棕色粉末,不溶于水。
②化学性质
与盐酸反应的离子方程式:Fe2O3+6H+===2Fe3++3H2O。
③用途:Fe2O3常用作红色颜料,赤铁矿(主要成分是Fe2O3)是炼铁的原料。
(3)四氧化三铁
是一种复杂的化合物,是具有磁性的黑色晶体,俗称磁性氧化铁。
2.铁的氢氧化物的性质
(1)物理性质
氢氧化亚铁:白色固体,不溶于水;
氢氧化铁:红褐色固体,不溶于水。
(2)化学性质
①与酸的反应
以盐酸为例,写出反应的离子方程式。
Fe(OH)2:Fe(OH)2+2H+===Fe2++2H2O。
Fe(OH)3:Fe(OH)3+3H+===Fe3++3H2O。
②不稳定性
Fe(OH)2FeO+H2O(隔绝空气),2Fe(OH)3Fe2O3+3H2O。
在空气中Fe(OH)2极易转化为Fe(OH)3,其化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。
3.铁的氢氧化物的实验室制备
Fe(OH)2 Fe(OH)3
操作
现象 产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色沉淀 生成红褐色沉淀
结论 在空气中,Fe(OH)2很不稳定,极易转化为Fe(OH)3
制备Fe(OH)2的离子方程式是Fe2++2OH-===Fe(OH)2↓;
制备Fe(OH)3的离子方程式是Fe3++3OH-===Fe(OH)3↓。
[交流研讨] 如图是制备氢氧化亚铁的改进装置,思考并回答下列问题:
(1)配制NaOH和FeSO4溶液的蒸馏水要经过________,目的是__________________________
_____________________________________________________________________________。
(2)在FeSO4溶液表面覆盖一层苯(一种有机溶剂,难溶于水,密度比水小)的作用是_____________________________________________________________________________
_______________________________________________________________________________。
(3)将吸有NaOH溶液的长滴管伸入FeSO4溶液液面以下,其目的是______________________
_______________________________________________________________________________。
提示:(1)加热煮沸 赶走溶解的氧气
(2)隔绝空气,防止生成的氢氧化亚铁被氧化
(3)防止滴加NaOH溶液时带入空气氧化Fe(OH)2
1.正误判断,错误的说明原因。
(1)Fe3O4中铁的化合价有+2和+3价,是一种混合物:_______________________________。
(2)Fe(OH)3不能利用化合反应生成:_______________________________________________
_______________________________________________________________________________。
(3)因为Fe(OH)2易被氧化,所以在制备时要隔绝空气:_______________________________。
答案:(1)错误。Fe3O4中铁的化合价有+2和+3价,是一种纯净物
(2) 错误。Fe(OH)3可以利用化合反应生成:4Fe(OH)2+O2+2H2O===4Fe(OH)3
(3)正确
2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制得的Fe(OH)2沉淀能较长时间保持白色。
(1)在试管Ⅰ里加入的试剂是____________。在试管Ⅱ里加入的试剂是____________。
(2)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是______________________________________________________________________________
______________________________________________________________________________。
(3)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是____________________________
____________________________________________________________________________________________________________________________________________________________。
答案:(1)稀H2SO4、铁屑 NaOH溶液
(2)打开止水夹a,待Ⅰ中反应生成的氢气排净装置中的空气后,再关闭止水夹a
(3)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
制备Fe(OH)2实验装置的改进
1.下列关于铁的叙述错误的是( )
A.纯净的铁是光亮的银白色金属
B.铁能被磁体吸引
C.铁是地壳中含量最多的金属元素
D.铁具有延展性和导热性,可制作炊具
答案:C
2.下列有关铁的说法不正确的是( )
A.铁与水蒸气的反应中铁为还原剂
B.铁和稀硫酸反应的离子方程式为2Fe+6H+===2Fe3++3H2↑
C.铁在纯氧中燃烧生成Fe3O4
D.工业上用CO在高温条件下还原含Fe2O3的矿石炼铁
答案:B
解析:铁和稀硫酸反应的离子方程式应为Fe+2H+===Fe2++H2↑。
3.铁与水蒸气反应实验改进前后的装置如图所示:
下列说法错误的是( )
A.将湿棉花改为浸水的尿不湿,酒精灯由单头改为双头,可提供足量的水蒸气
B.用具支试管可将试管口附近冷凝的水导出
C.将肥皂液改为吹泡泡水,收集H2的效果更好,点燃效果更明显
D.改进后,悬挂的磁铁能吸引铁粉,实验过程中,我们能看到具支试管中有黑色固体不断落下
答案:D
4.下列有关铁的化合物的说法不正确的是( )
A.Fe(OH)2不稳定,具有较强的氧化性
B.FeO、Fe2O3均为碱性氧化物,均可与盐酸反应
C.Fe(OH)3可通过化合反应得到,Fe(OH)2则不能
D.Fe3O4为磁性氧化铁,其中铁的化合价为+2和+3
答案:A
5.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是_______________________________________________________________________
_____________________________________________________________________________。
(2)实验开始时先将止水夹E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程:________________________________________________
_____________________________________________________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:___________________
______________________________________________________________________________。
答案:(1)铁屑 Fe+2H+===Fe2++H2↑
(2)打开 H2
(3)关闭止水夹E,使FeSO4溶液压入B瓶中进行反应
(4)4Fe(OH)2+O2+2H2O===4Fe(OH)3
解析:实验开始时先打开E,让H2把A、B装置中的空气排出,让Fe(OH)2在H2气氛中生成,以便较长时间观察Fe(OH)2的颜色。H2充满B后关闭E,A中的FeSO4溶液沿竖直长导管进入B瓶,与NaOH反应。空气进入装置B后,Fe(OH)2被氧化为Fe(OH)3。
课时测评22 铁的单质、氧化物和氢氧化物
(本栏目内容在学生用书中以活页形式分册装订!)
题点一 铁的单质
1.(2023·东莞高一调研)我国宋代《开宝本草》中记载了中药材铁华粉的制作方法:“取钢煅作叶,如笏或团,平面磨错令光、净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”下列说法错误的是( )
A.“取钢煅作叶,如笏或团”说明金属铁有较好的延展性
B.“平面磨错令光、净”的目的是除去表面的铁锈
C.“铁上衣生”的原因是铁被氧气氧化
D.中药材铁华粉的主要成分是醋酸亚铁
答案:C
解析:把钢煅作或长或圆的叶子形状,说明金属铁有良好的延展性,故A正确;中药材铁华粉的主要成分是醋酸亚铁,故开始要除去铁锈,防止三价铁影响产物纯度,故B正确;金属铁在醋瓮中密封保存,隔绝空气,不能与氧气反应,故C错误;隔绝空气,铁与醋酸反应生成醋酸亚铁,故D正确。
2.(2023·福州高一检测)常温下,将铁片放入下列溶液中,不发生反应的是( )
A.稀硫酸 B.氯水
C.氢氧化钠溶液 D.硫酸铜溶液
答案:C
解析:铁与稀硫酸反应:Fe+H2SO4===FeSO4+H2↑;氯水呈酸性、强氧化性,可以和铁反应;铁与硫酸铜发生置换反应:Fe+CuSO4===FeSO4+Cu;铁与氢氧化钠溶液不发生反应,C项符合题意。
3.(教材改编题)下列变化通过一步反应不能直接完成的是( )
A.Fe―→Fe3O4 B.Na―→Na2CO3
C.Na2O2―→NaOH D.Na―→Na2O2
答案:B
解析:A项反应为3Fe+4H2O(g)Fe3O4+4H2;B项Na性质活泼,但不能通过一步反应直接转化为Na2CO3;C项反应为2Na2O2+2H2O===4NaOH+O2↑;D项反应为2Na+O2Na2O2。
4.铁粉在高温条件下可与水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )
A.0.5 mol B.1 mol
C.1.5 mol D.2 mol
答案:C
解析:3Fe+4H2O(g)Fe3O4+4H2 Δm(固体)
3 mol 64 g
n(Fe) 32 g
解得n(Fe)=1.5 mol。
题点二 铁的氧化物
5.(2023·福建闽清高一检测)北宋沈括的《梦溪笔谈》对指南针已有详细记载:“方家以磁石磨针锋,则能指南。”磁石的主要成分是( )
A.FeO B.Fe2O3 C.Fe3O4 D.CuFeS2
答案:C
解析:Fe3O4叫磁性氧化铁,具有磁性,制指南针的磁石的主要成分是Fe3O4。
6.(2023·东莞高一检测)下列说法正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.Fe2O3为碱性氧化物,可与水反应生成Fe(OH)3
C.铁锈的主要成分是Fe2O3
D.Fe3O4中铁元素有+2价和+3价,Fe3O4是混合物
答案:C
解析:赤铁矿、铁锈的主要成分均是Fe2O3,A错误,C正确;Fe2O3为碱性氧化物,但不与水反应,B错误;Fe3O4为化合物是纯净物,不是混合物,D错误。
题点三 铁的氢氧化物
7.(2023·河北定州高一检测)在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述中不正确的是( )
A.生成物为氢氧化铁
B.该反应是化合反应
C.该反应是氧化还原反应
D.氢氧化亚铁做氧化剂
答案:D
解析:氢氧化亚铁易与氧气、水反应生成氢氧化铁,该反应既是化合反应,又是氧化还原反应,氢氧化亚铁是还原剂,氧气是氧化剂。
8.(2023·山东海阳高一段考)下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是( )
答案:D
解析:B项中CCl4密度大,应在下层,不能长时间观察到白色沉淀;D项中的操作可防止氧气氧化Fe(OH)2,能较长时间观察到白色沉淀。
9.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣。上述沉淀和残渣分别是( )
A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
答案:B
解析:铁与稀硫酸反应生成FeSO4,再与过量氨水反应生成白色沉淀Fe(OH)2,在空气中加热Fe(OH)2,铁元素被氧化为+3 价,最后所得红棕色残渣为Fe2O3。
10.(2023·山东莱阳一中高一检测)某学生以铁丝和Cl2为原料进行下列三个实验。从分类角度分析,下列说法正确的是( )
A.实验①②所涉及的物质均为电解质
B.实验①③发生的均为离子反应
C.实验②③均未发生氧化还原反应
D.实验①③反应制得的物质均为纯净物
答案:C
解析:实验①中铁与氯气都是单质,不是电解质,故A错误;实验①中铁与氯气反应生成氯化铁,不是离子间发生的反应,不属于离子反应,故B错误;实验②中氯化铁溶于水为物理变化,实验③中氯化铁水解生成氢氧化铁胶体,没有化合价变化,不属于氧化还原反应,故C正确;实验③得到氢氧化铁胶体,属于混合物,故D错误。
11.(2023·湖北松滋高一段考)铁有+2价和+3价两种价态,下列有关反应中不涉及铁元素价态变化的是( )
A.铁与稀硫酸反应
B.铁在氧气中燃烧,其产物溶于盐酸中可得到两种盐
C.氢氧化亚铁是白色固体,在空气中迅速变成灰绿色,最终变成红褐色
D.氢氧化铁受热分解
答案:D
解析:Fe与稀硫酸反应生成FeSO4和H2,铁元素的化合价由0价升至+2价,涉及铁元素价态变化,A不符合题意。Fe在氧气中燃烧生成Fe3O4,铁元素的化合价发生变化,B不符合题意。白色氢氧化亚铁固体在空气中迅速变成灰绿色,最终变成红褐色,发生反应:4Fe(OH)2+O2+2H2O===4Fe(OH)3,铁元素的化合价由+2价升至+3价,C不符合题意。氢氧化铁受热分解生成Fe2O3和水,反应前后铁元素的化合价均为+3价,不涉及铁元素价态变化,D符合题意。
12.(2023·安徽长丰一中高一段考)A~J都是初中化学中的常见物质,其中D、E对维持自然界生命活动至关重要,A、B为黑色固体,C是红色金属单质,H为气体,它们的相互转化关系如下图所示。
请回答下列问题:
(1)写出下列物质的化学式:B______;I______。
(2)反应①②③④中属于置换反应的是________(填序号)。
(3)写出反应④的化学方程式:__________________________________________________
_____________________________________________________________________________。
答案:(1)CuO FeSO4 (2)① (3)3CO+Fe2O32Fe+3CO2
解析:根据A~J都是初中化学中的常见物质,D、E对维持自然界生命活动至关重要,所以D、E可能是水、氧气或二氧化碳中的一种,C是红色的金属单质,所以C是铜,A、B为黑色固体,高温会生成铜和D,A在足量的E中可以燃烧,所以A是木炭,B就是氧化铜,D就是二氧化碳,木炭和氧气反应会生成二氧化碳,所以E是氧气,二氧化碳和木炭会生成一氧化碳,所以F是一氧化碳,二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,所以J是碳酸钙,一氧化碳和氧化铁会生成铁和二氧化碳,G是铁,铁和稀硫酸反应会生成硫酸亚铁和氢气,H是一种气体,所以H是氢气,I是硫酸亚铁。
13.已知Fe3O4是一种复杂的化合物,其化学式可改写为FeO·Fe2O3。对于Fe与水蒸气反应后的黑色物质,有三个学习小组提出了三种不同的猜想,以下是小组同学进行的实验猜想与探究,请你根据小组的思路与提示完成相关空白。
实验之前查阅资料得知Fe3+的盐溶液遇到KSCN溶液时,溶液变成红色,而Fe2+遇KSCN溶液无明显变化。
【猜想】甲组:黑色物质是FeO;
乙组:黑色物质是Fe3O4;
丙组:________________________________________________________________________。
【实验探究】
丙组认为一种简单定性的方法即可判断甲组的正误:取生成的黑色物质少许于烧杯中,加稀盐酸使其完全溶解,再加________溶液以检验Fe3+,观察到溶液有无出现________现象即可判断。
答案:黑色物质是FeO和Fe3O4的混合物 KSCN 红色
解析:Fe的氧化物有FeO、Fe2O3、Fe3O4,其中Fe2O3是红棕色固体,FeO、Fe3O4是黑色物质;黑色物质若为纯净物,可能为FeO,也可能为Fe3O4,若是混合物,则为FeO和Fe3O4的混合物。 Fe3+遇SCN-,溶液变为红色,所以向溶液中加入KSCN溶液,若观察到溶液无红色现象出现,即可判断无Fe3+,即原黑色物质为FeO。
21世纪教育网(www.21cnjy.com)
