2025年中考化学专题复习 课题三 碳和碳的氧化物(无答案)
文档属性
| 名称 | 2025年中考化学专题复习 课题三 碳和碳的氧化物(无答案) | 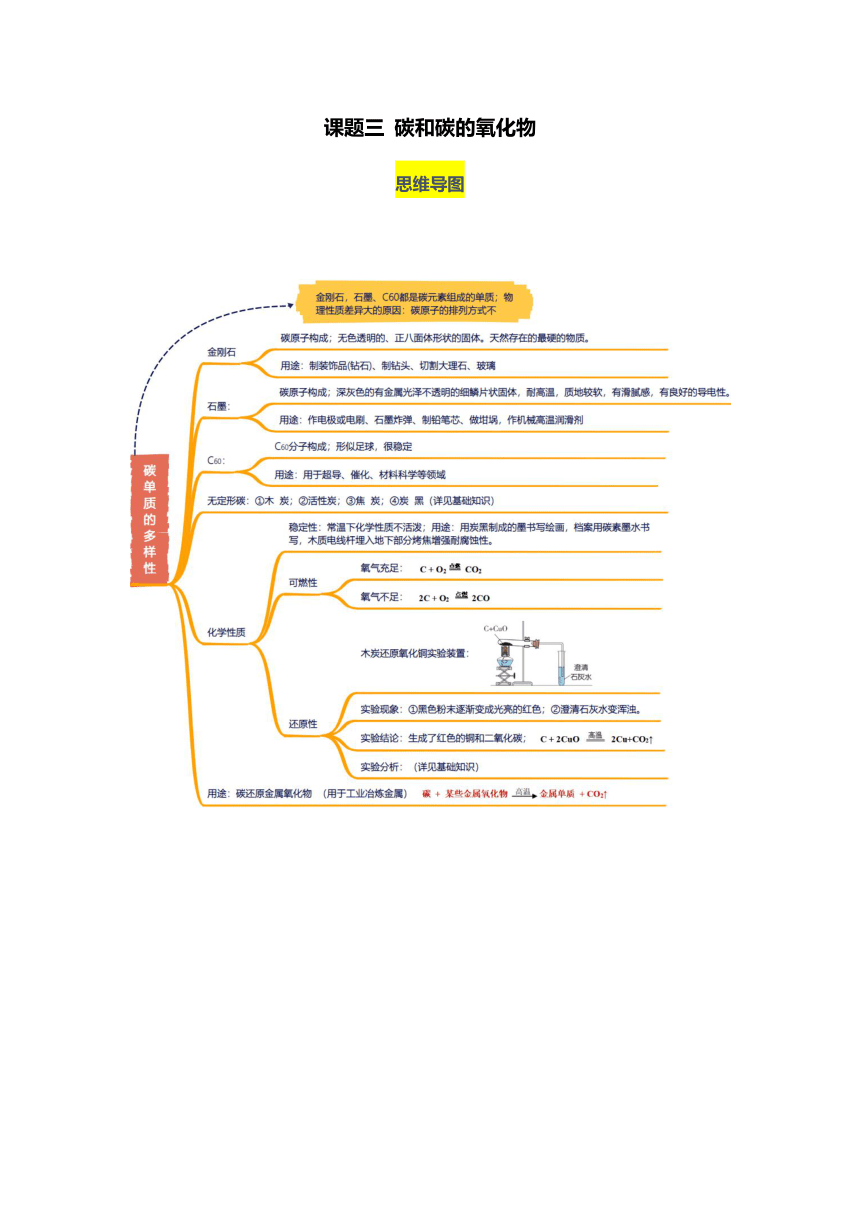 | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-13 10:09:53 | ||
图片预览




文档简介
课题三 碳和碳的氧化物
思维导图
知识清单
知识点一 碳单质的性质和用途
一、碳单质的物理性质比较
碳单质 石墨 金刚石 C60
组成、构成 由 组成 由 构成 由 组成 由 构成 由 组成 由 构成
微观结构
物理性质 色的有 光泽的固体,质地很 ,有 ,熔点 ,有良好的 色透明的、正八面体形状的固体,是 的物质 分子结构形似足球,很稳定
用途 作 或电刷、石墨炸弹、制铅笔芯、做坩埚,作机械高温润滑剂等 大:制装饰品(钻石)、制钻头、切割大理石、裁玻璃。 性好、 大:金刚石薄膜用作光学仪器涂层。 性好:用于集成电路基板散热 用于 、 、能源及医学等领域
性质差异 物理性质差异大的原因:
*C60中的60是指: 。
*同种元素组成的物质不一定是单质,可能是 。(如O2和O3混合;红磷和白磷混合等)
*同种元素组成的 才是单质。石墨在高温高压和催化剂的条件下可以转化为金刚石,二者是碳元素组成的不同 ,该转化是 变化。
二、无定形碳
1.木炭和活性炭:有 结构,具有 ,可吸附 等。
木炭:用于除去食品和工业产品里的色素,作 等。
活性炭:活性炭的吸附性比木炭强。用于防毒面具 中过滤毒气,
制糖工业中 ,用于净水器、冰箱除味剂,环保活性炭包等。
2.焦炭:用于 。
3.炭黑:制造黑色染料,油墨,油漆等,添加到橡胶里做补强剂,增强耐磨性。
(碳和炭的区别:“碳”是元素名称,并不指具体某种物质;“炭”表示由碳元素组成的具体物质)
结合常见碳单质的性质和用途,可知物质的结构决定 ,性质决定 。
三、碳单质的化学性质
碳的几种单质物理性质各异,而化学性质却相似。
1.常温下化学性质 (原因:碳原子的最外层电子数为 ,电子不易 )。
用途:用炭黑制成的墨书写绘画,档案用碳素墨水书写,木质电线杆埋入地下部分烤焦增强耐腐蚀性。
2. 性(作 )
反应物 氧气充足,碳完全燃烧 氧气不足,碳不完全燃烧
化学方程式: 化学方程式:
质量比
结论 反应物相同时,
应用 证明某物质含有碳元素(证明燃烧有二氧化碳生成): 。
3.还原性
(1)木炭还原氧化铜
木炭还原氧化铜实验装置 实验现象 实验结论
①黑色粉末逐渐变成 ; ②澄清石灰水 。 木炭与氧化铜反应,生成铜和二氧化碳; 化学方程式:
实验分析析 ①木炭粉和氧化铜粉末烘干的原因: 防止木炭与水蒸气反应生成的氢气和一氧化碳与氧化铜反应。 ②火焰加金属网罩的目的: 。 ③实验结束后,先撤出导气管,再停止加热的目的: 。 ④待试管冷却后再把试管中的粉末倒出的原因: 。 ⑤木炭配比比理论值稍微多一点,因为木炭会和试管中的氧气反应。
(2)碳还原金属氧化物(用于工业冶炼金属)碳 + 某些金属氧化物金属单质 + CO2↑如:焦炭还原氧化铁:
(3)碳与二氧化碳反应: ( 热反应)
补充:
置换反应: 与 反应生成 和 的反应。
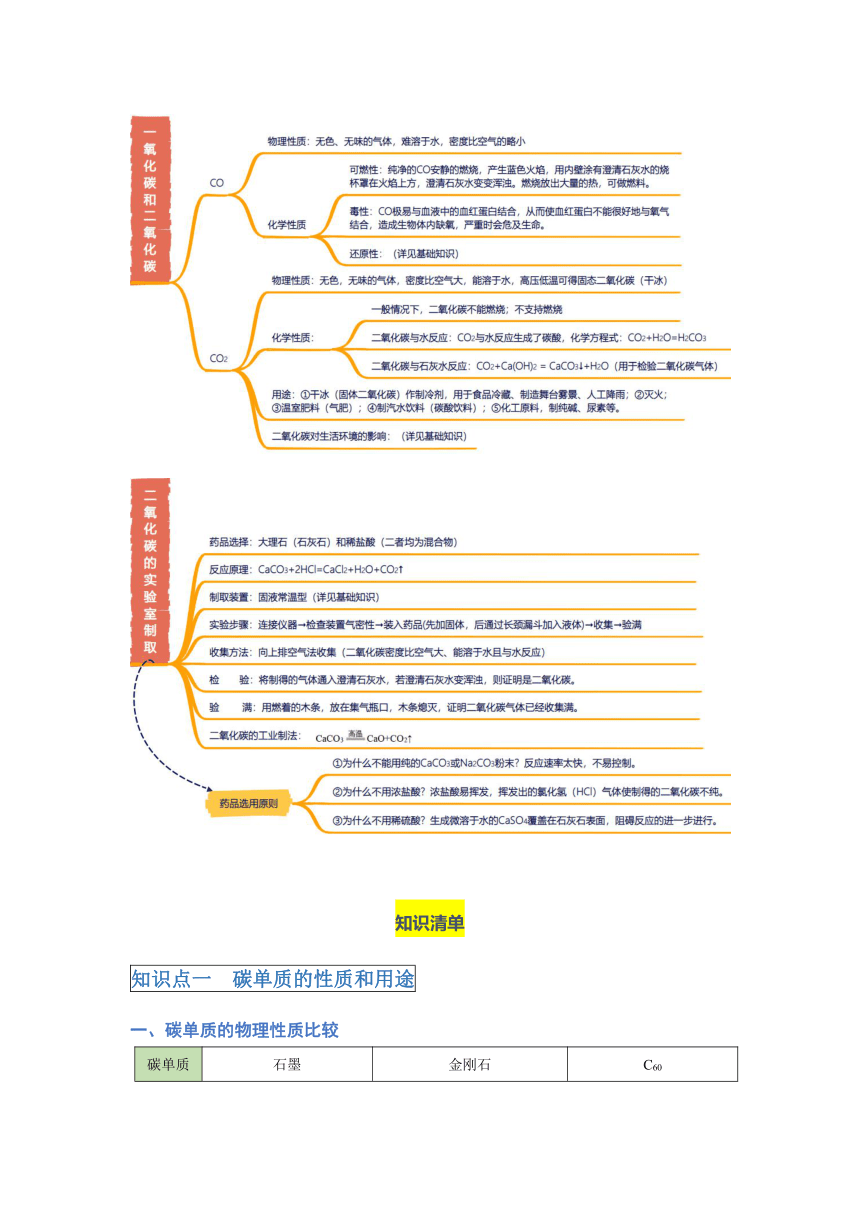
知识点二 碳的氧化物
一、二氧化碳的性质
1.物理性质: 色、 臭的 体,密度比空气 , 溶于水,高压低温下可得固态二氧化碳(也叫 )。
2.证明二氧化碳的密度大于空气、能溶于水
实验1 实验2
操作:将CO2倒入装有高、低燃着蜡烛的烧杯中。 现象: 。 分析:二氧化碳聚集在下层时,它会隔绝空气,导致下层蜡烛因缺氧而熄灭,而上层蜡烛由于二氧化碳尚未到达其位置,因此还能继续燃烧一段时间。 操作:向一个收集满二氧化碳气体的质地较软的塑料瓶中加入约1/3容积的水,立即旋紧瓶塞,振荡。 现象:软塑料瓶 。 分析:二氧化碳溶于水使瓶内气压变小,大气压使瓶子变瘪。
化学性质:二氧化碳① ;② ; 物理性质:密度比空气 。 物理性质:二氧化碳
生活小贴士:因为二氧化碳密度大于空气,且不能供给呼吸,故进入久未开启的菜窖或干涸的深井前,做 。
3.证明二氧化碳与水反应(资料:紫色石蕊试液遇酸性溶液变 )
实验 操作 ①干燥的石蕊小花上喷稀醋酸 ②干燥的石蕊小花上喷水 ③把干燥的小花放进CO2气体中 ④把用水湿润的石蕊小花放入CO2气体 ⑤取出实验④取出用吹风机烘干
现象
分析 稀醋酸能使石蕊变红 水不能使石蕊变红 二氧化碳不能 使石蕊变红 二氧化碳与水反应生成 使石蕊变红 碳酸不稳定,易分解
结论 CO2不显酸性,CO2与水反应生成了酸性物质,使紫色石蕊试液变成红色 化学方程式: 碳酸分解生成二氧 化碳和水 化学方程式:
4.证明二氧化碳与澄清石灰水反应
操作:将二氧化碳通入澄清石灰水;
现象:澄清石灰水变 ;
化学方程式: (用于 )
二、二氧化碳的用途
CO2的用途 依据的性质
①干冰(固体二氧化碳)作 ,用于食品冷藏、制造舞台雾景、 。 干冰 ( 变化)
②灭火 ①二氧化碳不能燃烧,②不支持燃烧,③密度比空气大
③ ( ),可以增大农作物的产量 CO2是 ,能促进光合作用
④制汽水饮料(碳酸饮料) CO2 ;且
⑤化工原料,制纯碱、尿素等 能与多种物质反应
三、二氧化碳对生活和环境的影响
1.二氧化碳对人体健康的影响
空气中二氧化碳的体积分数/% 对人体健康的影响
3 使人呼吸急促
10 使人丧失知觉、呼吸停止,以致死亡
2.自然界中的碳循环
产生二氧化碳: 、 等。
消耗二氧化碳:植物的 吸收二氧化碳并放出氧气,海水吸收二氧化碳。
3.温室效应
(1)温室效应加剧产生的原因:大气中 、一氧化二氮、氟氯代烃等温室气体增多;森林因为天灾和人类的乱砍滥伐,导致CO2的消耗减少,引起全球气候变暧;
(2)危害:全球气候变暖、两极冰川融化、海平面上升、土地沙漠化、农业减产等;引起暴雨、洪水等灾害,极端气候事件发生的频率和强度增加;影响自然生态系统,改变生物多样性。
低碳行动与可持续发展
减少使用 ,更多地利用 、 等清洁能源;促进节能产品和技术的进一步开发和普及,提高能源的生产效率和使用效率;大力植树造林,严禁乱砍滥伐森林;采用物理、化学等方法,捕集、利用与封存二氧化碳;等等。我国明确提出了减排目标:二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现 。
四、一氧化碳
1.物理性质: 色、 臭的 体, 溶于水,密度比空气的 。
2.产生:①碳的不完全燃烧,化学方程式: ;②含CO的燃料泄漏。
3.中毒生理过程:CO极易与血液中的血红蛋白结合,结合能力是氧气的200~300倍,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时会危及生命。
处理方法:
①万一CO中毒了,怎么急救? ______________________________。
②万一煤气泄漏,怎么处理? ______________________________。
③冬天用煤火取暖时,应该注意什么?______________________________。
④用煤炭取暖时,火炉上放一盆水,可以预防中毒吗?不能,因为 。
⑤煤气罐中掺有微量具有 ,为什么?便于 。
⑥检查煤气泄漏的时候怎么检漏? 用 检验,有气泡产生说明漏气了。
4.可燃性
(1)纯净的CO安静的燃烧,产生 色火焰,用内壁涂有澄清石灰水的烧杯罩在火焰上方,澄清石灰水变 。
(2)燃烧的化学方程式:
澄清石灰水变浑浊的化学方程式:
(3)利用可燃性作燃料。注意点燃前先检验气体的纯度( )。
煤炉不同位置反应的化学方程式:
煤炉底部:
煤炉中部:
煤炉上口:
5.还原性
装置及说明 现象及注意事项
A处的现象是:黑色粉末逐渐变 成 。 化学方程式: B处的现象是:澄清石灰水变 。 化学方程式: C处的现象是:气体燃烧,发出 。 化学方程式:
(1)澄清石灰水的目的是 。 (2)右侧酒精灯的作用是点燃尾气, 。 其它尾气处理的方法: ①用气球收集尾气(图A) ②用排水法收集尾气(图B) ③换一个长的导管伸到玻璃管下火焰处将尾气燃烧(图C) 【注意】 (1)先通一氧化碳后加热的原因是: 。 (2)实验结束后先停止加热继续通入CO至玻璃管冷却的原因是 。
CO具有还原性,用途: 。
★CO和CO2的化学性质有很大差异的原因是: 。
五、二氧化碳和一氧化碳的鉴别和除杂
1.鉴别
鉴别方法 现象及结论
通入澄清石灰水 能使澄清石灰水变浑浊的是 ,无明显现象的是
分别点燃 在空气中能燃烧的是 ,不能燃烧的是
通入紫色石蕊溶液 能使紫色石蕊溶液变红的是 ,无明显现象的是
还原金属氧化铜 通入灼热的氧化铜中,使黑色粉末变红的是 ,没有明显现象的是
2.除杂:括号外为主要物质,括号内为杂质。
CO(CO2):
CO2(CO):
CaO(CaCO3):
知识点三 二氧化碳的实验室制取
一、 二氧化碳制取的研究
1.工业制二氧化碳
煅烧石灰石: 。
(石灰石、大理石主要成分为 ;氧化钙CaO俗称 ;氢氧化钙Ca(OH)2俗称 )
2.实验室制二氧化碳:
(1)药品:块状石灰石(或大理石)和稀盐酸(均为混合物)。
(2)反应原理: 。
①为什么不能用纯的CaCO3或Na2CO3粉末? 。
②为什么不用浓盐酸? 。
③为什么不用稀硫酸? ,阻碍反应的进一步进行。
检验方法:
将制得的气体 ,则证明是二氧化碳。
验满方法:
用 ,证明二氧化碳气体已经收集满。
二、气体制取的一般思路
1.发生装置
选择依据: ;反应条件( )
固固加热型 固液常温型
高锰酸钾制氧气 大理石(石灰石)和稀盐酸制二氧化碳
试管口略 向下倾斜 适合制取 少量气体 适合制取 大量气体 长颈漏斗可随时添加液体药品,注意下端管口液封 分液漏斗可控制加入液体的速率,从而控制反应速率 注射器可控制加入液体的速率,从而控制反应速率
补充改进装置:
块状大理石和稀盐酸制二氧化碳的装置改进, 。
开始:打开弹簧夹,液体从长颈漏斗流下,淹没过石灰石,反应开始; 开始:打开弹簧夹 开始:打开弹簧夹,液体淹没固体 开始:将布袋子浸入溶液中 开始:将试管浸入液体中
停止:夹紧弹簧夹,液体由于气体压强回流回长颈漏斗,液体液面低于 隔板固液分离,反应停止 停止:关闭弹簧夹 停止:关闭弹簧夹,液体压入左侧 停止:提起布袋子离开液面 停止:提起试管离开液面
2.收集装置
选择依据: (气体相对分子质量与空气平均相对分子质量29相比判断)
排水集气法 向上排空气法 向下排空气法
适合气体溶解度小、 不与水反应的气体 适合密度比空气大、 不与空气反应的气体 适合密度比空气小、 不与空气反应的气体
注意事项:导管口出现 的气泡时开始收集; 时气体收集满 注意事项:导管 。 注意事项:导管 。
①所有气体从短管进 ②V排出的水=V气体 为 ,水面放一层 隔绝二者; 集气瓶上端若有空气,不影响收集的气体的体积数据,但是要影响收集的气体的纯度 气体进入集气瓶后出现在装置下端 气体的验满在另一侧出气口 气体进入集气瓶后出现在装置上端 气体的验满在另一侧出气口
实验室制取二氧化碳气体除杂和净化
盐酸具有挥发性,故制得的CO2 气体中可能混有少量的HCl气体,一般可用 。气体经过饱和碳酸氢钠溶液后,会有水蒸气混入,浓硫酸有吸水性,可用浓硫酸除去水蒸气,进行干燥。
思维导图
知识清单
知识点一 碳单质的性质和用途
一、碳单质的物理性质比较
碳单质 石墨 金刚石 C60
组成、构成 由 组成 由 构成 由 组成 由 构成 由 组成 由 构成
微观结构
物理性质 色的有 光泽的固体,质地很 ,有 ,熔点 ,有良好的 色透明的、正八面体形状的固体,是 的物质 分子结构形似足球,很稳定
用途 作 或电刷、石墨炸弹、制铅笔芯、做坩埚,作机械高温润滑剂等 大:制装饰品(钻石)、制钻头、切割大理石、裁玻璃。 性好、 大:金刚石薄膜用作光学仪器涂层。 性好:用于集成电路基板散热 用于 、 、能源及医学等领域
性质差异 物理性质差异大的原因:
*C60中的60是指: 。
*同种元素组成的物质不一定是单质,可能是 。(如O2和O3混合;红磷和白磷混合等)
*同种元素组成的 才是单质。石墨在高温高压和催化剂的条件下可以转化为金刚石,二者是碳元素组成的不同 ,该转化是 变化。
二、无定形碳
1.木炭和活性炭:有 结构,具有 ,可吸附 等。
木炭:用于除去食品和工业产品里的色素,作 等。
活性炭:活性炭的吸附性比木炭强。用于防毒面具 中过滤毒气,
制糖工业中 ,用于净水器、冰箱除味剂,环保活性炭包等。
2.焦炭:用于 。
3.炭黑:制造黑色染料,油墨,油漆等,添加到橡胶里做补强剂,增强耐磨性。
(碳和炭的区别:“碳”是元素名称,并不指具体某种物质;“炭”表示由碳元素组成的具体物质)
结合常见碳单质的性质和用途,可知物质的结构决定 ,性质决定 。
三、碳单质的化学性质
碳的几种单质物理性质各异,而化学性质却相似。
1.常温下化学性质 (原因:碳原子的最外层电子数为 ,电子不易 )。
用途:用炭黑制成的墨书写绘画,档案用碳素墨水书写,木质电线杆埋入地下部分烤焦增强耐腐蚀性。
2. 性(作 )
反应物 氧气充足,碳完全燃烧 氧气不足,碳不完全燃烧
化学方程式: 化学方程式:
质量比
结论 反应物相同时,
应用 证明某物质含有碳元素(证明燃烧有二氧化碳生成): 。
3.还原性
(1)木炭还原氧化铜
木炭还原氧化铜实验装置 实验现象 实验结论
①黑色粉末逐渐变成 ; ②澄清石灰水 。 木炭与氧化铜反应,生成铜和二氧化碳; 化学方程式:
实验分析析 ①木炭粉和氧化铜粉末烘干的原因: 防止木炭与水蒸气反应生成的氢气和一氧化碳与氧化铜反应。 ②火焰加金属网罩的目的: 。 ③实验结束后,先撤出导气管,再停止加热的目的: 。 ④待试管冷却后再把试管中的粉末倒出的原因: 。 ⑤木炭配比比理论值稍微多一点,因为木炭会和试管中的氧气反应。
(2)碳还原金属氧化物(用于工业冶炼金属)碳 + 某些金属氧化物金属单质 + CO2↑如:焦炭还原氧化铁:
(3)碳与二氧化碳反应: ( 热反应)
补充:
置换反应: 与 反应生成 和 的反应。
知识点二 碳的氧化物
一、二氧化碳的性质
1.物理性质: 色、 臭的 体,密度比空气 , 溶于水,高压低温下可得固态二氧化碳(也叫 )。
2.证明二氧化碳的密度大于空气、能溶于水
实验1 实验2
操作:将CO2倒入装有高、低燃着蜡烛的烧杯中。 现象: 。 分析:二氧化碳聚集在下层时,它会隔绝空气,导致下层蜡烛因缺氧而熄灭,而上层蜡烛由于二氧化碳尚未到达其位置,因此还能继续燃烧一段时间。 操作:向一个收集满二氧化碳气体的质地较软的塑料瓶中加入约1/3容积的水,立即旋紧瓶塞,振荡。 现象:软塑料瓶 。 分析:二氧化碳溶于水使瓶内气压变小,大气压使瓶子变瘪。
化学性质:二氧化碳① ;② ; 物理性质:密度比空气 。 物理性质:二氧化碳
生活小贴士:因为二氧化碳密度大于空气,且不能供给呼吸,故进入久未开启的菜窖或干涸的深井前,做 。
3.证明二氧化碳与水反应(资料:紫色石蕊试液遇酸性溶液变 )
实验 操作 ①干燥的石蕊小花上喷稀醋酸 ②干燥的石蕊小花上喷水 ③把干燥的小花放进CO2气体中 ④把用水湿润的石蕊小花放入CO2气体 ⑤取出实验④取出用吹风机烘干
现象
分析 稀醋酸能使石蕊变红 水不能使石蕊变红 二氧化碳不能 使石蕊变红 二氧化碳与水反应生成 使石蕊变红 碳酸不稳定,易分解
结论 CO2不显酸性,CO2与水反应生成了酸性物质,使紫色石蕊试液变成红色 化学方程式: 碳酸分解生成二氧 化碳和水 化学方程式:
4.证明二氧化碳与澄清石灰水反应
操作:将二氧化碳通入澄清石灰水;
现象:澄清石灰水变 ;
化学方程式: (用于 )
二、二氧化碳的用途
CO2的用途 依据的性质
①干冰(固体二氧化碳)作 ,用于食品冷藏、制造舞台雾景、 。 干冰 ( 变化)
②灭火 ①二氧化碳不能燃烧,②不支持燃烧,③密度比空气大
③ ( ),可以增大农作物的产量 CO2是 ,能促进光合作用
④制汽水饮料(碳酸饮料) CO2 ;且
⑤化工原料,制纯碱、尿素等 能与多种物质反应
三、二氧化碳对生活和环境的影响
1.二氧化碳对人体健康的影响
空气中二氧化碳的体积分数/% 对人体健康的影响
3 使人呼吸急促
10 使人丧失知觉、呼吸停止,以致死亡
2.自然界中的碳循环
产生二氧化碳: 、 等。
消耗二氧化碳:植物的 吸收二氧化碳并放出氧气,海水吸收二氧化碳。
3.温室效应
(1)温室效应加剧产生的原因:大气中 、一氧化二氮、氟氯代烃等温室气体增多;森林因为天灾和人类的乱砍滥伐,导致CO2的消耗减少,引起全球气候变暧;
(2)危害:全球气候变暖、两极冰川融化、海平面上升、土地沙漠化、农业减产等;引起暴雨、洪水等灾害,极端气候事件发生的频率和强度增加;影响自然生态系统,改变生物多样性。
低碳行动与可持续发展
减少使用 ,更多地利用 、 等清洁能源;促进节能产品和技术的进一步开发和普及,提高能源的生产效率和使用效率;大力植树造林,严禁乱砍滥伐森林;采用物理、化学等方法,捕集、利用与封存二氧化碳;等等。我国明确提出了减排目标:二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现 。
四、一氧化碳
1.物理性质: 色、 臭的 体, 溶于水,密度比空气的 。
2.产生:①碳的不完全燃烧,化学方程式: ;②含CO的燃料泄漏。
3.中毒生理过程:CO极易与血液中的血红蛋白结合,结合能力是氧气的200~300倍,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时会危及生命。
处理方法:
①万一CO中毒了,怎么急救? ______________________________。
②万一煤气泄漏,怎么处理? ______________________________。
③冬天用煤火取暖时,应该注意什么?______________________________。
④用煤炭取暖时,火炉上放一盆水,可以预防中毒吗?不能,因为 。
⑤煤气罐中掺有微量具有 ,为什么?便于 。
⑥检查煤气泄漏的时候怎么检漏? 用 检验,有气泡产生说明漏气了。
4.可燃性
(1)纯净的CO安静的燃烧,产生 色火焰,用内壁涂有澄清石灰水的烧杯罩在火焰上方,澄清石灰水变 。
(2)燃烧的化学方程式:
澄清石灰水变浑浊的化学方程式:
(3)利用可燃性作燃料。注意点燃前先检验气体的纯度( )。
煤炉不同位置反应的化学方程式:
煤炉底部:
煤炉中部:
煤炉上口:
5.还原性
装置及说明 现象及注意事项
A处的现象是:黑色粉末逐渐变 成 。 化学方程式: B处的现象是:澄清石灰水变 。 化学方程式: C处的现象是:气体燃烧,发出 。 化学方程式:
(1)澄清石灰水的目的是 。 (2)右侧酒精灯的作用是点燃尾气, 。 其它尾气处理的方法: ①用气球收集尾气(图A) ②用排水法收集尾气(图B) ③换一个长的导管伸到玻璃管下火焰处将尾气燃烧(图C) 【注意】 (1)先通一氧化碳后加热的原因是: 。 (2)实验结束后先停止加热继续通入CO至玻璃管冷却的原因是 。
CO具有还原性,用途: 。
★CO和CO2的化学性质有很大差异的原因是: 。
五、二氧化碳和一氧化碳的鉴别和除杂
1.鉴别
鉴别方法 现象及结论
通入澄清石灰水 能使澄清石灰水变浑浊的是 ,无明显现象的是
分别点燃 在空气中能燃烧的是 ,不能燃烧的是
通入紫色石蕊溶液 能使紫色石蕊溶液变红的是 ,无明显现象的是
还原金属氧化铜 通入灼热的氧化铜中,使黑色粉末变红的是 ,没有明显现象的是
2.除杂:括号外为主要物质,括号内为杂质。
CO(CO2):
CO2(CO):
CaO(CaCO3):
知识点三 二氧化碳的实验室制取
一、 二氧化碳制取的研究
1.工业制二氧化碳
煅烧石灰石: 。
(石灰石、大理石主要成分为 ;氧化钙CaO俗称 ;氢氧化钙Ca(OH)2俗称 )
2.实验室制二氧化碳:
(1)药品:块状石灰石(或大理石)和稀盐酸(均为混合物)。
(2)反应原理: 。
①为什么不能用纯的CaCO3或Na2CO3粉末? 。
②为什么不用浓盐酸? 。
③为什么不用稀硫酸? ,阻碍反应的进一步进行。
检验方法:
将制得的气体 ,则证明是二氧化碳。
验满方法:
用 ,证明二氧化碳气体已经收集满。
二、气体制取的一般思路
1.发生装置
选择依据: ;反应条件( )
固固加热型 固液常温型
高锰酸钾制氧气 大理石(石灰石)和稀盐酸制二氧化碳
试管口略 向下倾斜 适合制取 少量气体 适合制取 大量气体 长颈漏斗可随时添加液体药品,注意下端管口液封 分液漏斗可控制加入液体的速率,从而控制反应速率 注射器可控制加入液体的速率,从而控制反应速率
补充改进装置:
块状大理石和稀盐酸制二氧化碳的装置改进, 。
开始:打开弹簧夹,液体从长颈漏斗流下,淹没过石灰石,反应开始; 开始:打开弹簧夹 开始:打开弹簧夹,液体淹没固体 开始:将布袋子浸入溶液中 开始:将试管浸入液体中
停止:夹紧弹簧夹,液体由于气体压强回流回长颈漏斗,液体液面低于 隔板固液分离,反应停止 停止:关闭弹簧夹 停止:关闭弹簧夹,液体压入左侧 停止:提起布袋子离开液面 停止:提起试管离开液面
2.收集装置
选择依据: (气体相对分子质量与空气平均相对分子质量29相比判断)
排水集气法 向上排空气法 向下排空气法
适合气体溶解度小、 不与水反应的气体 适合密度比空气大、 不与空气反应的气体 适合密度比空气小、 不与空气反应的气体
注意事项:导管口出现 的气泡时开始收集; 时气体收集满 注意事项:导管 。 注意事项:导管 。
①所有气体从短管进 ②V排出的水=V气体 为 ,水面放一层 隔绝二者; 集气瓶上端若有空气,不影响收集的气体的体积数据,但是要影响收集的气体的纯度 气体进入集气瓶后出现在装置下端 气体的验满在另一侧出气口 气体进入集气瓶后出现在装置上端 气体的验满在另一侧出气口
实验室制取二氧化碳气体除杂和净化
盐酸具有挥发性,故制得的CO2 气体中可能混有少量的HCl气体,一般可用 。气体经过饱和碳酸氢钠溶液后,会有水蒸气混入,浓硫酸有吸水性,可用浓硫酸除去水蒸气,进行干燥。
同课章节目录
