3.1.2 铁及其化合物 课件(共19张PPT)
文档属性
| 名称 | 3.1.2 铁及其化合物 课件(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-13 15:15:58 | ||
图片预览




文档简介
(共19张PPT)
高中化学人教版必修第一册
第三章 第一节 第二课时
《铁及其化合物》
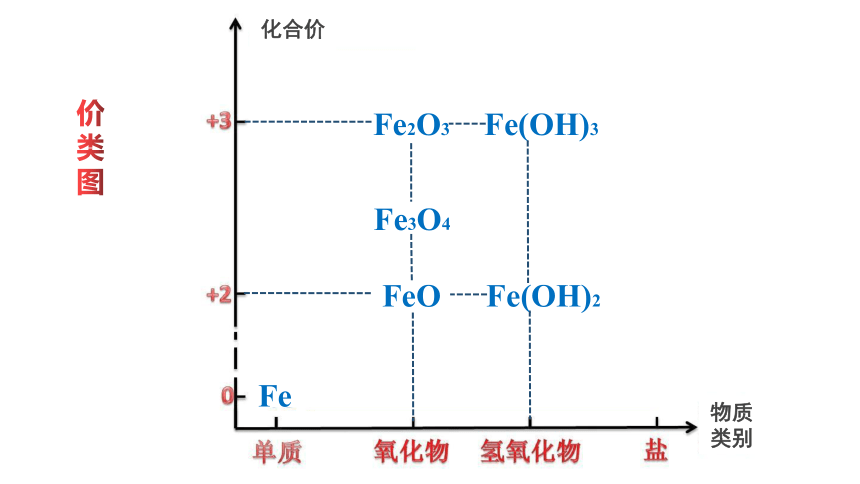
物质
类别
化合价
价
类
图
Fe
Fe2O3
FeO
Fe3O4
Fe(OH)2
Fe(OH)3
一、铁的氧化物
1.物理性质
化学式 FeO Fe2O3 Fe3O4
俗名 \
颜色状态
溶解性 黑色粉末
黑色晶体
红棕色粉末
磁性氧化铁
铁红
均不溶于水
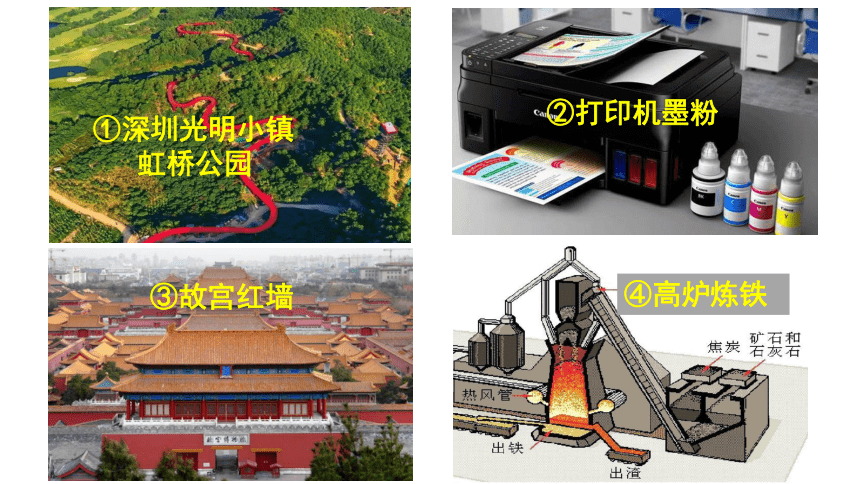
③故宫红墙
①深圳光明小镇
虹桥公园
②打印机墨粉
④高炉炼铁
一、铁的氧化物
2.化学性质
练习1:分别写出以赤铁矿、磁铁矿为原料的高炉炼铁化学方程式。
Fe2O3 + 3CO = 2 Fe+3CO2
高温
Fe3O4 + 4CO = 3 Fe+4CO2
高温
练习2:写出工业上用稀盐酸除去铁表面的铁锈的离子方程式(提示:铁锈主要成分为氧化铁 )
FeO+2H+= Fe2++H2O
Fe2O3+6H+ = 2Fe3++3H2O
二、铁的氢氧化物
1. Fe(OH)3
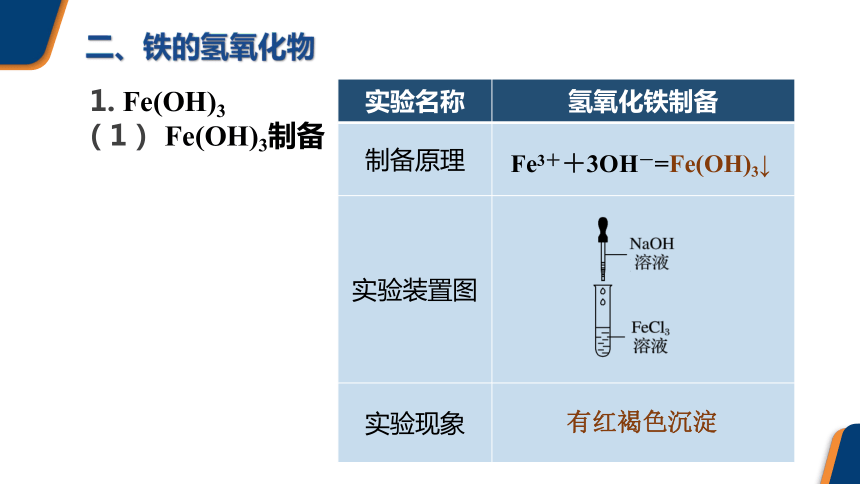
(1) Fe(OH)3制备
实验名称 氢氧化铁制备
制备原理
实验装置图
实验现象
Fe3++3OH-=Fe(OH)3↓
有红褐色沉淀
化学式 Fe(OH)3
物理性质
化学性质 化合价角度
物质类别角度
热稳定性
(2) Fe(OH)3性质
Fe(OH)3+3H+=Fe3++3H2O
2Fe(OH)3 = Fe2O3+3H2O
红褐色沉淀
——
二、铁的氢氧化物
2. Fe(OH)2
(1) Fe(OH)2制备
实验名称 氢氧化铁制备
制备原理
实验 装置图
实验现象
Fe2++2OH-=Fe(OH)2↓
白色沉淀
灰绿色
红褐色
4Fe(OH)2+O2+2H2O=4Fe(OH)3
化学式 Fe(OH)2
物理性质
化学性质 化合价角度
物质类别角度
热稳定性
(2) Fe(OH)2性质
Fe(OH)2+2H+=Fe2++2H2O
白色沉淀
4Fe(OH)2+O2+2H2O=4Fe(OH)3
——
(3) Fe(OH)2制备实验改进
4Fe(OH)2+O2+2H2O=4Fe(OH)3
加热
煮沸
现配现用
胶头滴管伸入液面以下
不溶于水
密度比水小
实验名称 改进实验
装置图
药品 NaOH溶液、铁屑、稀H2SO4
思考
该实验能较长时间保持白色沉淀,其理由是?
(3) Fe(OH)2制备实验改进
价
类
图
Fe
Fe2O3
FeO
Fe3O4
Fe(OH)2
Fe(OH)3
氧
化
剂
△
氧
化
剂
Fe2+
Fe3+
酸
酸
酸
酸
还原剂
碱
碱
物质
类别
化合价
三、课堂小结
1.下列有关铁的化合物的说法不正确的是( )
A. FeO不稳定,在空气中加热生成Fe2O3
B. FeO、Fe2O3均为碱性氧化物,均可与盐酸反应
C. Fe(OH)3可通过化合反应得到,Fe(OH)2则不能
D. Fe3O4为磁性氧化铁,其中铁的化合价为+2和+3
2.有关铁的氧化物的说法中,不正确的是( )
A. 赤铁矿主要成分是Fe2O3,Fe2O3俗称铁红,常用作红
色油漆和涂料
B. 磁铁矿的主要成分是Fe3O4,打印机的墨粉中添加有
Fe3O4
C. 烤蓝是一种古老的金属处理工艺,即在金属表面形成
一层致密并且拥有一定厚度的氧化层,该氧化层的主
要成分为Fe2O3
D. 高炉炼铁是用还原的方法把铁从铁矿石中提炼出来
3.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是 ( )
A. Fe(OH)3;Fe2O3
Fe(OH)2;Fe2O3
Fe(OH)2;Fe(OH)3、Fe3O4
Fe2O3;Fe(OH)3
4.下列化学方程式或离子方程式错误的是( )
A. 4Fe(OH)2+O2+2H2O=4Fe(OH)3
B. FeO+2H+=Fe3++H2O
C. 2Fe(OH)3=Fe2O3+3H2O
D. Fe3++3OH-=Fe(OH)3↓
5.有关铁的化合物的说法中,错误的是 ( )
A. Fe(OH)2是一种灰绿色沉淀,不稳定,在空
气中易被氧化转变为红褐色
B. 由图示操作可制取Fe(OH)2
C. Fe3O4、Fe(OH)3都可以由化合反应制得
D. Fe(OH)3胶体呈红褐色、透明,能发生丁
达尔效应
参考答案
1. A
2. C
3. B
4. B
5. A
谢 谢
高中化学人教版必修第一册
第三章 第一节 第二课时
《铁及其化合物》
物质
类别
化合价
价
类
图
Fe
Fe2O3
FeO
Fe3O4
Fe(OH)2
Fe(OH)3
一、铁的氧化物
1.物理性质
化学式 FeO Fe2O3 Fe3O4
俗名 \
颜色状态
溶解性 黑色粉末
黑色晶体
红棕色粉末
磁性氧化铁
铁红
均不溶于水
③故宫红墙
①深圳光明小镇
虹桥公园
②打印机墨粉
④高炉炼铁
一、铁的氧化物
2.化学性质
练习1:分别写出以赤铁矿、磁铁矿为原料的高炉炼铁化学方程式。
Fe2O3 + 3CO = 2 Fe+3CO2
高温
Fe3O4 + 4CO = 3 Fe+4CO2
高温
练习2:写出工业上用稀盐酸除去铁表面的铁锈的离子方程式(提示:铁锈主要成分为氧化铁 )
FeO+2H+= Fe2++H2O
Fe2O3+6H+ = 2Fe3++3H2O
二、铁的氢氧化物
1. Fe(OH)3
(1) Fe(OH)3制备
实验名称 氢氧化铁制备
制备原理
实验装置图
实验现象
Fe3++3OH-=Fe(OH)3↓
有红褐色沉淀
化学式 Fe(OH)3
物理性质
化学性质 化合价角度
物质类别角度
热稳定性
(2) Fe(OH)3性质
Fe(OH)3+3H+=Fe3++3H2O
2Fe(OH)3 = Fe2O3+3H2O
红褐色沉淀
——
二、铁的氢氧化物
2. Fe(OH)2
(1) Fe(OH)2制备
实验名称 氢氧化铁制备
制备原理
实验 装置图
实验现象
Fe2++2OH-=Fe(OH)2↓
白色沉淀
灰绿色
红褐色
4Fe(OH)2+O2+2H2O=4Fe(OH)3
化学式 Fe(OH)2
物理性质
化学性质 化合价角度
物质类别角度
热稳定性
(2) Fe(OH)2性质
Fe(OH)2+2H+=Fe2++2H2O
白色沉淀
4Fe(OH)2+O2+2H2O=4Fe(OH)3
——
(3) Fe(OH)2制备实验改进
4Fe(OH)2+O2+2H2O=4Fe(OH)3
加热
煮沸
现配现用
胶头滴管伸入液面以下
不溶于水
密度比水小
实验名称 改进实验
装置图
药品 NaOH溶液、铁屑、稀H2SO4
思考
该实验能较长时间保持白色沉淀,其理由是?
(3) Fe(OH)2制备实验改进
价
类
图
Fe
Fe2O3
FeO
Fe3O4
Fe(OH)2
Fe(OH)3
氧
化
剂
△
氧
化
剂
Fe2+
Fe3+
酸
酸
酸
酸
还原剂
碱
碱
物质
类别
化合价
三、课堂小结
1.下列有关铁的化合物的说法不正确的是( )
A. FeO不稳定,在空气中加热生成Fe2O3
B. FeO、Fe2O3均为碱性氧化物,均可与盐酸反应
C. Fe(OH)3可通过化合反应得到,Fe(OH)2则不能
D. Fe3O4为磁性氧化铁,其中铁的化合价为+2和+3
2.有关铁的氧化物的说法中,不正确的是( )
A. 赤铁矿主要成分是Fe2O3,Fe2O3俗称铁红,常用作红
色油漆和涂料
B. 磁铁矿的主要成分是Fe3O4,打印机的墨粉中添加有
Fe3O4
C. 烤蓝是一种古老的金属处理工艺,即在金属表面形成
一层致密并且拥有一定厚度的氧化层,该氧化层的主
要成分为Fe2O3
D. 高炉炼铁是用还原的方法把铁从铁矿石中提炼出来
3.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是 ( )
A. Fe(OH)3;Fe2O3
Fe(OH)2;Fe2O3
Fe(OH)2;Fe(OH)3、Fe3O4
Fe2O3;Fe(OH)3
4.下列化学方程式或离子方程式错误的是( )
A. 4Fe(OH)2+O2+2H2O=4Fe(OH)3
B. FeO+2H+=Fe3++H2O
C. 2Fe(OH)3=Fe2O3+3H2O
D. Fe3++3OH-=Fe(OH)3↓
5.有关铁的化合物的说法中,错误的是 ( )
A. Fe(OH)2是一种灰绿色沉淀,不稳定,在空
气中易被氧化转变为红褐色
B. 由图示操作可制取Fe(OH)2
C. Fe3O4、Fe(OH)3都可以由化合反应制得
D. Fe(OH)3胶体呈红褐色、透明,能发生丁
达尔效应
参考答案
1. A
2. C
3. B
4. B
5. A
谢 谢
