人教版高中化学选择性必修1专题突破(八)水溶液中离子平衡图像学案
文档属性
| 名称 | 人教版高中化学选择性必修1专题突破(八)水溶液中离子平衡图像学案 |  | |
| 格式 | docx | ||
| 文件大小 | 704.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-13 14:24:45 | ||
图片预览




文档简介
一、滴定曲线
1.强碱滴定一元弱酸——抓“五点”
室温下,向20 mL 0.1 mol·L-1 HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,溶液pH的变化如图所示
关键点分析 溶液中溶质成分及粒子浓度大小关系
抓反应的“起始”点,即A点,判断酸、碱的相对强弱 溶质为HA,0.1 mol·L-1 HA溶液的pH>1,故HA为弱酸 粒子浓度大小关系:c(HA)>c(H+)>c(A-)>c(OH-)
抓反应的“一半”点,即B点,判断是哪种溶质的等量混合 溶质是等物质的量的HA和NaA,且pH<7 粒子浓度大小关系:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
抓溶液的“中性”点,即C点,判断溶液中溶质的成分及哪种物质过量或不足 溶质是NaA和少量的HA,pH=7 粒子浓度大小关系:c(Na+)=c(A-)>c(H+)=c(OH-)
抓“恰好”反应点,即D点,判断生成的溶质成分及溶液的酸碱性 溶质是NaA,pH>7 粒子浓度大小关系:c(Na+)>c(A-)>c(OH-)>c(H+)
抓反应的“过量”点,即E点,判断溶液中的溶质,判断哪种物质过量 溶质是等物质的量的NaA和NaOH,pH>7 粒子浓度大小关系:c(Na+)>c(OH-)>c(A-)>c(H+)
针对练1.25 ℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液。滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法中,错误的是( )
A.CH3COOH溶液的浓度为0.1 mol·L-1
B.图中点①到点③所示溶液中,水的电离程度先增大后减小
C.点④所示溶液中存在:c(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
D.滴定过程中会存在:c(Na+)>c(CH3COO-)=c(OH-)>c(H+)
答案:C
解析:图像分析氢氧化钠溶液的浓度为0.1 mol/L,②点时氢氧化钠溶液恰好被中和消耗醋酸溶液20 mL,则醋酸浓度为0.1 mol/L,不选A;图中①点到③点所示溶液中随着醋酸逐渐滴入,氢氧化钠不断被消耗,水的电离被抑制程度减小,即水的电离程度增大,恰好反应后继续滴加醋酸,对水的电离起到抑制作用,图中①到③所示的溶液中水的电离程度先增大后减小,不选B;④点所示溶液是等物质的量的醋酸和醋酸钠溶液,c(CH3COOH)+c(CH3COO-)=2c(Na+),电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),选C;滴定过程中的某点,醋酸钠和氢氧化钠混合溶液中会有c(Na+)>c(CH3COO-)=c(OH-)>c(H+),不选D。
针对练2. 25 ℃时,向10 mL 0.1 mol·L-1CH2ClCOONa溶液中加入0.1 mol·L-1的盐酸,溶液pH随加入盐酸的体积变化情况如图所示。下列说法不正确的是( )
A.①所示溶液中:c(OH-)=c(H+)+c(CH2ClCOOH)
B.②所示溶液中:c(CH2ClCOO-)+c(Cl-)=c(Na+)
C.③所示溶液中:c(Na+)>c(CH2ClCOOH)>c(CH2ClCOO-)>c(H+)>c(OH-)
D.④所示溶液中:c(Na+)=c(CH2ClCOO-)+c(CH2ClCOOH)
答案:C
解析:点①所示溶液中:c(OH-)=c(H+)+c(CH2ClCOOH)是质子守恒,故A正确;由于点②的pH=7,即溶液中呈中性,根据电荷守恒可得c(CH2ClCOO-)+c(Cl-)=c(Na+),故B正确;依据图像可知,点③溶液中为等物质的量的CH2ClCOONa、CH2ClCOOH、NaCl,且溶液显酸性,说明CH2ClCOOH的电离程度大于CH2ClCOO-的水解程度,所以离子浓度关系为c(Na+)>c(CH2ClCOO-)>c(CH2ClCOOH)>c(H+)>c(OH-),故C错误;根据元素守恒可知点④所示溶液中:c(Na+)=c(CH2ClCOO-)+c(CH2ClCOOH),故D正确。
2.多组反应图像
(1)强碱滴定一元强酸、一元弱酸
氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线
①曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低 ②突跃点变化范围不同:强碱与强酸反应的突跃点变化范围大于强碱与弱酸反应 ③室温下pH=7不一定是终点:强碱与强酸反应时,终点是pH=7;强碱与弱酸反应时,终点不是pH=7而是pH>7
(2)强酸滴定一元强碱、一元弱碱
盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线
续表
盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线
①曲线起点不同:强酸滴定强碱、弱碱的曲线,强碱起点高 ②突跃点变化范围不同:强酸与强碱反应的突跃点变化范围大于强酸与弱碱反应 ③室温下pH=7不一定是终点:强酸与强碱反应时,终点是pH=7;强酸与弱碱反应时,终点不是pH=7而是pH<7
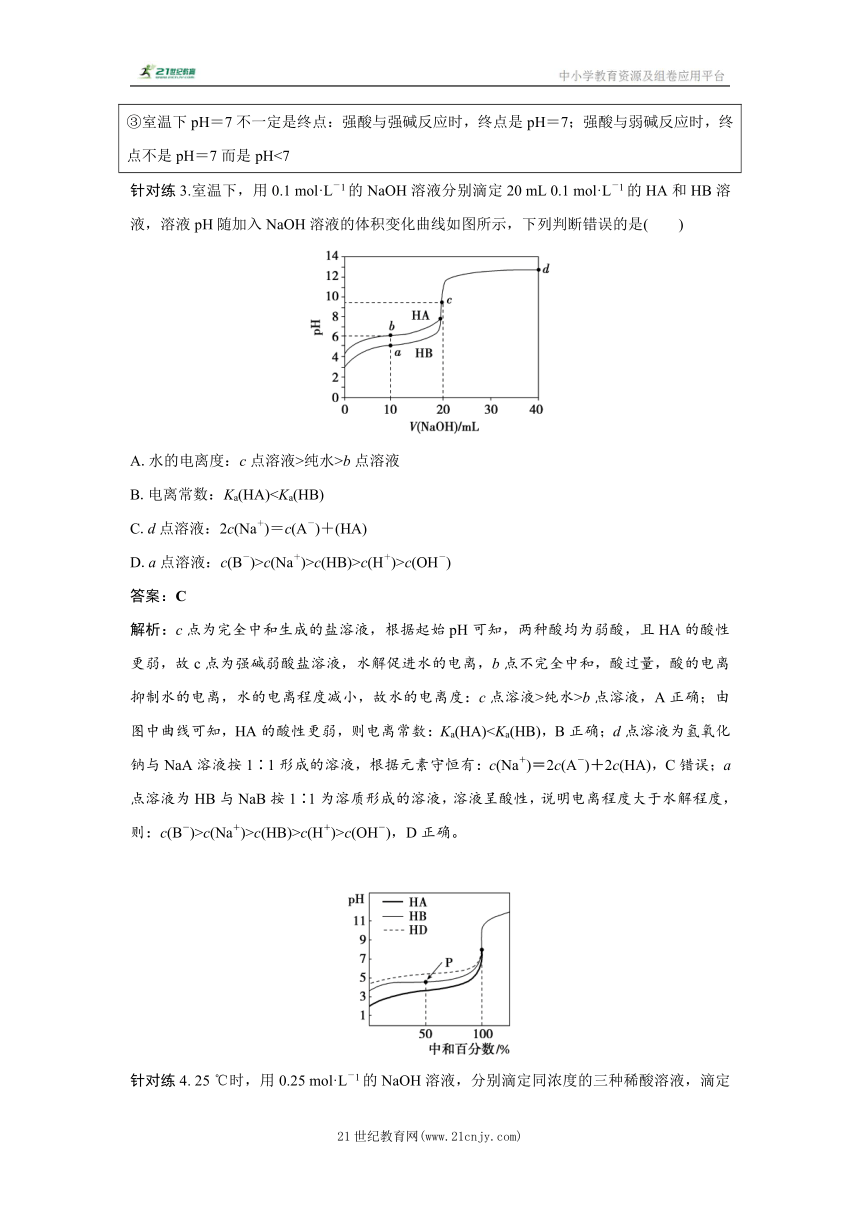
针对练3.室温下,用0.1 mol·L-1的NaOH溶液分别滴定20 mL 0.1 mol·L-1的HA和HB溶液,溶液pH随加入NaOH溶液的体积变化曲线如图所示,下列判断错误的是( )
A.水的电离度:c点溶液>纯水>b点溶液
B.电离常数:Ka(HA)C.d点溶液:2c(Na+)=c(A-)+(HA)
D.a点溶液:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
答案:C
解析:c点为完全中和生成的盐溶液,根据起始pH可知,两种酸均为弱酸,且HA的酸性更弱,故c点为强碱弱酸盐溶液,水解促进水的电离,b点不完全中和,酸过量,酸的电离抑制水的电离,水的电离程度减小,故水的电离度:c点溶液>纯水>b点溶液,A正确;由图中曲线可知,HA的酸性更弱,则电离常数:Ka(HA)c(Na+)>c(HB)>c(H+)>c(OH-),D正确。
针对练4. 25 ℃时,用0.25 mol·L-1的NaOH溶液,分别滴定同浓度的三种稀酸溶液,滴定的曲线如图所示,下列判断不正确的是( )
A.同浓度的稀酸中:c(A-)>c(B-)>c(D-)
B.滴定至P点时,溶液中:c(B-)>c(HB)
C.pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
答案:D
3.一元强碱滴定多元弱酸曲线
向20 mL 0.1 mol/L H2A溶液中滴加0.1 mol/L NaOH溶液
①发生的反应有 NaOH+H2A===NaHA+H2O NaOH+NaHA===Na2A+H2O 2NaOH+H2A===Na2A+2H2O ②根据反应的规律可知:Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- ③判断NaHA酸碱性的方法:V(NaOH)=20 mL时,溶质为NaHA,此时由纵坐标可得出c(HA-)>c(A2-)>c(H2A),可知NaHA显酸性
针对练5.如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液 , 根据图示判断,下列说法正确的是( )
A.H2A在水中的电离方程式是:H2A===H++HA-;HA-H++A2-
B.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
D.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
答案:B
解析:据图可知,当V(NaOH)=20 mL时,发生的反应为NaOH+H2A===NaHA+H2O,溶质主要为NaHA,此时溶液中同时存在HA-、A2-和H2A,说明H2A是一种二元弱酸,则H2A在水中的电离方程式为H2AH++HA-、HA-H++A2-,故A错误;当V(NaOH)=20 mL时,发生的反应为NaOH+H2A===NaHA+H2O,溶质主要为NaHA,据图可知,此时溶液中c(A2-)>c(H2A),说明HA-的电离程度大于水解程度,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正确;当V(NaOH)=30 mL时,发生的反应为NaOH+H2A===NaHA+H2O、NaHA+NaOH===Na2A+H2O,溶液为等物质的量浓度的NaHA和Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),根据元素守恒得:3c(HA-)+3c(A2-)+3c(H2A)=2c(Na+),联立两式得:2c(H+)+c(HA-)+3c(H2A)=c(A2-)+2c(OH-),故C错误;由图示关系可知,等体积等浓度的NaOH溶液与H2A溶液混合后得到NaHA溶液,此时溶液中的c(A2-)>c(H2A),说明HA-的电离程度大于水解程度,溶液显酸性,水的电离受到抑制,所以等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小,故D错误;答案选B。
针对练6.常温下,向10 mL某浓度的H2SO3溶液中滴加0.2 mol·L-1NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )
A.曲线Ⅱ代表H2SO3的浓度
B.V(NaOH)=10 ml时,溶液温度最高,c(H2SO3)=0.1 mol·L-1
C.水的电离程度大小:a点<b点<c点
D.若c点pH=6,则K2(H2SO3)=10-8
答案:C
二、平衡常数(Kw、Ksp)曲线
1.双曲线型
不同温度下水溶液中c(H+)与c(OH-)的变化曲线 常温下,CaSO4在水中的沉淀溶解平衡曲线[Ksp=9×10-6]
(1)A、C、B三点均为中性,温度依次升高,Kw依次增大 (2)D点为酸性溶液,E点为碱性溶液,T2温度时Kw=1×10-14 (3)AB直线的左上方均为碱性溶液,任意一点均有c(H+)Ksp,将会有沉淀生成 (3)d点在曲线的下方,Q针对练7.某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.含有大量SO的溶液中肯定不存在Ag+
B.该温度下,Ag2SO4的溶度积常数(Ksp)的数量级是10-3
C.可以通过加入硫酸银固体使a点移动到b点
D.该温度下,0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合,不会生成沉淀
答案:D
解析:Ag2SO4溶液中存在沉淀溶解平衡,Ag+、SO共同存在于同一平衡体系中,A错误;图中b点处于沉淀溶解平衡曲线上,据此可得该温度下,Ag2SO4的溶度积常数Ksp=c2(Ag+)·c(SO)=(2×10-2)2×5×10-2=2×10-5,故Ksp的数量级为10-5,B错误;a点是Ag2SO4的不饱和溶液,加入Ag2SO4固体能继续溶解,得到该温度下的饱和溶液,c(Ag+)、c(SO)均增大,故不能使a点移动到b点,C错误;该温度下,0.02 mol/L AgNO3溶液和0.2 mol/L Na2SO4溶液等体积混合后,离子积Q=c2(Ag+)·c(SO)=(0.01)2×0.1=1×10-5<Ksp=2×10-5,故不能生成沉淀,D正确。
针对练8.在t ℃时,AgBr的沉淀溶解平衡曲线如图所示,又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)的平衡常数K≈816
答案:B
解析:根据题给图中c点的c(Ag+)和c(Br-)可得该温度下AgBr的Ksp为4.9×10-13,A正确;在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,AgBr的溶解平衡逆向移动,c(Ag+)减小,故B错误;在a点时Q针对练9.AlPO4的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法正确的是( )
A.图像中四个点的Ksp:a=b>c>d
B.AlPO4在b点对应的溶解度大于c点
C.AlPO4(s)Al3+(aq)+PO(aq) ΔH<0
D.升高温度可使d点移动到b点
答案:B
解析:由图像可知,温度越高溶度积常数越大,则图像中四个点的Ksp:a=c=d<b,A错误;b点温度高,溶解度大,AlPO4在b点对应的溶解度大于c点,B正确;根据图像可知,温度升高溶度积常数增大,则AlPO4(s)Al3+(aq)+PO(aq) ΔH>0,C错误;升高温度,阴阳离子浓度均增大,不可能使d点移动到b点,D错误。
2.直线型(pM-pR曲线)
pM为阳离子浓度的负对数,pR为阴离子浓度的负对数
(1)直线AB上的点对应的溶液中:c(M2+)=c(R2-)
(2)溶度积:CaSO4>CaCO3>MnCO3;
(3)X点对于CaCO3来说要析出沉淀,对于CaSO4来说是不饱和溶液,能继续溶解CaSO4;
(4)Y点:c(SO)>c(Ca2+),二者浓度的乘积等于10-5;Z点:c(CO)针对练10.(2021·全国乙卷)HA是一元弱酸,难溶盐MA的饱和溶液中c2(M+)随c(H+)而变化,M+不发生水解。实验发现,298 K时c2(M+)-c(H+)为线性关系,如下图中实线所示。
下列叙述错误的是( )
A.溶液pH=4时,c(M+)<3.0×10-4mol·L-1
B.MA的溶度积Ksp(MA)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4
答案:C
解析:由图可知pH=4,即c(H+)=10×10-5mol/L时,c2(M+)=7.5×10-8mol2/L2,c(M+)=mol/L=×10-4mol/L<3.0×10-4mol/L,A正确;由图可知,c(H+)=0时,可看作溶液中有较大浓度的OH-,此时A-的水解极大地被抑制,溶液中c(M+)=c(A-),则Ksp(MA)=c(M+)×c(A-)=c2(M+)=5.0×10-8,B正确;设调pH所用的酸为HnX,则结合电荷守恒可知c(M+)+c(H+)=c(A-)+c(OH-)+nc(Xn-),题给等式右边缺阴离子部分nc(Xn-),C错误;Ka(HA)=,当c(A-)=c(HA)时,由元素守恒知c(A-)+c(HA)=c(M+),则c(A-)=,Ksp(MA)=c(M+)×c(A-)==5.0×10-8,则c2(M+)=10×10-8,对应图得此时溶液中c(H+)=2.0×10-4mol·L-1,Ka(HA)==c(H+)≈2.0×10-4,D正确;故选C。
针对练11.25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与lg X的变化关系如图所示。已知:lg X=lg或lg ,下列叙述正确的是( )
A.曲线m表示pH与lg的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO)+2c(CO)
C.Ka1(H2CO3)的数量级为10-6
D.滴加过程中,保持不变
答案:D
解析:对图像进行以下分析:
当溶液显中性时,根据电荷守恒c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)+c(Cl-),c(H+)=c(OH-),则有c(Na+)>c(HCO)+2c(CO),B项错误。根据图像分析知Ka1(H2CO3)=10-6.4,数量级为10-7,C项错误。=×=Ka1(H2CO3)·Ka2(H2CO3),温度不变,Ka1(H2CO3)、Ka2(H2CO3)不变,故滴加过程中,保持不变,D项正确。
三、正态分布系数图及分析
一元弱酸(以CH3COOH为例) 二元酸(以草酸H2C2O4为例)
注:pKa为电离常数的负对数
δ0为CH3COOH分布分数,δ1为CH3COO-分布分数 δ0为H2C2O4分布分数、δ1为HC2O分布分数、δ2为C2O分布分数
随着pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。根据分布分数可以书写一定pH时所发生反应的离子方程式
同一pH条件下可以存在多种溶质微粒。根据在一定pH的溶液中微粒分布分数和酸的初始浓度,就可以计算各成分在该pH时的平衡浓度
针对练12.(2021·辽宁卷)用0.100 0 mol·L-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图。下列说法正确的是[如A2-分布分数:δ(A2-)=]( )
A.H2A的Ka1为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作指示剂
D.c(Na2A)=0.200 0 mol·L-1
答案:C
解析:用0.100 0 mol·L-1盐酸滴定20.00 mL Na2A溶液,pH较大时A2-的分布分数δ最大,随着pH的减小,A2-的分布分数δ逐渐减小,HA-的分布分数δ逐渐增大,恰好生成NaHA之后,HA-的分布分数δ逐渐减小,H2A的分布分数δ逐渐增大,表示H2A、HA-、A2-的分布分数δ的曲线如图所示,
H2A的Ka1=,根据上图交点1计算可知Ka1=10-6.38,A错误;根据图像可知c点中c(HA-)>c(H2A)>c(A2-),B错误;根据图像可知第一次滴定突跃溶液呈碱性,所以可以选择酚酞做指示剂,C正确;根据图像e点可知,当加入盐酸40 mL时,全部生成H2A,根据Na2A+2HCl===2NaCl+H2A计算可知c(Na2A)=0.100 0 mol·L-1,D错误;答案为C。
针对练13.向等物质的量浓度的K2S、KOH的混合溶液中滴加稀盐酸至过量。其中含硫微粒(H2S、HS-、S2-)的分布分数(平衡时某含硫微粒的浓度占各含硫微粒浓度之和的百分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出,KHS溶液显碱性)。下列说法不正确的是( )
A.曲线A表示S2-的变化情况
B.若Y点对应溶液的pH=a,则Ka1(H2S)=10-a
C.X、Y点对应溶液中水的电离程度大小关系:X<Y
D.Y点对应溶液中c(K+)=3[c(H2S)+c(HS-)+c(S2-)]
答案:C
解析:滴加盐酸时,盐酸先与KOH发生反应,再与K2S发生反应,盐酸与K2S发生反应时,首先发生反应:S2-+H+HS-,该过程中S2-的分布分数减小,HS-的分布分数增大,再发生反应:HS-+H+H2S,该过程中HS-的分布分数减小,H2S的分布分数增大,所以曲线A、B、C依次对应S2-、HS-、H2S的变化情况,A项正确;Y点对应溶液中c(H2S)=c(HS-),则Ka1(H2S)==c(H+)=10-a,B项正确;KCl不影响水的电离,X点对应溶液中c(HS-)=c(S2-),Y点对应溶液中c(H2S)=c(HS-),且X点对应溶液中c(HS-)>Y点对应溶液中c(HS-),KHS溶液显碱性,即HS-能促进水的电离(浓度越大对水的电离促进作用越强),又X点对应溶液中S2-的水解促进水的电离,Y点对应溶液中H2S的电离抑制水的电离,故X点对应溶液中水的电离程度较大,C项错误;原溶液为等物质的量浓度的K2S、KOH的混合溶液,根据元素守恒可知,Y点对应溶液中c(K+)=3[c(H2S)+c(HS-)+c(S2-)],D项正确。
四、水电离曲线
常温下,向20 mL 0.1 mol·L-1 MOH溶液中滴加盐酸,溶液中由水电离出的c水(H+)随加入盐酸体积的变化如图所示
预备知识 影响水的电离平衡的因素: ①外加酸、碱或强酸的酸式盐抑制水的电离 ②盐类水解促进水的电离
关键点分析 ①a点:由水电离出的c水(H+)=10-11mol·L-1,可知0.1 mol·L-1 MOH溶液中c(OH-)=10-3mol·L-1,推出MOH为弱碱,并可以求出其电离常数 ②盐酸滴入MOH溶液过程中,溶质由MOH―→MOH和MCl―→MCl―→MCl和HCl,在这个过程中水的电离程度最大应该是MCl,可知c点应为MCl,那么b点应为MOH和MCl,d点应为MCl和HCl;因此b点为中性,d点不为中性,为酸性
针对练14.常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出的c水(H+)的对数与NaOH溶液的体积之间的关系如图所示,下列推断正确的是( )
A.用pH试纸测定E点对应溶液,其pH=3
B.H、F点对应溶液中都存在:c(Na+)=c(Cl-)+c(ClO-)
C.G点对应溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
D.常温下加水稀释H点对应溶液,溶液的pH增大
答案:C
解析:E点新制氯水溶液中含有HClO,HClO有漂白性,pH试纸先变色后褪色,所以不能用pH试纸测定E点对应溶液的pH,故A错误;H点对应溶液中溶质为NaCl、NaClO和NaOH,根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(ClO-),此时溶液为碱性,则c(OH-)>c(H+),所以c(Na+)>c(Cl-)+c(ClO-),故B错误;G点为完全反应生成NaClO,溶液呈碱性,ClO-水解,新制氯水中起始时是等量的HCl和HClO,所以有c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),故C正确;加水稀释H点对应的溶液,H点为碱性溶液,加水稀释时促使溶液pH值接近中性,所以pH值降低,故D错误;故选C。
针对练15.常温下,向20.00 mL 0.1 mol·L-1HA溶液中滴入0.1 mol·L-1NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lg c水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法中不正确的是( )
A.常温下,Ka(HA)约为10-5
B.M、P两点溶液对应的pH=7
C.b=20.00
D.M点后溶液中均存在c(Na+)>c(A-)
答案:B
解析:0.1 mol·L-1HA溶液中,-lg c水(H+)=11,c水(H+)=c水(OH-)=10-11 mol·L-1,根据常温下水的离子积求出溶液中c(H+)==10-3 mol·L-1,HA??H++A-,c(H+)=c(A-)=10-3 mol·L-1,Ka(HA)=≈=10-5,A正确;N点水电离出的H+浓度最大,说明HA与NaOH恰好完全反应生成NaA,则P点溶质为NaOH和NaA,溶液呈碱性,即P点pH不等于7,B错误;0~b段水的电离程度逐渐增大,当V(NaOH溶液)=b mL时水的电离程度达到最大,即溶质为NaA,说明HA和NaOH恰好完全反应,则b=20.00,C正确;M点溶液的pH=7,根据溶液呈电中性可知,c(Na+)=c(A-),则M点后,c(Na+)>c(A-),D正确;综上所述,本题应选B。
21世纪教育网(www.21cnjy.com)
1.强碱滴定一元弱酸——抓“五点”
室温下,向20 mL 0.1 mol·L-1 HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,溶液pH的变化如图所示
关键点分析 溶液中溶质成分及粒子浓度大小关系
抓反应的“起始”点,即A点,判断酸、碱的相对强弱 溶质为HA,0.1 mol·L-1 HA溶液的pH>1,故HA为弱酸 粒子浓度大小关系:c(HA)>c(H+)>c(A-)>c(OH-)
抓反应的“一半”点,即B点,判断是哪种溶质的等量混合 溶质是等物质的量的HA和NaA,且pH<7 粒子浓度大小关系:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
抓溶液的“中性”点,即C点,判断溶液中溶质的成分及哪种物质过量或不足 溶质是NaA和少量的HA,pH=7 粒子浓度大小关系:c(Na+)=c(A-)>c(H+)=c(OH-)
抓“恰好”反应点,即D点,判断生成的溶质成分及溶液的酸碱性 溶质是NaA,pH>7 粒子浓度大小关系:c(Na+)>c(A-)>c(OH-)>c(H+)
抓反应的“过量”点,即E点,判断溶液中的溶质,判断哪种物质过量 溶质是等物质的量的NaA和NaOH,pH>7 粒子浓度大小关系:c(Na+)>c(OH-)>c(A-)>c(H+)
针对练1.25 ℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液。滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法中,错误的是( )
A.CH3COOH溶液的浓度为0.1 mol·L-1
B.图中点①到点③所示溶液中,水的电离程度先增大后减小
C.点④所示溶液中存在:c(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
D.滴定过程中会存在:c(Na+)>c(CH3COO-)=c(OH-)>c(H+)
答案:C
解析:图像分析氢氧化钠溶液的浓度为0.1 mol/L,②点时氢氧化钠溶液恰好被中和消耗醋酸溶液20 mL,则醋酸浓度为0.1 mol/L,不选A;图中①点到③点所示溶液中随着醋酸逐渐滴入,氢氧化钠不断被消耗,水的电离被抑制程度减小,即水的电离程度增大,恰好反应后继续滴加醋酸,对水的电离起到抑制作用,图中①到③所示的溶液中水的电离程度先增大后减小,不选B;④点所示溶液是等物质的量的醋酸和醋酸钠溶液,c(CH3COOH)+c(CH3COO-)=2c(Na+),电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),选C;滴定过程中的某点,醋酸钠和氢氧化钠混合溶液中会有c(Na+)>c(CH3COO-)=c(OH-)>c(H+),不选D。
针对练2. 25 ℃时,向10 mL 0.1 mol·L-1CH2ClCOONa溶液中加入0.1 mol·L-1的盐酸,溶液pH随加入盐酸的体积变化情况如图所示。下列说法不正确的是( )
A.①所示溶液中:c(OH-)=c(H+)+c(CH2ClCOOH)
B.②所示溶液中:c(CH2ClCOO-)+c(Cl-)=c(Na+)
C.③所示溶液中:c(Na+)>c(CH2ClCOOH)>c(CH2ClCOO-)>c(H+)>c(OH-)
D.④所示溶液中:c(Na+)=c(CH2ClCOO-)+c(CH2ClCOOH)
答案:C
解析:点①所示溶液中:c(OH-)=c(H+)+c(CH2ClCOOH)是质子守恒,故A正确;由于点②的pH=7,即溶液中呈中性,根据电荷守恒可得c(CH2ClCOO-)+c(Cl-)=c(Na+),故B正确;依据图像可知,点③溶液中为等物质的量的CH2ClCOONa、CH2ClCOOH、NaCl,且溶液显酸性,说明CH2ClCOOH的电离程度大于CH2ClCOO-的水解程度,所以离子浓度关系为c(Na+)>c(CH2ClCOO-)>c(CH2ClCOOH)>c(H+)>c(OH-),故C错误;根据元素守恒可知点④所示溶液中:c(Na+)=c(CH2ClCOO-)+c(CH2ClCOOH),故D正确。
2.多组反应图像
(1)强碱滴定一元强酸、一元弱酸
氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线
①曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低 ②突跃点变化范围不同:强碱与强酸反应的突跃点变化范围大于强碱与弱酸反应 ③室温下pH=7不一定是终点:强碱与强酸反应时,终点是pH=7;强碱与弱酸反应时,终点不是pH=7而是pH>7
(2)强酸滴定一元强碱、一元弱碱
盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线
续表
盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线
①曲线起点不同:强酸滴定强碱、弱碱的曲线,强碱起点高 ②突跃点变化范围不同:强酸与强碱反应的突跃点变化范围大于强酸与弱碱反应 ③室温下pH=7不一定是终点:强酸与强碱反应时,终点是pH=7;强酸与弱碱反应时,终点不是pH=7而是pH<7
针对练3.室温下,用0.1 mol·L-1的NaOH溶液分别滴定20 mL 0.1 mol·L-1的HA和HB溶液,溶液pH随加入NaOH溶液的体积变化曲线如图所示,下列判断错误的是( )
A.水的电离度:c点溶液>纯水>b点溶液
B.电离常数:Ka(HA)
D.a点溶液:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
答案:C
解析:c点为完全中和生成的盐溶液,根据起始pH可知,两种酸均为弱酸,且HA的酸性更弱,故c点为强碱弱酸盐溶液,水解促进水的电离,b点不完全中和,酸过量,酸的电离抑制水的电离,水的电离程度减小,故水的电离度:c点溶液>纯水>b点溶液,A正确;由图中曲线可知,HA的酸性更弱,则电离常数:Ka(HA)
针对练4. 25 ℃时,用0.25 mol·L-1的NaOH溶液,分别滴定同浓度的三种稀酸溶液,滴定的曲线如图所示,下列判断不正确的是( )
A.同浓度的稀酸中:c(A-)>c(B-)>c(D-)
B.滴定至P点时,溶液中:c(B-)>c(HB)
C.pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
答案:D
3.一元强碱滴定多元弱酸曲线
向20 mL 0.1 mol/L H2A溶液中滴加0.1 mol/L NaOH溶液
①发生的反应有 NaOH+H2A===NaHA+H2O NaOH+NaHA===Na2A+H2O 2NaOH+H2A===Na2A+2H2O ②根据反应的规律可知:Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- ③判断NaHA酸碱性的方法:V(NaOH)=20 mL时,溶质为NaHA,此时由纵坐标可得出c(HA-)>c(A2-)>c(H2A),可知NaHA显酸性
针对练5.如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液 , 根据图示判断,下列说法正确的是( )
A.H2A在水中的电离方程式是:H2A===H++HA-;HA-H++A2-
B.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
D.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
答案:B
解析:据图可知,当V(NaOH)=20 mL时,发生的反应为NaOH+H2A===NaHA+H2O,溶质主要为NaHA,此时溶液中同时存在HA-、A2-和H2A,说明H2A是一种二元弱酸,则H2A在水中的电离方程式为H2AH++HA-、HA-H++A2-,故A错误;当V(NaOH)=20 mL时,发生的反应为NaOH+H2A===NaHA+H2O,溶质主要为NaHA,据图可知,此时溶液中c(A2-)>c(H2A),说明HA-的电离程度大于水解程度,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正确;当V(NaOH)=30 mL时,发生的反应为NaOH+H2A===NaHA+H2O、NaHA+NaOH===Na2A+H2O,溶液为等物质的量浓度的NaHA和Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),根据元素守恒得:3c(HA-)+3c(A2-)+3c(H2A)=2c(Na+),联立两式得:2c(H+)+c(HA-)+3c(H2A)=c(A2-)+2c(OH-),故C错误;由图示关系可知,等体积等浓度的NaOH溶液与H2A溶液混合后得到NaHA溶液,此时溶液中的c(A2-)>c(H2A),说明HA-的电离程度大于水解程度,溶液显酸性,水的电离受到抑制,所以等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小,故D错误;答案选B。
针对练6.常温下,向10 mL某浓度的H2SO3溶液中滴加0.2 mol·L-1NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )
A.曲线Ⅱ代表H2SO3的浓度
B.V(NaOH)=10 ml时,溶液温度最高,c(H2SO3)=0.1 mol·L-1
C.水的电离程度大小:a点<b点<c点
D.若c点pH=6,则K2(H2SO3)=10-8
答案:C
二、平衡常数(Kw、Ksp)曲线
1.双曲线型
不同温度下水溶液中c(H+)与c(OH-)的变化曲线 常温下,CaSO4在水中的沉淀溶解平衡曲线[Ksp=9×10-6]
(1)A、C、B三点均为中性,温度依次升高,Kw依次增大 (2)D点为酸性溶液,E点为碱性溶液,T2温度时Kw=1×10-14 (3)AB直线的左上方均为碱性溶液,任意一点均有c(H+)
A.含有大量SO的溶液中肯定不存在Ag+
B.该温度下,Ag2SO4的溶度积常数(Ksp)的数量级是10-3
C.可以通过加入硫酸银固体使a点移动到b点
D.该温度下,0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合,不会生成沉淀
答案:D
解析:Ag2SO4溶液中存在沉淀溶解平衡,Ag+、SO共同存在于同一平衡体系中,A错误;图中b点处于沉淀溶解平衡曲线上,据此可得该温度下,Ag2SO4的溶度积常数Ksp=c2(Ag+)·c(SO)=(2×10-2)2×5×10-2=2×10-5,故Ksp的数量级为10-5,B错误;a点是Ag2SO4的不饱和溶液,加入Ag2SO4固体能继续溶解,得到该温度下的饱和溶液,c(Ag+)、c(SO)均增大,故不能使a点移动到b点,C错误;该温度下,0.02 mol/L AgNO3溶液和0.2 mol/L Na2SO4溶液等体积混合后,离子积Q=c2(Ag+)·c(SO)=(0.01)2×0.1=1×10-5<Ksp=2×10-5,故不能生成沉淀,D正确。
针对练8.在t ℃时,AgBr的沉淀溶解平衡曲线如图所示,又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)的平衡常数K≈816
答案:B
解析:根据题给图中c点的c(Ag+)和c(Br-)可得该温度下AgBr的Ksp为4.9×10-13,A正确;在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,AgBr的溶解平衡逆向移动,c(Ag+)减小,故B错误;在a点时Q
A.图像中四个点的Ksp:a=b>c>d
B.AlPO4在b点对应的溶解度大于c点
C.AlPO4(s)Al3+(aq)+PO(aq) ΔH<0
D.升高温度可使d点移动到b点
答案:B
解析:由图像可知,温度越高溶度积常数越大,则图像中四个点的Ksp:a=c=d<b,A错误;b点温度高,溶解度大,AlPO4在b点对应的溶解度大于c点,B正确;根据图像可知,温度升高溶度积常数增大,则AlPO4(s)Al3+(aq)+PO(aq) ΔH>0,C错误;升高温度,阴阳离子浓度均增大,不可能使d点移动到b点,D错误。
2.直线型(pM-pR曲线)
pM为阳离子浓度的负对数,pR为阴离子浓度的负对数
(1)直线AB上的点对应的溶液中:c(M2+)=c(R2-)
(2)溶度积:CaSO4>CaCO3>MnCO3;
(3)X点对于CaCO3来说要析出沉淀,对于CaSO4来说是不饱和溶液,能继续溶解CaSO4;
(4)Y点:c(SO)>c(Ca2+),二者浓度的乘积等于10-5;Z点:c(CO)
下列叙述错误的是( )
A.溶液pH=4时,c(M+)<3.0×10-4mol·L-1
B.MA的溶度积Ksp(MA)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4
答案:C
解析:由图可知pH=4,即c(H+)=10×10-5mol/L时,c2(M+)=7.5×10-8mol2/L2,c(M+)=mol/L=×10-4mol/L<3.0×10-4mol/L,A正确;由图可知,c(H+)=0时,可看作溶液中有较大浓度的OH-,此时A-的水解极大地被抑制,溶液中c(M+)=c(A-),则Ksp(MA)=c(M+)×c(A-)=c2(M+)=5.0×10-8,B正确;设调pH所用的酸为HnX,则结合电荷守恒可知c(M+)+c(H+)=c(A-)+c(OH-)+nc(Xn-),题给等式右边缺阴离子部分nc(Xn-),C错误;Ka(HA)=,当c(A-)=c(HA)时,由元素守恒知c(A-)+c(HA)=c(M+),则c(A-)=,Ksp(MA)=c(M+)×c(A-)==5.0×10-8,则c2(M+)=10×10-8,对应图得此时溶液中c(H+)=2.0×10-4mol·L-1,Ka(HA)==c(H+)≈2.0×10-4,D正确;故选C。
针对练11.25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与lg X的变化关系如图所示。已知:lg X=lg或lg ,下列叙述正确的是( )
A.曲线m表示pH与lg的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO)+2c(CO)
C.Ka1(H2CO3)的数量级为10-6
D.滴加过程中,保持不变
答案:D
解析:对图像进行以下分析:
当溶液显中性时,根据电荷守恒c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)+c(Cl-),c(H+)=c(OH-),则有c(Na+)>c(HCO)+2c(CO),B项错误。根据图像分析知Ka1(H2CO3)=10-6.4,数量级为10-7,C项错误。=×=Ka1(H2CO3)·Ka2(H2CO3),温度不变,Ka1(H2CO3)、Ka2(H2CO3)不变,故滴加过程中,保持不变,D项正确。
三、正态分布系数图及分析
一元弱酸(以CH3COOH为例) 二元酸(以草酸H2C2O4为例)
注:pKa为电离常数的负对数
δ0为CH3COOH分布分数,δ1为CH3COO-分布分数 δ0为H2C2O4分布分数、δ1为HC2O分布分数、δ2为C2O分布分数
随着pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。根据分布分数可以书写一定pH时所发生反应的离子方程式
同一pH条件下可以存在多种溶质微粒。根据在一定pH的溶液中微粒分布分数和酸的初始浓度,就可以计算各成分在该pH时的平衡浓度
针对练12.(2021·辽宁卷)用0.100 0 mol·L-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图。下列说法正确的是[如A2-分布分数:δ(A2-)=]( )
A.H2A的Ka1为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作指示剂
D.c(Na2A)=0.200 0 mol·L-1
答案:C
解析:用0.100 0 mol·L-1盐酸滴定20.00 mL Na2A溶液,pH较大时A2-的分布分数δ最大,随着pH的减小,A2-的分布分数δ逐渐减小,HA-的分布分数δ逐渐增大,恰好生成NaHA之后,HA-的分布分数δ逐渐减小,H2A的分布分数δ逐渐增大,表示H2A、HA-、A2-的分布分数δ的曲线如图所示,
H2A的Ka1=,根据上图交点1计算可知Ka1=10-6.38,A错误;根据图像可知c点中c(HA-)>c(H2A)>c(A2-),B错误;根据图像可知第一次滴定突跃溶液呈碱性,所以可以选择酚酞做指示剂,C正确;根据图像e点可知,当加入盐酸40 mL时,全部生成H2A,根据Na2A+2HCl===2NaCl+H2A计算可知c(Na2A)=0.100 0 mol·L-1,D错误;答案为C。
针对练13.向等物质的量浓度的K2S、KOH的混合溶液中滴加稀盐酸至过量。其中含硫微粒(H2S、HS-、S2-)的分布分数(平衡时某含硫微粒的浓度占各含硫微粒浓度之和的百分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出,KHS溶液显碱性)。下列说法不正确的是( )
A.曲线A表示S2-的变化情况
B.若Y点对应溶液的pH=a,则Ka1(H2S)=10-a
C.X、Y点对应溶液中水的电离程度大小关系:X<Y
D.Y点对应溶液中c(K+)=3[c(H2S)+c(HS-)+c(S2-)]
答案:C
解析:滴加盐酸时,盐酸先与KOH发生反应,再与K2S发生反应,盐酸与K2S发生反应时,首先发生反应:S2-+H+HS-,该过程中S2-的分布分数减小,HS-的分布分数增大,再发生反应:HS-+H+H2S,该过程中HS-的分布分数减小,H2S的分布分数增大,所以曲线A、B、C依次对应S2-、HS-、H2S的变化情况,A项正确;Y点对应溶液中c(H2S)=c(HS-),则Ka1(H2S)==c(H+)=10-a,B项正确;KCl不影响水的电离,X点对应溶液中c(HS-)=c(S2-),Y点对应溶液中c(H2S)=c(HS-),且X点对应溶液中c(HS-)>Y点对应溶液中c(HS-),KHS溶液显碱性,即HS-能促进水的电离(浓度越大对水的电离促进作用越强),又X点对应溶液中S2-的水解促进水的电离,Y点对应溶液中H2S的电离抑制水的电离,故X点对应溶液中水的电离程度较大,C项错误;原溶液为等物质的量浓度的K2S、KOH的混合溶液,根据元素守恒可知,Y点对应溶液中c(K+)=3[c(H2S)+c(HS-)+c(S2-)],D项正确。
四、水电离曲线
常温下,向20 mL 0.1 mol·L-1 MOH溶液中滴加盐酸,溶液中由水电离出的c水(H+)随加入盐酸体积的变化如图所示
预备知识 影响水的电离平衡的因素: ①外加酸、碱或强酸的酸式盐抑制水的电离 ②盐类水解促进水的电离
关键点分析 ①a点:由水电离出的c水(H+)=10-11mol·L-1,可知0.1 mol·L-1 MOH溶液中c(OH-)=10-3mol·L-1,推出MOH为弱碱,并可以求出其电离常数 ②盐酸滴入MOH溶液过程中,溶质由MOH―→MOH和MCl―→MCl―→MCl和HCl,在这个过程中水的电离程度最大应该是MCl,可知c点应为MCl,那么b点应为MOH和MCl,d点应为MCl和HCl;因此b点为中性,d点不为中性,为酸性
针对练14.常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出的c水(H+)的对数与NaOH溶液的体积之间的关系如图所示,下列推断正确的是( )
A.用pH试纸测定E点对应溶液,其pH=3
B.H、F点对应溶液中都存在:c(Na+)=c(Cl-)+c(ClO-)
C.G点对应溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
D.常温下加水稀释H点对应溶液,溶液的pH增大
答案:C
解析:E点新制氯水溶液中含有HClO,HClO有漂白性,pH试纸先变色后褪色,所以不能用pH试纸测定E点对应溶液的pH,故A错误;H点对应溶液中溶质为NaCl、NaClO和NaOH,根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(ClO-),此时溶液为碱性,则c(OH-)>c(H+),所以c(Na+)>c(Cl-)+c(ClO-),故B错误;G点为完全反应生成NaClO,溶液呈碱性,ClO-水解,新制氯水中起始时是等量的HCl和HClO,所以有c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),故C正确;加水稀释H点对应的溶液,H点为碱性溶液,加水稀释时促使溶液pH值接近中性,所以pH值降低,故D错误;故选C。
针对练15.常温下,向20.00 mL 0.1 mol·L-1HA溶液中滴入0.1 mol·L-1NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lg c水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法中不正确的是( )
A.常温下,Ka(HA)约为10-5
B.M、P两点溶液对应的pH=7
C.b=20.00
D.M点后溶液中均存在c(Na+)>c(A-)
答案:B
解析:0.1 mol·L-1HA溶液中,-lg c水(H+)=11,c水(H+)=c水(OH-)=10-11 mol·L-1,根据常温下水的离子积求出溶液中c(H+)==10-3 mol·L-1,HA??H++A-,c(H+)=c(A-)=10-3 mol·L-1,Ka(HA)=≈=10-5,A正确;N点水电离出的H+浓度最大,说明HA与NaOH恰好完全反应生成NaA,则P点溶质为NaOH和NaA,溶液呈碱性,即P点pH不等于7,B错误;0~b段水的电离程度逐渐增大,当V(NaOH溶液)=b mL时水的电离程度达到最大,即溶质为NaA,说明HA和NaOH恰好完全反应,则b=20.00,C正确;M点溶液的pH=7,根据溶液呈电中性可知,c(Na+)=c(A-),则M点后,c(Na+)>c(A-),D正确;综上所述,本题应选B。
21世纪教育网(www.21cnjy.com)
