【全国百强校】辽宁省大连市第二十四中学高中化学必修二:1.1元素周期表 课件(共52张PPT)
文档属性
| 名称 | 【全国百强校】辽宁省大连市第二十四中学高中化学必修二:1.1元素周期表 课件(共52张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-05-12 21:25:39 | ||
图片预览







文档简介
课件52张PPT。第一节 元素周期表一、原子结构1、道尔顿学说------1803年, 认为原子是微小的不可分割的实心球体。原子结构模型的演变史2、汤姆生原子模型(1904年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成中性原子。3、卢瑟福原子模型(1911年):在原子的中心有一个带正电的核,质量几乎等于原子的全部质量,电子在核周围沿不同轨道上运转,
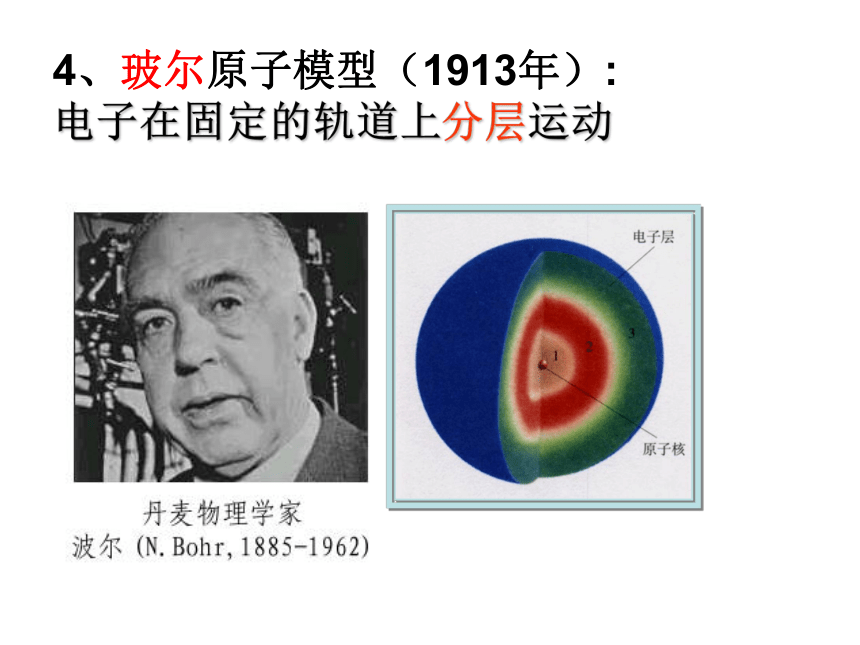
就像行星环绕太阳一样运转。4、玻尔原子模型(1913年):
电子在固定的轨道上分层运动 现在,科学家已能利用电子显微镜和扫描隧道显微镜摄制显示原子图像的照片。随着现代科学技术的发展,人类对原子的认识过程还会不断深化。5.电子云模型(1927 至今)核外电子质子
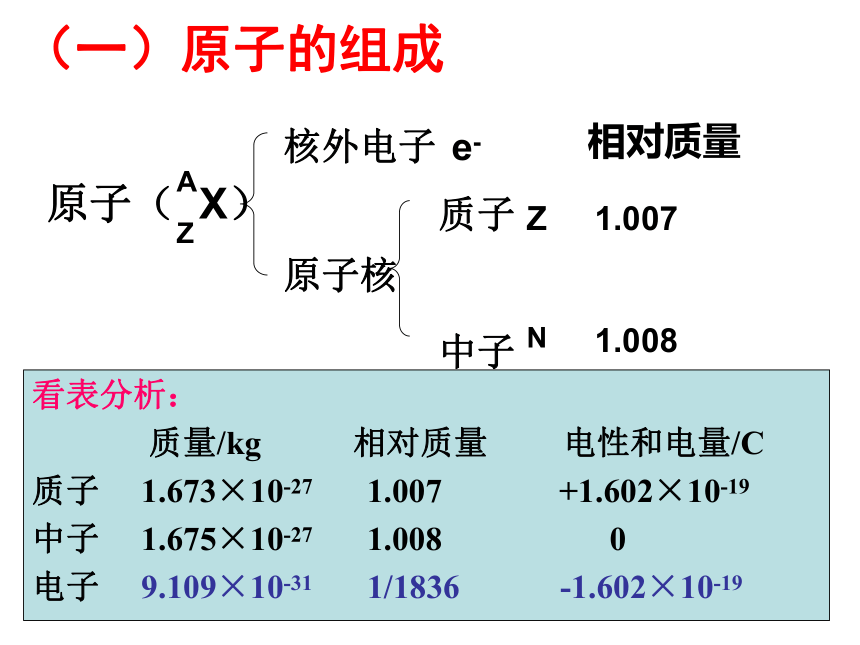
中子Z1.007(一)原子的组成相对质量N1.008原子核 e-看表分析:
质量/kg 相对质量 电性和电量/C
质子 1.673×10-27 1.007 +1.602×10-19
中子 1.675×10-27 1.008 0
电子 9.109×10-31 1/1836 -1.602×10-191.质子:带正电决定1)元素的种数2)核电荷数3)相对原子质量大小2.中子:不带电决定1)同位素(后面介绍)3.电子:带负电决定元素的化学性质2)相对原子质量大小4.质量数(A):练习:1)质子、中子、电子、H+四种微粒中.
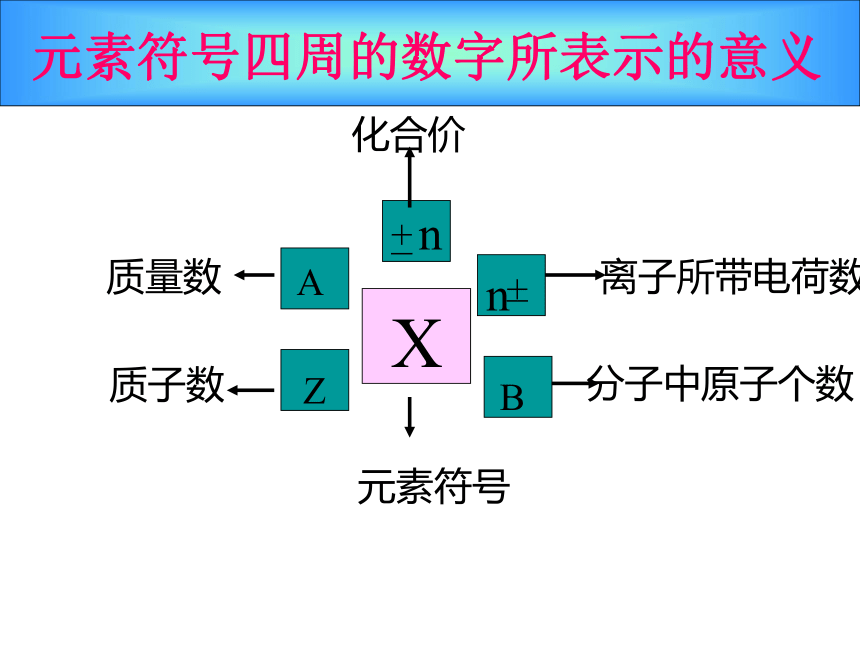
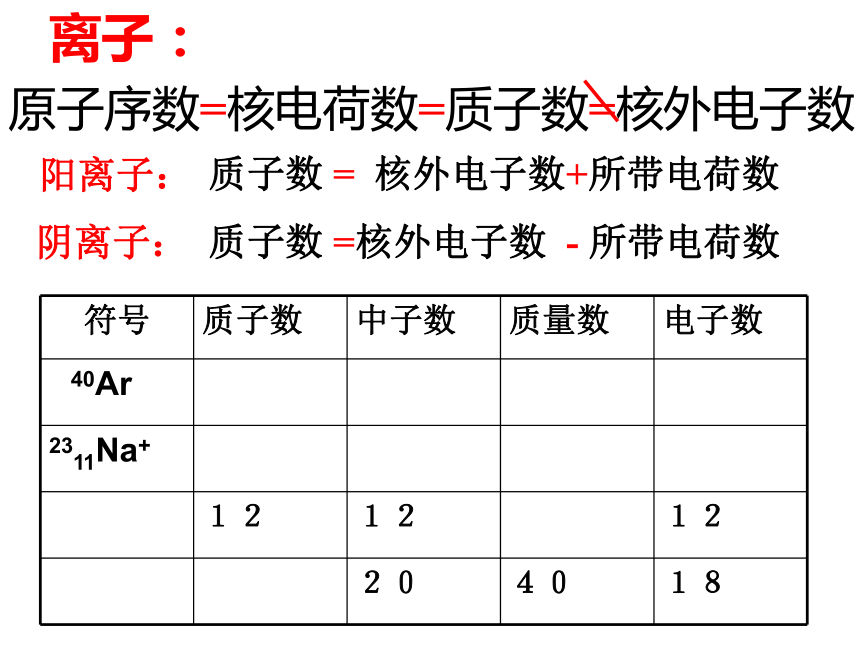
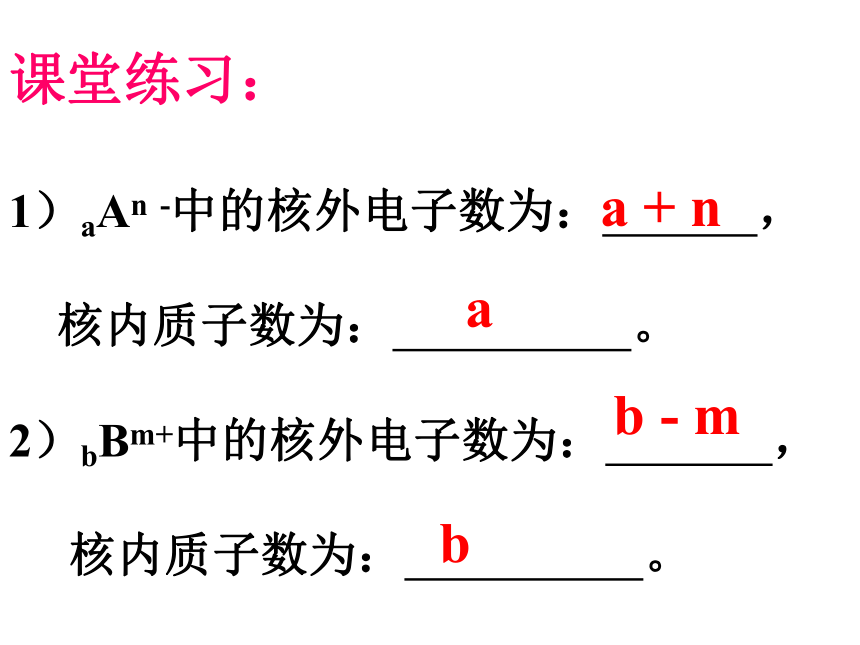
质量最大的是( )最小的是( ) 2)a克32S2-中含有电子数为( )molA = Z + N忽略电子质量,将质子、中子的相对质量取其整数相加Z元素符号四周的数字所表示的意义XA+—nn+—B元素符号质子数质量数化合价离子所带电荷数分子中原子个数阳离子:质子数 = 核外电子数+所带电荷数阴离子:质子数 =核外电子数 - 所带电荷数 原子序数=核电荷数=质子数=核外电子数离子:课堂练习:
1)aAn -中的核外电子数为: ,
核内质子数为: 。
2)bBm+中的核外电子数为: ,
核内质子数为: 。 b - ma + nab (二)原子核外电子的排布1.电子层: 核外电子是分层排布的K L M N O P Q由内到外,能量逐渐升高2.电子排布一般规律1)从内到外排列2)每层最多容纳的电子数: 2n23)最外层不超过8
次外层不超过18
倒数第三层不超过323.原子结构的表示方法:
(1)原子结构示意图+11表示核电荷数,弧线表示电子层,弧线上的数字表示该层电子数。(2)电子式在元素符号周围用小黑点“ · ”或“×”表示原子核外最外层电子(练习:试写出Br原子的原子结构示意图及电子式)(三)核素1.核素:2.同位素:具有一定数目质子和一定数目中子的一种原子。 质子数相同而中子数不同的同一元素的不同原子3.同位素的特点:2)元素符号相同3)电子排布相同4)化学性质相同5)在周期表位置相同6)在自然界中含量(丰度)不变1)质子数.电子数.核电荷数相同4.同位素的应用: 铀-235原子核完全裂变放出的能量是同量煤完全燃烧放出能量的2700000倍。也就是说1克U-235完全裂变释放的能量相当于2吨半优质煤完全燃烧时所释放的能量。放射性C-14射线测定装置(1)核素的相对原子质量: 如:816O的相对原子质量 = 2.657*10-26 kg/[(1/12)*1.993*10-26 kg]= 16.00 (2)核素的近似原子质量:如: 816O的近似相对原子质量为16。5.相对原子质量(Mr)(3)元素的相对原子质量: 如:氯元素的同位素有 1735Cl?、1737Cl 两种, ???????????
相对原子质量为??? 34.969?????? 36.966 ?????????
原子个数百分比为??? 75.77%?????? 24.23% ??????
氯元素的相对原子质量 = 34.969*75.77% + 36.966*24.23% = 35.453 (4)元素的近似相对原子质量 如:氯元素的近似相对原子质量 = 35*75.77% + 37*24.23%?= 35.48 门捷列夫
Mendeleev第一张元素周期表Ga1869年,俄国化学家门捷列夫:
1)按相对原子质量由大到小依次排列
2)化学性质相似放在一个纵行四.元素周期表<原子序数>:按元素在周期表中的顺序给元素编号原子序数=核电荷数=质子数=核外电子数1. 编排原则1)、把电子层数相同的元素,
按原子序数递增从左到右排成横行2)、把最外层电子数相同的元素,
按电子层数递增从上到下排成纵行镧系与锕系每一个小格中的符号和数字的意义 红色指放射性元素注*是人造元素相对原子质量1)周期(横行)短周期长周期第1周期:2 种元素第2 :8 种第3 :8 种第4 :18 种第5 :18 种第6 :32 种第7 :26 种(不完全)7个周期2. 表的结构16个族7个主族:7个副族:ⅠA ,ⅡA, ⅢA ,ⅣA ,ⅤA ,ⅥA ,ⅦA 1个第VIII 族:(18个纵行) 1个0族 (稀有气体)ⅠB, ⅡB, ⅢB , ⅣB, ⅤB, ⅥB,ⅦB (三个纵行)由短.长周期组成的族----主族 “A”仅由长周期构成的族----副族 “B”2)族(纵行)元素周期表IAIIAIIIAIVAV
AVIAVIIA0主族周期副族
过渡元素3.注意:1)过渡元素---过渡金属 3)锕系元素:2)镧系元素:4)超铀元素:5)人造元素,遵从加法规则ⅢB→ⅡB 10个纵行,68种金属镧57La – 镥71Lu共15种锕89Ac – 铹103Lr共15种铀92U后面的元素 (多数是人工合成)五.原子结构与周期表关系1.电子层数=周期序数2.最外层电子数=主族序数=价电子数=最高正价 3.主族元素:最高正价 = 族序数
非金属:负化合价绝对值 = 8 - 主族序数 4. 元素在周期表中位置的确定1)主族元素用画原子结构简图法
如:37号元素,53号元素<价电子>最外层电子
某些次外层、到数第三层电子2)差值法:原子序数与各周期元素之差*差值大于18再减14 如:37号元素,53号元素,
87号元素,112号元素现有的周期表完美吗?
还可作哪些改进??形式多样的周期表螺旋型周期表棱台型元素周期表立式周期表展示电子排布的周期表扇形元素周期表课堂练习1、下列元素中, Na 、Fe Cu He K F
属于短周期的主族元素是: 。
属于长周期的主族元素是: 。
属于非金属主族元素是: 。
属于零族元素是: 。
属于副族元素是: 。
属于第八族元素是: 。NaFKFHeCuFe2、推算原子序数为6、13、8、17、16 的元素在周期表中的位置。23233IVAIIIAVIAVIIAVIA3、填写下表:4、下表是元素周期表的一部分,数字
是该元素的原子序数,请填出其下一周期
元素的原子序数:19355、主族元素在周期表中所处的
位置,取决于该元素的
(A)最外层电子数和原子量
(B)原子量和核外电子数
(C)次外层电子数和电子层数
(D)电子层数和最外层电子数D 6、下列各图若为元素周期表中的
一部分(表中数字为原子序数),
其中X为35的是AD 7、X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z是
A.Mg、Al、Si B.Li、Be、Mg
C.N、O、S D.P、S、OC8、X、Y是短周期元素,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数为
(A)n+1 (B)n+4
(C)n+3 (D)n-5ACD 已知a为Ⅱ A族元素,b为Ⅲ A族素,且它们的原子序数分别为m和n,且a、b为同一周期,关系式必定错误的是( ) (01年高考)
A. n=m+10 B. n=m+1
C. n=m+11 D. n=m+25A练习1下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D练习2练习3 A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C 分别为什么元素? 三种元素原子最外层电子平均数为 17/3 = 5.7 三种元素位于第ⅤA、ⅥA族。 三种元素质子数之和为31,内层电子数为
31-17=14,则2+2+10=14可得A是氮元素 B是氧元素C是硫元素5 + 2×6 = 17
中子Z1.007(一)原子的组成相对质量N1.008原子核 e-看表分析:
质量/kg 相对质量 电性和电量/C
质子 1.673×10-27 1.007 +1.602×10-19
中子 1.675×10-27 1.008 0
电子 9.109×10-31 1/1836 -1.602×10-191.质子:带正电决定1)元素的种数2)核电荷数3)相对原子质量大小2.中子:不带电决定1)同位素(后面介绍)3.电子:带负电决定元素的化学性质2)相对原子质量大小4.质量数(A):练习:1)质子、中子、电子、H+四种微粒中.
质量最大的是( )最小的是( ) 2)a克32S2-中含有电子数为( )molA = Z + N忽略电子质量,将质子、中子的相对质量取其整数相加Z元素符号四周的数字所表示的意义XA+—nn+—B元素符号质子数质量数化合价离子所带电荷数分子中原子个数阳离子:质子数 = 核外电子数+所带电荷数阴离子:质子数 =核外电子数 - 所带电荷数 原子序数=核电荷数=质子数=核外电子数离子:课堂练习:
1)aAn -中的核外电子数为: ,
核内质子数为: 。
2)bBm+中的核外电子数为: ,
核内质子数为: 。 b - ma + nab (二)原子核外电子的排布1.电子层: 核外电子是分层排布的K L M N O P Q由内到外,能量逐渐升高2.电子排布一般规律1)从内到外排列2)每层最多容纳的电子数: 2n23)最外层不超过8
次外层不超过18
倒数第三层不超过323.原子结构的表示方法:
(1)原子结构示意图+11表示核电荷数,弧线表示电子层,弧线上的数字表示该层电子数。(2)电子式在元素符号周围用小黑点“ · ”或“×”表示原子核外最外层电子(练习:试写出Br原子的原子结构示意图及电子式)(三)核素1.核素:2.同位素:具有一定数目质子和一定数目中子的一种原子。 质子数相同而中子数不同的同一元素的不同原子3.同位素的特点:2)元素符号相同3)电子排布相同4)化学性质相同5)在周期表位置相同6)在自然界中含量(丰度)不变1)质子数.电子数.核电荷数相同4.同位素的应用: 铀-235原子核完全裂变放出的能量是同量煤完全燃烧放出能量的2700000倍。也就是说1克U-235完全裂变释放的能量相当于2吨半优质煤完全燃烧时所释放的能量。放射性C-14射线测定装置(1)核素的相对原子质量: 如:816O的相对原子质量 = 2.657*10-26 kg/[(1/12)*1.993*10-26 kg]= 16.00 (2)核素的近似原子质量:如: 816O的近似相对原子质量为16。5.相对原子质量(Mr)(3)元素的相对原子质量: 如:氯元素的同位素有 1735Cl?、1737Cl 两种, ???????????
相对原子质量为??? 34.969?????? 36.966 ?????????
原子个数百分比为??? 75.77%?????? 24.23% ??????
氯元素的相对原子质量 = 34.969*75.77% + 36.966*24.23% = 35.453 (4)元素的近似相对原子质量 如:氯元素的近似相对原子质量 = 35*75.77% + 37*24.23%?= 35.48 门捷列夫
Mendeleev第一张元素周期表Ga1869年,俄国化学家门捷列夫:
1)按相对原子质量由大到小依次排列
2)化学性质相似放在一个纵行四.元素周期表<原子序数>:按元素在周期表中的顺序给元素编号原子序数=核电荷数=质子数=核外电子数1. 编排原则1)、把电子层数相同的元素,
按原子序数递增从左到右排成横行2)、把最外层电子数相同的元素,
按电子层数递增从上到下排成纵行镧系与锕系每一个小格中的符号和数字的意义 红色指放射性元素注*是人造元素相对原子质量1)周期(横行)短周期长周期第1周期:2 种元素第2 :8 种第3 :8 种第4 :18 种第5 :18 种第6 :32 种第7 :26 种(不完全)7个周期2. 表的结构16个族7个主族:7个副族:ⅠA ,ⅡA, ⅢA ,ⅣA ,ⅤA ,ⅥA ,ⅦA 1个第VIII 族:(18个纵行) 1个0族 (稀有气体)ⅠB, ⅡB, ⅢB , ⅣB, ⅤB, ⅥB,ⅦB (三个纵行)由短.长周期组成的族----主族 “A”仅由长周期构成的族----副族 “B”2)族(纵行)元素周期表IAIIAIIIAIVAV
AVIAVIIA0主族周期副族
过渡元素3.注意:1)过渡元素---过渡金属 3)锕系元素:2)镧系元素:4)超铀元素:5)人造元素,遵从加法规则ⅢB→ⅡB 10个纵行,68种金属镧57La – 镥71Lu共15种锕89Ac – 铹103Lr共15种铀92U后面的元素 (多数是人工合成)五.原子结构与周期表关系1.电子层数=周期序数2.最外层电子数=主族序数=价电子数=最高正价 3.主族元素:最高正价 = 族序数
非金属:负化合价绝对值 = 8 - 主族序数 4. 元素在周期表中位置的确定1)主族元素用画原子结构简图法
如:37号元素,53号元素<价电子>最外层电子
某些次外层、到数第三层电子2)差值法:原子序数与各周期元素之差*差值大于18再减14 如:37号元素,53号元素,
87号元素,112号元素现有的周期表完美吗?
还可作哪些改进??形式多样的周期表螺旋型周期表棱台型元素周期表立式周期表展示电子排布的周期表扇形元素周期表课堂练习1、下列元素中, Na 、Fe Cu He K F
属于短周期的主族元素是: 。
属于长周期的主族元素是: 。
属于非金属主族元素是: 。
属于零族元素是: 。
属于副族元素是: 。
属于第八族元素是: 。NaFKFHeCuFe2、推算原子序数为6、13、8、17、16 的元素在周期表中的位置。23233IVAIIIAVIAVIIAVIA3、填写下表:4、下表是元素周期表的一部分,数字
是该元素的原子序数,请填出其下一周期
元素的原子序数:19355、主族元素在周期表中所处的
位置,取决于该元素的
(A)最外层电子数和原子量
(B)原子量和核外电子数
(C)次外层电子数和电子层数
(D)电子层数和最外层电子数D 6、下列各图若为元素周期表中的
一部分(表中数字为原子序数),
其中X为35的是AD 7、X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z是
A.Mg、Al、Si B.Li、Be、Mg
C.N、O、S D.P、S、OC8、X、Y是短周期元素,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数为
(A)n+1 (B)n+4
(C)n+3 (D)n-5ACD 已知a为Ⅱ A族元素,b为Ⅲ A族素,且它们的原子序数分别为m和n,且a、b为同一周期,关系式必定错误的是( ) (01年高考)
A. n=m+10 B. n=m+1
C. n=m+11 D. n=m+25A练习1下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D练习2练习3 A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C 分别为什么元素? 三种元素原子最外层电子平均数为 17/3 = 5.7 三种元素位于第ⅤA、ⅥA族。 三种元素质子数之和为31,内层电子数为
31-17=14,则2+2+10=14可得A是氮元素 B是氧元素C是硫元素5 + 2×6 = 17
