第六章 化学反应与能量(B卷能力提升)(含答案)——2024-2025学年高一化学人教版(2019)必修二单元测试AB卷
文档属性
| 名称 | 第六章 化学反应与能量(B卷能力提升)(含答案)——2024-2025学年高一化学人教版(2019)必修二单元测试AB卷 |  | |
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-18 08:59:50 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第六章 化学反应与能量(B卷能力提升)——2024-2025学年高一化学人教版(2019)必修二单元测试AB卷
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共42分)
1.下列变化属于吸热反应的是( )
A.碘的升华 B.酸碱中和反应
C.氢气的燃烧 D.和反应
2.下列有关化学反应速率的说法正确的是( )
A.用铁片与稀硫酸反应制氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.的盐酸与锌片反应,加入适量的氯化钠溶液,反应速率不变
C.的催化氧化反应是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成和,减小压强时反应速率减慢
3.如图所示为某铜锌原电池示意图。下列有关该原电池的说法正确的是( )
A.锌电极为负极,发生氧化反应
B.溶液中流向Cu电极
C.电子从铜电极通过电流计流向锌电极
D.铜电极上发生的电极反应为
4.图为某原电池装置的示意图。下列叙述中,不正确的是( )
A.电子由Zn片通过导线流向Cu片
B.一段时间后,溶液的pH减小
C.将Zn片换成Fe片,电路中电流方向不变
D.将稀硫酸换成柠檬汁,导线中也会有电子移动
5.将气体和气体在的密闭容器中混合并在一定条件下发生如下反应:,若经后测得C的浓度为,则下列几种说法中正确的是( )
①2s末物质B的物质的量为
②用物质D表示的平均反应速率为
③2s时,物质A的转化率为30%
④用A、B、C来表示反应速率,其速率之比为2:1:3
A.①③④ B.①②③④ C.②④ D.③④
6.反应,在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A.mol/(L·s) B.mol/(L·s)
C.mol/(L·s) D.mol/(L·s)
7.反应在10L的密闭容器中进行,测得2min内,的物质的量由20mol减小到8mol,则2min内用表示的反应速率为( )
A.1.2mol/(L·min) B.6mol/(L·min) C.0.6mol/(L·min) D.0.4mol/(L·min)
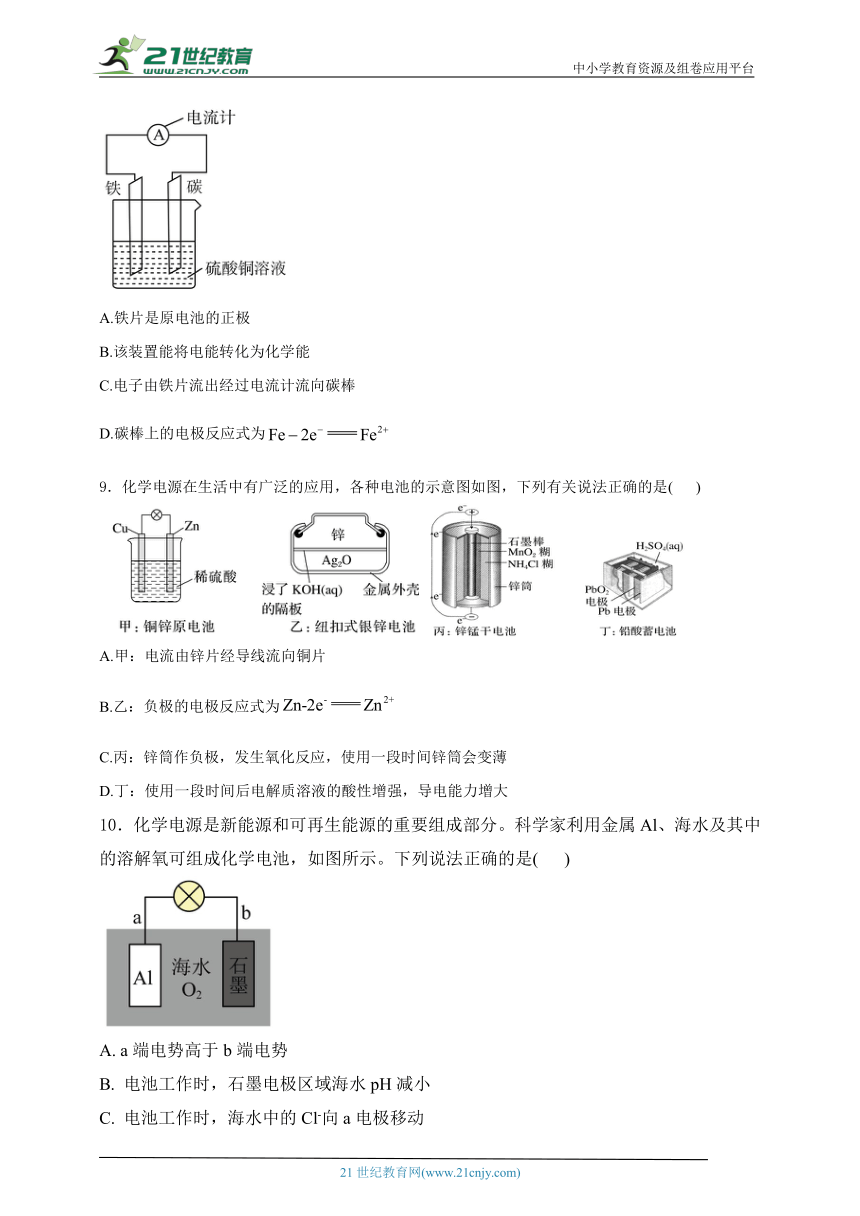
8.电池因能提供持久稳定的电力支持,满足不同领域的需求,故应用广泛。如图为铁—碳原电池的装置示意图,下列说法正确的是( )
A.铁片是原电池的正极
B.该装置能将电能转化为化学能
C.电子由铁片流出经过电流计流向碳棒
D.碳棒上的电极反应式为
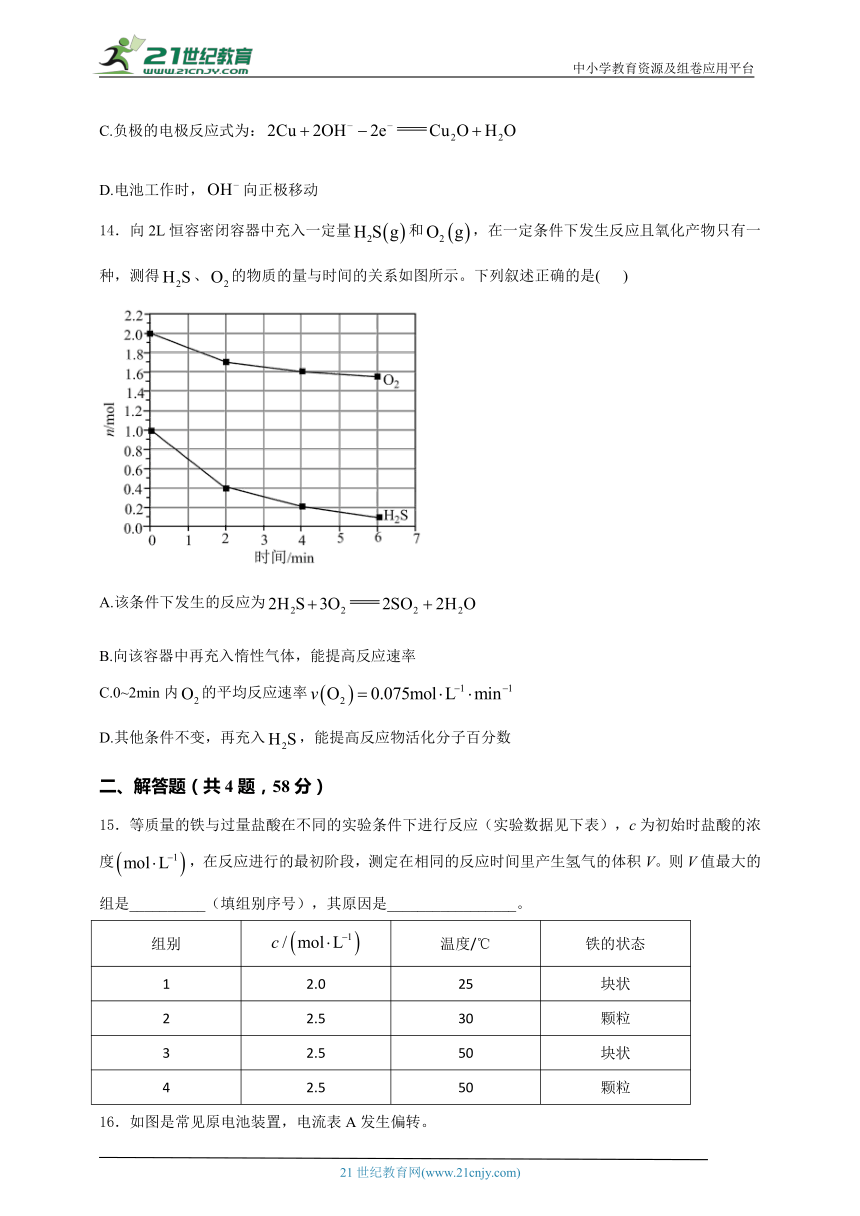
9.化学电源在生活中有广泛的应用,各种电池的示意图如图,下列有关说法正确的是( )
A.甲:电流由锌片经导线流向铜片
B.乙:负极的电极反应式为
C.丙:锌筒作负极,发生氧化反应,使用一段时间锌筒会变薄
D.丁:使用一段时间后电解质溶液的酸性增强,导电能力增大
10.化学电源是新能源和可再生能源的重要组成部分。科学家利用金属Al、海水及其中的溶解氧可组成化学电池,如图所示。下列说法正确的是( )
A. a端电势高于b端电势
B. 电池工作时,石墨电极区域海水pH减小
C. 电池工作时,海水中的Cl-向a电极移动
D. 67.2LO2参加反应,a电极消耗Al的质量为54g
11.CO和在一定条件下可以合成乙醇:,下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A.CO全部转化为乙醇
B.正反应和逆反应的化学反应速率均为0
C.CO和以1∶2的物质的量之比反应生成乙醇
D.反应体系中乙醇的物质的量浓度不再变化
12.已知反应的能量变化如图所示,下列说法正确的是( )
A.该反应为放热反应 B.该反应为吸热反应
C.反应物的总能量高于生成物的总能量 D.该反应只有在加热条件下才能进行
13.普通水泥在固化过程中自由水分子减少并产生,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此法的原理如图所示,反应的总方程式为:,下列有关说法正确的是( )
A.装置中电流方向由Cu经导线到
B.测量原理示意图中,为负极
C.负极的电极反应式为:
D.电池工作时,向正极移动
14.向2L恒容密闭容器中充入一定量和,在一定条件下发生反应且氧化产物只有一种,测得、的物质的量与时间的关系如图所示。下列叙述正确的是( )
A.该条件下发生的反应为
B.向该容器中再充入惰性气体,能提高反应速率
C.0~2min内的平均反应速率
D.其他条件不变,再充入,能提高反应物活化分子百分数
二、解答题(共4题,58分)
15.等质量的铁与过量盐酸在不同的实验条件下进行反应(实验数据见下表),c为初始时盐酸的浓度,在反应进行的最初阶段,测定在相同的反应时间里产生氢气的体积V。则V值最大的组是__________(填组别序号),其原因是_________________。
组别 温度/℃ 铁的状态
1 2.0 25 块状
2 2.5 30 颗粒
3 2.5 50 块状
4 2.5 50 颗粒
16.如图是常见原电池装置,电流表A发生偏转。
(1)若两个电极分别是锌、铜,电解质溶液是稀硫酸,正极的电极反应式为_____________;
如果把电解质溶液换成硫酸铜溶液,则正极的电极反应式为____________________________。
(2)若电池的总反应是,则可以作负极材料的是________,负极反应式是___________________________________,正极反应式是___________________________。
(3)若电解质溶液是稀硫酸,镁、铝两种金属作电极,则镁电极的反应式为___________;
若电解质溶液换作稀氢氧化钠溶液,镁、铝两金属作电极,则镁是________(选填“正极”或“负极”),总反应的离子方程式是_________________________________________________。
17.利用催化转化反应,可有效地将汽车尾气中的CO和NO同时除去。
(1)已知:;。计算:_________。
(2)一定温度下,向某密闭容器中充入等物质的量的NO和CO,发生上述反应。测得NO浓度随时间t的变化曲线如图。
①0~2s内的平均反应速率_________。
②下列有关该反应的说法正确的是_________(填标号)。
A.体系中混合气体的平均摩尔质量不变时,该反应达到平衡状态
B.体系中保持不变时,该反应达到平衡状态
C.一定压强下充入惰性气体,、均不变
D.5s时,
(3)增大催化剂的比表面积可提高该反应速率,为了探究温度、催化剂的比表面积对该反应速率的影响规律,某同学设计了如下三组实验。
实验编号 T/℃ NO初始浓度/() CO初始浓度/() 催化剂的比表面积/()
Ⅰ 280 82
Ⅱ 280 b 124
Ⅲ 350 a 82
①_______。
②探究温度对该反应速率影响规律的实验有_______(填实验编号)。
③实验Ⅰ和实验Ⅱ中,随时间t的变化曲线如图,表示实验Ⅱ的是曲线_______(填“甲”或“乙”)。
18.我国科学家研发的“液态阳光”计划:通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢制备成甲醇,其反应原理为。
(1)在一定温度下,相关物质的相对能量如图甲所示,该反应为________(填“放热”或“吸热”)反应;断裂1mol和3mol中化学键吸收的总能量________(填“大于”或“小于”)形成1mol和1mol中化学键释放的总能量。
(2)在体积为2L的密闭容器中充入2mol和6mol,分别在温度和下反应,测得的物质的量随时间变化如图乙所示。
①________(填“>”或“<”),原因为________。
②温度下,0~10min内________;a、b两点反应速率的大小关系为________。
③恒温恒容条件下,下列不能说明反应已达平衡状态的是________(填选项字母)。
A.混合气体的平均相对分子质量保持不变
B.
C.容器中浓度与浓度之比保持不变
D.的物质的量保持不变
(3)甲醇-氧气固体氧化物燃料电池属于第三代燃料电池,其工作原理如图丙所示。
①气体M为________(填化学式),电子由电极________(填“m”或“n”)流出。
②负极的电极反应式为________,当外电路中通过1mol电子时,消耗气体M的质量为________g。
参考答案
1.答案:D
解析:A.碘的升华过程吸热,但该过程是物理变化,A不符合题意;
B.酸碱中和反应属于放热反应,B不符合题意;
C.氢气的燃烧属于放热反应,C不符合题意;
D.与晶体混合反应是吸热反应,D符合题意;
答案选D。
2.答案:D
解析:A.常温下,铁遇到浓硫酸发生钝化,铁片与98%的浓硫酸无法反应生成氢气,A错误;
B.100mL2mol/L的盐酸与锌片反应,加入适量NaCl溶液,盐酸被稀释,反应速率减小,B错误;
C.的催化氧化是一个放热反应,但是一般情况下,升高温度,反应速率都会增大,C错误;
D.汽车尾气中的NO和CO反应生成和,减小压强反应速率减小,D正确;
故答案选D。
3.答案:A
解析:
4.答案:B
解析:
5.答案:D
解析:①经后测得C的浓度为,此时生成C的物质的量为,结合反应可知消耗的B的物质的量==0.6mol,2s末物质B的物质的量为,故错误;
②D为固体,不能表示反应速率,故错误;
③结合上述解题思路,2s时,消耗A的物质的量;A的转化率=,故正确;
④同一反应中用不同的物质表示的反应速率之比等于化学计量数之比,故正确;
综上所述,正确的为③④;
故选:D。
6.答案:A
解析:
7.答案:A
解析:2min内,的物质的量由20mol减小到8mol,则,则2min内的反应速率为=0.6mol/(L·min);在同一个化学反应中,不同物质表示的速率之比等于化学计量数之比,,=1.2mol/(L·min),B、C、D错误;
故选A。
8.答案:C
解析:A.铁失电子生成,铁片是原电池的负极,碳棒是原电池的正极,故A错误;
B.该装置属于原电池,将化学能转化为电能,故B错误;
C.在原电池中,电子从负极沿导线流入正极,所以该原电池中,铁是负极、碳是正极,电子由铁片流出经过电流计流向碳棒,故C正确;
D.碳棒是原电池的正极,电极反应式为,故D错误;
选C。
9.答案:C
解析:A.活泼金属做负极,所以Zn为负极,Cu为正极,电流由铜片经导线流向锌片,A错误;
B.电解质溶液是KOH溶液,负极的电极反应式为,B错误;
C.锌筒作负极,发生氧化反应,锌失电子生成,使用一段时间锌筒会变薄,C正确;
D.铅蓄电池放电时,,使用一段时间后电解质溶液的酸性减弱,导电能力减弱,D错误;
故答案选C。
10.答案:C
解析:
11.答案:D
解析:可逆反应中反应物不可能完全转化为生成物,A项错误;可逆反应在一定条件下达到反应的限度即达到化学平衡状态,此时正、逆反应速率相等,都大于0,是动态平衡,B项错误;只要反应发生,CO和就以物质的量之比为1:2反应生成乙醇,C项错误;反应体系中乙醇的物质的量浓度不再变化,说明正、逆反应速率相等,反应达到最大限度,D项正确。
12.答案:B
解析:根据图解题思路,反应物的总能量低于生成物的总能量,反应为吸热反应,吸热反应不一定需要加热才能发生,有的吸热反应在常温下能发生。综上所述,B正确,选B,
13.答案:C
解析:A.装置中Cu作负极,电流方向由经导线到Cu,故A错误;
B.测量原理示意图中,被还原为正极,故B错误;
C.负极的电极反应式为:,故C正确;
D.电池工作时,向负极(也是阳极)移动,故D错误。
答案选C。
14.答案:C
解析:A.0~4min内消耗,消耗,根据速率之比等于化学计量数之比可知,A错误;
B.恒容容器中充入惰性气体,化学反应中各物质的浓度不变速率不变,B错误;
C.0~2min内变化了,体积为2L,代入数据计算的平均反应速率为,C正确;
D.增大反应物浓度,活化分子百分数不变,D错误;
故选C。
15.答案:4;第4组盐酸浓度较大,温度较高且铁呈颗粒状
解析:反应物浓度越大,反应速率越大;温度越高,反应速率越大;固体反应物表面积越大,反应速率越大。
16.答案:(1);
(2)Fe(铁);;
(3);正极;
解析: (1)根据两极金属相对活动性可确定锌为负极,铜为正极;
负极金属本身失去电子,发生氧化反应:;
若电解质为硫酸溶液,溶液中的氢离子在正极上得电子,发生还原反应:;
若电解质为硫酸铜溶液,溶液中的铜离子在正极上得电子,发生还原反应:。
(2)由电池的总反应方程式可知,铁的化合价升高,失去电子发生氧化反应,铁(Fe)作负极,负极反应式为;比铁活动性弱的金属或导电非金属作正极,氯化铁溶液为电解质溶液,溶液中的阳离子在正极上发生还原反应,正极反应式为。
(3)镁、铝与稀硫酸组成的原电池中,相对活动性强的金属镁为负极,铝为正极;负极反应式为。镁、铝与氢氧化钠溶液组成的原电池中,金属铝为负极,反应的离子方程式为。
17.答案:(1)
(2);AD
(3);Ⅰ和Ⅲ;乙
解析:(1)已知:①;
②;
则根据盖斯定律由①+②可以得到,=,故答案为:
(2)①0~2s内的变化量为mol/L,则的变化量为mol/L,则,故答案为:;
②A.该反应正反应是气体体积减小的反应,若体系中混合气体的平均摩尔质量不变,则各物质浓度笔辩,该反应达到平衡状态,故A正确;
B.体系中NO与均为生成物,始终为,故B错误;
C.一定压强下充入惰性气体,则体积变大,各物质浓度减小、均减小,故C错误;
D.该反应在4s时达到平衡状态,则,故,故D正确;
故选AD;
(3)①由表格数据可知,实验Ⅰ、Ⅱ温度相同,催化剂的比表面积不同,实验目的是验证催化剂的比表面积对反应速率的影响,则温度和反应物的初始浓度要相同;实验Ⅰ、Ⅲ催化剂的比表面积相同、温度不同,实验目的是验证温度对反应速率的影响,则反应物的初始浓度要相同,a应该为;故答案为:;
②由表格数据可知,实验Ⅰ、Ⅲ催化剂的比表面积相同,温度不同,实验目的是验证温度对反应速率的影响,故答案为:Ⅰ和Ⅲ;
③因实验Ⅰ、Ⅱ催化剂的比表面积不同,温度、反应物的初始浓度相同,催化剂的比表面积对平衡移动无影响,但实验Ⅱ的反应速率快,先达到化学平衡状态,故实验Ⅱ对应的为曲线乙,故答案为:乙。
18.答案:(1)放热;小于
(2)>,温度下反应速率快,先达到平衡,温度较高;;;B
(3),n;;8
解析:(1)根据相关物质的相对能量可知,1mol和3mol的总能量大于1mol和1mol的总能量,因此该反应为放热反应。放热反应反应物的键能之和小于生成物的键能之和,因此断裂1mol和3mol中的化学键吸收的总能量小于形成1mol和1mol中化学键释放的总能量。
(2)①温度,原因为温度下反应速率快,反应先达到平衡,温度较高。
②温度下,;a、b两点反应速
率的大小关系为。
③,未表明是正向速率还是逆向速率,不能说明反应已达到平衡状态,B符合题意。故选B。
(3)根据的迁移方向可知,电极n为负极,电极m为正极。①气体M为,电子的流向为由电极n沿导线流向电极m。
②负极的电极反应式为,正极的电极反应式为,当外电路中通过1mol电子时,消耗气体M的质量为8g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
第六章 化学反应与能量(B卷能力提升)——2024-2025学年高一化学人教版(2019)必修二单元测试AB卷
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共42分)
1.下列变化属于吸热反应的是( )
A.碘的升华 B.酸碱中和反应
C.氢气的燃烧 D.和反应
2.下列有关化学反应速率的说法正确的是( )
A.用铁片与稀硫酸反应制氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.的盐酸与锌片反应,加入适量的氯化钠溶液,反应速率不变
C.的催化氧化反应是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成和,减小压强时反应速率减慢
3.如图所示为某铜锌原电池示意图。下列有关该原电池的说法正确的是( )
A.锌电极为负极,发生氧化反应
B.溶液中流向Cu电极
C.电子从铜电极通过电流计流向锌电极
D.铜电极上发生的电极反应为
4.图为某原电池装置的示意图。下列叙述中,不正确的是( )
A.电子由Zn片通过导线流向Cu片
B.一段时间后,溶液的pH减小
C.将Zn片换成Fe片,电路中电流方向不变
D.将稀硫酸换成柠檬汁,导线中也会有电子移动
5.将气体和气体在的密闭容器中混合并在一定条件下发生如下反应:,若经后测得C的浓度为,则下列几种说法中正确的是( )
①2s末物质B的物质的量为
②用物质D表示的平均反应速率为
③2s时,物质A的转化率为30%
④用A、B、C来表示反应速率,其速率之比为2:1:3
A.①③④ B.①②③④ C.②④ D.③④
6.反应,在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A.mol/(L·s) B.mol/(L·s)
C.mol/(L·s) D.mol/(L·s)
7.反应在10L的密闭容器中进行,测得2min内,的物质的量由20mol减小到8mol,则2min内用表示的反应速率为( )
A.1.2mol/(L·min) B.6mol/(L·min) C.0.6mol/(L·min) D.0.4mol/(L·min)
8.电池因能提供持久稳定的电力支持,满足不同领域的需求,故应用广泛。如图为铁—碳原电池的装置示意图,下列说法正确的是( )
A.铁片是原电池的正极
B.该装置能将电能转化为化学能
C.电子由铁片流出经过电流计流向碳棒
D.碳棒上的电极反应式为
9.化学电源在生活中有广泛的应用,各种电池的示意图如图,下列有关说法正确的是( )
A.甲:电流由锌片经导线流向铜片
B.乙:负极的电极反应式为
C.丙:锌筒作负极,发生氧化反应,使用一段时间锌筒会变薄
D.丁:使用一段时间后电解质溶液的酸性增强,导电能力增大
10.化学电源是新能源和可再生能源的重要组成部分。科学家利用金属Al、海水及其中的溶解氧可组成化学电池,如图所示。下列说法正确的是( )
A. a端电势高于b端电势
B. 电池工作时,石墨电极区域海水pH减小
C. 电池工作时,海水中的Cl-向a电极移动
D. 67.2LO2参加反应,a电极消耗Al的质量为54g
11.CO和在一定条件下可以合成乙醇:,下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A.CO全部转化为乙醇
B.正反应和逆反应的化学反应速率均为0
C.CO和以1∶2的物质的量之比反应生成乙醇
D.反应体系中乙醇的物质的量浓度不再变化
12.已知反应的能量变化如图所示,下列说法正确的是( )
A.该反应为放热反应 B.该反应为吸热反应
C.反应物的总能量高于生成物的总能量 D.该反应只有在加热条件下才能进行
13.普通水泥在固化过程中自由水分子减少并产生,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此法的原理如图所示,反应的总方程式为:,下列有关说法正确的是( )
A.装置中电流方向由Cu经导线到
B.测量原理示意图中,为负极
C.负极的电极反应式为:
D.电池工作时,向正极移动
14.向2L恒容密闭容器中充入一定量和,在一定条件下发生反应且氧化产物只有一种,测得、的物质的量与时间的关系如图所示。下列叙述正确的是( )
A.该条件下发生的反应为
B.向该容器中再充入惰性气体,能提高反应速率
C.0~2min内的平均反应速率
D.其他条件不变,再充入,能提高反应物活化分子百分数
二、解答题(共4题,58分)
15.等质量的铁与过量盐酸在不同的实验条件下进行反应(实验数据见下表),c为初始时盐酸的浓度,在反应进行的最初阶段,测定在相同的反应时间里产生氢气的体积V。则V值最大的组是__________(填组别序号),其原因是_________________。
组别 温度/℃ 铁的状态
1 2.0 25 块状
2 2.5 30 颗粒
3 2.5 50 块状
4 2.5 50 颗粒
16.如图是常见原电池装置,电流表A发生偏转。
(1)若两个电极分别是锌、铜,电解质溶液是稀硫酸,正极的电极反应式为_____________;
如果把电解质溶液换成硫酸铜溶液,则正极的电极反应式为____________________________。
(2)若电池的总反应是,则可以作负极材料的是________,负极反应式是___________________________________,正极反应式是___________________________。
(3)若电解质溶液是稀硫酸,镁、铝两种金属作电极,则镁电极的反应式为___________;
若电解质溶液换作稀氢氧化钠溶液,镁、铝两金属作电极,则镁是________(选填“正极”或“负极”),总反应的离子方程式是_________________________________________________。
17.利用催化转化反应,可有效地将汽车尾气中的CO和NO同时除去。
(1)已知:;。计算:_________。
(2)一定温度下,向某密闭容器中充入等物质的量的NO和CO,发生上述反应。测得NO浓度随时间t的变化曲线如图。
①0~2s内的平均反应速率_________。
②下列有关该反应的说法正确的是_________(填标号)。
A.体系中混合气体的平均摩尔质量不变时,该反应达到平衡状态
B.体系中保持不变时,该反应达到平衡状态
C.一定压强下充入惰性气体,、均不变
D.5s时,
(3)增大催化剂的比表面积可提高该反应速率,为了探究温度、催化剂的比表面积对该反应速率的影响规律,某同学设计了如下三组实验。
实验编号 T/℃ NO初始浓度/() CO初始浓度/() 催化剂的比表面积/()
Ⅰ 280 82
Ⅱ 280 b 124
Ⅲ 350 a 82
①_______。
②探究温度对该反应速率影响规律的实验有_______(填实验编号)。
③实验Ⅰ和实验Ⅱ中,随时间t的变化曲线如图,表示实验Ⅱ的是曲线_______(填“甲”或“乙”)。
18.我国科学家研发的“液态阳光”计划:通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢制备成甲醇,其反应原理为。
(1)在一定温度下,相关物质的相对能量如图甲所示,该反应为________(填“放热”或“吸热”)反应;断裂1mol和3mol中化学键吸收的总能量________(填“大于”或“小于”)形成1mol和1mol中化学键释放的总能量。
(2)在体积为2L的密闭容器中充入2mol和6mol,分别在温度和下反应,测得的物质的量随时间变化如图乙所示。
①________(填“>”或“<”),原因为________。
②温度下,0~10min内________;a、b两点反应速率的大小关系为________。
③恒温恒容条件下,下列不能说明反应已达平衡状态的是________(填选项字母)。
A.混合气体的平均相对分子质量保持不变
B.
C.容器中浓度与浓度之比保持不变
D.的物质的量保持不变
(3)甲醇-氧气固体氧化物燃料电池属于第三代燃料电池,其工作原理如图丙所示。
①气体M为________(填化学式),电子由电极________(填“m”或“n”)流出。
②负极的电极反应式为________,当外电路中通过1mol电子时,消耗气体M的质量为________g。
参考答案
1.答案:D
解析:A.碘的升华过程吸热,但该过程是物理变化,A不符合题意;
B.酸碱中和反应属于放热反应,B不符合题意;
C.氢气的燃烧属于放热反应,C不符合题意;
D.与晶体混合反应是吸热反应,D符合题意;
答案选D。
2.答案:D
解析:A.常温下,铁遇到浓硫酸发生钝化,铁片与98%的浓硫酸无法反应生成氢气,A错误;
B.100mL2mol/L的盐酸与锌片反应,加入适量NaCl溶液,盐酸被稀释,反应速率减小,B错误;
C.的催化氧化是一个放热反应,但是一般情况下,升高温度,反应速率都会增大,C错误;
D.汽车尾气中的NO和CO反应生成和,减小压强反应速率减小,D正确;
故答案选D。
3.答案:A
解析:
4.答案:B
解析:
5.答案:D
解析:①经后测得C的浓度为,此时生成C的物质的量为,结合反应可知消耗的B的物质的量==0.6mol,2s末物质B的物质的量为,故错误;
②D为固体,不能表示反应速率,故错误;
③结合上述解题思路,2s时,消耗A的物质的量;A的转化率=,故正确;
④同一反应中用不同的物质表示的反应速率之比等于化学计量数之比,故正确;
综上所述,正确的为③④;
故选:D。
6.答案:A
解析:
7.答案:A
解析:2min内,的物质的量由20mol减小到8mol,则,则2min内的反应速率为=0.6mol/(L·min);在同一个化学反应中,不同物质表示的速率之比等于化学计量数之比,,=1.2mol/(L·min),B、C、D错误;
故选A。
8.答案:C
解析:A.铁失电子生成,铁片是原电池的负极,碳棒是原电池的正极,故A错误;
B.该装置属于原电池,将化学能转化为电能,故B错误;
C.在原电池中,电子从负极沿导线流入正极,所以该原电池中,铁是负极、碳是正极,电子由铁片流出经过电流计流向碳棒,故C正确;
D.碳棒是原电池的正极,电极反应式为,故D错误;
选C。
9.答案:C
解析:A.活泼金属做负极,所以Zn为负极,Cu为正极,电流由铜片经导线流向锌片,A错误;
B.电解质溶液是KOH溶液,负极的电极反应式为,B错误;
C.锌筒作负极,发生氧化反应,锌失电子生成,使用一段时间锌筒会变薄,C正确;
D.铅蓄电池放电时,,使用一段时间后电解质溶液的酸性减弱,导电能力减弱,D错误;
故答案选C。
10.答案:C
解析:
11.答案:D
解析:可逆反应中反应物不可能完全转化为生成物,A项错误;可逆反应在一定条件下达到反应的限度即达到化学平衡状态,此时正、逆反应速率相等,都大于0,是动态平衡,B项错误;只要反应发生,CO和就以物质的量之比为1:2反应生成乙醇,C项错误;反应体系中乙醇的物质的量浓度不再变化,说明正、逆反应速率相等,反应达到最大限度,D项正确。
12.答案:B
解析:根据图解题思路,反应物的总能量低于生成物的总能量,反应为吸热反应,吸热反应不一定需要加热才能发生,有的吸热反应在常温下能发生。综上所述,B正确,选B,
13.答案:C
解析:A.装置中Cu作负极,电流方向由经导线到Cu,故A错误;
B.测量原理示意图中,被还原为正极,故B错误;
C.负极的电极反应式为:,故C正确;
D.电池工作时,向负极(也是阳极)移动,故D错误。
答案选C。
14.答案:C
解析:A.0~4min内消耗,消耗,根据速率之比等于化学计量数之比可知,A错误;
B.恒容容器中充入惰性气体,化学反应中各物质的浓度不变速率不变,B错误;
C.0~2min内变化了,体积为2L,代入数据计算的平均反应速率为,C正确;
D.增大反应物浓度,活化分子百分数不变,D错误;
故选C。
15.答案:4;第4组盐酸浓度较大,温度较高且铁呈颗粒状
解析:反应物浓度越大,反应速率越大;温度越高,反应速率越大;固体反应物表面积越大,反应速率越大。
16.答案:(1);
(2)Fe(铁);;
(3);正极;
解析: (1)根据两极金属相对活动性可确定锌为负极,铜为正极;
负极金属本身失去电子,发生氧化反应:;
若电解质为硫酸溶液,溶液中的氢离子在正极上得电子,发生还原反应:;
若电解质为硫酸铜溶液,溶液中的铜离子在正极上得电子,发生还原反应:。
(2)由电池的总反应方程式可知,铁的化合价升高,失去电子发生氧化反应,铁(Fe)作负极,负极反应式为;比铁活动性弱的金属或导电非金属作正极,氯化铁溶液为电解质溶液,溶液中的阳离子在正极上发生还原反应,正极反应式为。
(3)镁、铝与稀硫酸组成的原电池中,相对活动性强的金属镁为负极,铝为正极;负极反应式为。镁、铝与氢氧化钠溶液组成的原电池中,金属铝为负极,反应的离子方程式为。
17.答案:(1)
(2);AD
(3);Ⅰ和Ⅲ;乙
解析:(1)已知:①;
②;
则根据盖斯定律由①+②可以得到,=,故答案为:
(2)①0~2s内的变化量为mol/L,则的变化量为mol/L,则,故答案为:;
②A.该反应正反应是气体体积减小的反应,若体系中混合气体的平均摩尔质量不变,则各物质浓度笔辩,该反应达到平衡状态,故A正确;
B.体系中NO与均为生成物,始终为,故B错误;
C.一定压强下充入惰性气体,则体积变大,各物质浓度减小、均减小,故C错误;
D.该反应在4s时达到平衡状态,则,故,故D正确;
故选AD;
(3)①由表格数据可知,实验Ⅰ、Ⅱ温度相同,催化剂的比表面积不同,实验目的是验证催化剂的比表面积对反应速率的影响,则温度和反应物的初始浓度要相同;实验Ⅰ、Ⅲ催化剂的比表面积相同、温度不同,实验目的是验证温度对反应速率的影响,则反应物的初始浓度要相同,a应该为;故答案为:;
②由表格数据可知,实验Ⅰ、Ⅲ催化剂的比表面积相同,温度不同,实验目的是验证温度对反应速率的影响,故答案为:Ⅰ和Ⅲ;
③因实验Ⅰ、Ⅱ催化剂的比表面积不同,温度、反应物的初始浓度相同,催化剂的比表面积对平衡移动无影响,但实验Ⅱ的反应速率快,先达到化学平衡状态,故实验Ⅱ对应的为曲线乙,故答案为:乙。
18.答案:(1)放热;小于
(2)>,温度下反应速率快,先达到平衡,温度较高;;;B
(3),n;;8
解析:(1)根据相关物质的相对能量可知,1mol和3mol的总能量大于1mol和1mol的总能量,因此该反应为放热反应。放热反应反应物的键能之和小于生成物的键能之和,因此断裂1mol和3mol中的化学键吸收的总能量小于形成1mol和1mol中化学键释放的总能量。
(2)①温度,原因为温度下反应速率快,反应先达到平衡,温度较高。
②温度下,;a、b两点反应速
率的大小关系为。
③,未表明是正向速率还是逆向速率,不能说明反应已达到平衡状态,B符合题意。故选B。
(3)根据的迁移方向可知,电极n为负极,电极m为正极。①气体M为,电子的流向为由电极n沿导线流向电极m。
②负极的电极反应式为,正极的电极反应式为,当外电路中通过1mol电子时,消耗气体M的质量为8g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
