第五单元 化工生产中的重要非金属元素(B卷能力提升)(含答案)——2024-2025学年高一化学人教版(2019)必修二单元测试AB卷
文档属性
| 名称 | 第五单元 化工生产中的重要非金属元素(B卷能力提升)(含答案)——2024-2025学年高一化学人教版(2019)必修二单元测试AB卷 |

|
|
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-18 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第五单元 化工生产中的重要非金属元素(B卷能力提升)——2024-2025学年高一化学人教版(2019)必修二单元测试AB卷
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共42分)
1.民之自信来之国之强大,化学与生产生活密切相关,下列说法中正确的是( )
A.陶瓷的主要原料是黏土,陶瓷可用于生产绝缘材料、卫生洁具等
B.硅在自然界中主要以单质形式存在
C.手机芯片和光导纤维的主要成分都是硅单质
D.石墨烯具有电阻率低、强度高等特点,是一种新型的化合物
2.实验室进行粗盐提纯时,需除去、和,所用试剂除、NaOH、盐酸和水外,还应该必备的试剂是( )
A. B. C.硝酸 D.小苏打
3.下列有关海水资源综合利用的说法错误的是( )
A.蒸馏海水可获得淡水
B.在制溴工业中,涉及氧化还原反应
C.在制镁工业中,可用贝壳为原料生产石灰乳以沉淀
D.为除去粗盐中的、、,可依次加入足量的、、溶液
4.我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。”这里的“强水”是指硝酸,下列有关硝酸的相关描述中正确的是( )
A.浓硝酸保存于无色试剂瓶中
B.常温下,浓硝酸可以用铝制容器储存,说明浓硝酸与铝不反应
C.向盛有溶液的试管中加入稀硫酸,可在试管口观察到红棕色气体
D.稀硝酸与金属反应时,可被还原为更低价态,说明稀硝酸氧化性强于浓硝酸
5.为除去粗盐中的、、、以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量),有关说法正确的是( )
A.步骤①:根据粗盐的质量和溶解度来确定烧杯和量筒的规格
B.步骤②~④:、和的滴加“顺序”和“量”不可调整
C.步骤⑥:用玻璃棒搅拌滤液,直到没有气泡冒出,且试纸检验滤液呈碱性
D.步骤①~⑦:需要的实验用品有分液漏斗、蒸发皿、玻璃棒、陶土网和胶头滴管
6.下列关于二氧化氮性质的描述中,不正确的是( )
A.无色气体 B.有刺激性气味
C.相同条件下密度比空气的大 D.能与水反应
7.利用如图装置进行浓硫酸与蔗糖反应的实验,敞口瓶中的蔗糖滴有少量水,将注射器中的浓硫酸注入其中,反应一段时间后,下列说法正确的是( )
A.湿润的蓝色石蕊试纸先变红后褪色,说明具有漂白性
B.浸有酸性溶液的滤纸条褪色,说明具有还原性
C.澄清石灰水变浑浊,说明反应有产生
D.该实验只体现了浓硫酸的吸水性和强氧化性
8.和在生产、生活和科学研究中有着广泛的应用,在实验室用下图装置验证木炭与浓硫酸反应中生成的气体成分,下列有关说法正确的是( )
A.①中品红褪色证明有氧化性
B.②中的试剂X应该是浓硫酸
C.③中的试剂Y应该是NaOH溶液
D.②中颜色变浅,但不消失,且③中出现浑浊,即可证明气体中有
9.下列气体中,不能用浓硫酸干燥的是( )
A.CO B. C. D.
10.下列实验操作和现象及结论均正确的是( )
选项 实验操作和现象 结论
A 向溴水中加入苯,振荡后静置,水层颜色变浅 溴与苯发生了加成反应
B 向溶液中加入2 mL溶液,将溶液分成两份,一份滴加淀粉溶液呈蓝色,另一份滴加KSCN溶液呈红色 和的反应存在限度
C 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
D 向丙烯醛中滴加溴水,溴水褪色 丙烯醛分子中含有碳碳双键
A.A B.B C.C D.D
11.下列反应中,不属于氮的固定的是( )
A.空气中的与放电时生成NO B.NO遇空气中的生成
C.和在一定条件下合成 D.豆科植物把转化为化合态的氮
12.下列事实与括号中浓硫酸的性质对应关系正确的是( )
A.浓硫酸可用来干燥某些气体(吸水性)
B.浓硫酸在加热条件下与铜反应(脱水性)
C.用浓硫酸在纸上书写的字迹变黑(氧化性)
D.空气中敞口久置的浓硫酸质量增大(挥发性)
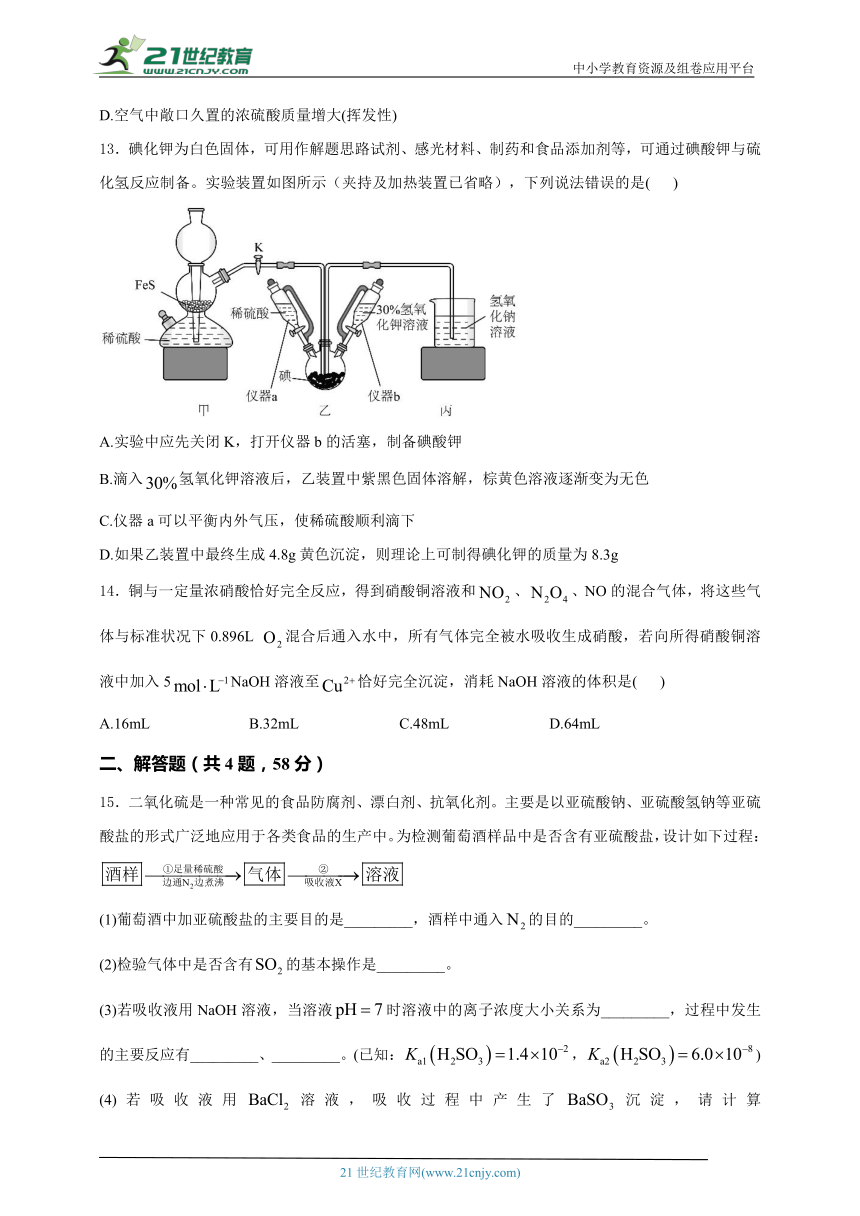
13.碘化钾为白色固体,可用作解题思路试剂、感光材料、制药和食品添加剂等,可通过碘酸钾与硫化氢反应制备。实验装置如图所示(夹持及加热装置已省略),下列说法错误的是( )
A.实验中应先关闭K,打开仪器b的活塞,制备碘酸钾
B.滴入氢氧化钾溶液后,乙装置中紫黑色固体溶解,棕黄色溶液逐渐变为无色
C.仪器a可以平衡内外气压,使稀硫酸顺利滴下
D.如果乙装置中最终生成4.8g黄色沉淀,则理论上可制得碘化钾的质量为8.3g
14.铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和、、NO的混合气体,将这些气体与标准状况下0.896L 混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5NaOH溶液至恰好完全沉淀,消耗NaOH溶液的体积是( )
A.16mL B.32mL C.48mL D.64mL
二、解答题(共4题,58分)
15.二氧化硫是一种常见的食品防腐剂、漂白剂、抗氧化剂。主要是以亚硫酸钠、亚硫酸氢钠等亚硫酸盐的形式广泛地应用于各类食品的生产中。为检测葡萄酒样品中是否含有亚硫酸盐,设计如下过程:
(1)葡萄酒中加亚硫酸盐的主要目的是_________,酒样中通入的目的_________。
(2)检验气体中是否含有的基本操作是_________。
(3)若吸收液用NaOH溶液,当溶液时溶液中的离子浓度大小关系为_________,过程中发生的主要反应有_________、_________。(已知:,)
(4)若吸收液用溶液,吸收过程中产生了沉淀,请计算的平衡常数_________。(已知:)
16.下表列出了①~⑨十种元素在周期表中的位置:
族周期 IA 0
1 ① IIA IIIA IVA VA VIA VIIA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
请按要求回答下列问题:
(1)⑧的名称是___________,1mol含有的中子个数为___________。
(2)上述元素中,最高价氧化物对应水化物酸性最强的是___________(写出酸的化学式)。
(3)由④、⑤、⑦四种元素形成的简单离子半径由大到小的顺序是:___________。(用离子符号表示)
(4)元素①,④以原子个数比为1∶1形成的化合物中含有化学键的类型为___________。(填“极性共价键”或“非极性共价键”或“离子键”)
(5)元素①、④、⑨以原子个数比为1∶1∶1形成的化合物的电子式为___________。
(6)19.2g金属铜与③的最高价氧化物的水化物反应生成还原产物,写出该反应的离子方程式:___________。
(7)可以比较⑤、⑥两元素金属性强弱的实验是___________。
A.比较这两种元素最高价氧化物对应的水化物的碱性
B.将⑤的单质投入到⑥的盐溶液中
C.将这两种元素的单质分别放入冷水中
D.比较这两种元素的单质与酸反应时失电子的数目
17.利用元素价—类二维图可以从不同角度研究物质的性质及其转化关系。如图为、元素的价—类二维图。回答下列问题:
(1)b的化学式为___________,c的电子式___________。
(2)e与h在碱性溶液中反应可得到i,发生反应的离子方程式为___________。
(3)按下图装置进行实验,验证高温分解产生的气体。现有试剂:
a.溶液 b.NaOH溶液 c.品红溶液 d.溶液
则装置I、II、III中所需试剂依次为___________(填标号)。
(4)在一定量NaOH溶液中通入一定量的,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有、、三种含氯元素的离子,其中、两种离子的物质的量()与反应时间()的曲线如图所示。
①时,NaOH与发生反应的总反应的化学方程式为:___________。
②据解题思路,生成的反应是由温度升高引起的,通入的速度不同,和的比例也不同。
若在原NaOH溶液中通入氯气的速度加快,则反应后___________3(填“>”、“<”或“=”);若,则___________mol(用含的代数式来表示)。
18.某粗盐溶液中除泥沙外,还含有等杂质离子,粗盐提纯后可以通过侯氏制碱法和氯碱工业制取多种重要工业产品。下图是有关工艺流程,A、B、C、D、E、F为中学化学常见物质。
回答下列问题:
(1)环节Ⅰ中A、C依次应加入的物质为、_______,加入D发生反应的离子方程式为_______________。
(2)环节Ⅱ中为了产生更多沉淀,应先通入过量的气体E为__________(填化学式),再通入_________(填“少量”或“过量”)的F,这时发生反应的化学方程式为_________________。热分解时需用到的仪器为______(填字母)。
A.表面皿 B.蒸发皿 C.培养皿 D.坩埚
(3)环节Ⅲ在阴极发生的电极反应为___________,电解一段时间后加适量__________可以使电解液恢复到电解前的浓度;产生的气体2可以与所得烧碱溶液发生反应制取消毒液,化学方程式为____________________。
参考答案
1.答案:A
解析:
A.陶瓷的主要原料是黏土,陶瓷可用于生产绝缘材料、卫生洁具等,A正确;
B.Si在自然界中主要以化合态存在,主要以硅酸盐和氧化物的形式存在,B错误;
C.光纤的主要成分是二氧化硅,手机芯片的主要成分是单质硅,C错误;
D.石墨烯具有电阻率低、强度高等特点,是单质,D错误;
故选A。
2.答案:A
解析:加入氯化钡时,能和反应生成硫酸钡沉淀,从而除去,加入碳酸钠溶液时,能和反应生成碳酸钙沉淀、碳酸钡沉淀,从而除去钙离子和过量的钡离子;加入过量氢氧化钠溶液,生成氢氧化镁沉淀,除去镁离子;过滤,向滤液中加入适量的稀盐酸时,可以把过量的氢氧化钠和碳酸钠除去,故还应该必备的试剂是,故选:A。
3.答案:D
解析:A.蒸馏海水可获得淡水蒸馏水,A正确;
B.在制溴工业中,通过氧化、还原、再氧化的步骤实现了将海水中溴的富集,B正确;
C.氢氧化钙和镁离子可以生成氢氧化镁沉淀,C正确;
D.操作中碳酸钠应该在氯化钡之后,碳酸钠可除去钙离子和过量的钡离子,D错误;
故选D。
4.答案:C
解析:浓硝酸见光会分解,要保存在棕色试剂瓶中,A项错误:常温下,铝与浓硝酸发生钝化,所以浓硝酸可以用铝制容器储存,B项错误:酸性溶液中硝酸根离子有强氧化性,与亚铁离子发生氧化还原反应生成一氧化氮,一氧化氮在试管口与氧气反应生成二氧化氮,可在试管口观察到红棕色气体,C项正确:稀硝酸与金属反应时,稀硝酸被还原为一氧化氮,反应较慢,浓硝酸被还原为二氧化氮,反应较快,所以稀硝酸的氧化性比浓硝酸弱,D项错误。
5.答案:A
解析:A.溶解操作中要根据粗盐的质量和溶解度来确定烧杯和量筒的规格,A正确;
B.步骤②~④中:必须要在加完溶液之后再加入,作用是除去和过量的Ba2+,NaOH的顺序没有要求,B错误;
C.步骤⑥加适量HCl除去③加入的过量的和④加入的过量的,加入的盐酸是过量的,溶液呈酸性,C错误;
D.由解题思路可知,步骤①~⑦中没有分液,不需要用到分液漏斗,D错误;
故选A。
6.答案:A
解析:A.为红棕色气体,A不正确;
B.有刺激性气味,B正确;
C.相同条件下,密度比空气的大,C正确;
D.能与水反应生成硝酸和NO,D正确。
选不正确的,故为A。
7.答案:B
解析:A.能使湿润石蕊试纸变红,但不能使石蕊褪色,A错误;
B.浸有酸性溶液的滤纸条褪色,二氧化硫被氧化为硫酸根离子,说明具有还原性,B正确;
C.和均能使澄清石灰水变浑浊,C错误;
D.蔗糖变黑,则发生脱水炭化,该实验体现了浓硫酸的脱水性和强氧化性,D错误;
故选B。
8.答案:D
解析:A.①中品红褪色证明有漂白性,A错误;
B.②中X溶液用于吸收,可用酸性高锰酸钾溶液,浓硫酸只能用于干燥气体,B错误;
C.③中的Y溶液为澄清石灰水,用于检验,C错误;
D.②中酸性高锰酸钾溶液颜色变浅,但不消失,证明被完全吸收,③中出现浑浊,即可证明气体中有,D正确;
故选D。
9.答案:D
A.COA.CO可以用浓硫酸干燥,A正确;
B.可以用浓硫酸干燥,B正确;
C.可以用浓硫酸干燥,C正确;
D.浓硫酸具有酸性,不可以干燥碱性气体氨气,D正确;
故选D。
10.答案:B
解析:向溴水中加入苯,振荡后静置,溴被苯萃取,水层颜色变浅,不能说明溴与苯发生了加成反应,A错误;可将氧化为,关系式:,过量,根据实验现象可知,反应后溶液中存在和,说明该反应是可逆反应,存在限度,B正确;浓硝酸常温下使Fe发生针化,无明显现象不能说明稀硝酸的氧化性强于浓硝酸,C错误;丙烯醛分子中含有碳碳双键和醛基,两者均可使溴水褪色,不能得出相应结论,D错误。
11.答案:B
解析:将游离态的氮转化为化合态的氮的过程,叫做氮的固定,据此解题思路作答。
A.雷雨闪电时空气中的与化合生成NO,是将游离态的氮转化为化合态的氮的过程,属于氮的固定,A项正确;
B.NO和生成是氮的化合物之间的转化过程,不属于氮的固定,B项错误;
C.和在一定条件下合成,是将游离态的氮转化为化合态的氮的过程,属于氮的固定,C项正确;
D.豆科植物把转化为化合态的氮,是将游离态的氮转化为化合态的氮的过程,属于氮的固定,D项正确;
答案选B。
12.答案:A
解析:A.浓硫酸具有吸水性,可用来做干燥剂,干燥某些气体,故A正确;
B.浓硫酸在加热条件下与铜反应,体现了浓硫酸的氧化性和酸性,故B错误;
C.浓硫酸在纸上书写的字迹变黑,是浓硫酸使纸中纤维脱水碳化,故C错误;
D.空气中敞口久置的浓硫酸质量增大,是因为浓硫酸具有吸水性,故D错误;
答案A。
13.答案:D
解析:仪器a、b为恒压滴液漏斗,利用碘酸钾与硫化氢气体制备碘化钾,需先关闭K、打开仪器b制备碘酸钾,然后打开K将硫化氢通入碘酸钾溶液制备碘化钾,A项正确;
碘单质溶解后溶液呈棕黄色,随着碘单质与氢氧化钾反应生成无色的碘化钾和碘酸钾,溶液逐渐变为无色,B项正确;
硫化氢为弱电解质,加入稀硫酸能抑制硫化氢的电离,降低其溶解度,使其逸出吸收,C项正确;
黄色沉淀为S,为0.15mol,硫元素由硫化氢中的-2价升高为0价,转移0.3mol电子,每生成1mol碘化钾转移1mol电子,因此共生成碘化钾0.3mol,质量为49.8g,D项错误。
14.答案:B
解析:、、NO混合气体与标准状况下0.896L 混合后通入水中,所有气体完全被水吸收生成硝酸,说明整个过程中被还原的反应前后没有变化,即Cu失去的电子都被得到了,根据得失电子守恒建立关系式:,解得,根据得NaOH为,则NaOH溶液的体积。
15.答案:(1)防止葡萄酒被氧化;赶出
(2)将气体通入品红溶液中,溶液褪色,受热后又恢复红色,则说明有二氧化硫
(3);;
或
(4)1.68
解析:
16.答案:(1)①.硫②.
(2)
(3)
(4)极性共价键和非极性共价键
(5)
(6)
(7)AC
解析:(1)⑧为S元素,名称为硫,1个含有10个中子,1mol含有的中子个数为10;
(2)上述元素中,对应的最高价氧化物对应水化物酸性最强的是;
(3)由④、⑤、⑦四种元素形成的简单离子分别为,它们的核外电子层结构相同,核电荷数越小,离子半径越大,故半径:;
(4)元素H和O按照1∶1形成的化合物是,含有的化学键有极性共价键和非极性共价键;
(5)元素H、O、Cl以原子个数比为1∶1∶1形成的化合物是HClO,电子式为:;
(6)③的最高价氧化物的水化物,1.92gCu的物质的量为0.3mol,失去0.6mol电子,得到的还原产物是,根据电子守恒,NO的物质的量为0.1mol,为0.3mol,离子方程式为:;
(7)A.⑤、⑥两元素分别为Na、Mg,元素的金属性越强,其最高价氧化物对应水化物的碱性越强,则比较这两种元素最高价氧化物对应的水化物的碱性,可确定Na的金属性比Mg强,故A符合题意;
B.因为Na能与水反应,所以将Na投入到Mg的盐溶液中,二者不能发生置换反应,故B不符合题意;
C.将这两种元素的单质分别放入冷水中,Na与冷水剧烈反应,而Mg与冷水不反应,从而确定Na的金属性比Mg强,故C符合题意;
D.元素的金属性强弱与失电子能力有关,与其单质与酸反应时失电子的数目无关,则比较这两种元素的单质与酸反应时失电子的数目,不能比较⑤、⑥两元素金属性强弱,故D不符合题意;答案为AC。
17.答案:(1);
(2)
(3)d,c,b
(4);<;
解析:a为,b为,c为HClO,d为,e为KClO,f为Fe,g为,h为,i为;
(1)b的类型是氧化物,氯元素化合价为+7,则化学式为,c为HClO,O分别与H和Cl共用1对电子对,电子式为;
(2)e为KClO,h为,在碱性溶液中反应可得到i为,铁元素化合价升高,则氯元素化合价降低,KClO被还原为KCl,发生反应的离子方程式为;
(3)高温分解产生的气体为,先用溶液检验的存在,再用品红溶液检验的存在,最后用NaOH溶液除去气体,则装置I、II、III中所需试剂依次为d,c,b;
(4)①由图可知,时,n()=1mol,失去电子为3mol×1+1mol×5=8mol,则得到电子为8mol,时,NaOH与发生反应的总反应的化学方程式为:;
②通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n()增多,则反应后<3;时氯气恰好与NaOH完全反应,参与反应的氯气,根据氯元素守恒可知,,若,根据电子转移守恒有,,根据电子转移守恒有,,联立方程解得。
18.答案:(1);、
(2);过量;
(或);D
(3)或;HCl;
解析:(1)由解题思路可知。环节Ⅰ中A、B、C依次应加入的物质为,试剂D为盐酸,盐酸和过量的氢氧化钠,过量的碳酸钠反应,离子方程式为、;
(2)氨气在水中的溶解度大,故先通入过量的气体E为;再通入过量二氧化碳;对应的反应为;加热碳酸氢钠分解生成碳酸钠,加热固体物质应该用坩埚。故选D;
(3)电解氯化钠溶液时,在阴极发生的电极反应为或;在阳极氯离子失去电子生成气体2为氯气。氯气与所得烧碱溶液发生反应制取消毒液。化学方程式为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
第五单元 化工生产中的重要非金属元素(B卷能力提升)——2024-2025学年高一化学人教版(2019)必修二单元测试AB卷
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共42分)
1.民之自信来之国之强大,化学与生产生活密切相关,下列说法中正确的是( )
A.陶瓷的主要原料是黏土,陶瓷可用于生产绝缘材料、卫生洁具等
B.硅在自然界中主要以单质形式存在
C.手机芯片和光导纤维的主要成分都是硅单质
D.石墨烯具有电阻率低、强度高等特点,是一种新型的化合物
2.实验室进行粗盐提纯时,需除去、和,所用试剂除、NaOH、盐酸和水外,还应该必备的试剂是( )
A. B. C.硝酸 D.小苏打
3.下列有关海水资源综合利用的说法错误的是( )
A.蒸馏海水可获得淡水
B.在制溴工业中,涉及氧化还原反应
C.在制镁工业中,可用贝壳为原料生产石灰乳以沉淀
D.为除去粗盐中的、、,可依次加入足量的、、溶液
4.我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。”这里的“强水”是指硝酸,下列有关硝酸的相关描述中正确的是( )
A.浓硝酸保存于无色试剂瓶中
B.常温下,浓硝酸可以用铝制容器储存,说明浓硝酸与铝不反应
C.向盛有溶液的试管中加入稀硫酸,可在试管口观察到红棕色气体
D.稀硝酸与金属反应时,可被还原为更低价态,说明稀硝酸氧化性强于浓硝酸
5.为除去粗盐中的、、、以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量),有关说法正确的是( )
A.步骤①:根据粗盐的质量和溶解度来确定烧杯和量筒的规格
B.步骤②~④:、和的滴加“顺序”和“量”不可调整
C.步骤⑥:用玻璃棒搅拌滤液,直到没有气泡冒出,且试纸检验滤液呈碱性
D.步骤①~⑦:需要的实验用品有分液漏斗、蒸发皿、玻璃棒、陶土网和胶头滴管
6.下列关于二氧化氮性质的描述中,不正确的是( )
A.无色气体 B.有刺激性气味
C.相同条件下密度比空气的大 D.能与水反应
7.利用如图装置进行浓硫酸与蔗糖反应的实验,敞口瓶中的蔗糖滴有少量水,将注射器中的浓硫酸注入其中,反应一段时间后,下列说法正确的是( )
A.湿润的蓝色石蕊试纸先变红后褪色,说明具有漂白性
B.浸有酸性溶液的滤纸条褪色,说明具有还原性
C.澄清石灰水变浑浊,说明反应有产生
D.该实验只体现了浓硫酸的吸水性和强氧化性
8.和在生产、生活和科学研究中有着广泛的应用,在实验室用下图装置验证木炭与浓硫酸反应中生成的气体成分,下列有关说法正确的是( )
A.①中品红褪色证明有氧化性
B.②中的试剂X应该是浓硫酸
C.③中的试剂Y应该是NaOH溶液
D.②中颜色变浅,但不消失,且③中出现浑浊,即可证明气体中有
9.下列气体中,不能用浓硫酸干燥的是( )
A.CO B. C. D.
10.下列实验操作和现象及结论均正确的是( )
选项 实验操作和现象 结论
A 向溴水中加入苯,振荡后静置,水层颜色变浅 溴与苯发生了加成反应
B 向溶液中加入2 mL溶液,将溶液分成两份,一份滴加淀粉溶液呈蓝色,另一份滴加KSCN溶液呈红色 和的反应存在限度
C 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
D 向丙烯醛中滴加溴水,溴水褪色 丙烯醛分子中含有碳碳双键
A.A B.B C.C D.D
11.下列反应中,不属于氮的固定的是( )
A.空气中的与放电时生成NO B.NO遇空气中的生成
C.和在一定条件下合成 D.豆科植物把转化为化合态的氮
12.下列事实与括号中浓硫酸的性质对应关系正确的是( )
A.浓硫酸可用来干燥某些气体(吸水性)
B.浓硫酸在加热条件下与铜反应(脱水性)
C.用浓硫酸在纸上书写的字迹变黑(氧化性)
D.空气中敞口久置的浓硫酸质量增大(挥发性)
13.碘化钾为白色固体,可用作解题思路试剂、感光材料、制药和食品添加剂等,可通过碘酸钾与硫化氢反应制备。实验装置如图所示(夹持及加热装置已省略),下列说法错误的是( )
A.实验中应先关闭K,打开仪器b的活塞,制备碘酸钾
B.滴入氢氧化钾溶液后,乙装置中紫黑色固体溶解,棕黄色溶液逐渐变为无色
C.仪器a可以平衡内外气压,使稀硫酸顺利滴下
D.如果乙装置中最终生成4.8g黄色沉淀,则理论上可制得碘化钾的质量为8.3g
14.铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和、、NO的混合气体,将这些气体与标准状况下0.896L 混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5NaOH溶液至恰好完全沉淀,消耗NaOH溶液的体积是( )
A.16mL B.32mL C.48mL D.64mL
二、解答题(共4题,58分)
15.二氧化硫是一种常见的食品防腐剂、漂白剂、抗氧化剂。主要是以亚硫酸钠、亚硫酸氢钠等亚硫酸盐的形式广泛地应用于各类食品的生产中。为检测葡萄酒样品中是否含有亚硫酸盐,设计如下过程:
(1)葡萄酒中加亚硫酸盐的主要目的是_________,酒样中通入的目的_________。
(2)检验气体中是否含有的基本操作是_________。
(3)若吸收液用NaOH溶液,当溶液时溶液中的离子浓度大小关系为_________,过程中发生的主要反应有_________、_________。(已知:,)
(4)若吸收液用溶液,吸收过程中产生了沉淀,请计算的平衡常数_________。(已知:)
16.下表列出了①~⑨十种元素在周期表中的位置:
族周期 IA 0
1 ① IIA IIIA IVA VA VIA VIIA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
请按要求回答下列问题:
(1)⑧的名称是___________,1mol含有的中子个数为___________。
(2)上述元素中,最高价氧化物对应水化物酸性最强的是___________(写出酸的化学式)。
(3)由④、⑤、⑦四种元素形成的简单离子半径由大到小的顺序是:___________。(用离子符号表示)
(4)元素①,④以原子个数比为1∶1形成的化合物中含有化学键的类型为___________。(填“极性共价键”或“非极性共价键”或“离子键”)
(5)元素①、④、⑨以原子个数比为1∶1∶1形成的化合物的电子式为___________。
(6)19.2g金属铜与③的最高价氧化物的水化物反应生成还原产物,写出该反应的离子方程式:___________。
(7)可以比较⑤、⑥两元素金属性强弱的实验是___________。
A.比较这两种元素最高价氧化物对应的水化物的碱性
B.将⑤的单质投入到⑥的盐溶液中
C.将这两种元素的单质分别放入冷水中
D.比较这两种元素的单质与酸反应时失电子的数目
17.利用元素价—类二维图可以从不同角度研究物质的性质及其转化关系。如图为、元素的价—类二维图。回答下列问题:
(1)b的化学式为___________,c的电子式___________。
(2)e与h在碱性溶液中反应可得到i,发生反应的离子方程式为___________。
(3)按下图装置进行实验,验证高温分解产生的气体。现有试剂:
a.溶液 b.NaOH溶液 c.品红溶液 d.溶液
则装置I、II、III中所需试剂依次为___________(填标号)。
(4)在一定量NaOH溶液中通入一定量的,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有、、三种含氯元素的离子,其中、两种离子的物质的量()与反应时间()的曲线如图所示。
①时,NaOH与发生反应的总反应的化学方程式为:___________。
②据解题思路,生成的反应是由温度升高引起的,通入的速度不同,和的比例也不同。
若在原NaOH溶液中通入氯气的速度加快,则反应后___________3(填“>”、“<”或“=”);若,则___________mol(用含的代数式来表示)。
18.某粗盐溶液中除泥沙外,还含有等杂质离子,粗盐提纯后可以通过侯氏制碱法和氯碱工业制取多种重要工业产品。下图是有关工艺流程,A、B、C、D、E、F为中学化学常见物质。
回答下列问题:
(1)环节Ⅰ中A、C依次应加入的物质为、_______,加入D发生反应的离子方程式为_______________。
(2)环节Ⅱ中为了产生更多沉淀,应先通入过量的气体E为__________(填化学式),再通入_________(填“少量”或“过量”)的F,这时发生反应的化学方程式为_________________。热分解时需用到的仪器为______(填字母)。
A.表面皿 B.蒸发皿 C.培养皿 D.坩埚
(3)环节Ⅲ在阴极发生的电极反应为___________,电解一段时间后加适量__________可以使电解液恢复到电解前的浓度;产生的气体2可以与所得烧碱溶液发生反应制取消毒液,化学方程式为____________________。
参考答案
1.答案:A
解析:
A.陶瓷的主要原料是黏土,陶瓷可用于生产绝缘材料、卫生洁具等,A正确;
B.Si在自然界中主要以化合态存在,主要以硅酸盐和氧化物的形式存在,B错误;
C.光纤的主要成分是二氧化硅,手机芯片的主要成分是单质硅,C错误;
D.石墨烯具有电阻率低、强度高等特点,是单质,D错误;
故选A。
2.答案:A
解析:加入氯化钡时,能和反应生成硫酸钡沉淀,从而除去,加入碳酸钠溶液时,能和反应生成碳酸钙沉淀、碳酸钡沉淀,从而除去钙离子和过量的钡离子;加入过量氢氧化钠溶液,生成氢氧化镁沉淀,除去镁离子;过滤,向滤液中加入适量的稀盐酸时,可以把过量的氢氧化钠和碳酸钠除去,故还应该必备的试剂是,故选:A。
3.答案:D
解析:A.蒸馏海水可获得淡水蒸馏水,A正确;
B.在制溴工业中,通过氧化、还原、再氧化的步骤实现了将海水中溴的富集,B正确;
C.氢氧化钙和镁离子可以生成氢氧化镁沉淀,C正确;
D.操作中碳酸钠应该在氯化钡之后,碳酸钠可除去钙离子和过量的钡离子,D错误;
故选D。
4.答案:C
解析:浓硝酸见光会分解,要保存在棕色试剂瓶中,A项错误:常温下,铝与浓硝酸发生钝化,所以浓硝酸可以用铝制容器储存,B项错误:酸性溶液中硝酸根离子有强氧化性,与亚铁离子发生氧化还原反应生成一氧化氮,一氧化氮在试管口与氧气反应生成二氧化氮,可在试管口观察到红棕色气体,C项正确:稀硝酸与金属反应时,稀硝酸被还原为一氧化氮,反应较慢,浓硝酸被还原为二氧化氮,反应较快,所以稀硝酸的氧化性比浓硝酸弱,D项错误。
5.答案:A
解析:A.溶解操作中要根据粗盐的质量和溶解度来确定烧杯和量筒的规格,A正确;
B.步骤②~④中:必须要在加完溶液之后再加入,作用是除去和过量的Ba2+,NaOH的顺序没有要求,B错误;
C.步骤⑥加适量HCl除去③加入的过量的和④加入的过量的,加入的盐酸是过量的,溶液呈酸性,C错误;
D.由解题思路可知,步骤①~⑦中没有分液,不需要用到分液漏斗,D错误;
故选A。
6.答案:A
解析:A.为红棕色气体,A不正确;
B.有刺激性气味,B正确;
C.相同条件下,密度比空气的大,C正确;
D.能与水反应生成硝酸和NO,D正确。
选不正确的,故为A。
7.答案:B
解析:A.能使湿润石蕊试纸变红,但不能使石蕊褪色,A错误;
B.浸有酸性溶液的滤纸条褪色,二氧化硫被氧化为硫酸根离子,说明具有还原性,B正确;
C.和均能使澄清石灰水变浑浊,C错误;
D.蔗糖变黑,则发生脱水炭化,该实验体现了浓硫酸的脱水性和强氧化性,D错误;
故选B。
8.答案:D
解析:A.①中品红褪色证明有漂白性,A错误;
B.②中X溶液用于吸收,可用酸性高锰酸钾溶液,浓硫酸只能用于干燥气体,B错误;
C.③中的Y溶液为澄清石灰水,用于检验,C错误;
D.②中酸性高锰酸钾溶液颜色变浅,但不消失,证明被完全吸收,③中出现浑浊,即可证明气体中有,D正确;
故选D。
9.答案:D
A.COA.CO可以用浓硫酸干燥,A正确;
B.可以用浓硫酸干燥,B正确;
C.可以用浓硫酸干燥,C正确;
D.浓硫酸具有酸性,不可以干燥碱性气体氨气,D正确;
故选D。
10.答案:B
解析:向溴水中加入苯,振荡后静置,溴被苯萃取,水层颜色变浅,不能说明溴与苯发生了加成反应,A错误;可将氧化为,关系式:,过量,根据实验现象可知,反应后溶液中存在和,说明该反应是可逆反应,存在限度,B正确;浓硝酸常温下使Fe发生针化,无明显现象不能说明稀硝酸的氧化性强于浓硝酸,C错误;丙烯醛分子中含有碳碳双键和醛基,两者均可使溴水褪色,不能得出相应结论,D错误。
11.答案:B
解析:将游离态的氮转化为化合态的氮的过程,叫做氮的固定,据此解题思路作答。
A.雷雨闪电时空气中的与化合生成NO,是将游离态的氮转化为化合态的氮的过程,属于氮的固定,A项正确;
B.NO和生成是氮的化合物之间的转化过程,不属于氮的固定,B项错误;
C.和在一定条件下合成,是将游离态的氮转化为化合态的氮的过程,属于氮的固定,C项正确;
D.豆科植物把转化为化合态的氮,是将游离态的氮转化为化合态的氮的过程,属于氮的固定,D项正确;
答案选B。
12.答案:A
解析:A.浓硫酸具有吸水性,可用来做干燥剂,干燥某些气体,故A正确;
B.浓硫酸在加热条件下与铜反应,体现了浓硫酸的氧化性和酸性,故B错误;
C.浓硫酸在纸上书写的字迹变黑,是浓硫酸使纸中纤维脱水碳化,故C错误;
D.空气中敞口久置的浓硫酸质量增大,是因为浓硫酸具有吸水性,故D错误;
答案A。
13.答案:D
解析:仪器a、b为恒压滴液漏斗,利用碘酸钾与硫化氢气体制备碘化钾,需先关闭K、打开仪器b制备碘酸钾,然后打开K将硫化氢通入碘酸钾溶液制备碘化钾,A项正确;
碘单质溶解后溶液呈棕黄色,随着碘单质与氢氧化钾反应生成无色的碘化钾和碘酸钾,溶液逐渐变为无色,B项正确;
硫化氢为弱电解质,加入稀硫酸能抑制硫化氢的电离,降低其溶解度,使其逸出吸收,C项正确;
黄色沉淀为S,为0.15mol,硫元素由硫化氢中的-2价升高为0价,转移0.3mol电子,每生成1mol碘化钾转移1mol电子,因此共生成碘化钾0.3mol,质量为49.8g,D项错误。
14.答案:B
解析:、、NO混合气体与标准状况下0.896L 混合后通入水中,所有气体完全被水吸收生成硝酸,说明整个过程中被还原的反应前后没有变化,即Cu失去的电子都被得到了,根据得失电子守恒建立关系式:,解得,根据得NaOH为,则NaOH溶液的体积。
15.答案:(1)防止葡萄酒被氧化;赶出
(2)将气体通入品红溶液中,溶液褪色,受热后又恢复红色,则说明有二氧化硫
(3);;
或
(4)1.68
解析:
16.答案:(1)①.硫②.
(2)
(3)
(4)极性共价键和非极性共价键
(5)
(6)
(7)AC
解析:(1)⑧为S元素,名称为硫,1个含有10个中子,1mol含有的中子个数为10;
(2)上述元素中,对应的最高价氧化物对应水化物酸性最强的是;
(3)由④、⑤、⑦四种元素形成的简单离子分别为,它们的核外电子层结构相同,核电荷数越小,离子半径越大,故半径:;
(4)元素H和O按照1∶1形成的化合物是,含有的化学键有极性共价键和非极性共价键;
(5)元素H、O、Cl以原子个数比为1∶1∶1形成的化合物是HClO,电子式为:;
(6)③的最高价氧化物的水化物,1.92gCu的物质的量为0.3mol,失去0.6mol电子,得到的还原产物是,根据电子守恒,NO的物质的量为0.1mol,为0.3mol,离子方程式为:;
(7)A.⑤、⑥两元素分别为Na、Mg,元素的金属性越强,其最高价氧化物对应水化物的碱性越强,则比较这两种元素最高价氧化物对应的水化物的碱性,可确定Na的金属性比Mg强,故A符合题意;
B.因为Na能与水反应,所以将Na投入到Mg的盐溶液中,二者不能发生置换反应,故B不符合题意;
C.将这两种元素的单质分别放入冷水中,Na与冷水剧烈反应,而Mg与冷水不反应,从而确定Na的金属性比Mg强,故C符合题意;
D.元素的金属性强弱与失电子能力有关,与其单质与酸反应时失电子的数目无关,则比较这两种元素的单质与酸反应时失电子的数目,不能比较⑤、⑥两元素金属性强弱,故D不符合题意;答案为AC。
17.答案:(1);
(2)
(3)d,c,b
(4);<;
解析:a为,b为,c为HClO,d为,e为KClO,f为Fe,g为,h为,i为;
(1)b的类型是氧化物,氯元素化合价为+7,则化学式为,c为HClO,O分别与H和Cl共用1对电子对,电子式为;
(2)e为KClO,h为,在碱性溶液中反应可得到i为,铁元素化合价升高,则氯元素化合价降低,KClO被还原为KCl,发生反应的离子方程式为;
(3)高温分解产生的气体为,先用溶液检验的存在,再用品红溶液检验的存在,最后用NaOH溶液除去气体,则装置I、II、III中所需试剂依次为d,c,b;
(4)①由图可知,时,n()=1mol,失去电子为3mol×1+1mol×5=8mol,则得到电子为8mol,时,NaOH与发生反应的总反应的化学方程式为:;
②通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n()增多,则反应后<3;时氯气恰好与NaOH完全反应,参与反应的氯气,根据氯元素守恒可知,,若,根据电子转移守恒有,,根据电子转移守恒有,,联立方程解得。
18.答案:(1);、
(2);过量;
(或);D
(3)或;HCl;
解析:(1)由解题思路可知。环节Ⅰ中A、B、C依次应加入的物质为,试剂D为盐酸,盐酸和过量的氢氧化钠,过量的碳酸钠反应,离子方程式为、;
(2)氨气在水中的溶解度大,故先通入过量的气体E为;再通入过量二氧化碳;对应的反应为;加热碳酸氢钠分解生成碳酸钠,加热固体物质应该用坩埚。故选D;
(3)电解氯化钠溶液时,在阴极发生的电极反应为或;在阳极氯离子失去电子生成气体2为氯气。氯气与所得烧碱溶液发生反应制取消毒液。化学方程式为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
