湖北省随州市部分高中2024-2025学年高一下学期3月联考化学试卷(含解析)
文档属性
| 名称 | 湖北省随州市部分高中2024-2025学年高一下学期3月联考化学试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 413.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-17 16:14:27 | ||
图片预览




文档简介
湖北省随州市部分高中2024--2025学年下学期三月联考
高一化学试题
本试卷共8页,19题,全卷满分100分,考试用时75分钟。
★祝考试顺利★
考试范围:
必修一;必修二第1章
注意事项:
1、答题前,请将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准考证号条形码粘贴在答题卡上的制定位置。
2、选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3、非选择题作答:用黑色签字笔直接答在答题卡对应的答题区域内,写在试卷、草稿纸和答题卡上的非答题区域均无效。
4、考试结束后,请将答题卡上交。
一、选择题:本题共15小题,每题3分,共45分,每小题仅有一项是符合题意。
1、下列每组反应可用同一离子方程式表示的是( )
A.HCl溶液+Na2CO3溶液;HCl溶液+NaHCO3溶液
B.NaOH溶液+HCl溶液;Ba(OH)2溶液+H2SO4溶液
C.CaCO3+HCl溶液;Na2CO3溶液+H2SO4溶液
D.BaCl2溶液+H2SO4溶液;Ba(OH)2溶液+Na2SO4溶液
2、氮元素在自然界的某种转化示意图如图所示(a、b、c和d代表一定比例的H+和e-)。下列说法正确的是( )
A.过程①中NO体现氧化性
B.过程②中发生反应的离子方程式为NO+H++e-===NO↑+H2O
C.过程③中c代表的是3H++3e-
D.过程④中1 mol N2H4参加反应转移6 mol电子
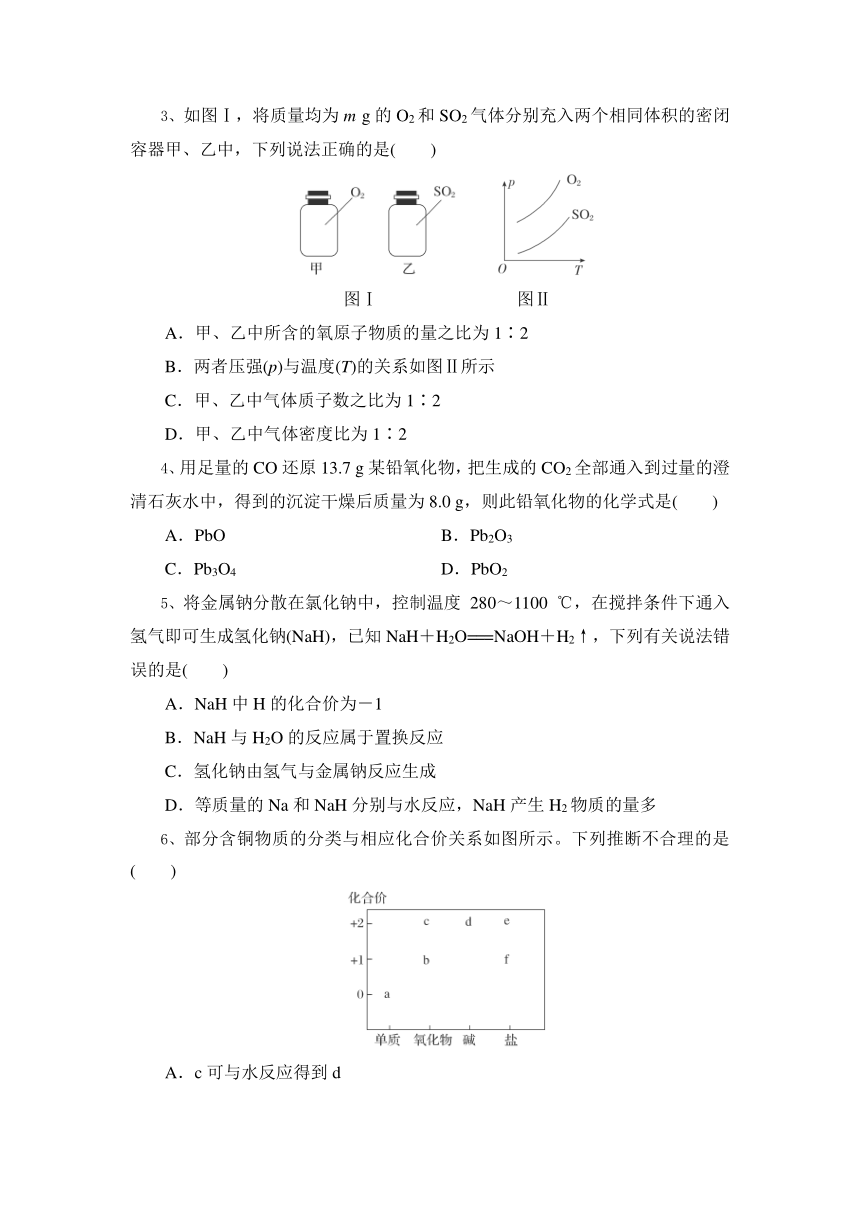
3、如图Ⅰ,将质量均为m g的O2和SO2气体分别充入两个相同体积的密闭容器甲、乙中,下列说法正确的是( )
图Ⅰ 图Ⅱ
A.甲、乙中所含的氧原子物质的量之比为1∶2
B.两者压强(p)与温度(T)的关系如图Ⅱ所示
C.甲、乙中气体质子数之比为1∶2
D.甲、乙中气体密度比为1∶2
4、用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此铅氧化物的化学式是( )
A.PbO B.Pb2O3
C.Pb3O4 D.PbO2
5、将金属钠分散在氯化钠中,控制温度280~1100 ℃,在搅拌条件下通入氢气即可生成氢化钠(NaH),已知NaH+H2O===NaOH+H2↑,下列有关说法错误的是( )
A.NaH中H的化合价为-1
B.NaH与H2O的反应属于置换反应
C.氢化钠由氢气与金属钠反应生成
D.等质量的Na和NaH分别与水反应,NaH产生H2物质的量多
6、部分含铜物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.c可与水反应得到d
B.a可与硫单质反应生成f
C.可将葡萄糖与新制的d混合后加热制得b
D.可存在a→c→e→a的循环转化关系
7、已知X、Y元素同周期,且电负性:X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能可能Y小于X
C.气态氢化物的稳定性:HmY<HnX
D.最高价氧化物对应的水化物的酸性:X8、下列化学用语或表述正确的是( )
A.(2023·北京卷)NaCl的电子式为
B.(2023·浙江6月选考)H2S分子的球棍模型:
C.(2023·湖北卷)用电子云轮廓图表示H—H的s-s σ键形成的示意图:
D.(2023·浙江1月选考)HCl的形成过程:―→H+[]-
9、工业上常用NaClO碱性溶液吸收工业废气中的SO2,为了提高吸收效率,常用Ni2O3作为催化剂,在反应过程中产生的正四价镍和氧原子具有极强的氧化能力,可加快对SO2的吸收,该催化过程如图所示:
下列说法错误的是( )
A.过程1中,氧化剂与还原剂的物质的量之比是1∶1
B.过程2的离子方程式:2NiO2+ClO-===Cl-+Ni2O3+2O
C.吸收反应的总方程式:ClO-+SO2+2OH-===Cl-+SO+H2O
D.用Ca(ClO)2代替NaClO脱硫效果更好
10、一溴化碘(IBr)是一种易溶于液溴的黑褐色晶体,常用于有机合成等研究。工业上制备IBr的方法如下:碘单质(I2)黑褐色晶体(IBr),下列说法错误的是 ( )
A.过程①加入过量Br2的目的是提高I2的转化率
B.过程②在高温下进行对制得IBr的量无影响
C.过程③通入CO2,可吹出过量的Br2
D.过程③可采用水浴加热
11、天然气是应用广泛的燃料,但含有少量H2S等气体。在酸性溶液中利用氧化亚铁硫杆菌可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是( )
A.过程甲中发生反应的离子方程式为2Fe3++H2S===2Fe2++S↓+2H+
B.脱硫过程中O2间接氧化H2S
C.该脱硫过程需要不断添加Fe2(SO4)3溶液
D.过程乙中发生反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O
12、下列说法中正确的是( )
A.可用排空气法收集NO
B.NO2与水反应的离子方程式:3NO2+H2O===2H++2NO+NO
C.在实验室里NO2不可用排空气法收集
D.NO2通入Fe(NO3)2溶液中始终无明显现象
13、水玻璃(Na2SiO3溶液)广泛应用于耐火材料、洗涤剂生产等领域,是一种重要的工业原料。如图是用稻壳灰(SiO2:65%~70%、C:30%~35%)制取水玻璃的工艺流程:
下列说法正确的是( )
A.原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值
B.操作A与操作B完全相同
C.该流程中硅元素的化合价发生改变
D.反应器中发生的反应为氧化还原反应
14、下列生产工艺能体现“绿色化学”或节能环保思想的是( )
A.工业制氢气:用天然气发电再电解水制得
B.工业制硫酸:提高尾气排放的烟囱高度
C.工业制胆矾:向稀硫酸中吹空气并加热溶解铜
D.降低PM2.5的排放:用油改煤技术,推广优质煤的使用范围
15、根据实验目的设计如图装置,连接正确的是( )
A.制备收集C2H4:连接a→c→g
B.制备收集NO:连接b→c→e→d
C.制备收集NH3:连接b→d→e→c
D.制备收集Cl2:连接a→f→c→e→d
二、非选择题:本题共4小题,共55分。
16、(13分)
用下面几种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,还需加入少量铁屑,原因是_________________________________________________________________________________________________________________________。(写离子方程式)
(2)除去蒸馏水中溶解的O2常采用____________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________ _____________________________________________________________________________________________________________________。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(4)在试管Ⅰ里加入的试剂是____________。
(5)在试管Ⅱ里加入的试剂是____________。
(6)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________________________________________________ _________________________________________________________________。
(7)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是____________ ____________________________________________________________________________________________________________________________________。
17、(14分)
二氧化硫是中学化学的重要物质。某化学兴趣小组设计如图实验探究SO2的性质。
(1)仪器b的名称是____________,已知b中放入的是纯铜片,写出装置A中的化学方程________________________________________________________ _______________________________________________________________________________________。
(2)同学甲认为该套装置存在一个明显缺陷,其理由是________________ ________________________________________________________________________________________________________________________________。
(3)关于该探究实验,下列说法错误的是_______________(填序号)。
①装置A中,橡皮管a的作用是使分液漏斗中的液体能顺利流下
②装置B中,紫色溶液变红,证明二氧化硫是酸性氧化物
③装置C中,品红溶液褪色,证明二氧化硫具有漂白性
④装置D中溶液变浑浊,生成了硫单质,证明SO2具有还原性
(4)装置E中溶液褪色,发生的反应离子方程式是________________ ________________________________________________________________________________________________________________________________。
(5)实验过程中,同学乙观察到E中溶液在完全褪色后开始逐渐变浑浊。查阅资料后得知,在催化剂的作用下,SO2在水中会发生歧化反应。于是又设计以下实验进行探究(实验中溶液的体积及溶质的物质的量浓度均相同)。
【实验装置】
【实验现象】一段时间后,F、H中无明显现象,I中比G中的溶液先变浑浊。
【实验结论】在水中,SO2歧化的离子方程式为_______________________ _________________________________________________________________________________________________________________________。
该反应中的催化剂是____________(填序号)。
①H+ ②I- ③H+、I- ④K+、H+ ⑤K+、I-
18、(14分)
向含x mol HNO3和y mol H2SO4的混合稀溶液中缓慢加入铁粉,其氧化产物与所加铁粉的物质的量关系如图所示:
回答下列问题:
(1)Oa段发生反应的离子方程式为_________________________________ _________________________________________________________________。
(2)dc段表示的是____________(填“Fe2+”或“Fe3+”)物质的量变化。
(3)x=____________,y=____________。
(4)反应至c点,可收集到标准状况下的气体为___________L。
19、(14分)
溴酸钠应用广泛,“氯气氧化法”制备NaBrO3装置如下:
(1)装置Ⅰ中发生反应的还原剂与还原产物物质的量之比为____________。
(2)装置Ⅱ的作用是__________________________________。
(3)检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,先打开电热磁力搅拌器,升温至50~60 ℃,滴入适量液溴。然后打开活塞____________,当pH传感器显示接近中性时,关闭所有活塞。反应结束后,在拆卸装置前为避免Ⅰ中残留较多的Cl2污染空气,应打开活塞____________。
(4)装置Ⅲ中发生总反应的离子方程式为______________________ ________________________________________________________________________________________________________________________。
高二化学试题答案
一、选择题:本题共15小题,每题3分,共45分,每小题仅有一项是符合题意。
1、解析:D A项Na2CO3写成CO,NaHCO3写成HCO;B项前者生成水,后者除了水还有BaSO4沉淀生成;C项CaCO3写成化学式,Na2CO3写成离子形式;D项,共同的离子方程式为Ba2++SO===BaSO4↓.
2、解析:A 过程①中NO转化为NO,N元素化合价由+5价下降到+3价,NO体现氧化性,A正确;过程②中NO转化为NO,反应的离子方程式为NO+2H++e-===NO↑+H2O,B错误;过程③中NO转化为N2H4,N元素化合价由+2价下降到-2价,反应的离子方程式为NO+NH+3e-+2H+===N2H4+H2O,c代表的是2H++3e-,C错误;过程④中N2H4转化为N2,N元素化合价由-2价上升到0价,1 mol N2H4参加反应转移4 mol电子,D错误。
3、解析:B A.根据n=,质量均为m g的O2和SO2物质的量之比与摩尔质量成反比,即n(O2)∶n(SO2)=64∶32=2∶1,甲、乙中所含的氧原子物质的量之比为2∶1,故A错误;B.根据pV=nRT,则体积相等的甲和乙,压强与温度成正比,且n(O2)∶n(SO2)=2∶1即代表氧气的曲线较高,故B正确;C.n(O2)∶n(SO2)=2∶1,质子数之比为(2×16)∶(1×32)=1∶1,故C错误;D.根据ρ=,甲、乙容器体积相等,两种气体的质量相等,则密度也相等,即甲、乙中气体密度比为1∶1,故D错误。
4、解析:C 设此铅氧化物的化学式为PbxOy,
PbxOy~ y[O]~yCO~yCO2~ yCaCO3
16y 100y
m(O)=1.28 g 8.0 g
所以m(Pb)=13.7 g-1.28 g=12.42 g,
x∶y=∶=∶=3∶4。
5、解析:B 在NaH中,Na为+1价,H元素的化合价为-1价,A正确;NaH与H2O的反应中反应物没有单质,因此该反应不属于置换反应,B错误;根据已知条件可知:将金属钠分散在NaCl中,将温度控制在280~1100 ℃,在搅拌条件下通入氢气即可生成氢化钠(NaH),故氢化钠由氢气与金属钠反应生成,C正确;反应方程式为:2Na+2H2O===2NaOH+H2↑,NaH+H2O===NaOH+H2↑,根据方程式可知:制取1 mol H2,需Na质量是46 g,需NaH质量是24 g,可见等质量的Na和NaH分别与水反应,NaH产生H2物质的量多,D正确。
6、解析:A CuO不能与H2O反应,A错误;铜能与硫单质在加热的条件下反应得到硫化亚铜,B正确;新制的Cu(OH)2与葡萄糖溶液混合后加热可得Cu2O,C正确;Cu可以在O2中加热得到CuO,CuO溶于酸可得到Cu2+,Cu2+可被铁单质置换生成Cu,D正确。
7、解析:D 同周期元素从左到右,原子序数依次增大,原子半径依次减小,非金属性依次增强,电负性依次增大。电负性大的元素在化合物中显负价,所以X和Y形成化合物时,X显负价,Y显正价,故A正确;同周期元素从左到右,第一电离能呈增大的趋势,但第ⅡA和第ⅤA族元素的最高能级轨道为全充满、半充满稳定结构,第一电离能大于相邻的元素,第一电离能Y可能大于X,也可能小于X,故B正确;元素非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:HmY<HnX,故C正确;元素非金属性越强,其最高价氧化物对应的水化物的酸性越强,非金属性:X>Y,则X最高价氧化物对应水化物的酸性强于Y最高价氧化物对应的水化物的酸性,故D错误。
8、解析:C 氯化钠是离子化合物,其电子式是Na+,A错误;H2S分子是“V”形结构,不是直线形分子,B错误;H的s能级为球形,两个氢原子形成氢气的时候,是两个s能级的原子轨道相互靠近,形成新的轨道,C正确;HCl是共价化合物,不存在电子得失,其形成过程应为,D错误。
9、解析:D 过程1中,ClO-转化为Cl-,Cl元素化合价由+1价变为-1价,ClO-为氧化剂,Ni2O3转化为NiO2,Ni元素化合价由+3价变为+4价,Ni2O3为还原剂,根据得失电子守恒可得,氧化剂与还原剂的物质的量之比是1∶1,A项正确;过程2中,NiO2和ClO-反应生成Ni2O3、Cl-和O,离子方程式为2NiO2+ClO-===Cl-+Ni2O3+2O,B项正确;碱性条件下,ClO-将SO2氧化为SO,吸收反应的总方程式为ClO-+SO2+2OH-===Cl-+SO+H2O,C项正确;Ca2+与SO结合生成微溶的CaSO4,CaSO4会覆盖在催化剂表面,不利于反应进行,D项错误。
10、解析:B 过程①加入过量Br2的目的是提高I2的转化率,故A正确;I2易升华,Br2易挥发,过程②在高温下进行,会减少IBr产量,故B错误;通入CO2,可吹出过量的Br2,提高产品纯度,故C正确;过程③在50 ℃进行,可用水浴加热,故D正确。
11、解析:C 根据题图可知,过程甲中硫酸铁与硫化氢反应可生成硫酸亚铁、单质硫,则反应的离子方程式为2Fe3++H2S===2Fe2++S↓+2H+,A项正确;过程乙中氧气将亚铁离子氧化为铁离子,过程甲中铁离子氧化硫化氢,则脱硫过程中O2间接氧化H2S,B项正确;该脱硫过程中Fe3+、Fe2+相互转化,不需要不断添加Fe2(SO4)3溶液,C项错误;过程乙中氧气将亚铁离子氧化为铁离子,发生反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O,D项正确。
12、解析:B 不能用排空气法收集NO,因为NO与空气中的O2会发生反应,A错误;NO2可用排空气法收集,C错误;NO2通入Fe(NO3)2溶液中后,生成的硝酸能把亚铁离子氧化,溶液颜色变为黄色,D错误。
13、解析:A A项,稻壳灰来源广泛,价格低廉,活性炭具有吸附性,有较高的经济价值,正确;B项,操作A为过滤,操作B为蒸发浓缩,是两种不同的操作,错误;C项,二氧化硅中硅元素的化合价是+4价,硅酸钠中硅元素的化合价也是+4价,所以该流程中硅元素的化合价没有发生改变,错误;D项,反应器中发生的反应为SiO2+2NaOH===Na2SiO3+H2O,此反应没有元素化合价的变化,属于非氧化还原反应,错误。
14、解析:C 用天然气发电再电解水制氢气,会造成能量的损耗,故A错误;提高尾气排放的烟囱高度不能减少有害气体的排放,故B错误;吹入空气并加热铜使之生成氧化铜,氧化铜再与稀硫酸反应生成硫酸铜,硫酸利用率高,无污染,故C正确;用油改煤技术,推广优质煤的使用范围,不会降低PM2.5的排放,故D错误。
15、解析:D 制备C2H4没有控制温度的温度计,A错误;NO与O2反应,不能用排空气法收集,B错误;浓硫酸吸收多余的NH3,易发生倒吸,C错误;饱和食盐水除去HCl气体,浓硫酸吸收水蒸气,碱石灰吸收多余的Cl2,D正确。
二、非选择题:本题共4小题,共55分。
16、(13分)
解析:方法二中,向试管Ⅰ中加铁屑和稀硫酸,向试管Ⅱ中加NaOH溶液,这样铁屑和稀硫酸反应可以制取FeSO4溶液,借助生成的氢气将两支试管内的空气都排出去,使氢气充满试管Ⅰ和试管Ⅱ(起保护气的作用),反应一段时间后,关闭止水夹,试管Ⅰ内压强增大,FeSO4溶液顺着导管进入试管Ⅱ的NaOH溶液中,NaOH与FeSO4发生反应生成Fe(OH)2沉淀。(1)+2价的铁有还原性,其化合物无论是在空气中还是在水中,都易被氧化为+3价铁的化合物,加入少量铁屑可防止Fe2+被氧化,离子方程式为:Fe+2Fe3+===3Fe2+;(2)除去蒸馏水中溶解的O2常采用煮沸的方法;(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是避免生成的Fe(OH)2沉淀接触到空气中的O2而被氧化;(4)试管Ⅰ中加入的试剂是铁屑和稀硫酸;(5)试管Ⅱ中加入的试剂是NaOH溶液;(6)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后,试管Ⅰ中生成氢气和硫酸亚铁,氢气沿着导管进入试管Ⅱ中,收集试管Ⅱ出口处的气体,检验氢气的纯度,当排出的H2纯净时,再夹紧止水夹,这时试管Ⅰ内压强增大,FeSO4溶液顺着导管进入试管Ⅱ的NaOH溶液中,NaOH与FeSO4发生反应生成Fe(OH)2沉淀;(7)铁屑和稀硫酸反应生成的氢气将两支试管内的空气都排出去,使氢气充满试管Ⅰ和试管Ⅱ(起保护气的作用),且外界空气不容易进入,由于有氢气的保护作用,Fe(OH)2沉淀能较长时间地稳定存在。
答案:(1)Fe+2Fe3+===3Fe2+ (2)煮沸
(3)避免生成的Fe(OH)2沉淀接触到空气中的O2而被氧化 (4)铁屑和稀硫酸
(5)NaOH溶液 (6)收集试管Ⅱ出口处的气体,检验氢气的纯度,当排出的H2纯净时,再夹紧止水夹 (7)铁屑和稀硫酸反应生成的氢气将两支试管内的空气都排出去,使氢气充满试管Ⅰ和试管Ⅱ(起保护气的作用),且外界空气不容易进入,由于有氢气的保护作用,Fe(OH)2沉淀能较长时间地稳定存在
17、(14分)
解析:(2)没有除去尾气中的二氧化硫气体的装置,二氧化硫会污染空气;(3)装置A中,橡皮管a连接分液漏斗和蒸馏烧瓶,相当于恒压滴液漏斗,其作用是使分液漏斗中的液体能顺利流下,①正确;装置B中,紫色石蕊溶液变红说明溶液显酸性,证明二氧化硫是酸性氧化物,②正确;装置C中,品红溶液褪色能证明二氧化硫具有漂白性,③正确;装置D中溶液变浑浊,生成了硫单质,说明SO2和硫化氢发生氧化还原反应,二氧化硫具有氧化性,④错误;(4)碘水中碘单质具有氧化性,二氧化硫具有还原性,二者在水溶液中发生氧化还原反应生成两种强酸:硫酸和氢碘酸。离子方程式为I2+SO2+2H2O===4H++SO+2I-;(5)溶液变浑浊说明有硫单质生成,故在水中,SO2歧化的离子方程式为3SO2+2H2O===4H++2SO+S↓;一段时间后,F、H中无明显现象且I中比G中的溶液先变浑浊,说明氢离子和钾离子不是催化剂。碘离子可作为该反应的催化剂,催化过程:SO2+4I-+4H+===2I2+S↓+2H2O,I2+2H2O+SO2===SO+4H++2I-,故选②。
答案:(1)蒸馏烧瓶 Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (2)没有除去尾气中的二氧化硫气体,会污染空气 (3)④ (4)I2+SO2+2H2O===4H++SO+2I- (5)3SO2+2H2O===4H++2SO+S↓ ②
18、(14分)
解析:(3)在Oa段NO完全转化为NO,由离子方程式可得,n(NO)=n(Fe3+)=0.1 mol,即x=0.1;c点溶质为FeSO4,溶液中Fe2+为0.2 mol,即n(FeSO4)=0.2 mol,根据硫酸根离子守恒得,n(H2SO4)=n(FeSO4)=0.2 mol,即y=0.2。
(4)Fe+NO+ 4H+=== Fe3+ + NO↑+2H2O
0.4 mol 0.1 mol 0.1 mol
Fe +2H+===Fe2+ +H2↑
0.1 mol 0.05 mol
所以V=(0.1 mol+0.05 mol)×22.4 L·mol-1=3.36 L。
答案:(1)Fe+NO+4H+===Fe3++NO↑+2H2O (2)Fe2+ (3)0.1 0.2 (4)3.36
19、(14分)
解析:装置Ⅰ中浓盐酸和漂粉精反应生成氯气,化学方程式为4HCl(浓)+Ca(ClO)2===2Cl2↑+CaCl2+2H2O。生成的氯气中混有HCl,因此通过Ⅱ中饱和食盐水除去氯气中的HCl,氯气进入Ⅲ与Br2、CO反应生成BrO,最后Ⅳ中NaOH溶液用于吸收多余的Cl2和生成的CO2。(3)检验装置气密性后进行反应,升温至50~60 ℃,滴入适量液溴,打开活塞K1、K3,装置Ⅰ中反应生成氯气,氯气经提纯后进入Ⅲ,与溴单质、碳酸根离子反应生成溴酸根离子。反应结束后在拆卸装置前为避免Ⅰ残留较多的Cl2污染空气,应打开活塞K2,吸收多余的氯气。(4)氯气进入Ⅲ与Br2、CO反应生成BrO,离子方程式为5Cl2+Br2+6CO===2BrO+10Cl-+6CO2↑。
答案:(1)2∶1 (2)除去HCl气体 (3)K1、K3 K2 (4)5Cl2+Br2+6CO===2BrO+10Cl-+6CO2↑
高一化学试题
本试卷共8页,19题,全卷满分100分,考试用时75分钟。
★祝考试顺利★
考试范围:
必修一;必修二第1章
注意事项:
1、答题前,请将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准考证号条形码粘贴在答题卡上的制定位置。
2、选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3、非选择题作答:用黑色签字笔直接答在答题卡对应的答题区域内,写在试卷、草稿纸和答题卡上的非答题区域均无效。
4、考试结束后,请将答题卡上交。
一、选择题:本题共15小题,每题3分,共45分,每小题仅有一项是符合题意。
1、下列每组反应可用同一离子方程式表示的是( )
A.HCl溶液+Na2CO3溶液;HCl溶液+NaHCO3溶液
B.NaOH溶液+HCl溶液;Ba(OH)2溶液+H2SO4溶液
C.CaCO3+HCl溶液;Na2CO3溶液+H2SO4溶液
D.BaCl2溶液+H2SO4溶液;Ba(OH)2溶液+Na2SO4溶液
2、氮元素在自然界的某种转化示意图如图所示(a、b、c和d代表一定比例的H+和e-)。下列说法正确的是( )
A.过程①中NO体现氧化性
B.过程②中发生反应的离子方程式为NO+H++e-===NO↑+H2O
C.过程③中c代表的是3H++3e-
D.过程④中1 mol N2H4参加反应转移6 mol电子
3、如图Ⅰ,将质量均为m g的O2和SO2气体分别充入两个相同体积的密闭容器甲、乙中,下列说法正确的是( )
图Ⅰ 图Ⅱ
A.甲、乙中所含的氧原子物质的量之比为1∶2
B.两者压强(p)与温度(T)的关系如图Ⅱ所示
C.甲、乙中气体质子数之比为1∶2
D.甲、乙中气体密度比为1∶2
4、用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此铅氧化物的化学式是( )
A.PbO B.Pb2O3
C.Pb3O4 D.PbO2
5、将金属钠分散在氯化钠中,控制温度280~1100 ℃,在搅拌条件下通入氢气即可生成氢化钠(NaH),已知NaH+H2O===NaOH+H2↑,下列有关说法错误的是( )
A.NaH中H的化合价为-1
B.NaH与H2O的反应属于置换反应
C.氢化钠由氢气与金属钠反应生成
D.等质量的Na和NaH分别与水反应,NaH产生H2物质的量多
6、部分含铜物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.c可与水反应得到d
B.a可与硫单质反应生成f
C.可将葡萄糖与新制的d混合后加热制得b
D.可存在a→c→e→a的循环转化关系
7、已知X、Y元素同周期,且电负性:X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能可能Y小于X
C.气态氢化物的稳定性:HmY<HnX
D.最高价氧化物对应的水化物的酸性:X
A.(2023·北京卷)NaCl的电子式为
B.(2023·浙江6月选考)H2S分子的球棍模型:
C.(2023·湖北卷)用电子云轮廓图表示H—H的s-s σ键形成的示意图:
D.(2023·浙江1月选考)HCl的形成过程:―→H+[]-
9、工业上常用NaClO碱性溶液吸收工业废气中的SO2,为了提高吸收效率,常用Ni2O3作为催化剂,在反应过程中产生的正四价镍和氧原子具有极强的氧化能力,可加快对SO2的吸收,该催化过程如图所示:
下列说法错误的是( )
A.过程1中,氧化剂与还原剂的物质的量之比是1∶1
B.过程2的离子方程式:2NiO2+ClO-===Cl-+Ni2O3+2O
C.吸收反应的总方程式:ClO-+SO2+2OH-===Cl-+SO+H2O
D.用Ca(ClO)2代替NaClO脱硫效果更好
10、一溴化碘(IBr)是一种易溶于液溴的黑褐色晶体,常用于有机合成等研究。工业上制备IBr的方法如下:碘单质(I2)黑褐色晶体(IBr),下列说法错误的是 ( )
A.过程①加入过量Br2的目的是提高I2的转化率
B.过程②在高温下进行对制得IBr的量无影响
C.过程③通入CO2,可吹出过量的Br2
D.过程③可采用水浴加热
11、天然气是应用广泛的燃料,但含有少量H2S等气体。在酸性溶液中利用氧化亚铁硫杆菌可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是( )
A.过程甲中发生反应的离子方程式为2Fe3++H2S===2Fe2++S↓+2H+
B.脱硫过程中O2间接氧化H2S
C.该脱硫过程需要不断添加Fe2(SO4)3溶液
D.过程乙中发生反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O
12、下列说法中正确的是( )
A.可用排空气法收集NO
B.NO2与水反应的离子方程式:3NO2+H2O===2H++2NO+NO
C.在实验室里NO2不可用排空气法收集
D.NO2通入Fe(NO3)2溶液中始终无明显现象
13、水玻璃(Na2SiO3溶液)广泛应用于耐火材料、洗涤剂生产等领域,是一种重要的工业原料。如图是用稻壳灰(SiO2:65%~70%、C:30%~35%)制取水玻璃的工艺流程:
下列说法正确的是( )
A.原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值
B.操作A与操作B完全相同
C.该流程中硅元素的化合价发生改变
D.反应器中发生的反应为氧化还原反应
14、下列生产工艺能体现“绿色化学”或节能环保思想的是( )
A.工业制氢气:用天然气发电再电解水制得
B.工业制硫酸:提高尾气排放的烟囱高度
C.工业制胆矾:向稀硫酸中吹空气并加热溶解铜
D.降低PM2.5的排放:用油改煤技术,推广优质煤的使用范围
15、根据实验目的设计如图装置,连接正确的是( )
A.制备收集C2H4:连接a→c→g
B.制备收集NO:连接b→c→e→d
C.制备收集NH3:连接b→d→e→c
D.制备收集Cl2:连接a→f→c→e→d
二、非选择题:本题共4小题,共55分。
16、(13分)
用下面几种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,还需加入少量铁屑,原因是_________________________________________________________________________________________________________________________。(写离子方程式)
(2)除去蒸馏水中溶解的O2常采用____________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________ _____________________________________________________________________________________________________________________。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(4)在试管Ⅰ里加入的试剂是____________。
(5)在试管Ⅱ里加入的试剂是____________。
(6)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________________________________________________ _________________________________________________________________。
(7)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是____________ ____________________________________________________________________________________________________________________________________。
17、(14分)
二氧化硫是中学化学的重要物质。某化学兴趣小组设计如图实验探究SO2的性质。
(1)仪器b的名称是____________,已知b中放入的是纯铜片,写出装置A中的化学方程________________________________________________________ _______________________________________________________________________________________。
(2)同学甲认为该套装置存在一个明显缺陷,其理由是________________ ________________________________________________________________________________________________________________________________。
(3)关于该探究实验,下列说法错误的是_______________(填序号)。
①装置A中,橡皮管a的作用是使分液漏斗中的液体能顺利流下
②装置B中,紫色溶液变红,证明二氧化硫是酸性氧化物
③装置C中,品红溶液褪色,证明二氧化硫具有漂白性
④装置D中溶液变浑浊,生成了硫单质,证明SO2具有还原性
(4)装置E中溶液褪色,发生的反应离子方程式是________________ ________________________________________________________________________________________________________________________________。
(5)实验过程中,同学乙观察到E中溶液在完全褪色后开始逐渐变浑浊。查阅资料后得知,在催化剂的作用下,SO2在水中会发生歧化反应。于是又设计以下实验进行探究(实验中溶液的体积及溶质的物质的量浓度均相同)。
【实验装置】
【实验现象】一段时间后,F、H中无明显现象,I中比G中的溶液先变浑浊。
【实验结论】在水中,SO2歧化的离子方程式为_______________________ _________________________________________________________________________________________________________________________。
该反应中的催化剂是____________(填序号)。
①H+ ②I- ③H+、I- ④K+、H+ ⑤K+、I-
18、(14分)
向含x mol HNO3和y mol H2SO4的混合稀溶液中缓慢加入铁粉,其氧化产物与所加铁粉的物质的量关系如图所示:
回答下列问题:
(1)Oa段发生反应的离子方程式为_________________________________ _________________________________________________________________。
(2)dc段表示的是____________(填“Fe2+”或“Fe3+”)物质的量变化。
(3)x=____________,y=____________。
(4)反应至c点,可收集到标准状况下的气体为___________L。
19、(14分)
溴酸钠应用广泛,“氯气氧化法”制备NaBrO3装置如下:
(1)装置Ⅰ中发生反应的还原剂与还原产物物质的量之比为____________。
(2)装置Ⅱ的作用是__________________________________。
(3)检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,先打开电热磁力搅拌器,升温至50~60 ℃,滴入适量液溴。然后打开活塞____________,当pH传感器显示接近中性时,关闭所有活塞。反应结束后,在拆卸装置前为避免Ⅰ中残留较多的Cl2污染空气,应打开活塞____________。
(4)装置Ⅲ中发生总反应的离子方程式为______________________ ________________________________________________________________________________________________________________________。
高二化学试题答案
一、选择题:本题共15小题,每题3分,共45分,每小题仅有一项是符合题意。
1、解析:D A项Na2CO3写成CO,NaHCO3写成HCO;B项前者生成水,后者除了水还有BaSO4沉淀生成;C项CaCO3写成化学式,Na2CO3写成离子形式;D项,共同的离子方程式为Ba2++SO===BaSO4↓.
2、解析:A 过程①中NO转化为NO,N元素化合价由+5价下降到+3价,NO体现氧化性,A正确;过程②中NO转化为NO,反应的离子方程式为NO+2H++e-===NO↑+H2O,B错误;过程③中NO转化为N2H4,N元素化合价由+2价下降到-2价,反应的离子方程式为NO+NH+3e-+2H+===N2H4+H2O,c代表的是2H++3e-,C错误;过程④中N2H4转化为N2,N元素化合价由-2价上升到0价,1 mol N2H4参加反应转移4 mol电子,D错误。
3、解析:B A.根据n=,质量均为m g的O2和SO2物质的量之比与摩尔质量成反比,即n(O2)∶n(SO2)=64∶32=2∶1,甲、乙中所含的氧原子物质的量之比为2∶1,故A错误;B.根据pV=nRT,则体积相等的甲和乙,压强与温度成正比,且n(O2)∶n(SO2)=2∶1即代表氧气的曲线较高,故B正确;C.n(O2)∶n(SO2)=2∶1,质子数之比为(2×16)∶(1×32)=1∶1,故C错误;D.根据ρ=,甲、乙容器体积相等,两种气体的质量相等,则密度也相等,即甲、乙中气体密度比为1∶1,故D错误。
4、解析:C 设此铅氧化物的化学式为PbxOy,
PbxOy~ y[O]~yCO~yCO2~ yCaCO3
16y 100y
m(O)=1.28 g 8.0 g
所以m(Pb)=13.7 g-1.28 g=12.42 g,
x∶y=∶=∶=3∶4。
5、解析:B 在NaH中,Na为+1价,H元素的化合价为-1价,A正确;NaH与H2O的反应中反应物没有单质,因此该反应不属于置换反应,B错误;根据已知条件可知:将金属钠分散在NaCl中,将温度控制在280~1100 ℃,在搅拌条件下通入氢气即可生成氢化钠(NaH),故氢化钠由氢气与金属钠反应生成,C正确;反应方程式为:2Na+2H2O===2NaOH+H2↑,NaH+H2O===NaOH+H2↑,根据方程式可知:制取1 mol H2,需Na质量是46 g,需NaH质量是24 g,可见等质量的Na和NaH分别与水反应,NaH产生H2物质的量多,D正确。
6、解析:A CuO不能与H2O反应,A错误;铜能与硫单质在加热的条件下反应得到硫化亚铜,B正确;新制的Cu(OH)2与葡萄糖溶液混合后加热可得Cu2O,C正确;Cu可以在O2中加热得到CuO,CuO溶于酸可得到Cu2+,Cu2+可被铁单质置换生成Cu,D正确。
7、解析:D 同周期元素从左到右,原子序数依次增大,原子半径依次减小,非金属性依次增强,电负性依次增大。电负性大的元素在化合物中显负价,所以X和Y形成化合物时,X显负价,Y显正价,故A正确;同周期元素从左到右,第一电离能呈增大的趋势,但第ⅡA和第ⅤA族元素的最高能级轨道为全充满、半充满稳定结构,第一电离能大于相邻的元素,第一电离能Y可能大于X,也可能小于X,故B正确;元素非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:HmY<HnX,故C正确;元素非金属性越强,其最高价氧化物对应的水化物的酸性越强,非金属性:X>Y,则X最高价氧化物对应水化物的酸性强于Y最高价氧化物对应的水化物的酸性,故D错误。
8、解析:C 氯化钠是离子化合物,其电子式是Na+,A错误;H2S分子是“V”形结构,不是直线形分子,B错误;H的s能级为球形,两个氢原子形成氢气的时候,是两个s能级的原子轨道相互靠近,形成新的轨道,C正确;HCl是共价化合物,不存在电子得失,其形成过程应为,D错误。
9、解析:D 过程1中,ClO-转化为Cl-,Cl元素化合价由+1价变为-1价,ClO-为氧化剂,Ni2O3转化为NiO2,Ni元素化合价由+3价变为+4价,Ni2O3为还原剂,根据得失电子守恒可得,氧化剂与还原剂的物质的量之比是1∶1,A项正确;过程2中,NiO2和ClO-反应生成Ni2O3、Cl-和O,离子方程式为2NiO2+ClO-===Cl-+Ni2O3+2O,B项正确;碱性条件下,ClO-将SO2氧化为SO,吸收反应的总方程式为ClO-+SO2+2OH-===Cl-+SO+H2O,C项正确;Ca2+与SO结合生成微溶的CaSO4,CaSO4会覆盖在催化剂表面,不利于反应进行,D项错误。
10、解析:B 过程①加入过量Br2的目的是提高I2的转化率,故A正确;I2易升华,Br2易挥发,过程②在高温下进行,会减少IBr产量,故B错误;通入CO2,可吹出过量的Br2,提高产品纯度,故C正确;过程③在50 ℃进行,可用水浴加热,故D正确。
11、解析:C 根据题图可知,过程甲中硫酸铁与硫化氢反应可生成硫酸亚铁、单质硫,则反应的离子方程式为2Fe3++H2S===2Fe2++S↓+2H+,A项正确;过程乙中氧气将亚铁离子氧化为铁离子,过程甲中铁离子氧化硫化氢,则脱硫过程中O2间接氧化H2S,B项正确;该脱硫过程中Fe3+、Fe2+相互转化,不需要不断添加Fe2(SO4)3溶液,C项错误;过程乙中氧气将亚铁离子氧化为铁离子,发生反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O,D项正确。
12、解析:B 不能用排空气法收集NO,因为NO与空气中的O2会发生反应,A错误;NO2可用排空气法收集,C错误;NO2通入Fe(NO3)2溶液中后,生成的硝酸能把亚铁离子氧化,溶液颜色变为黄色,D错误。
13、解析:A A项,稻壳灰来源广泛,价格低廉,活性炭具有吸附性,有较高的经济价值,正确;B项,操作A为过滤,操作B为蒸发浓缩,是两种不同的操作,错误;C项,二氧化硅中硅元素的化合价是+4价,硅酸钠中硅元素的化合价也是+4价,所以该流程中硅元素的化合价没有发生改变,错误;D项,反应器中发生的反应为SiO2+2NaOH===Na2SiO3+H2O,此反应没有元素化合价的变化,属于非氧化还原反应,错误。
14、解析:C 用天然气发电再电解水制氢气,会造成能量的损耗,故A错误;提高尾气排放的烟囱高度不能减少有害气体的排放,故B错误;吹入空气并加热铜使之生成氧化铜,氧化铜再与稀硫酸反应生成硫酸铜,硫酸利用率高,无污染,故C正确;用油改煤技术,推广优质煤的使用范围,不会降低PM2.5的排放,故D错误。
15、解析:D 制备C2H4没有控制温度的温度计,A错误;NO与O2反应,不能用排空气法收集,B错误;浓硫酸吸收多余的NH3,易发生倒吸,C错误;饱和食盐水除去HCl气体,浓硫酸吸收水蒸气,碱石灰吸收多余的Cl2,D正确。
二、非选择题:本题共4小题,共55分。
16、(13分)
解析:方法二中,向试管Ⅰ中加铁屑和稀硫酸,向试管Ⅱ中加NaOH溶液,这样铁屑和稀硫酸反应可以制取FeSO4溶液,借助生成的氢气将两支试管内的空气都排出去,使氢气充满试管Ⅰ和试管Ⅱ(起保护气的作用),反应一段时间后,关闭止水夹,试管Ⅰ内压强增大,FeSO4溶液顺着导管进入试管Ⅱ的NaOH溶液中,NaOH与FeSO4发生反应生成Fe(OH)2沉淀。(1)+2价的铁有还原性,其化合物无论是在空气中还是在水中,都易被氧化为+3价铁的化合物,加入少量铁屑可防止Fe2+被氧化,离子方程式为:Fe+2Fe3+===3Fe2+;(2)除去蒸馏水中溶解的O2常采用煮沸的方法;(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是避免生成的Fe(OH)2沉淀接触到空气中的O2而被氧化;(4)试管Ⅰ中加入的试剂是铁屑和稀硫酸;(5)试管Ⅱ中加入的试剂是NaOH溶液;(6)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后,试管Ⅰ中生成氢气和硫酸亚铁,氢气沿着导管进入试管Ⅱ中,收集试管Ⅱ出口处的气体,检验氢气的纯度,当排出的H2纯净时,再夹紧止水夹,这时试管Ⅰ内压强增大,FeSO4溶液顺着导管进入试管Ⅱ的NaOH溶液中,NaOH与FeSO4发生反应生成Fe(OH)2沉淀;(7)铁屑和稀硫酸反应生成的氢气将两支试管内的空气都排出去,使氢气充满试管Ⅰ和试管Ⅱ(起保护气的作用),且外界空气不容易进入,由于有氢气的保护作用,Fe(OH)2沉淀能较长时间地稳定存在。
答案:(1)Fe+2Fe3+===3Fe2+ (2)煮沸
(3)避免生成的Fe(OH)2沉淀接触到空气中的O2而被氧化 (4)铁屑和稀硫酸
(5)NaOH溶液 (6)收集试管Ⅱ出口处的气体,检验氢气的纯度,当排出的H2纯净时,再夹紧止水夹 (7)铁屑和稀硫酸反应生成的氢气将两支试管内的空气都排出去,使氢气充满试管Ⅰ和试管Ⅱ(起保护气的作用),且外界空气不容易进入,由于有氢气的保护作用,Fe(OH)2沉淀能较长时间地稳定存在
17、(14分)
解析:(2)没有除去尾气中的二氧化硫气体的装置,二氧化硫会污染空气;(3)装置A中,橡皮管a连接分液漏斗和蒸馏烧瓶,相当于恒压滴液漏斗,其作用是使分液漏斗中的液体能顺利流下,①正确;装置B中,紫色石蕊溶液变红说明溶液显酸性,证明二氧化硫是酸性氧化物,②正确;装置C中,品红溶液褪色能证明二氧化硫具有漂白性,③正确;装置D中溶液变浑浊,生成了硫单质,说明SO2和硫化氢发生氧化还原反应,二氧化硫具有氧化性,④错误;(4)碘水中碘单质具有氧化性,二氧化硫具有还原性,二者在水溶液中发生氧化还原反应生成两种强酸:硫酸和氢碘酸。离子方程式为I2+SO2+2H2O===4H++SO+2I-;(5)溶液变浑浊说明有硫单质生成,故在水中,SO2歧化的离子方程式为3SO2+2H2O===4H++2SO+S↓;一段时间后,F、H中无明显现象且I中比G中的溶液先变浑浊,说明氢离子和钾离子不是催化剂。碘离子可作为该反应的催化剂,催化过程:SO2+4I-+4H+===2I2+S↓+2H2O,I2+2H2O+SO2===SO+4H++2I-,故选②。
答案:(1)蒸馏烧瓶 Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (2)没有除去尾气中的二氧化硫气体,会污染空气 (3)④ (4)I2+SO2+2H2O===4H++SO+2I- (5)3SO2+2H2O===4H++2SO+S↓ ②
18、(14分)
解析:(3)在Oa段NO完全转化为NO,由离子方程式可得,n(NO)=n(Fe3+)=0.1 mol,即x=0.1;c点溶质为FeSO4,溶液中Fe2+为0.2 mol,即n(FeSO4)=0.2 mol,根据硫酸根离子守恒得,n(H2SO4)=n(FeSO4)=0.2 mol,即y=0.2。
(4)Fe+NO+ 4H+=== Fe3+ + NO↑+2H2O
0.4 mol 0.1 mol 0.1 mol
Fe +2H+===Fe2+ +H2↑
0.1 mol 0.05 mol
所以V=(0.1 mol+0.05 mol)×22.4 L·mol-1=3.36 L。
答案:(1)Fe+NO+4H+===Fe3++NO↑+2H2O (2)Fe2+ (3)0.1 0.2 (4)3.36
19、(14分)
解析:装置Ⅰ中浓盐酸和漂粉精反应生成氯气,化学方程式为4HCl(浓)+Ca(ClO)2===2Cl2↑+CaCl2+2H2O。生成的氯气中混有HCl,因此通过Ⅱ中饱和食盐水除去氯气中的HCl,氯气进入Ⅲ与Br2、CO反应生成BrO,最后Ⅳ中NaOH溶液用于吸收多余的Cl2和生成的CO2。(3)检验装置气密性后进行反应,升温至50~60 ℃,滴入适量液溴,打开活塞K1、K3,装置Ⅰ中反应生成氯气,氯气经提纯后进入Ⅲ,与溴单质、碳酸根离子反应生成溴酸根离子。反应结束后在拆卸装置前为避免Ⅰ残留较多的Cl2污染空气,应打开活塞K2,吸收多余的氯气。(4)氯气进入Ⅲ与Br2、CO反应生成BrO,离子方程式为5Cl2+Br2+6CO===2BrO+10Cl-+6CO2↑。
答案:(1)2∶1 (2)除去HCl气体 (3)K1、K3 K2 (4)5Cl2+Br2+6CO===2BrO+10Cl-+6CO2↑
同课章节目录
