2026广西专版新教材化学高考第一轮同步基础练--热点专项练6 元素周期表中“位—构—性”综合推断(含答案)
文档属性
| 名称 | 2026广西专版新教材化学高考第一轮同步基础练--热点专项练6 元素周期表中“位—构—性”综合推断(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 360.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-19 09:36:16 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
热点专项练6 元素周期表中“位—构—性”综合推断
1.短周期元素A、B、C、D、E的原子序数依次增大;A的一种核素常用来鉴定一些文物的年代;B的氢化物的水溶液呈碱性;C、D为金属元素,且D原子最外层电子数等于其K层电子数;若往E单质的水溶液中滴加少量紫色石蕊溶液,可观察到先变红后褪色。下列说法正确的是( )
A.A的氢化物常温下一定为气态
B.简单离子半径大小顺序为E>B>C>D
C.C的简单氧化物比D的氧化物熔点高
D.E的氧化物均可作为消毒剂,其对应水化物均为强酸
2.一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是( )
W+[]-
A.第一电离能:Q>Z>W
B.电负性:X>Y>Z
C.WZX与WXQ均是强电解质,两者在水溶液中可以反应
D.W2Q2Z3与X2QZ4溶液反应生成黄色浑浊和无色气体,属于非氧化还原反应
3.(2024广西桂林模拟)常温下,W、X、Y、Z四种短周期主族元素的最高价氧化物对应的水化物溶液的pH(浓度均为0.01 mol·L-1)和原子半径、原子序数的关系如图所示。下列叙述正确的是( )
A.简单离子半径:Z>Y>X>W
B.第一电离能:Z>Y>W
C.Z的单质具有强氧化性和漂白性
D.W、Y、Z都可能形成18e-的氢化物分子
4.X、Y、Z、W都属于短周期元素,其中X、Y位于同一主族,Y、Z、W处于同一周期。X原子的最外层电子数是其电子层数的3倍。基态Z原子的电子总数是其最高能级电子数的5倍。W与X形成的一种气体常用于漂白和消毒,下列说法正确的是( )
A.第一电离能:YB.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.Y、Z、W三种元素的气态氢化物中,Z的气态氢化物最稳定
D.简单离子半径由小到大的顺序为X5.元素周期表对化学学科的发展起到了至关重要的作用,如图是元素周期表短周期的一部分,下列说法正确的是( )
A.图中四种元素电负性最大的是X
B.元素的第一电离能大小:Y>W
C.Y原子的价层电子排布式为
1s22s22p63s23p4
D.Z单质与X的简单氢化物能发生置换反应
6.短周期元素X、Y、Z、W的原子序数依次增大。X、Y、Z是同一周期的非金属元素。化合物WZ的晶体为离子晶体,W的二价阳离子与Z的阴离子具有相同的电子层结构。XZ2为非极性分子。Y、Z简单氢化物的沸点比它们同族相邻周期元素简单氢化物的沸点高。下列说法正确的是( )
A.第一电离能:I1(X)B.原子半径:r(X)C.电负性:χ(Y)<χ(Z)<χ(W)
D.X的最高价氧化物对应水化物的酸性比Y的弱
7.已知A、B、C、D、E是五种短周期主族元素,其原子半径与原子序数的关系如图1,且A、B、C、D形成的化合物X如图2,C与E同主族。下列说法正确的是( )
A.形成的简单离子半径:D>C
B.化合物X在高温下稳定性较强
C.第一电离能:C>E
D.A、C形成化合物的沸点高于A、B形成化合物的沸点
8.(2024湖南长沙三模)四种短周期主族元素Q、X、Y、Z的原子序数依次增大,由它们组成的一种化合物结构如图所示,其中Y、Z同族,基态X原子核外有2个未成对电子。下列说法正确的是( )
A.电负性:QB.同周期主族元素中第一电离能比Y大的只有一种
C.Z的氧化物对应的水化物为二元强酸
D.简单氢化物稳定性:X>Y>Z
9.(2025八省联考云南卷)我国科研工作者合成了一种非线性光学晶体QWX3Y6Z,其阴离子结构如图所示(电荷未标出)。X、Y、Z、W是原子序数依次增大的短周期元素,基态X的核外电子有5种运动状态,Y、Z与X同周期,W的氢氧化物具有两性,Q是第六周期半径最大的主族元素。下列说法错误的是( )
A.金属性:Q>W
B.原子半径:Z>Y
C.该晶体结构中X的化合价为+3价
D.Y的第一电离能比同周期相邻元素的都低
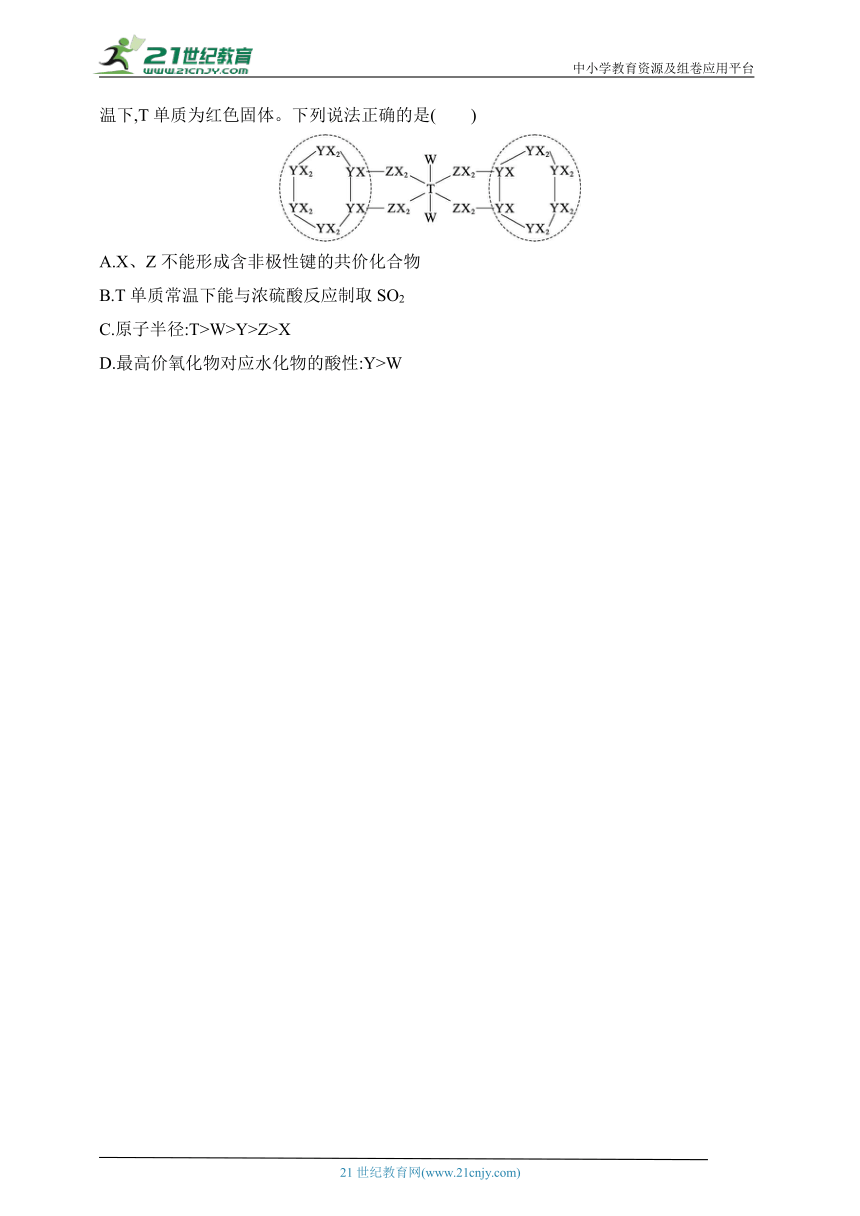
10.(2024宁夏银川模拟)原子序数依次增大的前四周期元素X、Y、Z、W、T形成的化合物结构如图所示,其中只有Y和Z位于同一周期,Z的单质常充入食品包装袋用以防腐,常温下,T单质为红色固体。下列说法正确的是( )
A.X、Z不能形成含非极性键的共价化合物
B.T单质常温下能与浓硫酸反应制取SO2
C.原子半径:T>W>Y>Z>X
D.最高价氧化物对应水化物的酸性:Y>W
参考答案
热点专项练6 元素周期表中“位—构—性”综合推断
1.B 解析 根据A的一种核素的用途,可确定A为碳元素,B的氢化物的水溶液呈碱性,则B为氮元素,D是短周期金属元素,原子的最外层电子数等于其K层电子数,且原子序数大于7,即D为Mg元素,则C为Na元素,氯气的水溶液既显酸性又具有漂白性,可使紫色石蕊溶液先变红后褪色,则E为Cl元素。碳的氢化物即为烃类,随着碳原子数的增多,常温下的状态有气态、液态或固态,A错误;简单离子半径大小顺序为Cl->N3->Na+>Mg2+,B正确;氧化钠和氧化镁均为离子晶体,镁离子比钠离子电荷数多、离子半径小,因而氧化镁中离子键强,熔点高,C错误;氯的氧化物都具有氧化性,有的可作消毒剂;在氯的含氧酸中,HClO、HClO2为弱酸,D错误。
2.C 解析 X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,由结构可知Z、Q的最外层有6个电子,Z为O,Q为S;Q和W的简单离子具有相同的电子层结构,W的原子序数最大,则W为K;Y可形成4个共价键,X只形成1个共价键,结合原子序数可知X为H,Y为C。这5种元素的非金属性越强,其第一电离能就越大,所以第一电离能:Z>Q>W,A项错误;一般情况下,元素的非金属性越强,其电负性就越大,所以元素的电负性:X3.D 解析 根据溶液的浓度和对应的pH可知X的最高价氧化物对应的水化物为一元强碱,W、Z的最高价氧化物对应的水化物是一元强酸,W的原子序数小于X,Z的原子序数大于X,则X是Na元素,W是N元素,Z是Cl元素;同浓度Y的最高价氧化物对应的水化物溶液的pH比HNO3的pH小,结合原子序数:XCl->N3->Na+,A项错误;第一电离能:N>S,B项错误;氯气没有漂白性,氯气与水生成的次氯酸才具有漂白性,C项错误;N2H4、H2S、HCl都是含18e-的氢化物,D项正确。
4.A 解析 X、Y、Z、W都属于短周期元素,X原子的最外层电子数是其电子层数的3倍,则X有2个电子层,最外层电子数为6,故X为氧元素,X、Y位于同一主族,故Y为硫元素;Y、Z、W处于同一周期,基态Z原子的电子总数是其最高能级电子数的5倍,则Z为磷元素。W与X形成的一种气体常用于漂白和消毒,W为氯元素。同一周期主族元素中,从左到右非金属性增强,第一电离能呈增大趋势,第ⅡA族和第ⅤA族大于相邻主族元素,则第一电离能:Sr(S2-)>r(Cl-)>r(O2-),即X5.D 解析 由图可知,X、Z、W、Y分别为氧、氟、磷、硫元素。图中四种元素电负性最大的是Z,A错误;元素的第一电离能大小:Y6.D 解析 W的二价阳离子与Z的阴离子具有相同的电子层结构,且化合物为WZ,即Z的阴离子为负二价,推出W为Mg,Z为O;Y、Z简单氢化物的沸点比它们同族相邻周期简单氢化物的沸点高,说明Y、Z氢化物中存在分子间氢键,因为原子序数依次增大,因此Y为N,Z为O;XZ2为非极性分子,且X与N、O是同一周期的非金属元素,推出X为C。同一周期从左向右,元素的第一电离能呈增大趋势,但ⅤA族>ⅥA族,三种元素第一电离能大小顺序是I1(N)>I1(O)>I1(C),故A项错误;同一周期从左向右,主族元素原子半径依次减小,因此r(C)>r(N)>r(O),故B项错误;O的电负性大于N,Mg属于活泼金属,Mg的电负性小于N,故C项错误;C的最高价氧化物对应水化物是H2CO3,H2CO3属于弱酸,N的最高价氧化物对应水化物是HNO3,HNO3属于强酸,故D项正确。
7.C 解析 A、B、C、D、E是五种短周期主族元素且原子序数依次增大,化合物X中元素D形成+1价阳离子,而D的原子序数大于A、B、C,可知D为Na元素;结合A的原子半径小于B、C,可知A为H元素;由原子序数可知B、C处于第二周期,化合物X中C可以形成2个共价键、B形成4个共价键,故B为C元素、C为O元素;而C与E同主族,则E为S元素。
8.A 解析 四种短周期主族元素Q、X、Y、Z的原子序数依次增大,在该化合物中,Y形成2个键,Z形成6个键,又Y、Z同族,则Y为O,Z为S;X形成4个键,基态X原子核外有2个未成对电子,则X为C;Q形成1个键,则Q为H。电负性:HS>C,D项错误。
9.B 解析 X、Y、Z、W是原子序数依次增大的短周期元素,基态X的核外电子有5种运动状态,每一种电子的运动状态各不相同,则X为B元素,Y、Z与X同周期,Y形成2个键,Z形成1个键,Y为O元素,Z为F元素;W的氢氧化物具有两性,则W为Al元素,Q是第六周期半径最大的主族元素,则为Cs元素,QWX3Y6Z为CsAlB3O6F。同主族元素从上到下金属性增强,同周期元素从左到右金属性依次减弱,故金属性:Q(Cs)>W(Al),A项正确;同周期元素从左到右原子半径减小,故原子半径:Z(F)N>O,Y的第一电离能比同周期相邻元素的都低,D项正确。
10.C 解析 由题干信息可推知:原子序数依次增大的前四周期元素X、Y、Z、W、T,Z的单质常充入食品包装袋用以防腐,Z为N;T单质为红色固体,T为Cu;Y形成四个共价键,且与N同周期,Y为C;W和X均形成一个共价键,则X为H,W为Cl,据此分析,X、Y、Z、W依次为H元素、C元素、N元素、Cl元素。X、Z能形成含非极性键的共价化合物,例如肼,NH2—NH2,A项错误;T单质需要在加热条件下能与浓硫酸反应制取SO2,B项错误;电子层数越多半径越大,电子层数相同,原子序数越大半径越小,原子半径:Cu>Cl>C>N>H,C项正确;元素非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:C21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
热点专项练6 元素周期表中“位—构—性”综合推断
1.短周期元素A、B、C、D、E的原子序数依次增大;A的一种核素常用来鉴定一些文物的年代;B的氢化物的水溶液呈碱性;C、D为金属元素,且D原子最外层电子数等于其K层电子数;若往E单质的水溶液中滴加少量紫色石蕊溶液,可观察到先变红后褪色。下列说法正确的是( )
A.A的氢化物常温下一定为气态
B.简单离子半径大小顺序为E>B>C>D
C.C的简单氧化物比D的氧化物熔点高
D.E的氧化物均可作为消毒剂,其对应水化物均为强酸
2.一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是( )
W+[]-
A.第一电离能:Q>Z>W
B.电负性:X>Y>Z
C.WZX与WXQ均是强电解质,两者在水溶液中可以反应
D.W2Q2Z3与X2QZ4溶液反应生成黄色浑浊和无色气体,属于非氧化还原反应
3.(2024广西桂林模拟)常温下,W、X、Y、Z四种短周期主族元素的最高价氧化物对应的水化物溶液的pH(浓度均为0.01 mol·L-1)和原子半径、原子序数的关系如图所示。下列叙述正确的是( )
A.简单离子半径:Z>Y>X>W
B.第一电离能:Z>Y>W
C.Z的单质具有强氧化性和漂白性
D.W、Y、Z都可能形成18e-的氢化物分子
4.X、Y、Z、W都属于短周期元素,其中X、Y位于同一主族,Y、Z、W处于同一周期。X原子的最外层电子数是其电子层数的3倍。基态Z原子的电子总数是其最高能级电子数的5倍。W与X形成的一种气体常用于漂白和消毒,下列说法正确的是( )
A.第一电离能:Y
C.Y、Z、W三种元素的气态氢化物中,Z的气态氢化物最稳定
D.简单离子半径由小到大的顺序为X
A.图中四种元素电负性最大的是X
B.元素的第一电离能大小:Y>W
C.Y原子的价层电子排布式为
1s22s22p63s23p4
D.Z单质与X的简单氢化物能发生置换反应
6.短周期元素X、Y、Z、W的原子序数依次增大。X、Y、Z是同一周期的非金属元素。化合物WZ的晶体为离子晶体,W的二价阳离子与Z的阴离子具有相同的电子层结构。XZ2为非极性分子。Y、Z简单氢化物的沸点比它们同族相邻周期元素简单氢化物的沸点高。下列说法正确的是( )
A.第一电离能:I1(X)
D.X的最高价氧化物对应水化物的酸性比Y的弱
7.已知A、B、C、D、E是五种短周期主族元素,其原子半径与原子序数的关系如图1,且A、B、C、D形成的化合物X如图2,C与E同主族。下列说法正确的是( )
A.形成的简单离子半径:D>C
B.化合物X在高温下稳定性较强
C.第一电离能:C>E
D.A、C形成化合物的沸点高于A、B形成化合物的沸点
8.(2024湖南长沙三模)四种短周期主族元素Q、X、Y、Z的原子序数依次增大,由它们组成的一种化合物结构如图所示,其中Y、Z同族,基态X原子核外有2个未成对电子。下列说法正确的是( )
A.电负性:Q
C.Z的氧化物对应的水化物为二元强酸
D.简单氢化物稳定性:X>Y>Z
9.(2025八省联考云南卷)我国科研工作者合成了一种非线性光学晶体QWX3Y6Z,其阴离子结构如图所示(电荷未标出)。X、Y、Z、W是原子序数依次增大的短周期元素,基态X的核外电子有5种运动状态,Y、Z与X同周期,W的氢氧化物具有两性,Q是第六周期半径最大的主族元素。下列说法错误的是( )
A.金属性:Q>W
B.原子半径:Z>Y
C.该晶体结构中X的化合价为+3价
D.Y的第一电离能比同周期相邻元素的都低
10.(2024宁夏银川模拟)原子序数依次增大的前四周期元素X、Y、Z、W、T形成的化合物结构如图所示,其中只有Y和Z位于同一周期,Z的单质常充入食品包装袋用以防腐,常温下,T单质为红色固体。下列说法正确的是( )
A.X、Z不能形成含非极性键的共价化合物
B.T单质常温下能与浓硫酸反应制取SO2
C.原子半径:T>W>Y>Z>X
D.最高价氧化物对应水化物的酸性:Y>W
参考答案
热点专项练6 元素周期表中“位—构—性”综合推断
1.B 解析 根据A的一种核素的用途,可确定A为碳元素,B的氢化物的水溶液呈碱性,则B为氮元素,D是短周期金属元素,原子的最外层电子数等于其K层电子数,且原子序数大于7,即D为Mg元素,则C为Na元素,氯气的水溶液既显酸性又具有漂白性,可使紫色石蕊溶液先变红后褪色,则E为Cl元素。碳的氢化物即为烃类,随着碳原子数的增多,常温下的状态有气态、液态或固态,A错误;简单离子半径大小顺序为Cl->N3->Na+>Mg2+,B正确;氧化钠和氧化镁均为离子晶体,镁离子比钠离子电荷数多、离子半径小,因而氧化镁中离子键强,熔点高,C错误;氯的氧化物都具有氧化性,有的可作消毒剂;在氯的含氧酸中,HClO、HClO2为弱酸,D错误。
2.C 解析 X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,由结构可知Z、Q的最外层有6个电子,Z为O,Q为S;Q和W的简单离子具有相同的电子层结构,W的原子序数最大,则W为K;Y可形成4个共价键,X只形成1个共价键,结合原子序数可知X为H,Y为C。这5种元素的非金属性越强,其第一电离能就越大,所以第一电离能:Z>Q>W,A项错误;一般情况下,元素的非金属性越强,其电负性就越大,所以元素的电负性:X
4.A 解析 X、Y、Z、W都属于短周期元素,X原子的最外层电子数是其电子层数的3倍,则X有2个电子层,最外层电子数为6,故X为氧元素,X、Y位于同一主族,故Y为硫元素;Y、Z、W处于同一周期,基态Z原子的电子总数是其最高能级电子数的5倍,则Z为磷元素。W与X形成的一种气体常用于漂白和消毒,W为氯元素。同一周期主族元素中,从左到右非金属性增强,第一电离能呈增大趋势,第ⅡA族和第ⅤA族大于相邻主族元素,则第一电离能:S
7.C 解析 A、B、C、D、E是五种短周期主族元素且原子序数依次增大,化合物X中元素D形成+1价阳离子,而D的原子序数大于A、B、C,可知D为Na元素;结合A的原子半径小于B、C,可知A为H元素;由原子序数可知B、C处于第二周期,化合物X中C可以形成2个共价键、B形成4个共价键,故B为C元素、C为O元素;而C与E同主族,则E为S元素。
8.A 解析 四种短周期主族元素Q、X、Y、Z的原子序数依次增大,在该化合物中,Y形成2个键,Z形成6个键,又Y、Z同族,则Y为O,Z为S;X形成4个键,基态X原子核外有2个未成对电子,则X为C;Q形成1个键,则Q为H。电负性:H
9.B 解析 X、Y、Z、W是原子序数依次增大的短周期元素,基态X的核外电子有5种运动状态,每一种电子的运动状态各不相同,则X为B元素,Y、Z与X同周期,Y形成2个键,Z形成1个键,Y为O元素,Z为F元素;W的氢氧化物具有两性,则W为Al元素,Q是第六周期半径最大的主族元素,则为Cs元素,QWX3Y6Z为CsAlB3O6F。同主族元素从上到下金属性增强,同周期元素从左到右金属性依次减弱,故金属性:Q(Cs)>W(Al),A项正确;同周期元素从左到右原子半径减小,故原子半径:Z(F)
10.C 解析 由题干信息可推知:原子序数依次增大的前四周期元素X、Y、Z、W、T,Z的单质常充入食品包装袋用以防腐,Z为N;T单质为红色固体,T为Cu;Y形成四个共价键,且与N同周期,Y为C;W和X均形成一个共价键,则X为H,W为Cl,据此分析,X、Y、Z、W依次为H元素、C元素、N元素、Cl元素。X、Z能形成含非极性键的共价化合物,例如肼,NH2—NH2,A项错误;T单质需要在加热条件下能与浓硫酸反应制取SO2,B项错误;电子层数越多半径越大,电子层数相同,原子序数越大半径越小,原子半径:Cu>Cl>C>N>H,C项正确;元素非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:C
21世纪教育网(www.21cnjy.com)
同课章节目录
