(7)1.3.3元素周期表的应用(含解析)__高一化学鲁科版(2019)必修二同步课时作业
文档属性
| 名称 | (7)1.3.3元素周期表的应用(含解析)__高一化学鲁科版(2019)必修二同步课时作业 |  | |
| 格式 | docx | ||
| 文件大小 | 812.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-18 08:41:12 | ||
图片预览


文档简介
(7)1.3.3元素周期表的应用——高一化学鲁科版(2019)必修二同步课时作业
1.5月3日,我国嫦娥六号探测器成功发射,下列“嫦娥六号”所使用到的材料中属于新型无机非金属材料的是( )
A.主体框架—钛合金
B.光学望远镜—高致密碳化硅特种陶瓷
C.国旗—高性能芳纶纤维
D.降落伞的绳带—超高分子量聚乙烯纤维
2.自然界中普遍存在着元素的转化。下列选项中的各步转化无法通过一步反应实现的是( )
A.
B.
C.
D.
3.下列有关物质的俗称、分类和用途的说法都正确的是( )
选项 物质 俗称 分类 用途
A 生石灰 碱性氧化物 加入煤中可减少温室气体的排放
B 小苏打 盐 常用于中和发酵面团产生酸
C 明矾 电解质 作净水剂可用于杀菌消毒
D 水玻璃 电解质 是制备硅胶和木材防火剂的原料
A.A B.B C.C D.D
4.下列关于物质的分类中,正确的是( )
选项 酸性氧化物 酸 盐 电解质 非电解质
A 纯碱 液氯
B 硫酸铜溶液
C 酒精
D CO
A.A B.B C.C D.D
5.下列有关硅及其化合物的说法中不正确的是( )
A.在粗硅的提取中发生反应:,硅元素被还原
B.能与NaOH溶液反应生成硅酸钠
C.用制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入
D.由可知硅酸的酸性强于碳酸
6.下列说法不正确的是( )
A.熔点高,能用于制作坩埚
B.能与反应产生,可作供氧剂
C.是酸性氧化物,是生产陶瓷、玻璃和水泥的重要原料
D.浓硝酸见光易分解,应保存在棕色细口瓶中
7.一种从某混合物(主要成分为、、)中提取钒的工艺流程如图所示。已知:P2O4能够萃取溶液中的。下列说法正确的是( )
A.“酸浸”过程中发生了氧化还原反应
B.试剂a的作用是氧化
C.操作Ⅱ使用的主要玻璃仪器有漏斗、烧杯、玻璃棒
D.水层中可能含有
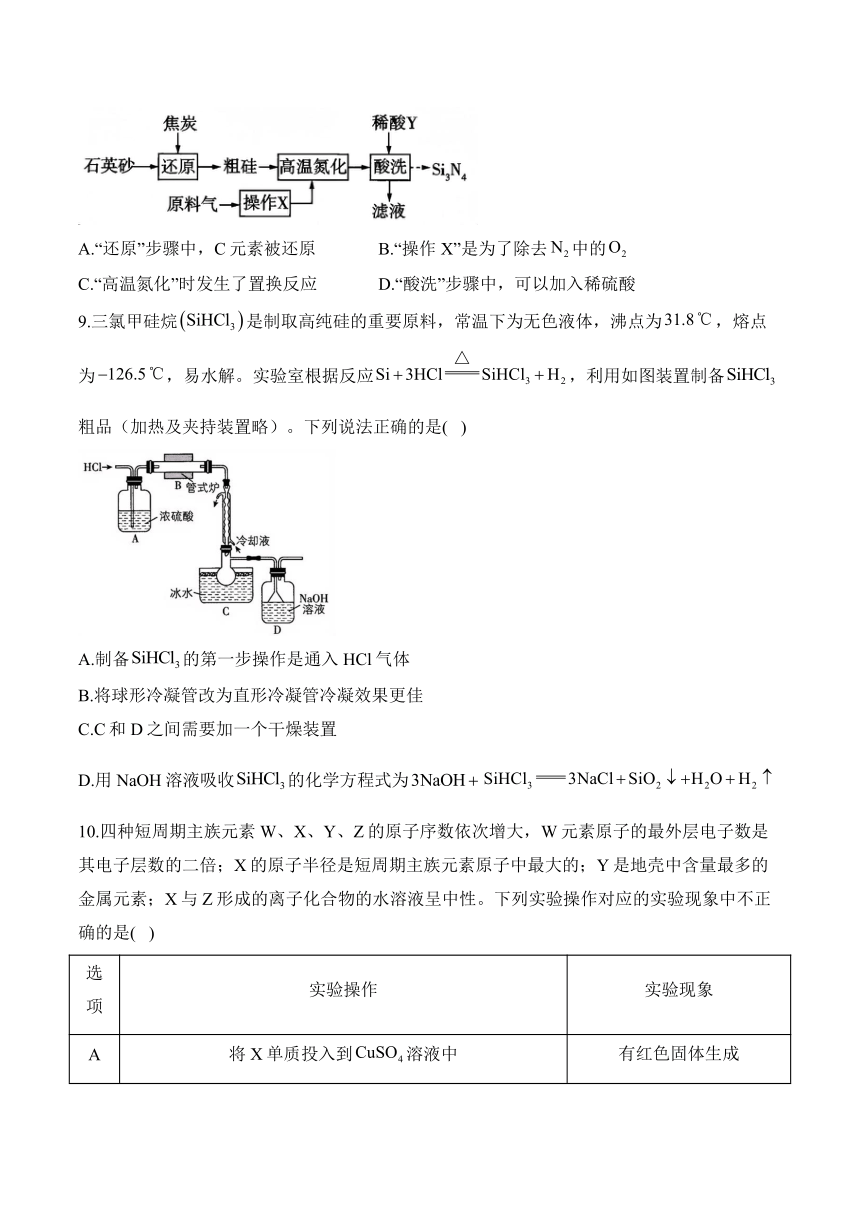
8.工业上用石英砂(主要成分为)和原料气(含和少量)制备的流程如下(粗硅中含少量杂质,高温氮化时杂质未参加反应)。下列说法正确的是( )
A.“还原”步骤中,C元素被还原 B.“操作X”是为了除去中的
C.“高温氮化”时发生了置换反应 D.“酸洗”步骤中,可以加入稀硫酸
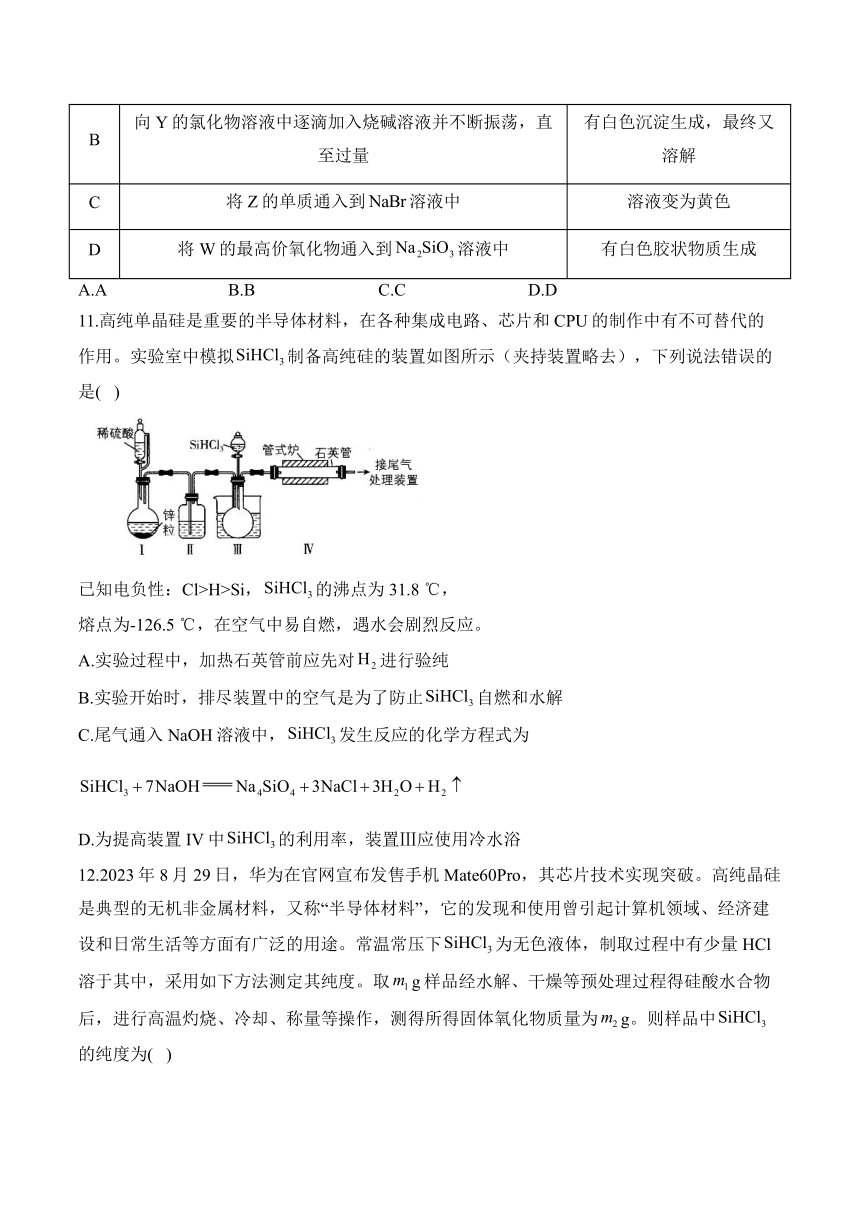
9.三氯甲硅烷是制取高纯硅的重要原料,常温下为无色液体,沸点为,熔点为,易水解。实验室根据反应,利用如图装置制备粗品(加热及夹持装置略)。下列说法正确的是( )
A.制备的第一步操作是通入HCl气体
B.将球形冷凝管改为直形冷凝管冷凝效果更佳
C.C和D之间需要加一个干燥装置
D.用NaOH溶液吸收的化学方程式为
10.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W元素原子的最外层电子数是其电子层数的二倍;X的原子半径是短周期主族元素原子中最大的;Y是地壳中含量最多的金属元素;X与Z形成的离子化合物的水溶液呈中性。下列实验操作对应的实验现象中不正确的是( )
选项 实验操作 实验现象
A 将X单质投入到溶液中 有红色固体生成
B 向Y的氯化物溶液中逐滴加入烧碱溶液并不断振荡,直至过量 有白色沉淀生成,最终又溶解
C 将Z的单质通入到溶液中 溶液变为黄色
D 将W的最高价氧化物通入到溶液中 有白色胶状物质生成
A.A B.B C.C D.D
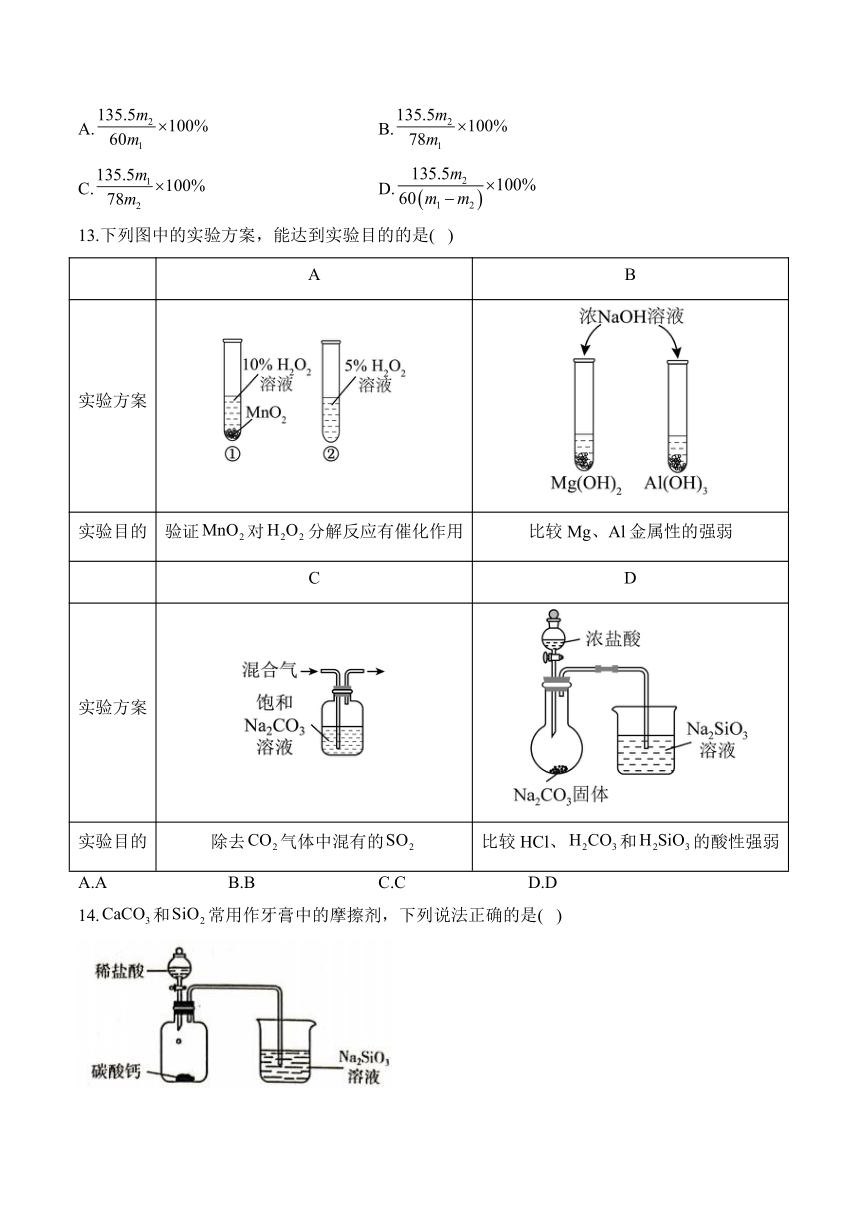
11.高纯单晶硅是重要的半导体材料,在各种集成电路、芯片和CPU的制作中有不可替代的作用。实验室中模拟制备高纯硅的装置如图所示(夹持装置略去),下列说法错误的是( )
已知电负性:Cl>H>Si,的沸点为31.8 ℃,
熔点为-126.5 ℃,在空气中易自燃,遇水会剧烈反应。
A.实验过程中,加热石英管前应先对进行验纯
B.实验开始时,排尽装置中的空气是为了防止自燃和水解
C.尾气通入NaOH溶液中,发生反应的化学方程式为
D.为提高装置IV中的利用率,装置Ⅲ应使用冷水浴
12.2023年8月29日,华为在官网宣布发售手机Mate60Pro,其芯片技术实现突破。高纯晶硅是典型的无机非金属材料,又称“半导体材料”,它的发现和使用曾引起计算机领域、经济建设和日常生活等方面有广泛的用途。常温常压下为无色液体,制取过程中有少量HCl溶于其中,采用如下方法测定其纯度。取g样品经水解、干燥等预处理过程得硅酸水合物后,进行高温灼烧、冷却、称量等操作,测得所得固体氧化物质量为g。则样品中的纯度为( )
A. B.
C. D.
13.下列图中的实验方案,能达到实验目的的是( )
A B
实验方案
实验目的 验证对分解反应有催化作用 比较Mg、Al金属性的强弱
C D
实验方案
实验目的 除去气体中混有的 比较HCl、和的酸性强弱
A.A B.B C.C D.D
14.和常用作牙膏中的摩擦剂,下列说法正确的是( )
A.属于电解质
B.可用乙酸除去水垢中的
C.由图中实验可得出酸性:
D.的俗称为金刚砂
15.Ⅰ.常用的干燥剂有:①生石灰;②无水氯化钙;③变色硅胶;④;⑤五氧化二磷;⑥浓硫酸。
(1)硅胶中无水氯化钴呈蓝色,吸水后变为粉红色的,该变化过程属于_______(填“物理变化”或“化学变化”);硅酸钠是制备硅胶的原材料,硅酸钠水溶液俗称_______。
(2)氯化钙结晶水合物进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是_______(填选项字母)。
A.氯化氢气流中加热到174℃
B.直接加热至174℃
C.乙醇气流中加热至260℃
D.氯化氢气流中加热到260℃
(3)吸湿性强,常被用作气体和液体的干燥剂,它甚至可以使硝酸完全脱水。该反应_______(填“是”或“不是”)氧化还原反应。
Ⅱ。某小组为了探究浓硫酸、五氧化二磷的干燥能力,设计如图实验(加热装置省略)。实验中观察到B中白色粉末变蓝,D中产生白色沉淀,且品红溶液不褪色。
部分信息如下:
①已知几种物质的熔点、沸点如下表所示:
98.3%硫酸 磷酸 三氧化硫
熔点/℃ 10.5 42 16.8
沸点/℃ 338 213 44.8
②为白色固体,难溶于水。
(4)B中反应的化学方程式为_______,装置D中产生的白色沉淀是_______(填化学式)。
(5)根据实验结果推知,98.3%硫酸的干燥能力_______(填“强于”“弱于”或“等于”)五氧化二磷的干燥能力。
(6)加热装置A时温度不宜超过213℃,其原因是_______。
答案以及解析
1.答案:B
解析:A.钛合金属于金属材料,A错误;
B.高致密碳化硅特种陶瓷属于新型无机非金属材料,B正确;
C.高性能芳纶纤维属于有机高分子材料,C错误;
D.超高分子量聚乙烯纤维属于有机高分子材料,D错误;
故选B。
2.答案:A
解析:A.氧化铁不溶于水,不能与水反应生成氢氧化铁,则物质间的各步转化无法通过一步反应实现,故A符合题意;
B.钠在氯气中燃烧生成氯化钠、氯化钠溶液与氨气、二氧化碳反应能生成碳酸氢钠、碳酸氢钠溶液与盐酸反应能生成氯化钠、氯化钠熔融电解能生成钠,则物质间的各步转化通过一步反应实现,故B不符合题意;
C.二氧化硅高温条件下与碳反应能生成硅、硅与氯化氢在高温下反应能生成三氯硅烷、三氯硅烷与氢气在高温下反应能生成硅、硅与氧气高温下反应能生成二氧化硅,则物质间的各步转化通过一步反应实现,故C不符合题意;
D.一氧化氮与氧气反应能生成二氧化氮、二氧化氮与水反应能生成硝酸、浓硝酸与铜反应能生成二氧化氮、二氧化氮与水反应能生成一氧化氮,则物质间的各步转化通过一步反应实现,故D不符合题意;
故选A。
3.答案:B
解析:A.CaO是碱性氧化物,加入煤中,燃烧过程中硫元素生成硫酸钙,可减少二氧化硫的排放,故A错误;
B.属于盐,俗名是小苏打,常用于中和发酵面团产生酸,故B正确;
C.的俗名是明矾,在水溶液中,铝离子水解为氢氧化铝胶体,吸附水中的悬浮物,可作净水剂,但不能用于杀菌消毒,故C错误;
D.水溶液俗称水玻璃,为混合物,不属于电解质,为盐类,属于电解质,故D错误;故答案选B。
4.答案:C
解析:A.液氯是单质,不是非电解质,A错误;
B.硫酸铜溶液是混合物,不是电解质,B错误;
C.三氧化硫能和碱反应生成盐和水的氧化物属于酸性氧化物;碳酸为酸、氢氧化钠为碱;硅酸钠是由金属阳离子和酸根离子构成的化合物,为盐;酒精为有机物属于非电解质,C正确;
D.CO不和碱反应,不是酸性氧化物;硫酸氢钠为盐不是酸,D错误;
故选C。
5.答案:D
解析:A.根据化学方程式可知,该反应中中的Si化合价降低,得到电子,被还原,故A项正确;
B.与NaOH溶液反应生成硅酸钠和水,化学方程式为:,故B项正确;
C.二氧化硅无法直接与水反应生成硅酸,因此先使二氧化硅与氢氧化钠溶液反应生成硅酸钠,硅酸钠溶液再与二氧化碳反应生成硅酸,故C项正确;
D.酸性强弱的比较需要在没有外界条件干扰的情况下才能比较,该反应的反应条件为高温,干扰了化学反应,若要验证酸性强弱,可向硅酸钠溶液中通入二氧化碳生成硅酸,可知,碳酸酸性强于硅酸,故D项错误;
故答案选D。
6.答案:C
解析:A.熔点很高,是一种比较好的耐火材料,可用来制造耐火坩埚,A正确;
B.能与反应产生,该反应能安全发生且不生成有毒气体,故可作供氧剂,B正确;
C.能够和NaOH溶液反应生成和,是酸性氧化物,是生产玻璃和水泥的重要原料,生产陶瓷的原料是黏土,不是生成陶瓷的重要原料,C错误;
D.硝酸化学性质不稳定,见光或受热分解,,在贮存时用棕色细口瓶可以避免见光,放置在阴凉处可避免受热,D正确;
故选C。
7.答案:D
解析:A.根据分析,“酸浸”过程中各元素化合价未变,没有发生氧化还原反应,A错误;
B.试剂a的作用是将还原为,B错误;
C.操作Ⅱ为分液,使用的主要玻璃仪器有分液漏斗、烧杯,C错误;
D.整个过程中铁元素在操作二后进入了水层,容易被氧化,水层中可能含有,D正确;
故选D。
8.答案:B
解析:“还原”步骤中发生反应,C元素被氧化,A错误;“高温氮化”过程中发生反应,“操作X”是为了除去中的,B正确、C错误;由于稀硫酸不与铜反应,因此“酸洗”步骤中不能用稀硫酸,D错误。
9.答案:C
解析:制备的第一步操作应该是搭建实验装置并检查装置的气密性,A错误;球形冷凝管中冷凝水的接触面积更大,冷凝效果更好,B错误;容易水解,C和D之间应添加一个干燥装置,以防止D装置中挥发出的水蒸气进入C装置,C正确;用NaOH溶液吸收时的化学方程式为,D错误。
10.答案:A
解析:A.将单质钠投入到溶液中,钠先和水反应生成NaOH和氢气,NaOH和反应生成蓝色沉淀,钠不能置换出单质铜,所以无大量红色固体生成,A错误;
B.当向氯化铝溶液中逐滴加入烧碱溶液时,首先发生反应生成氯化钠和氢氧化铝,氢氧化铝为白色沉淀,继续滴加氢氧化钠溶液至过量时,氢氧化铝沉淀会溶解,生成偏铝酸钠,B正确;
C.将氯气通入到NaBr溶液中,发生反应生成氯化钠和溴单质,生成的单质溴使溶液变为黄色,C正确;
D.将通入到溶液中,发生反应生成碳酸钠和硅酸,生成的硅酸为白色沉淀,D正确;
故选A。
11.答案:D
解析:实验过程中,应先对进行验纯再加热石英管,防止氢气不纯造成危险,A正确;在空气中易自燃,遇水会剧烈反应,实验开始时,排尽装置中的空气是为了防止自燃和水解,B正确;电负性:Cl>H>Si,中H为-1价,具有还原性,可与氢氧化钠溶液发生归中反应,化学方程式为,C正确;装置Ⅲ的作用是使汽化,汽化后的与氢气在石英管中反应,不可使用冷水浴,D错误。
12.答案:A
解析:样品经水解,干燥等预处理过程得到硅酸水合物后,高温灼烧,在干燥器中冷却后,称量,所得固体氧化物为二氧化硅,质量为,则二氧化硅的物质的量为,根据硅元素守恒可知。样品纯度为,化简得,选A。
答案为:A。
13.答案:B
解析:A.要验证对分解反应有催化作用,则应该只有催化剂不同,其它条件必须完全相同,该实验中催化剂、反应物过氧化氢的浓度都不同,所以达不到实验目的,A不符合题意;
B.氢氧化镁不溶于浓氢氧化钠溶液而氢氧化铝能溶于浓氢氧化钠溶液,说明氢氧化镁的碱性强于氢氧化铝,则金属性:Mg>Al,该实验方案能达到实验目的,B符合题意;
C.二氧化碳、二氧化硫都能和饱和碳酸钠溶液反应,应该用饱和的碳酸氢钠溶液除去二氧化碳中的二氧化硫,C不符合题意;
D.较强的酸能和较弱的酸对应的酸盐反应生成较弱的酸,浓盐酸和碳酸钠固体反应可生成二氧化碳,说明盐酸的酸性强于碳酸,但由于生成的二氧化碳中混有挥发出的HCl,HCl也能和硅酸钠溶液反应而干扰二氧化碳与硅酸钠溶液的反应,无法比较出碳酸和硅酸的酸性强弱,D不符合题意;
故答案为B。
14.答案:B
解析:A.在水溶液和熔融状态下均不能电离出阴阳离子而导电,不属于电解质,A错误;
B.乙酸的酸性比碳酸强,乙酸可与碳酸钙反应生成乙酸钙、水和二氧化碳,乙酸钙可溶于水,故可用乙酸除去水垢中的,B正确;
C.由于盐酸易挥发,通过导气管进入硅酸钠溶液中的二氧化碳气体中混有少量 HCl;HCl也能与硅酸钠溶液反应生成硅酸沉淀,从而干扰了碳酸和硅酸的酸性比较,C错误;
D.金刚砂即碳化硅,化学式为SiC,D错误。
15.答案:(1)化学变化;水玻璃
(2)D
(3)不是
(4);
(5)弱于
(6)防止磷酸挥发,干扰实验
解析:
【分析】Ⅱ:浓硫酸和反应,生成的产物使B中白色粉末变蓝,说明有水生成,D中产生白色沉淀且品红溶液不褪色,说明还有生成,则A中浓硫酸和五氧化二磷反应生成气体,B中无水硫酸铜检验水,C干燥,D吸收并检验气体。
【详解】(1)硅胶中无水氯化钴呈蓝色,吸水后变为粉红色的,该变化过程中有新物质生成,属于化学变化;硅酸钠水溶液俗称水玻璃;
(2)由于的相对分子质量为219、假如有,则相对分子质量分别为183、147、129,的相对分子质量为111,根据相对分子质量及质量关系,将转化为最佳脱水的方法应该选D;
(3)反应方程式为,无价态变化,不是氧化还原反应;
(4)无水硫酸铜遇水变蓝,根据B中现象,可推断从A中逸出的物质含。B中反应的化学方程式为;D中和氯化钡溶液反应生成硫酸钡沉淀和盐酸,反应的离子方程式为,装置D中产生白色沉淀为;
(5)反应中有生成,是五氧化二磷吸收了浓硫酸中的水,使其转化为,说明五氧化二磷的干燥能力强于98.3%的浓硫酸;
(6)从表中可知,磷酸的沸点为213℃,为防止磷酸挥发,与氯化钡溶液反应生成沉淀干扰实验,加热A装置时温度不宜超过213℃。
1.5月3日,我国嫦娥六号探测器成功发射,下列“嫦娥六号”所使用到的材料中属于新型无机非金属材料的是( )
A.主体框架—钛合金
B.光学望远镜—高致密碳化硅特种陶瓷
C.国旗—高性能芳纶纤维
D.降落伞的绳带—超高分子量聚乙烯纤维
2.自然界中普遍存在着元素的转化。下列选项中的各步转化无法通过一步反应实现的是( )
A.
B.
C.
D.
3.下列有关物质的俗称、分类和用途的说法都正确的是( )
选项 物质 俗称 分类 用途
A 生石灰 碱性氧化物 加入煤中可减少温室气体的排放
B 小苏打 盐 常用于中和发酵面团产生酸
C 明矾 电解质 作净水剂可用于杀菌消毒
D 水玻璃 电解质 是制备硅胶和木材防火剂的原料
A.A B.B C.C D.D
4.下列关于物质的分类中,正确的是( )
选项 酸性氧化物 酸 盐 电解质 非电解质
A 纯碱 液氯
B 硫酸铜溶液
C 酒精
D CO
A.A B.B C.C D.D
5.下列有关硅及其化合物的说法中不正确的是( )
A.在粗硅的提取中发生反应:,硅元素被还原
B.能与NaOH溶液反应生成硅酸钠
C.用制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入
D.由可知硅酸的酸性强于碳酸
6.下列说法不正确的是( )
A.熔点高,能用于制作坩埚
B.能与反应产生,可作供氧剂
C.是酸性氧化物,是生产陶瓷、玻璃和水泥的重要原料
D.浓硝酸见光易分解,应保存在棕色细口瓶中
7.一种从某混合物(主要成分为、、)中提取钒的工艺流程如图所示。已知:P2O4能够萃取溶液中的。下列说法正确的是( )
A.“酸浸”过程中发生了氧化还原反应
B.试剂a的作用是氧化
C.操作Ⅱ使用的主要玻璃仪器有漏斗、烧杯、玻璃棒
D.水层中可能含有
8.工业上用石英砂(主要成分为)和原料气(含和少量)制备的流程如下(粗硅中含少量杂质,高温氮化时杂质未参加反应)。下列说法正确的是( )
A.“还原”步骤中,C元素被还原 B.“操作X”是为了除去中的
C.“高温氮化”时发生了置换反应 D.“酸洗”步骤中,可以加入稀硫酸
9.三氯甲硅烷是制取高纯硅的重要原料,常温下为无色液体,沸点为,熔点为,易水解。实验室根据反应,利用如图装置制备粗品(加热及夹持装置略)。下列说法正确的是( )
A.制备的第一步操作是通入HCl气体
B.将球形冷凝管改为直形冷凝管冷凝效果更佳
C.C和D之间需要加一个干燥装置
D.用NaOH溶液吸收的化学方程式为
10.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W元素原子的最外层电子数是其电子层数的二倍;X的原子半径是短周期主族元素原子中最大的;Y是地壳中含量最多的金属元素;X与Z形成的离子化合物的水溶液呈中性。下列实验操作对应的实验现象中不正确的是( )
选项 实验操作 实验现象
A 将X单质投入到溶液中 有红色固体生成
B 向Y的氯化物溶液中逐滴加入烧碱溶液并不断振荡,直至过量 有白色沉淀生成,最终又溶解
C 将Z的单质通入到溶液中 溶液变为黄色
D 将W的最高价氧化物通入到溶液中 有白色胶状物质生成
A.A B.B C.C D.D
11.高纯单晶硅是重要的半导体材料,在各种集成电路、芯片和CPU的制作中有不可替代的作用。实验室中模拟制备高纯硅的装置如图所示(夹持装置略去),下列说法错误的是( )
已知电负性:Cl>H>Si,的沸点为31.8 ℃,
熔点为-126.5 ℃,在空气中易自燃,遇水会剧烈反应。
A.实验过程中,加热石英管前应先对进行验纯
B.实验开始时,排尽装置中的空气是为了防止自燃和水解
C.尾气通入NaOH溶液中,发生反应的化学方程式为
D.为提高装置IV中的利用率,装置Ⅲ应使用冷水浴
12.2023年8月29日,华为在官网宣布发售手机Mate60Pro,其芯片技术实现突破。高纯晶硅是典型的无机非金属材料,又称“半导体材料”,它的发现和使用曾引起计算机领域、经济建设和日常生活等方面有广泛的用途。常温常压下为无色液体,制取过程中有少量HCl溶于其中,采用如下方法测定其纯度。取g样品经水解、干燥等预处理过程得硅酸水合物后,进行高温灼烧、冷却、称量等操作,测得所得固体氧化物质量为g。则样品中的纯度为( )
A. B.
C. D.
13.下列图中的实验方案,能达到实验目的的是( )
A B
实验方案
实验目的 验证对分解反应有催化作用 比较Mg、Al金属性的强弱
C D
实验方案
实验目的 除去气体中混有的 比较HCl、和的酸性强弱
A.A B.B C.C D.D
14.和常用作牙膏中的摩擦剂,下列说法正确的是( )
A.属于电解质
B.可用乙酸除去水垢中的
C.由图中实验可得出酸性:
D.的俗称为金刚砂
15.Ⅰ.常用的干燥剂有:①生石灰;②无水氯化钙;③变色硅胶;④;⑤五氧化二磷;⑥浓硫酸。
(1)硅胶中无水氯化钴呈蓝色,吸水后变为粉红色的,该变化过程属于_______(填“物理变化”或“化学变化”);硅酸钠是制备硅胶的原材料,硅酸钠水溶液俗称_______。
(2)氯化钙结晶水合物进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是_______(填选项字母)。
A.氯化氢气流中加热到174℃
B.直接加热至174℃
C.乙醇气流中加热至260℃
D.氯化氢气流中加热到260℃
(3)吸湿性强,常被用作气体和液体的干燥剂,它甚至可以使硝酸完全脱水。该反应_______(填“是”或“不是”)氧化还原反应。
Ⅱ。某小组为了探究浓硫酸、五氧化二磷的干燥能力,设计如图实验(加热装置省略)。实验中观察到B中白色粉末变蓝,D中产生白色沉淀,且品红溶液不褪色。
部分信息如下:
①已知几种物质的熔点、沸点如下表所示:
98.3%硫酸 磷酸 三氧化硫
熔点/℃ 10.5 42 16.8
沸点/℃ 338 213 44.8
②为白色固体,难溶于水。
(4)B中反应的化学方程式为_______,装置D中产生的白色沉淀是_______(填化学式)。
(5)根据实验结果推知,98.3%硫酸的干燥能力_______(填“强于”“弱于”或“等于”)五氧化二磷的干燥能力。
(6)加热装置A时温度不宜超过213℃,其原因是_______。
答案以及解析
1.答案:B
解析:A.钛合金属于金属材料,A错误;
B.高致密碳化硅特种陶瓷属于新型无机非金属材料,B正确;
C.高性能芳纶纤维属于有机高分子材料,C错误;
D.超高分子量聚乙烯纤维属于有机高分子材料,D错误;
故选B。
2.答案:A
解析:A.氧化铁不溶于水,不能与水反应生成氢氧化铁,则物质间的各步转化无法通过一步反应实现,故A符合题意;
B.钠在氯气中燃烧生成氯化钠、氯化钠溶液与氨气、二氧化碳反应能生成碳酸氢钠、碳酸氢钠溶液与盐酸反应能生成氯化钠、氯化钠熔融电解能生成钠,则物质间的各步转化通过一步反应实现,故B不符合题意;
C.二氧化硅高温条件下与碳反应能生成硅、硅与氯化氢在高温下反应能生成三氯硅烷、三氯硅烷与氢气在高温下反应能生成硅、硅与氧气高温下反应能生成二氧化硅,则物质间的各步转化通过一步反应实现,故C不符合题意;
D.一氧化氮与氧气反应能生成二氧化氮、二氧化氮与水反应能生成硝酸、浓硝酸与铜反应能生成二氧化氮、二氧化氮与水反应能生成一氧化氮,则物质间的各步转化通过一步反应实现,故D不符合题意;
故选A。
3.答案:B
解析:A.CaO是碱性氧化物,加入煤中,燃烧过程中硫元素生成硫酸钙,可减少二氧化硫的排放,故A错误;
B.属于盐,俗名是小苏打,常用于中和发酵面团产生酸,故B正确;
C.的俗名是明矾,在水溶液中,铝离子水解为氢氧化铝胶体,吸附水中的悬浮物,可作净水剂,但不能用于杀菌消毒,故C错误;
D.水溶液俗称水玻璃,为混合物,不属于电解质,为盐类,属于电解质,故D错误;故答案选B。
4.答案:C
解析:A.液氯是单质,不是非电解质,A错误;
B.硫酸铜溶液是混合物,不是电解质,B错误;
C.三氧化硫能和碱反应生成盐和水的氧化物属于酸性氧化物;碳酸为酸、氢氧化钠为碱;硅酸钠是由金属阳离子和酸根离子构成的化合物,为盐;酒精为有机物属于非电解质,C正确;
D.CO不和碱反应,不是酸性氧化物;硫酸氢钠为盐不是酸,D错误;
故选C。
5.答案:D
解析:A.根据化学方程式可知,该反应中中的Si化合价降低,得到电子,被还原,故A项正确;
B.与NaOH溶液反应生成硅酸钠和水,化学方程式为:,故B项正确;
C.二氧化硅无法直接与水反应生成硅酸,因此先使二氧化硅与氢氧化钠溶液反应生成硅酸钠,硅酸钠溶液再与二氧化碳反应生成硅酸,故C项正确;
D.酸性强弱的比较需要在没有外界条件干扰的情况下才能比较,该反应的反应条件为高温,干扰了化学反应,若要验证酸性强弱,可向硅酸钠溶液中通入二氧化碳生成硅酸,可知,碳酸酸性强于硅酸,故D项错误;
故答案选D。
6.答案:C
解析:A.熔点很高,是一种比较好的耐火材料,可用来制造耐火坩埚,A正确;
B.能与反应产生,该反应能安全发生且不生成有毒气体,故可作供氧剂,B正确;
C.能够和NaOH溶液反应生成和,是酸性氧化物,是生产玻璃和水泥的重要原料,生产陶瓷的原料是黏土,不是生成陶瓷的重要原料,C错误;
D.硝酸化学性质不稳定,见光或受热分解,,在贮存时用棕色细口瓶可以避免见光,放置在阴凉处可避免受热,D正确;
故选C。
7.答案:D
解析:A.根据分析,“酸浸”过程中各元素化合价未变,没有发生氧化还原反应,A错误;
B.试剂a的作用是将还原为,B错误;
C.操作Ⅱ为分液,使用的主要玻璃仪器有分液漏斗、烧杯,C错误;
D.整个过程中铁元素在操作二后进入了水层,容易被氧化,水层中可能含有,D正确;
故选D。
8.答案:B
解析:“还原”步骤中发生反应,C元素被氧化,A错误;“高温氮化”过程中发生反应,“操作X”是为了除去中的,B正确、C错误;由于稀硫酸不与铜反应,因此“酸洗”步骤中不能用稀硫酸,D错误。
9.答案:C
解析:制备的第一步操作应该是搭建实验装置并检查装置的气密性,A错误;球形冷凝管中冷凝水的接触面积更大,冷凝效果更好,B错误;容易水解,C和D之间应添加一个干燥装置,以防止D装置中挥发出的水蒸气进入C装置,C正确;用NaOH溶液吸收时的化学方程式为,D错误。
10.答案:A
解析:A.将单质钠投入到溶液中,钠先和水反应生成NaOH和氢气,NaOH和反应生成蓝色沉淀,钠不能置换出单质铜,所以无大量红色固体生成,A错误;
B.当向氯化铝溶液中逐滴加入烧碱溶液时,首先发生反应生成氯化钠和氢氧化铝,氢氧化铝为白色沉淀,继续滴加氢氧化钠溶液至过量时,氢氧化铝沉淀会溶解,生成偏铝酸钠,B正确;
C.将氯气通入到NaBr溶液中,发生反应生成氯化钠和溴单质,生成的单质溴使溶液变为黄色,C正确;
D.将通入到溶液中,发生反应生成碳酸钠和硅酸,生成的硅酸为白色沉淀,D正确;
故选A。
11.答案:D
解析:实验过程中,应先对进行验纯再加热石英管,防止氢气不纯造成危险,A正确;在空气中易自燃,遇水会剧烈反应,实验开始时,排尽装置中的空气是为了防止自燃和水解,B正确;电负性:Cl>H>Si,中H为-1价,具有还原性,可与氢氧化钠溶液发生归中反应,化学方程式为,C正确;装置Ⅲ的作用是使汽化,汽化后的与氢气在石英管中反应,不可使用冷水浴,D错误。
12.答案:A
解析:样品经水解,干燥等预处理过程得到硅酸水合物后,高温灼烧,在干燥器中冷却后,称量,所得固体氧化物为二氧化硅,质量为,则二氧化硅的物质的量为,根据硅元素守恒可知。样品纯度为,化简得,选A。
答案为:A。
13.答案:B
解析:A.要验证对分解反应有催化作用,则应该只有催化剂不同,其它条件必须完全相同,该实验中催化剂、反应物过氧化氢的浓度都不同,所以达不到实验目的,A不符合题意;
B.氢氧化镁不溶于浓氢氧化钠溶液而氢氧化铝能溶于浓氢氧化钠溶液,说明氢氧化镁的碱性强于氢氧化铝,则金属性:Mg>Al,该实验方案能达到实验目的,B符合题意;
C.二氧化碳、二氧化硫都能和饱和碳酸钠溶液反应,应该用饱和的碳酸氢钠溶液除去二氧化碳中的二氧化硫,C不符合题意;
D.较强的酸能和较弱的酸对应的酸盐反应生成较弱的酸,浓盐酸和碳酸钠固体反应可生成二氧化碳,说明盐酸的酸性强于碳酸,但由于生成的二氧化碳中混有挥发出的HCl,HCl也能和硅酸钠溶液反应而干扰二氧化碳与硅酸钠溶液的反应,无法比较出碳酸和硅酸的酸性强弱,D不符合题意;
故答案为B。
14.答案:B
解析:A.在水溶液和熔融状态下均不能电离出阴阳离子而导电,不属于电解质,A错误;
B.乙酸的酸性比碳酸强,乙酸可与碳酸钙反应生成乙酸钙、水和二氧化碳,乙酸钙可溶于水,故可用乙酸除去水垢中的,B正确;
C.由于盐酸易挥发,通过导气管进入硅酸钠溶液中的二氧化碳气体中混有少量 HCl;HCl也能与硅酸钠溶液反应生成硅酸沉淀,从而干扰了碳酸和硅酸的酸性比较,C错误;
D.金刚砂即碳化硅,化学式为SiC,D错误。
15.答案:(1)化学变化;水玻璃
(2)D
(3)不是
(4);
(5)弱于
(6)防止磷酸挥发,干扰实验
解析:
【分析】Ⅱ:浓硫酸和反应,生成的产物使B中白色粉末变蓝,说明有水生成,D中产生白色沉淀且品红溶液不褪色,说明还有生成,则A中浓硫酸和五氧化二磷反应生成气体,B中无水硫酸铜检验水,C干燥,D吸收并检验气体。
【详解】(1)硅胶中无水氯化钴呈蓝色,吸水后变为粉红色的,该变化过程中有新物质生成,属于化学变化;硅酸钠水溶液俗称水玻璃;
(2)由于的相对分子质量为219、假如有,则相对分子质量分别为183、147、129,的相对分子质量为111,根据相对分子质量及质量关系,将转化为最佳脱水的方法应该选D;
(3)反应方程式为,无价态变化,不是氧化还原反应;
(4)无水硫酸铜遇水变蓝,根据B中现象,可推断从A中逸出的物质含。B中反应的化学方程式为;D中和氯化钡溶液反应生成硫酸钡沉淀和盐酸,反应的离子方程式为,装置D中产生白色沉淀为;
(5)反应中有生成,是五氧化二磷吸收了浓硫酸中的水,使其转化为,说明五氧化二磷的干燥能力强于98.3%的浓硫酸;
(6)从表中可知,磷酸的沸点为213℃,为防止磷酸挥发,与氯化钡溶液反应生成沉淀干扰实验,加热A装置时温度不宜超过213℃。
