(8)1.4海带提碘与海水提溴(含答案)__高一化学鲁科版(2019)必修二同步课时作业
文档属性
| 名称 | (8)1.4海带提碘与海水提溴(含答案)__高一化学鲁科版(2019)必修二同步课时作业 |  | |
| 格式 | docx | ||
| 文件大小 | 817.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-18 08:47:20 | ||
图片预览



文档简介
(8)1.4海带提碘与海水提溴——高一化学鲁科版(2019)必修二同步课时作业
1.《肘后方》中记载了一种“海藻酒”治疗瘿病(甲状腺疾病)的方法,原理是海藻中富含碘,其中制作“海藻酒”的过程为“以绢袋盛海藻,用酒浸渍”,如通过实验从海藻中提取碘,未涉及的操作是( )
A.溶解 B.过滤 C.分液 D.蒸发
2.通常利用反应从海水中提取。该反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
3.从海带中提碘要经过灼烧、浸取、过滤、氧化、萃取(萃取剂为苯)、分液、蒸馏等操作。利用下列装置,不能达到相关实验目的的是( )
A.利用装置①灼烧碎海带 B.利用装置②浸取海带灰中的
C.利用装置③放出下层的水溶液 D.利用装置④分离出碘单质,回收苯
4.我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如图,已知代表阿伏加德罗常数的值,下列说法错误的是( )
A.“氧化”前对海水酸化可以抑制歧化反应
B.“吸收塔”中的反应:
C.可用乙醇萃取替代“蒸馏”,更利于分离
D.理论上,获得1mol产品时共消耗2个
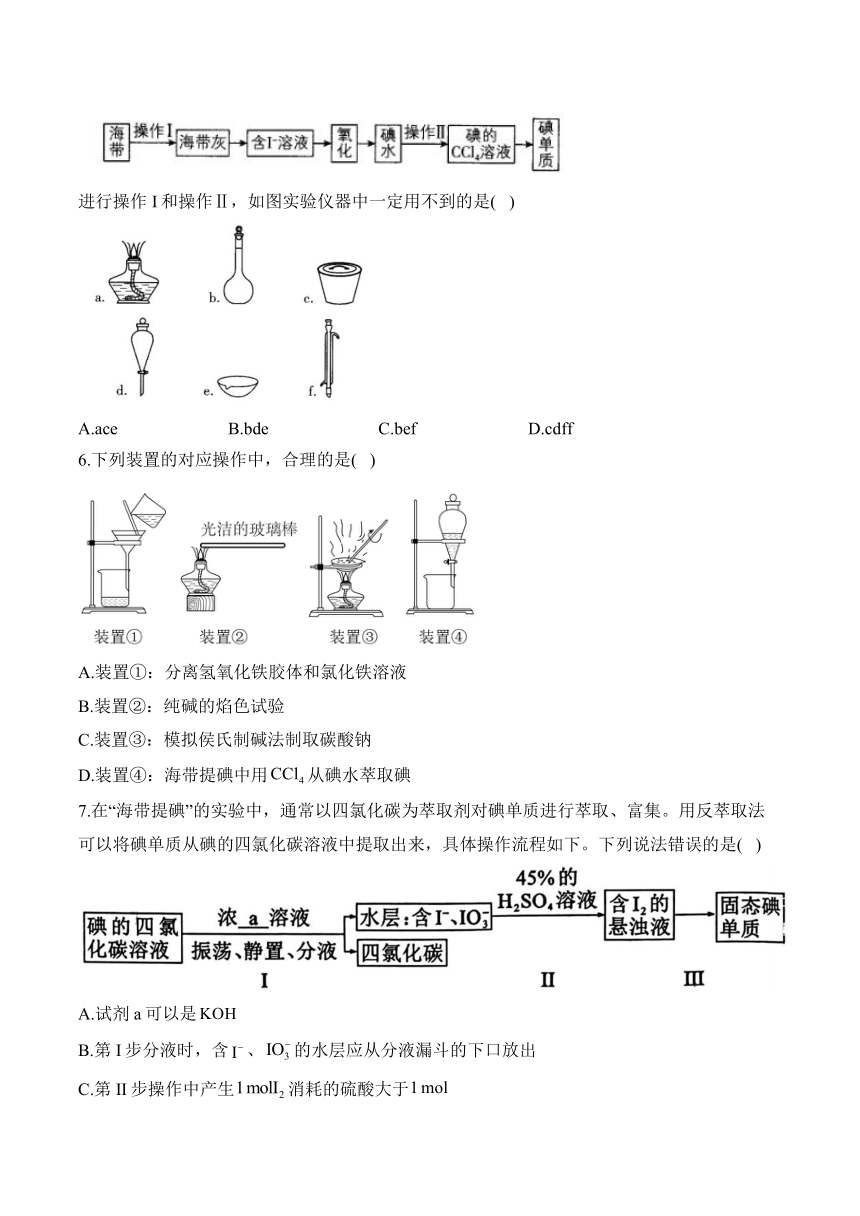
5.实验室模拟海水提碘的流程如图:
进行操作I和操作Ⅱ,如图实验仪器中一定用不到的是( )
A.ace B.bde C.bef D.cdff
6.下列装置的对应操作中,合理的是( )
A.装置①:分离氢氧化铁胶体和氯化铁溶液
B.装置②:纯碱的焰色试验
C.装置③:模拟侯氏制碱法制取碳酸钠
D.装置④:海带提碘中用从碘水萃取碘
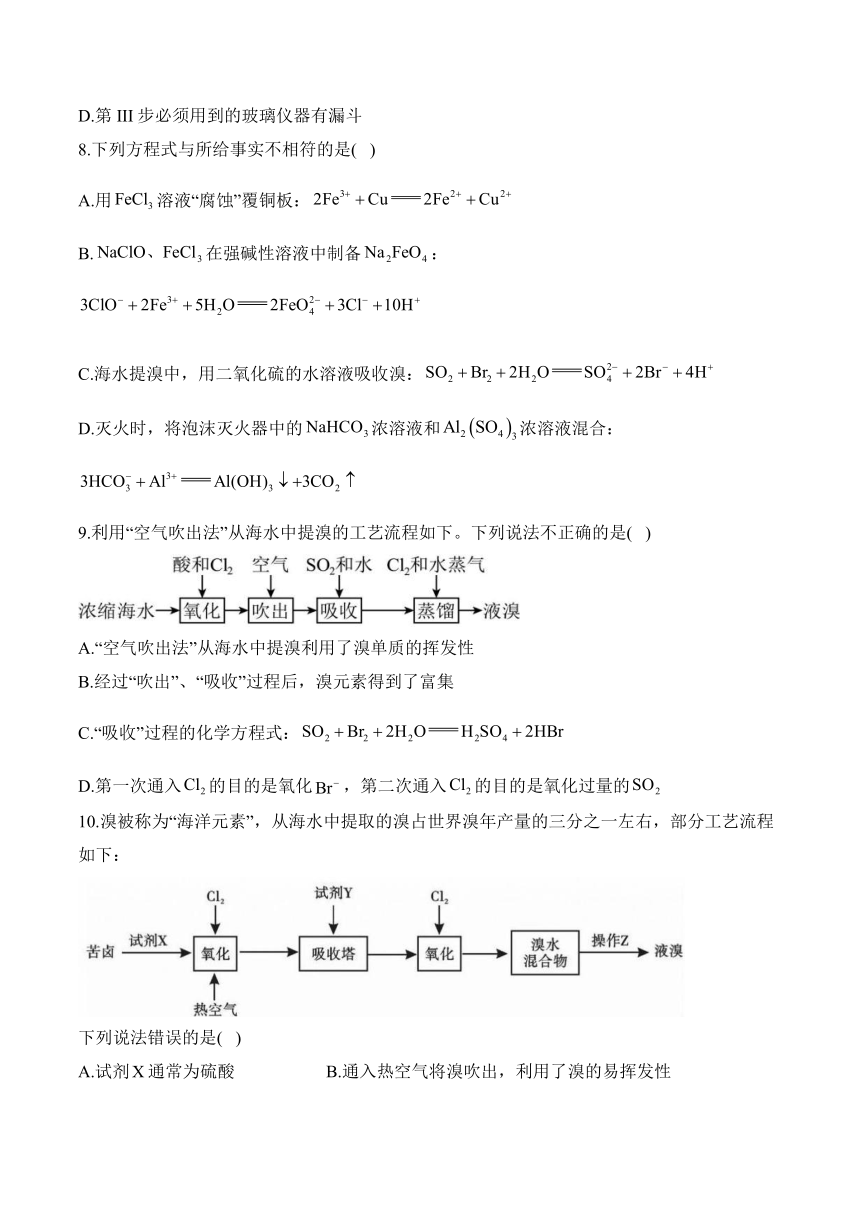
7.在“海带提碘”的实验中,通常以四氯化碳为萃取剂对碘单质进行萃取、富集。用反萃取法可以将碘单质从碘的四氯化碳溶液中提取出来,具体操作流程如下。下列说法错误的是( )
A.试剂a可以是
B.第I步分液时,含、的水层应从分液漏斗的下口放出
C.第II步操作中产生消耗的硫酸大于
D.第III步必须用到的玻璃仪器有漏斗
8.下列方程式与所给事实不相符的是( )
A.用溶液“腐蚀”覆铜板:
B.在强碱性溶液中制备:
C.海水提溴中,用二氧化硫的水溶液吸收溴:
D.灭火时,将泡沫灭火器中的浓溶液和浓溶液混合:
9.利用“空气吹出法”从海水中提溴的工艺流程如下。下列说法不正确的是( )
A.“空气吹出法”从海水中提溴利用了溴单质的挥发性
B.经过“吹出”、“吸收”过程后,溴元素得到了富集
C.“吸收”过程的化学方程式:
D.第一次通入的目的是氧化,第二次通入的目的是氧化过量的
10.溴被称为“海洋元素”,从海水中提取的溴占世界溴年产量的三分之一左右,部分工艺流程如下:
下列说法错误的是( )
A.试剂通常为硫酸 B.通入热空气将溴吹出,利用了溴的易挥发性
C.试剂可以选用 D.操作只需分液
11.下列物质的制备过程中,涉及的反应原理及部分流程较为合理的是( )
A.提纯硅:硅
B.冶炼铝:铝土矿
C.制溴:浓缩海水Br2
D.制碘:海带海带灰
12.已知海水中的溴含量约为,工业上常用的一种海水提溴技术“吹出法”,其流程如下:
下列说法正确的是( )
A.“氧化”过程中X物质可以是氯气
B.“吸收”中的离子方程式为:
C.“吹出”和“吸收”两步骤的目的是富集溴元素,利用了溴单质的挥发性和还原性
D.实验室分离溴还可以用萃取法,可选用酒精或裂化汽油作为萃取剂
13.碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)的一种制备方法如下图所示:
①加入粉进行转化反应的离子方程式为____________________________,生成的沉淀与硝酸反应,生成_______后可循环使用。
②通入的过程中,若氧化产物只有一种,反应的化学方程式为_________;若反应物用量比=1.5时,氧化产物为_______;当>1.5,单质碘的收率会降低,原因是_____________________________。
(2)以为原料制备的方法是:先向溶液中加入适量的,生成碘化物;再向混合溶液中加入溶液,反应得到,上述制备的总反应的离子方程式为__________________________________。
14.海水是人类的资源宝库。回答下列问题:
I.某同学用蒸馏法实现海水淡化的原理如图:
(1)仪器C的名称是________________。
(2)装置B中进水口应为________________ (填“a”或“b”)。
Ⅱ.空气吹出法是海水提溴的常用方法。其中一种工艺流程为
(3)在步骤③中发生反应:,反应中是________________ (填“氧化”或“还原”)剂。
(4)在步骤③中,每吸收,理论上需要通入________________ (标准状况下)。
(5)步骤④发生的反应类型是________________ (填“置换”或“复分解”)反应。
15.海洋中蕴含着丰富的化学元素,是人类资源的宝库。
I.某学校兴趣小组在实验室按如下实验流程提取海带中的碘。
(1)海带灼烧的目的是___________。海带灰中含有的其他可溶性无机盐,是在___________(从以上流程中选填实验操作名称)中实现与碘分离。上述实验流程中不需要用到的仪器是___________(从下列图中选择,写出名称)。
(2)“氧化”时加入和3%溶液,发生反应的离子方程式为___________。
(3)加碘食盐中的碘以形式存在,证明食盐中存在,必须使用的物质是___________(填序号)。
①pH试纸;②蓝色石蕊试纸;③碘化钾淀粉试纸;④蒸馏水;⑤食醋;⑥醇;
Ⅱ.某学校兴趣小组从海水晒盐后的盐卤(含等)中模拟工业生产来提取镁,主要过程如图甲:
(4)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是___________。步骤③的具体操作为___________。
(5)写出步骤④制备金属镁的化学方程式:___________。该过程得到的镁蒸气需要在特定的循环中冷却,可选用___________(填字母)作冷却剂。
A.Ar B. C.空气
D. E.水蒸气
答案以及解析
1.答案:D
解析:海藻提碘的实验流程为灼烧→浸泡溶解→过滤-→氧化→萃取→分液→升华,不涉及蒸发操作,故选D。
2.答案:C
解析:该反应是一种单质和一种化合物,反应生成另一种单质和另一种化合物,这样的反应为置换反应;答案选C。
3.答案:A
解析:灼烧碎海带应使用坩埚,装置①中的蒸发皿不能用于灼烧碎海带,故A项符合题意;海带灰中的碘化物易溶于热水,故B项不符合题意;萃取使用的萃取剂是苯,碘在苯中的溶解度大于在水中的溶解度,且苯的密度比水的小,有机层在上层,水溶液在下层,故C项不符合题意;碘和苯的沸点相差较大,可以用蒸馏法分离二者,冷凝水应从冷凝管的下口进、上口出,温度计的玻璃泡在蒸馏烧瓶的支管口处,故D项不符合题意。
4.答案:C
解析:A.氯气与水反应生成盐酸和次氯酸,将海水酸化可以抑制发生歧化反应,故A正确;
B.吸收塔中有,与、反应生成氢溴酸和硫酸,其反应的离子方程式为,故B正确;
C.乙醇与水互溶,不能用来萃取剂,故C错误;
D.,在氧化和蒸馏时都需要用到,都发生此反应,因此1mol会消耗2NA个,故D正确。
综上所述,答案为C。
5.答案:C
解析:操作I为灼烧,需要用到酒精灯、坩埚和泥三角等,操作Ⅱ为萃取,需要用到分液漏斗等,因此一定用不到的仪器有容量瓶、蒸发皿和冷凝管,即bef,故答案选C。
6.答案:D
解析:A.氢氧化铁胶体中的胶粒及氯化铁溶液中的溶质离子都可以通过滤纸,一层不能用过滤的方法分离氢氧化铁胶体和氯化铁溶液,应该用渗析的方法分离提纯,A错误;
B.玻璃棒中含有,焰色试验显黄色,会干扰待测溶液中金属阳离子的检验,应该用融嵌的铂丝的玻璃棒或光洁无锈的铁丝进行焰色试验,B错误;
C.在模拟侯氏制碱法制取碳酸钠时,应该在坩埚中灼烧固体,使其发生分解反应产生纯碱碳酸钠,C错误;
D.I2单质是由非极性分子构成的物质,在由非极性分子构成的中易溶,且与也不能发生反应,而在由极性分子构成的中溶解度不大,水与四氯化碳又互不相溶,因此可以用从碘水萃取碘,D正确;故合理选项是D。
7.答案:B
解析:
A项,碘单质在碱性条件下发生歧化反应生成和,因此试剂a可以是.A项正确;
B项,四氧化碳的密度大于水,含和的水溶液在上层,分液时应从分液漏斗的上口倒出。B项错误;
C项,第II步生成的离子方程式为:,可以看出生成需要,即硫酸;但由于水层溶液中存在的也会消耗硫酸,因此消耗硫酸的量大于。C项正确;
D项,第III步操作是过滤,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒。D项正确。
综上所述,本题正确答案为B.
8.答案:B
解析:A.用溶液“腐蚀”覆铜板的过程中,和Cu反应生成和,反应的离子方程式为:,A正确;
B.反应中Fe元素的化合价由+3价升高到+6价,Cl的化合价由+1价降低到-1价,在碱性环境中反应,根据得失电子守恒、电荷守恒和原子守恒配平得到反应的离子方程式为:,B错误;
C.用二氧化硫的水溶液吸收溴时,二者发生氧化还原反应生成两种强酸(、HBr),反应的离子方程式为:,C正确;
D.泡沫灭火器中铝离子与碳酸氢根发生双水解生成二氧化碳和氢氧化铝,反应的离子方程式为:,D正确;故选B。
9.答案:D
解析:A.溴单质沸点低,易挥发,“空气吹出法”从海水中提溴利用了溴单质的挥发性,故A正确;B.经过“吹出”、“吸收”过程后,溴元素得到了富集,故B正确;C.“吸收”过程的化学方程式,故C正确;D.第一次通入的目的是氧化,第二次通入的目的是氧化过量的,故D错误;故选D。
10.答案:D
解析:A.酸性条件下有利于氯气将海水中的溴离子氧化为单质溴,提高氯气的利用率,A正确;
B.溴易挥发,通入热空气将溴吹出,B正确;
C.二氧化硫有还原性,可以和氯气,水反应,从而达到富集溴的目的,C正确;
D.操作Z是分液和蒸馏的结合,D错误;
故选D。
11.答案:C
解析:C项,海水浓缩后加入氧化剂氧化为单质,被吸收后富集,再通入氧化HBr得到单质,步骤和实验过程正确,故C项正确。
12.答案:A
解析:A.由分析可知,“氧化”过程中X物质可以是氯气,A正确;
B.二氧化硫具有还原性、溴具有氧化性,“吸收”过程所发生的反应为二氧化硫和溴单质发生氧化还原反应生成硫酸和HBr,其离子方程式为,,B错误;
C.“吸收”过程利用了溴单质的氧化性,C错误;
D.酒精和水互溶,裂化汽油含碳碳不饱和键会和溴单质反应,故均不能作为萃取剂,D错误;
故选A。
13.答案:(1)①;;②;、;被过量的进一步氧化
(2)
解析:(1)①由流程图可知悬浊液中含AgI ,AgI可与Fe反应生成和Ag,易溶于水,在离子方程式中能拆,加入粉进行转化反应的离子方程式为:。
②通入的过程中,因还原性强于,先氧化还原性强的,若氧化产物只有一种,则该氧化产物只能是,故反应的化学方程式为:;若反应物用量比时即过量,先氧化完全部再氧化,恰好将全部和氧化,则氧化产物为;当即过量特别多,多余的氯气会与生成的单质碘以及水继续发生氧化还原反应,单质碘的收率会降低。
(2)先向溶液中加入计量的,生成碘化物即含的物质;再向混合溶液中加入溶液,反应得到,上述制备的两个反应中为中间产物,总反应为与发生氧化还原反应,生成和,根据得失电子守恒、电荷守恒及元素守恒配平离子方程式即可得:,
14.答案: (1)锥形瓶
(2)a
(3)氧化剂
(4)22.4L
(5)置换反应
解析:(1)由图知,仪器C的名称为锥形瓶;
(2)冷水下进上出可充满冷凝管,达到较好的冷凝效果,因此冷却水的进水口是a;
(3)在反应中,Br的化合价由0价降低为-1价,故反应中是氧化剂;
(4)由知,,为1mol,故理论上需要通入的二氧化硫为1mol,1mol二氧化硫的体积为22.4L;
(5)由分析知,步骤④发生的化学方程式为,反应类型为置换反应。
15.答案:(1)①.除去杂质有机物等获得碘离子(或将有机碘转化为碘离子);②.萃取、分液;③.蒸发皿、酸式滴定管;
(2);
(3)③④⑤
(4)①.;②.在HCl气氛中加热蒸干
(5)①.(熔融);②.A;
解析:(1)海带灼烧目的是将海带中的有机碘化合物转化为碘离子。利用碘在四氯化碳中的溶解度大于在水中的溶解度,通过萃取、分液的方式除去海带灰中的其他可溶性无机盐。海带灼烧需要坩埚,萃取、分液需要分液漏斗,过滤需要漏斗,不需要蒸发皿、酸式滴定管。
(2)氧化时,碘离子与H2O2在酸性条件下反应生成碘和水,离子方程式为
(3)要证明碘酸根离子的存在,需要将碘酸根转化为碘单质,再检验碘单质的存在,碘酸钾与KI在酸性条件下可反应生成,故需要的物质为③④⑤。
(4)盐卤加热到以上,硫酸镁的溶解度随温度升高而下降且溶解度最小,此时首先从盐卤中分离出来的晶体为。步骤③目的是将氯化镁晶体转化为氯化镁,加热能促进镁离子水解,为了防止镁离子水解,需要在HCl气氛中加热蒸干氯化镁晶体。
(5)步骤④电解熔融的氯化镁生成镁单质,化学方程式为(熔融)。高温条件下,镁能与、空气中的氧气、、水蒸气反应,因此冷却镁蒸气需要使用Ar作为冷却剂,答案选A。
1.《肘后方》中记载了一种“海藻酒”治疗瘿病(甲状腺疾病)的方法,原理是海藻中富含碘,其中制作“海藻酒”的过程为“以绢袋盛海藻,用酒浸渍”,如通过实验从海藻中提取碘,未涉及的操作是( )
A.溶解 B.过滤 C.分液 D.蒸发
2.通常利用反应从海水中提取。该反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
3.从海带中提碘要经过灼烧、浸取、过滤、氧化、萃取(萃取剂为苯)、分液、蒸馏等操作。利用下列装置,不能达到相关实验目的的是( )
A.利用装置①灼烧碎海带 B.利用装置②浸取海带灰中的
C.利用装置③放出下层的水溶液 D.利用装置④分离出碘单质,回收苯
4.我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如图,已知代表阿伏加德罗常数的值,下列说法错误的是( )
A.“氧化”前对海水酸化可以抑制歧化反应
B.“吸收塔”中的反应:
C.可用乙醇萃取替代“蒸馏”,更利于分离
D.理论上,获得1mol产品时共消耗2个
5.实验室模拟海水提碘的流程如图:
进行操作I和操作Ⅱ,如图实验仪器中一定用不到的是( )
A.ace B.bde C.bef D.cdff
6.下列装置的对应操作中,合理的是( )
A.装置①:分离氢氧化铁胶体和氯化铁溶液
B.装置②:纯碱的焰色试验
C.装置③:模拟侯氏制碱法制取碳酸钠
D.装置④:海带提碘中用从碘水萃取碘
7.在“海带提碘”的实验中,通常以四氯化碳为萃取剂对碘单质进行萃取、富集。用反萃取法可以将碘单质从碘的四氯化碳溶液中提取出来,具体操作流程如下。下列说法错误的是( )
A.试剂a可以是
B.第I步分液时,含、的水层应从分液漏斗的下口放出
C.第II步操作中产生消耗的硫酸大于
D.第III步必须用到的玻璃仪器有漏斗
8.下列方程式与所给事实不相符的是( )
A.用溶液“腐蚀”覆铜板:
B.在强碱性溶液中制备:
C.海水提溴中,用二氧化硫的水溶液吸收溴:
D.灭火时,将泡沫灭火器中的浓溶液和浓溶液混合:
9.利用“空气吹出法”从海水中提溴的工艺流程如下。下列说法不正确的是( )
A.“空气吹出法”从海水中提溴利用了溴单质的挥发性
B.经过“吹出”、“吸收”过程后,溴元素得到了富集
C.“吸收”过程的化学方程式:
D.第一次通入的目的是氧化,第二次通入的目的是氧化过量的
10.溴被称为“海洋元素”,从海水中提取的溴占世界溴年产量的三分之一左右,部分工艺流程如下:
下列说法错误的是( )
A.试剂通常为硫酸 B.通入热空气将溴吹出,利用了溴的易挥发性
C.试剂可以选用 D.操作只需分液
11.下列物质的制备过程中,涉及的反应原理及部分流程较为合理的是( )
A.提纯硅:硅
B.冶炼铝:铝土矿
C.制溴:浓缩海水Br2
D.制碘:海带海带灰
12.已知海水中的溴含量约为,工业上常用的一种海水提溴技术“吹出法”,其流程如下:
下列说法正确的是( )
A.“氧化”过程中X物质可以是氯气
B.“吸收”中的离子方程式为:
C.“吹出”和“吸收”两步骤的目的是富集溴元素,利用了溴单质的挥发性和还原性
D.实验室分离溴还可以用萃取法,可选用酒精或裂化汽油作为萃取剂
13.碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)的一种制备方法如下图所示:
①加入粉进行转化反应的离子方程式为____________________________,生成的沉淀与硝酸反应,生成_______后可循环使用。
②通入的过程中,若氧化产物只有一种,反应的化学方程式为_________;若反应物用量比=1.5时,氧化产物为_______;当>1.5,单质碘的收率会降低,原因是_____________________________。
(2)以为原料制备的方法是:先向溶液中加入适量的,生成碘化物;再向混合溶液中加入溶液,反应得到,上述制备的总反应的离子方程式为__________________________________。
14.海水是人类的资源宝库。回答下列问题:
I.某同学用蒸馏法实现海水淡化的原理如图:
(1)仪器C的名称是________________。
(2)装置B中进水口应为________________ (填“a”或“b”)。
Ⅱ.空气吹出法是海水提溴的常用方法。其中一种工艺流程为
(3)在步骤③中发生反应:,反应中是________________ (填“氧化”或“还原”)剂。
(4)在步骤③中,每吸收,理论上需要通入________________ (标准状况下)。
(5)步骤④发生的反应类型是________________ (填“置换”或“复分解”)反应。
15.海洋中蕴含着丰富的化学元素,是人类资源的宝库。
I.某学校兴趣小组在实验室按如下实验流程提取海带中的碘。
(1)海带灼烧的目的是___________。海带灰中含有的其他可溶性无机盐,是在___________(从以上流程中选填实验操作名称)中实现与碘分离。上述实验流程中不需要用到的仪器是___________(从下列图中选择,写出名称)。
(2)“氧化”时加入和3%溶液,发生反应的离子方程式为___________。
(3)加碘食盐中的碘以形式存在,证明食盐中存在,必须使用的物质是___________(填序号)。
①pH试纸;②蓝色石蕊试纸;③碘化钾淀粉试纸;④蒸馏水;⑤食醋;⑥醇;
Ⅱ.某学校兴趣小组从海水晒盐后的盐卤(含等)中模拟工业生产来提取镁,主要过程如图甲:
(4)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是___________。步骤③的具体操作为___________。
(5)写出步骤④制备金属镁的化学方程式:___________。该过程得到的镁蒸气需要在特定的循环中冷却,可选用___________(填字母)作冷却剂。
A.Ar B. C.空气
D. E.水蒸气
答案以及解析
1.答案:D
解析:海藻提碘的实验流程为灼烧→浸泡溶解→过滤-→氧化→萃取→分液→升华,不涉及蒸发操作,故选D。
2.答案:C
解析:该反应是一种单质和一种化合物,反应生成另一种单质和另一种化合物,这样的反应为置换反应;答案选C。
3.答案:A
解析:灼烧碎海带应使用坩埚,装置①中的蒸发皿不能用于灼烧碎海带,故A项符合题意;海带灰中的碘化物易溶于热水,故B项不符合题意;萃取使用的萃取剂是苯,碘在苯中的溶解度大于在水中的溶解度,且苯的密度比水的小,有机层在上层,水溶液在下层,故C项不符合题意;碘和苯的沸点相差较大,可以用蒸馏法分离二者,冷凝水应从冷凝管的下口进、上口出,温度计的玻璃泡在蒸馏烧瓶的支管口处,故D项不符合题意。
4.答案:C
解析:A.氯气与水反应生成盐酸和次氯酸,将海水酸化可以抑制发生歧化反应,故A正确;
B.吸收塔中有,与、反应生成氢溴酸和硫酸,其反应的离子方程式为,故B正确;
C.乙醇与水互溶,不能用来萃取剂,故C错误;
D.,在氧化和蒸馏时都需要用到,都发生此反应,因此1mol会消耗2NA个,故D正确。
综上所述,答案为C。
5.答案:C
解析:操作I为灼烧,需要用到酒精灯、坩埚和泥三角等,操作Ⅱ为萃取,需要用到分液漏斗等,因此一定用不到的仪器有容量瓶、蒸发皿和冷凝管,即bef,故答案选C。
6.答案:D
解析:A.氢氧化铁胶体中的胶粒及氯化铁溶液中的溶质离子都可以通过滤纸,一层不能用过滤的方法分离氢氧化铁胶体和氯化铁溶液,应该用渗析的方法分离提纯,A错误;
B.玻璃棒中含有,焰色试验显黄色,会干扰待测溶液中金属阳离子的检验,应该用融嵌的铂丝的玻璃棒或光洁无锈的铁丝进行焰色试验,B错误;
C.在模拟侯氏制碱法制取碳酸钠时,应该在坩埚中灼烧固体,使其发生分解反应产生纯碱碳酸钠,C错误;
D.I2单质是由非极性分子构成的物质,在由非极性分子构成的中易溶,且与也不能发生反应,而在由极性分子构成的中溶解度不大,水与四氯化碳又互不相溶,因此可以用从碘水萃取碘,D正确;故合理选项是D。
7.答案:B
解析:
A项,碘单质在碱性条件下发生歧化反应生成和,因此试剂a可以是.A项正确;
B项,四氧化碳的密度大于水,含和的水溶液在上层,分液时应从分液漏斗的上口倒出。B项错误;
C项,第II步生成的离子方程式为:,可以看出生成需要,即硫酸;但由于水层溶液中存在的也会消耗硫酸,因此消耗硫酸的量大于。C项正确;
D项,第III步操作是过滤,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒。D项正确。
综上所述,本题正确答案为B.
8.答案:B
解析:A.用溶液“腐蚀”覆铜板的过程中,和Cu反应生成和,反应的离子方程式为:,A正确;
B.反应中Fe元素的化合价由+3价升高到+6价,Cl的化合价由+1价降低到-1价,在碱性环境中反应,根据得失电子守恒、电荷守恒和原子守恒配平得到反应的离子方程式为:,B错误;
C.用二氧化硫的水溶液吸收溴时,二者发生氧化还原反应生成两种强酸(、HBr),反应的离子方程式为:,C正确;
D.泡沫灭火器中铝离子与碳酸氢根发生双水解生成二氧化碳和氢氧化铝,反应的离子方程式为:,D正确;故选B。
9.答案:D
解析:A.溴单质沸点低,易挥发,“空气吹出法”从海水中提溴利用了溴单质的挥发性,故A正确;B.经过“吹出”、“吸收”过程后,溴元素得到了富集,故B正确;C.“吸收”过程的化学方程式,故C正确;D.第一次通入的目的是氧化,第二次通入的目的是氧化过量的,故D错误;故选D。
10.答案:D
解析:A.酸性条件下有利于氯气将海水中的溴离子氧化为单质溴,提高氯气的利用率,A正确;
B.溴易挥发,通入热空气将溴吹出,B正确;
C.二氧化硫有还原性,可以和氯气,水反应,从而达到富集溴的目的,C正确;
D.操作Z是分液和蒸馏的结合,D错误;
故选D。
11.答案:C
解析:C项,海水浓缩后加入氧化剂氧化为单质,被吸收后富集,再通入氧化HBr得到单质,步骤和实验过程正确,故C项正确。
12.答案:A
解析:A.由分析可知,“氧化”过程中X物质可以是氯气,A正确;
B.二氧化硫具有还原性、溴具有氧化性,“吸收”过程所发生的反应为二氧化硫和溴单质发生氧化还原反应生成硫酸和HBr,其离子方程式为,,B错误;
C.“吸收”过程利用了溴单质的氧化性,C错误;
D.酒精和水互溶,裂化汽油含碳碳不饱和键会和溴单质反应,故均不能作为萃取剂,D错误;
故选A。
13.答案:(1)①;;②;、;被过量的进一步氧化
(2)
解析:(1)①由流程图可知悬浊液中含AgI ,AgI可与Fe反应生成和Ag,易溶于水,在离子方程式中能拆,加入粉进行转化反应的离子方程式为:。
②通入的过程中,因还原性强于,先氧化还原性强的,若氧化产物只有一种,则该氧化产物只能是,故反应的化学方程式为:;若反应物用量比时即过量,先氧化完全部再氧化,恰好将全部和氧化,则氧化产物为;当即过量特别多,多余的氯气会与生成的单质碘以及水继续发生氧化还原反应,单质碘的收率会降低。
(2)先向溶液中加入计量的,生成碘化物即含的物质;再向混合溶液中加入溶液,反应得到,上述制备的两个反应中为中间产物,总反应为与发生氧化还原反应,生成和,根据得失电子守恒、电荷守恒及元素守恒配平离子方程式即可得:,
14.答案: (1)锥形瓶
(2)a
(3)氧化剂
(4)22.4L
(5)置换反应
解析:(1)由图知,仪器C的名称为锥形瓶;
(2)冷水下进上出可充满冷凝管,达到较好的冷凝效果,因此冷却水的进水口是a;
(3)在反应中,Br的化合价由0价降低为-1价,故反应中是氧化剂;
(4)由知,,为1mol,故理论上需要通入的二氧化硫为1mol,1mol二氧化硫的体积为22.4L;
(5)由分析知,步骤④发生的化学方程式为,反应类型为置换反应。
15.答案:(1)①.除去杂质有机物等获得碘离子(或将有机碘转化为碘离子);②.萃取、分液;③.蒸发皿、酸式滴定管;
(2);
(3)③④⑤
(4)①.;②.在HCl气氛中加热蒸干
(5)①.(熔融);②.A;
解析:(1)海带灼烧目的是将海带中的有机碘化合物转化为碘离子。利用碘在四氯化碳中的溶解度大于在水中的溶解度,通过萃取、分液的方式除去海带灰中的其他可溶性无机盐。海带灼烧需要坩埚,萃取、分液需要分液漏斗,过滤需要漏斗,不需要蒸发皿、酸式滴定管。
(2)氧化时,碘离子与H2O2在酸性条件下反应生成碘和水,离子方程式为
(3)要证明碘酸根离子的存在,需要将碘酸根转化为碘单质,再检验碘单质的存在,碘酸钾与KI在酸性条件下可反应生成,故需要的物质为③④⑤。
(4)盐卤加热到以上,硫酸镁的溶解度随温度升高而下降且溶解度最小,此时首先从盐卤中分离出来的晶体为。步骤③目的是将氯化镁晶体转化为氯化镁,加热能促进镁离子水解,为了防止镁离子水解,需要在HCl气氛中加热蒸干氯化镁晶体。
(5)步骤④电解熔融的氯化镁生成镁单质,化学方程式为(熔融)。高温条件下,镁能与、空气中的氧气、、水蒸气反应,因此冷却镁蒸气需要使用Ar作为冷却剂,答案选A。
