(12)2.2.2化学反应与能量转化(含解析)高一化学鲁科版(2019)必修二同步课时作业
文档属性
| 名称 | (12)2.2.2化学反应与能量转化(含解析)高一化学鲁科版(2019)必修二同步课时作业 |  | |
| 格式 | docx | ||
| 文件大小 | 996.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-18 17:05:02 | ||
图片预览

文档简介
(12)2.2.2化学反应与能量转化——高一化学鲁科版(2019)必修二同步课时作业
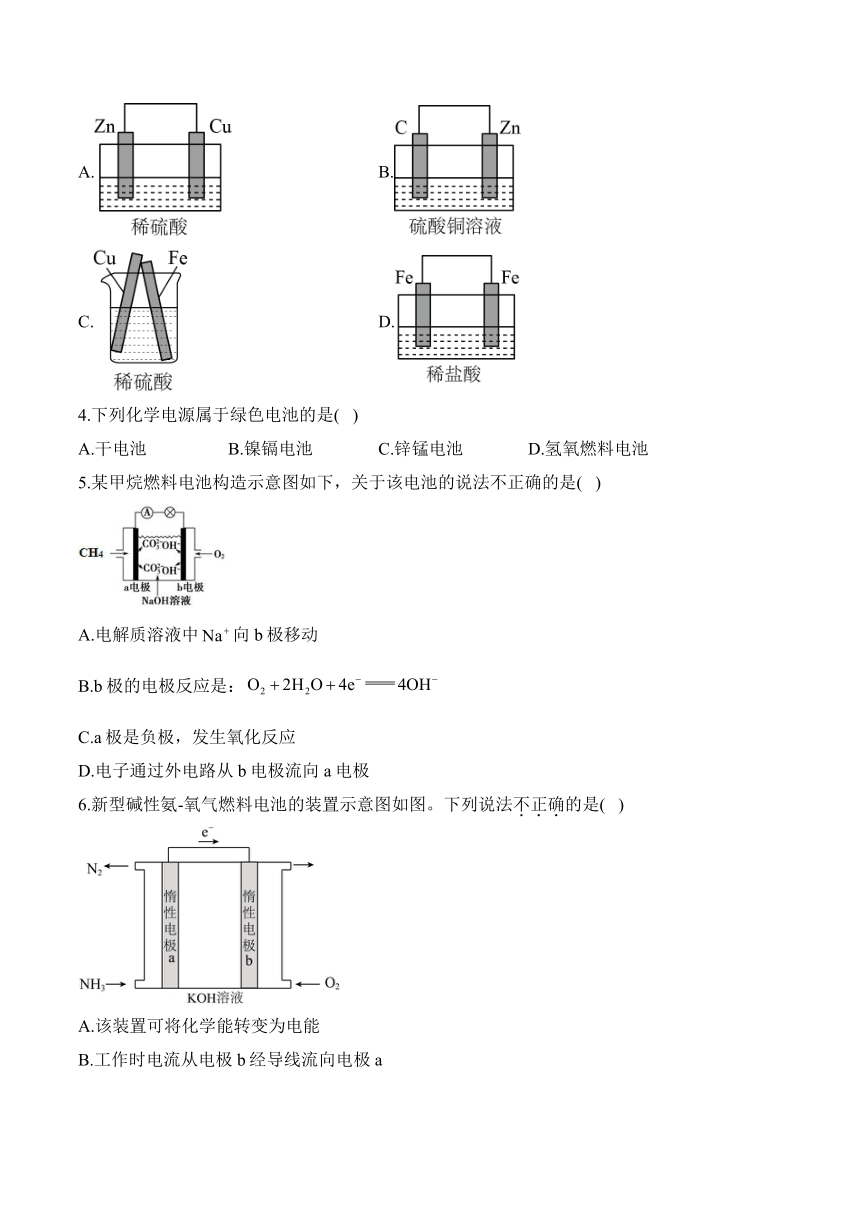
1.理论上,下列反应不能设计成原电池的是( )
A.
B.
C.
D.
2.下列装置能实现化学能直接转化为电能的是( )
A电解冶炼金属钠 B铜锌原电池
C火力发电 D太阳能电池
A.A B.B C.C D.D
3.下列图示的装置不能形成原电池的是( )
A. B.
C. D.
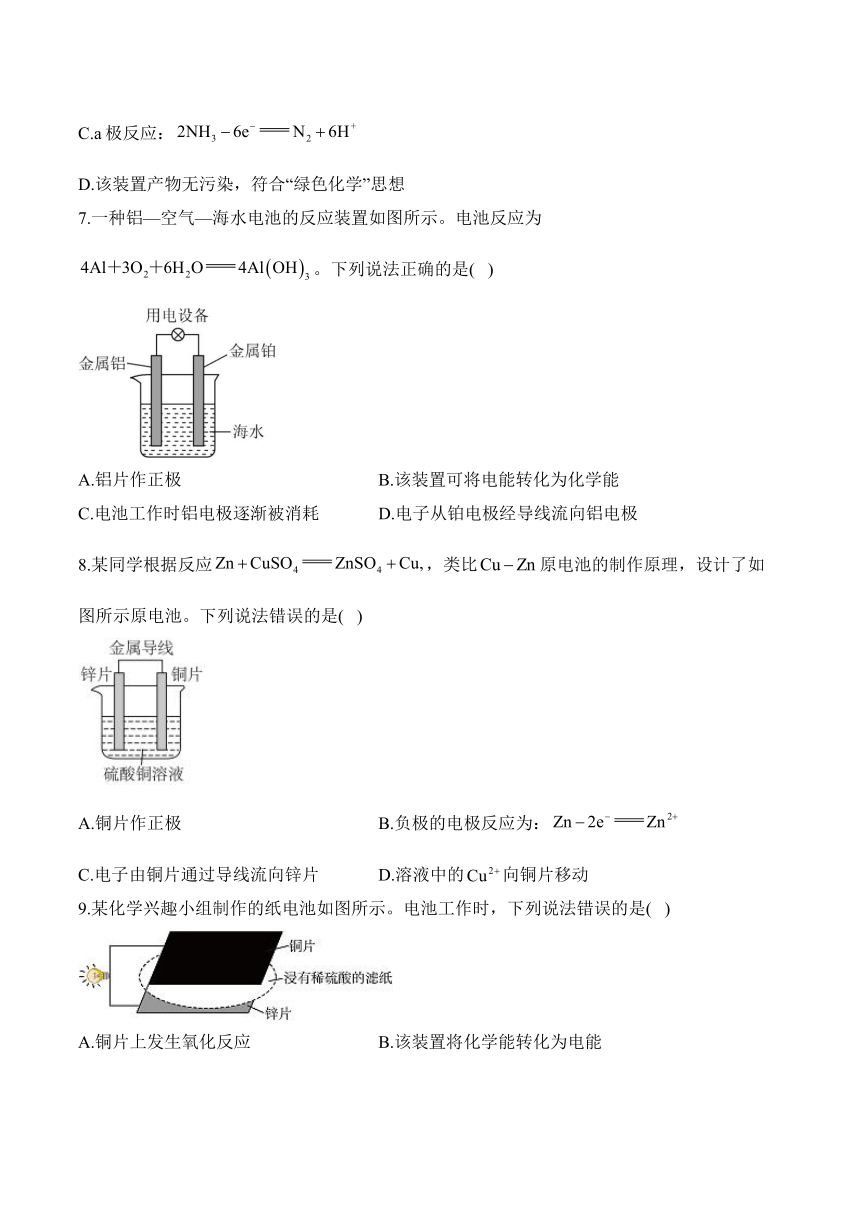
4.下列化学电源属于绿色电池的是( )
A.干电池 B.镍镉电池 C.锌锰电池 D.氢氧燃料电池
5.某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是( )
A.电解质溶液中向b极移动
B.b极的电极反应是:
C.a极是负极,发生氧化反应
D.电子通过外电路从b电极流向a电极
6.新型碱性氨-氧气燃料电池的装置示意图如图。下列说法不正确的是( )
A.该装置可将化学能转变为电能
B.工作时电流从电极b经导线流向电极a
C.a极反应:
D.该装置产物无污染,符合“绿色化学”思想
7.一种铝—空气—海水电池的反应装置如图所示。电池反应为。下列说法正确的是( )
A.铝片作正极 B.该装置可将电能转化为化学能
C.电池工作时铝电极逐渐被消耗 D.电子从铂电极经导线流向铝电极
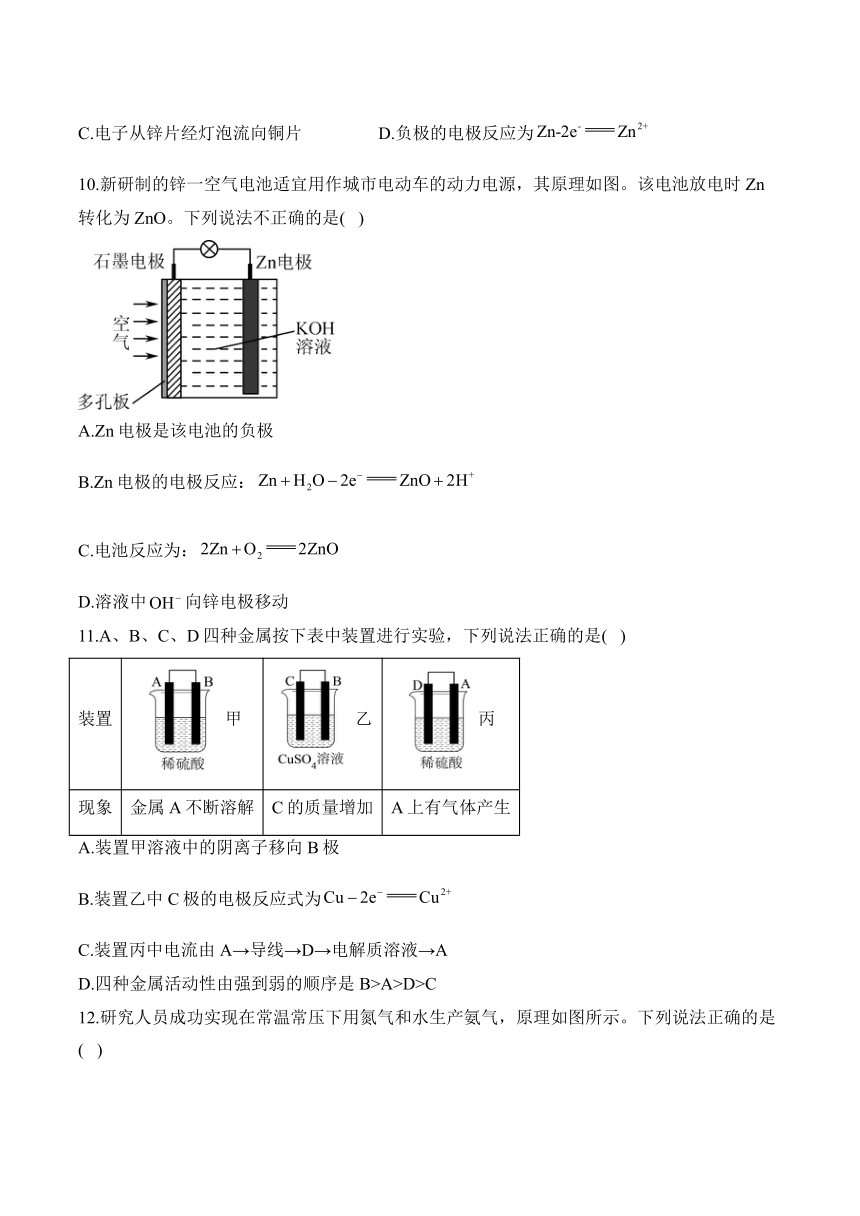
8.某同学根据反应,类比原电池的制作原理,设计了如图所示原电池。下列说法错误的是( )
A.铜片作正极 B.负极的电极反应为:
C.电子由铜片通过导线流向锌片 D.溶液中的向铜片移动
9.某化学兴趣小组制作的纸电池如图所示。电池工作时,下列说法错误的是( )
A.铜片上发生氧化反应 B.该装置将化学能转化为电能
C.电子从锌片经灯泡流向铜片 D.负极的电极反应为
10.新研制的锌一空气电池适宜用作城市电动车的动力电源,其原理如图。该电池放电时Zn转化为ZnO。下列说法不正确的是( )
A.Zn电极是该电池的负极
B.Zn电极的电极反应:
C.电池反应为:
D.溶液中向锌电极移动
11.A、B、C、D四种金属按下表中装置进行实验,下列说法正确的是( )
装置 甲 乙 丙
现象 金属A不断溶解 C的质量增加 A上有气体产生
A.装置甲溶液中的阴离子移向B极
B.装置乙中C极的电极反应式为
C.装置丙中电流由A→导线→D→电解质溶液→A
D.四种金属活动性由强到弱的顺序是B>A>D>C
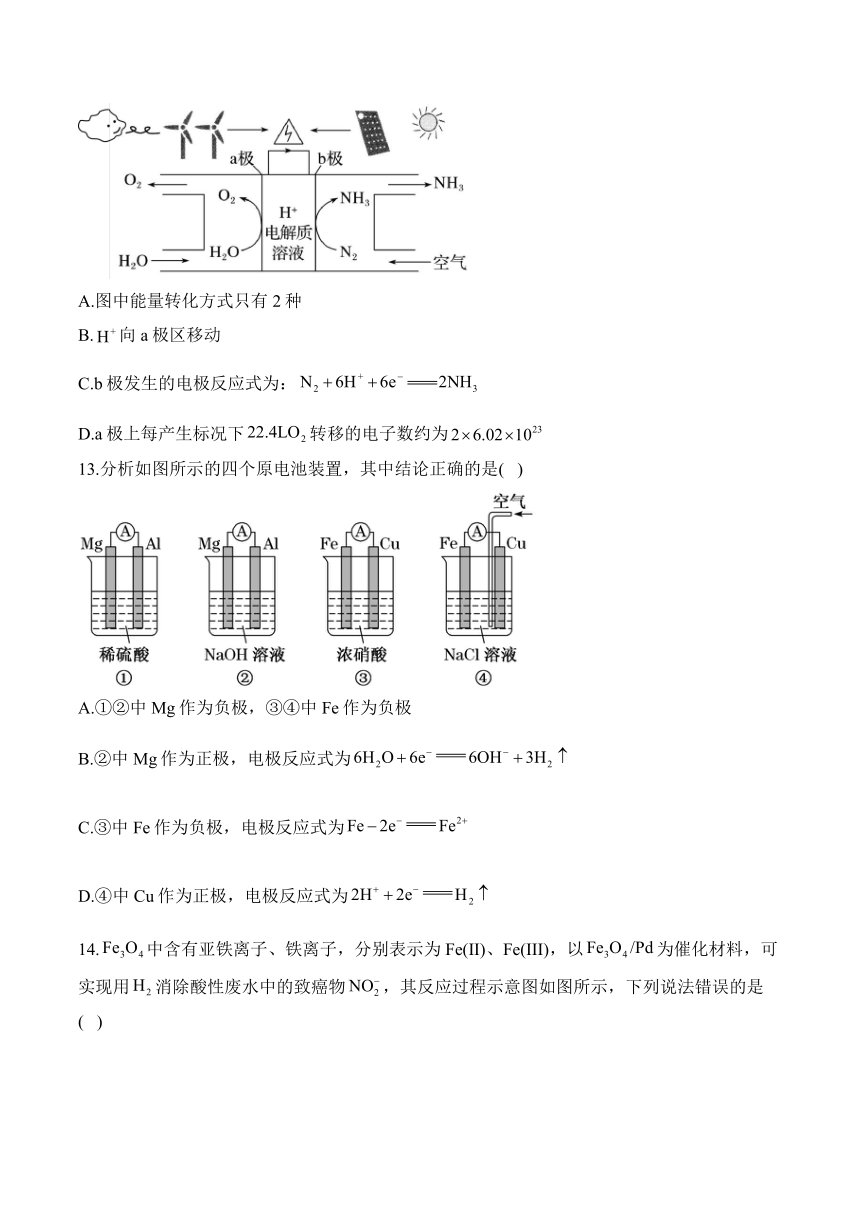
12.研究人员成功实现在常温常压下用氮气和水生产氨气,原理如图所示。下列说法正确的是( )
A.图中能量转化方式只有2种
B.向a极区移动
C.b极发生的电极反应式为:
D.a极上每产生标况下转移的电子数约为
13.分析如图所示的四个原电池装置,其中结论正确的是( )
A.①②中Mg作为负极,③④中Fe作为负极
B.②中Mg作为正极,电极反应式为
C.③中Fe作为负极,电极反应式为
D.④中Cu作为正极,电极反应式为
14.中含有亚铁离子、铁离子,分别表示为Fe(II)、Fe(III),以为催化材料,可实现用消除酸性废水中的致癌物,其反应过程示意图如图所示,下列说法错误的是( )
A.用该法处理后水体的pH降低。
B.反应过程中被Fe(II)还原为
C.Pd上发生的电极反应为
D.Fe(II)与Fe(III)的相互转化起到了传递电子的作用
15.如图所示装置是二甲醚()燃料电池,已知该装置工作时电子从b极流出,a极流入。
(1)A池中b电极是_______极(填“正”或“负”)。
(2)A池中a电极反应式为_______。
(3)A池中b电极反应式为_______。
(4)当装置A中消耗0.25mol二甲醚时,此时转移的电子的物质的量为_______;
(5)装置A中溶液的pH会_______(填写“增大”“减小”或“不变”)。
答案以及解析
1.答案:C
解析:原电池的构成条件为:1、活泼性不同的两个电极;2、电解质溶液;3、形成闭合回路;4、能自发进行氧化还原反应;
A、B、D反应方程式中都有化合价的变化,所以都是氧化还原反应;C的反应中没有化合价的变化,所以不是氧化还原反应,不能设计成原电池;
故选C。
2.答案:B
解析:A.电解冶炼金属钠,属于电解池,是将电能转化为化学能,A不符合题意;
B.铜锌原电池是将化学能直接转化为电能,B符合题意;
C.火力发电的能量转化形式为:燃料的化学能→蒸汽的热能→机械能→电能,属于化学能间接转化为电能,C不符合题意;
D.太阳能电池是将太阳能转化为电能,D不符合题意;
故选B。
3.答案:D
解析:构成原电池一般要满足以下条件:(1)有能自发进行的氧化还原反应:(2)有两个活泼性不同的电极;(3)有电解质溶液;(4)形成闭合回路。D项两个电极材料相同,不能构成原电池。
4.答案:D
解析:A.干电池中含有重金属锰,对环境有污染,A错误;
B.镍镉电池中含有重金属镍、镉,对环境有污染,B错误;
C.锌锰电池中含有重金属锰,对环境有污染,C错误;
D.氢氧燃料电池生成物为水,无污染,属于绿色电池,D正确;
故合理选项是D。
5.答案:D
解析:A. 原电池中,电解质溶液的阳离子向正极移动,所以钠离子向b极移动,故A正确;
B. b极为正极,电极反应式为,故B正确;
C. a极是负极,甲烷在负极失去电子,发生氧化反应,故C正确;
D. 电子通过外电路从a电极流向b电极,故D错误;
故答案选D。
6.答案:C
解析:A.该装置是原电池,该装置可将化学能转变为电能,A正确;
B.根据以上分析可知电极a是负极,电极b是正极,因此工作时电流从电极b经导线流向电极a,B正确;
C.a极是负极,溶液显碱性,电极反应式为,C错误;
D.生成物是氮气和水,该装置产物无污染,符合“绿色化学”思想,D正确;
答案选C。
7.答案:C
解析:A.由分析可知,Al发生氧化反应,为原电池的负极,A项错误;
B.该装置为原电池,原电池是将化学能转化为电能的装置,B项错误;
C.Al为负极,被氧化生成氢氧化铝,铝电极逐渐被消耗,C项正确;
D.电子从负极经导线流向正极,即从铝电极经导线流向铂电极,D项错误;
故选C。
8.答案:C
解析:锌铜原电池依据装置图分析,锌做负极失电子发生氧化反应生成锌离子,铜做正极,溶液中铜离子得到电子生成铜,发生还原反应,电子流向从负极沿导线流向正极,溶液中阳离子移向正极。
A.由分析,铜作正极,A正确;
B.锌做负极失电子发生氧化反应生成锌离子,电极反应为,B正确;
C.电子由负极移向正极,故电子由锌片通过导线流向铜,C错误;
D.溶液中阳离子移向正极,故向铜片移动,D正确;
故选C。
9.答案:A
解析:A.铜片是正极,电解液中氢离子在铜片电极上得电子生成氢气,发生还原反应,A错误;
B.该装置是原电池,在原电池中化学能主要转化为电能,B正确;
C.锌做负极,铜做正极,电子从锌片经灯泡流向铜片,C正确;
D.锌做负极,在负极上,锌失去电子生成锌离子,电极反应式为:,D正确;故选A。
10.答案:B
解析:A.由分析可知,锌电极为原电池的负极,故A正确;
B.由分析可知,锌电极为原电池的负极,碱性条件下锌失去电子发生氧化反应生成氧化锌,电极反应式为,故B错误;
C.由分析可知,电池的总反应为,故C正确;
D.电池工作时,溶液中阴离子向负极移动,由分析可知,锌电极为原电池的负极,则溶液中向锌电极移动,故D正确;
故选B。
11.答案:C
解析:A.在装置甲中金属A不断溶解,则A作原电池的负极,B作原电池的正极,在电解质溶液中,阴离子移向正电荷较多的A极,A错误;
B.在乙中C电极的质量增加,则C电极为原电池的正极,B电极为原电池的负极,C电极为正极,发生得到电子的还原反应,电极反应式为:,B错误;
C.在装置丙中,电极A上有气体产生,则A为原电池的正极,D为原电池的负极。负极失去电子发生氧化反应,正极得到电子发生还原反应,外电路中电子定向移动,在内电路中离子定向移动,电流的方向为正电荷移动方向。电流由正极经导线流向负极,因此电流方向为A→导线→D→电解质溶液→A,C正确;
D.在原电池装置中,负极金属活泼性强于正极,根据装置甲可知金属活动性:A>B;根据装置乙中现象,可知金属活动性:B>C;根据装置丙的现象可知金属活动性:D>A,故四种金属活动性由强到弱的顺序是:D>A>B>C,D错误;
故合理选项是C。
12.答案:C
解析:A.图中能量转化方式有风能转化为电能、太阳能转化为电能、化学能转化为电能等,A项错误;
B.b极氮气转化为氨气,氮元素化合价降低被还原,为阴极,故向阴极b极区移动,B项错误;
C.b极为阴极,发生的电极反应为:,C项正确;
D.a极为阳极,电极反应为,每产生标准状况下流过电极的电子数一定为,D项错误;
故答案选C。
13.答案:B
解析:②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应,失去电子,故Al作负极,③中Fe在浓硝酸中易钝化,Cu和浓硝酸反应失去电子,故Cu作负极,A、C项错误;
②中电池总反应为,负极反应式为,二者相减得到正极反应式为,B项正确;
④中Cu作正极,电极反应式为,D项错误。
14.答案:A
解析:A.总反应为,用该法处理后,由于消耗水体中的氢离子,故pH升高,A错误;
B.反应过程中被Fe(II)还原为,B正确;
C.根据分析可知,Pd上发生的电极反应为,C正确;
D.由图中信息可知,Fe(II)与Fe(III)是该反应的催化剂,其相互转化起到了传递电子的作用,D正确;
故答案选A。
15.答案:(1)负
(2)
(3)
(4)3mol
(5)减小
解析:(1)该装置工作时电子从b极流出,则b极发生氧化反应,作为负极;
(2)该装置工作时电子从a极流入,则a电极是正极,被还原为,则电极反应式为:;
(3)b电极是负极,在碱性环境下被氧化生成,则电极反应式为:;
(4)消耗1mol二甲醚转移12mol电子,则消耗0.25mol二甲醚时,转移电子数为;
(5)负极电极反应式:,正极电极反应式为:,则原电池总反应的离子方程式为:,反应过程消耗,同时生成水,则减小,pH减小。
1.理论上,下列反应不能设计成原电池的是( )
A.
B.
C.
D.
2.下列装置能实现化学能直接转化为电能的是( )
A电解冶炼金属钠 B铜锌原电池
C火力发电 D太阳能电池
A.A B.B C.C D.D
3.下列图示的装置不能形成原电池的是( )
A. B.
C. D.
4.下列化学电源属于绿色电池的是( )
A.干电池 B.镍镉电池 C.锌锰电池 D.氢氧燃料电池
5.某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是( )
A.电解质溶液中向b极移动
B.b极的电极反应是:
C.a极是负极,发生氧化反应
D.电子通过外电路从b电极流向a电极
6.新型碱性氨-氧气燃料电池的装置示意图如图。下列说法不正确的是( )
A.该装置可将化学能转变为电能
B.工作时电流从电极b经导线流向电极a
C.a极反应:
D.该装置产物无污染,符合“绿色化学”思想
7.一种铝—空气—海水电池的反应装置如图所示。电池反应为。下列说法正确的是( )
A.铝片作正极 B.该装置可将电能转化为化学能
C.电池工作时铝电极逐渐被消耗 D.电子从铂电极经导线流向铝电极
8.某同学根据反应,类比原电池的制作原理,设计了如图所示原电池。下列说法错误的是( )
A.铜片作正极 B.负极的电极反应为:
C.电子由铜片通过导线流向锌片 D.溶液中的向铜片移动
9.某化学兴趣小组制作的纸电池如图所示。电池工作时,下列说法错误的是( )
A.铜片上发生氧化反应 B.该装置将化学能转化为电能
C.电子从锌片经灯泡流向铜片 D.负极的电极反应为
10.新研制的锌一空气电池适宜用作城市电动车的动力电源,其原理如图。该电池放电时Zn转化为ZnO。下列说法不正确的是( )
A.Zn电极是该电池的负极
B.Zn电极的电极反应:
C.电池反应为:
D.溶液中向锌电极移动
11.A、B、C、D四种金属按下表中装置进行实验,下列说法正确的是( )
装置 甲 乙 丙
现象 金属A不断溶解 C的质量增加 A上有气体产生
A.装置甲溶液中的阴离子移向B极
B.装置乙中C极的电极反应式为
C.装置丙中电流由A→导线→D→电解质溶液→A
D.四种金属活动性由强到弱的顺序是B>A>D>C
12.研究人员成功实现在常温常压下用氮气和水生产氨气,原理如图所示。下列说法正确的是( )
A.图中能量转化方式只有2种
B.向a极区移动
C.b极发生的电极反应式为:
D.a极上每产生标况下转移的电子数约为
13.分析如图所示的四个原电池装置,其中结论正确的是( )
A.①②中Mg作为负极,③④中Fe作为负极
B.②中Mg作为正极,电极反应式为
C.③中Fe作为负极,电极反应式为
D.④中Cu作为正极,电极反应式为
14.中含有亚铁离子、铁离子,分别表示为Fe(II)、Fe(III),以为催化材料,可实现用消除酸性废水中的致癌物,其反应过程示意图如图所示,下列说法错误的是( )
A.用该法处理后水体的pH降低。
B.反应过程中被Fe(II)还原为
C.Pd上发生的电极反应为
D.Fe(II)与Fe(III)的相互转化起到了传递电子的作用
15.如图所示装置是二甲醚()燃料电池,已知该装置工作时电子从b极流出,a极流入。
(1)A池中b电极是_______极(填“正”或“负”)。
(2)A池中a电极反应式为_______。
(3)A池中b电极反应式为_______。
(4)当装置A中消耗0.25mol二甲醚时,此时转移的电子的物质的量为_______;
(5)装置A中溶液的pH会_______(填写“增大”“减小”或“不变”)。
答案以及解析
1.答案:C
解析:原电池的构成条件为:1、活泼性不同的两个电极;2、电解质溶液;3、形成闭合回路;4、能自发进行氧化还原反应;
A、B、D反应方程式中都有化合价的变化,所以都是氧化还原反应;C的反应中没有化合价的变化,所以不是氧化还原反应,不能设计成原电池;
故选C。
2.答案:B
解析:A.电解冶炼金属钠,属于电解池,是将电能转化为化学能,A不符合题意;
B.铜锌原电池是将化学能直接转化为电能,B符合题意;
C.火力发电的能量转化形式为:燃料的化学能→蒸汽的热能→机械能→电能,属于化学能间接转化为电能,C不符合题意;
D.太阳能电池是将太阳能转化为电能,D不符合题意;
故选B。
3.答案:D
解析:构成原电池一般要满足以下条件:(1)有能自发进行的氧化还原反应:(2)有两个活泼性不同的电极;(3)有电解质溶液;(4)形成闭合回路。D项两个电极材料相同,不能构成原电池。
4.答案:D
解析:A.干电池中含有重金属锰,对环境有污染,A错误;
B.镍镉电池中含有重金属镍、镉,对环境有污染,B错误;
C.锌锰电池中含有重金属锰,对环境有污染,C错误;
D.氢氧燃料电池生成物为水,无污染,属于绿色电池,D正确;
故合理选项是D。
5.答案:D
解析:A. 原电池中,电解质溶液的阳离子向正极移动,所以钠离子向b极移动,故A正确;
B. b极为正极,电极反应式为,故B正确;
C. a极是负极,甲烷在负极失去电子,发生氧化反应,故C正确;
D. 电子通过外电路从a电极流向b电极,故D错误;
故答案选D。
6.答案:C
解析:A.该装置是原电池,该装置可将化学能转变为电能,A正确;
B.根据以上分析可知电极a是负极,电极b是正极,因此工作时电流从电极b经导线流向电极a,B正确;
C.a极是负极,溶液显碱性,电极反应式为,C错误;
D.生成物是氮气和水,该装置产物无污染,符合“绿色化学”思想,D正确;
答案选C。
7.答案:C
解析:A.由分析可知,Al发生氧化反应,为原电池的负极,A项错误;
B.该装置为原电池,原电池是将化学能转化为电能的装置,B项错误;
C.Al为负极,被氧化生成氢氧化铝,铝电极逐渐被消耗,C项正确;
D.电子从负极经导线流向正极,即从铝电极经导线流向铂电极,D项错误;
故选C。
8.答案:C
解析:锌铜原电池依据装置图分析,锌做负极失电子发生氧化反应生成锌离子,铜做正极,溶液中铜离子得到电子生成铜,发生还原反应,电子流向从负极沿导线流向正极,溶液中阳离子移向正极。
A.由分析,铜作正极,A正确;
B.锌做负极失电子发生氧化反应生成锌离子,电极反应为,B正确;
C.电子由负极移向正极,故电子由锌片通过导线流向铜,C错误;
D.溶液中阳离子移向正极,故向铜片移动,D正确;
故选C。
9.答案:A
解析:A.铜片是正极,电解液中氢离子在铜片电极上得电子生成氢气,发生还原反应,A错误;
B.该装置是原电池,在原电池中化学能主要转化为电能,B正确;
C.锌做负极,铜做正极,电子从锌片经灯泡流向铜片,C正确;
D.锌做负极,在负极上,锌失去电子生成锌离子,电极反应式为:,D正确;故选A。
10.答案:B
解析:A.由分析可知,锌电极为原电池的负极,故A正确;
B.由分析可知,锌电极为原电池的负极,碱性条件下锌失去电子发生氧化反应生成氧化锌,电极反应式为,故B错误;
C.由分析可知,电池的总反应为,故C正确;
D.电池工作时,溶液中阴离子向负极移动,由分析可知,锌电极为原电池的负极,则溶液中向锌电极移动,故D正确;
故选B。
11.答案:C
解析:A.在装置甲中金属A不断溶解,则A作原电池的负极,B作原电池的正极,在电解质溶液中,阴离子移向正电荷较多的A极,A错误;
B.在乙中C电极的质量增加,则C电极为原电池的正极,B电极为原电池的负极,C电极为正极,发生得到电子的还原反应,电极反应式为:,B错误;
C.在装置丙中,电极A上有气体产生,则A为原电池的正极,D为原电池的负极。负极失去电子发生氧化反应,正极得到电子发生还原反应,外电路中电子定向移动,在内电路中离子定向移动,电流的方向为正电荷移动方向。电流由正极经导线流向负极,因此电流方向为A→导线→D→电解质溶液→A,C正确;
D.在原电池装置中,负极金属活泼性强于正极,根据装置甲可知金属活动性:A>B;根据装置乙中现象,可知金属活动性:B>C;根据装置丙的现象可知金属活动性:D>A,故四种金属活动性由强到弱的顺序是:D>A>B>C,D错误;
故合理选项是C。
12.答案:C
解析:A.图中能量转化方式有风能转化为电能、太阳能转化为电能、化学能转化为电能等,A项错误;
B.b极氮气转化为氨气,氮元素化合价降低被还原,为阴极,故向阴极b极区移动,B项错误;
C.b极为阴极,发生的电极反应为:,C项正确;
D.a极为阳极,电极反应为,每产生标准状况下流过电极的电子数一定为,D项错误;
故答案选C。
13.答案:B
解析:②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应,失去电子,故Al作负极,③中Fe在浓硝酸中易钝化,Cu和浓硝酸反应失去电子,故Cu作负极,A、C项错误;
②中电池总反应为,负极反应式为,二者相减得到正极反应式为,B项正确;
④中Cu作正极,电极反应式为,D项错误。
14.答案:A
解析:A.总反应为,用该法处理后,由于消耗水体中的氢离子,故pH升高,A错误;
B.反应过程中被Fe(II)还原为,B正确;
C.根据分析可知,Pd上发生的电极反应为,C正确;
D.由图中信息可知,Fe(II)与Fe(III)是该反应的催化剂,其相互转化起到了传递电子的作用,D正确;
故答案选A。
15.答案:(1)负
(2)
(3)
(4)3mol
(5)减小
解析:(1)该装置工作时电子从b极流出,则b极发生氧化反应,作为负极;
(2)该装置工作时电子从a极流入,则a电极是正极,被还原为,则电极反应式为:;
(3)b电极是负极,在碱性环境下被氧化生成,则电极反应式为:;
(4)消耗1mol二甲醚转移12mol电子,则消耗0.25mol二甲醚时,转移电子数为;
(5)负极电极反应式:,正极电极反应式为:,则原电池总反应的离子方程式为:,反应过程消耗,同时生成水,则减小,pH减小。
