6.1.1 化学反应与热能 课件(共26张PPT)
文档属性
| 名称 | 6.1.1 化学反应与热能 课件(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-18 19:39:35 | ||
图片预览




文档简介
(共26张PPT)
高中化学人教版必修第二册
第六章 第一节 第一课时
《化学反应与热能》
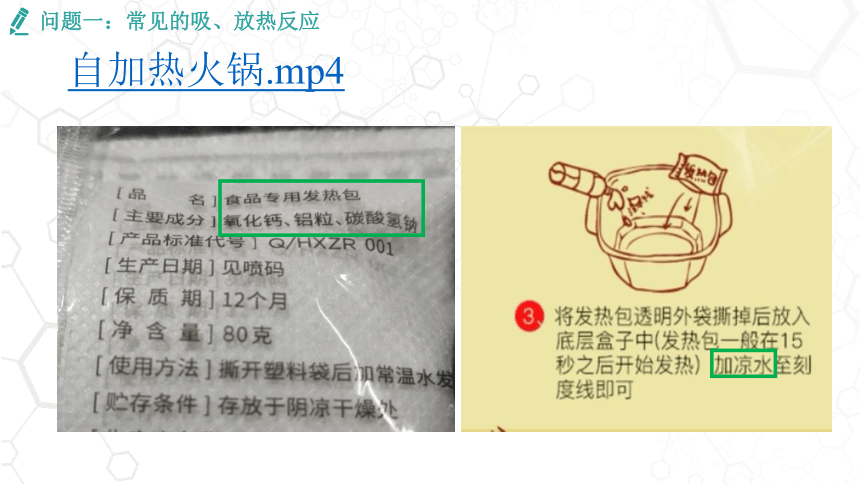
问题一:常见的吸、放热反应
自加热火锅.mp4
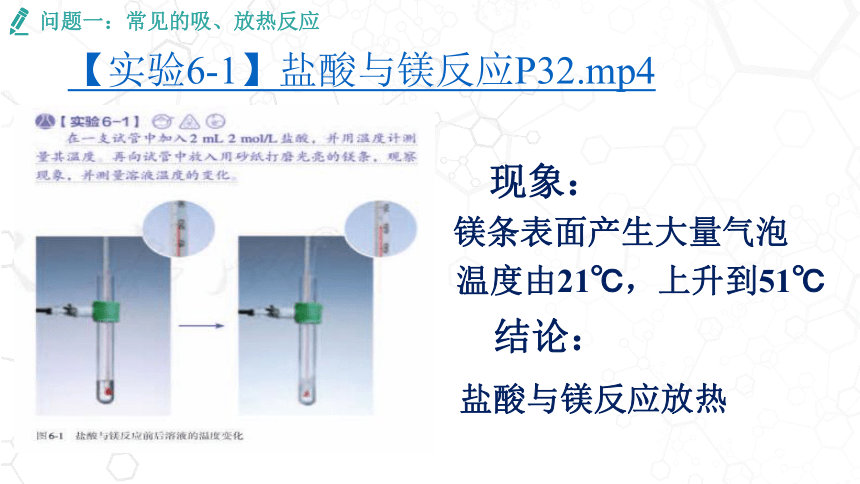
现象:
镁条表面产生大量气泡
温度由21℃,上升到51℃
【实验6-1】盐酸与镁反应P32.mp4
结论:
盐酸与镁反应放热
问题一:常见的吸、放热反应
现象:
3.产生有刺激性气味的气体
2.烧杯变凉,小木片粘到了烧杯底部
1.烧杯内产物呈糊状
【实验6-2】 氢氧化钡晶体与氯化铵晶体的反应P33.mp4
结论:
这是一个吸热反应
问题一:常见的吸、放热反应
1.放热反应:
(1)定义:
释放热量的化学反应称为放热反应
(2)常见的放热反应:
所有的燃烧反应和缓慢氧化反应、
所有的酸碱中和反应、
大多数化合反应、
铝热反应、
活泼金属与水或酸的反应
问题一:常见的吸、放热反应
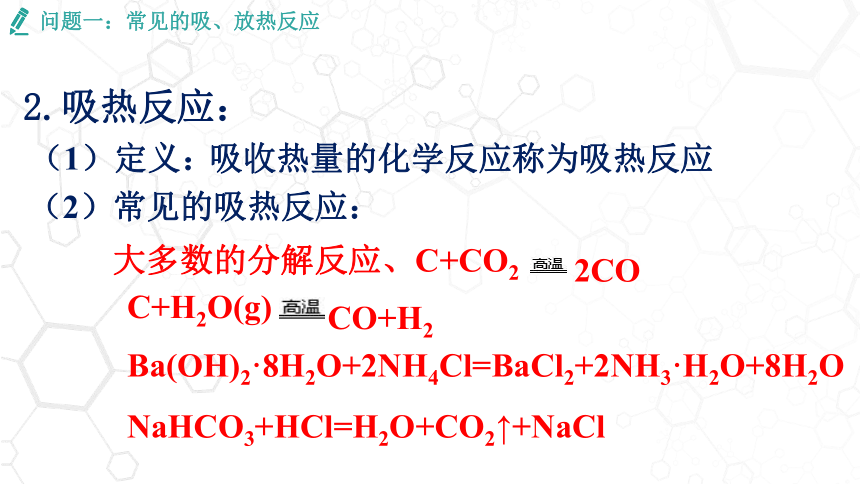
2.吸热反应:
(1)定义:
吸收热量的化学反应称为吸热反应
(2)常见的吸热反应:
大多数的分解反应、C+CO2
C+H2O(g)
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
2CO
CO+H2
NaHCO3+HCl=H2O+CO2↑+NaCl
问题一:常见的吸、放热反应
注:
NaOH固体溶于水、浓硫酸的稀释,属于放热过程;
NH4NO3固体溶于水,升华、蒸发等属于吸热过程。
①吸热反应和放热反应均是化学反应
②需要加热的反应不一定是吸热反应
③在可逆反应中,如果正反应为吸热,
则逆反应为放热
问题一:常见的吸、放热反应
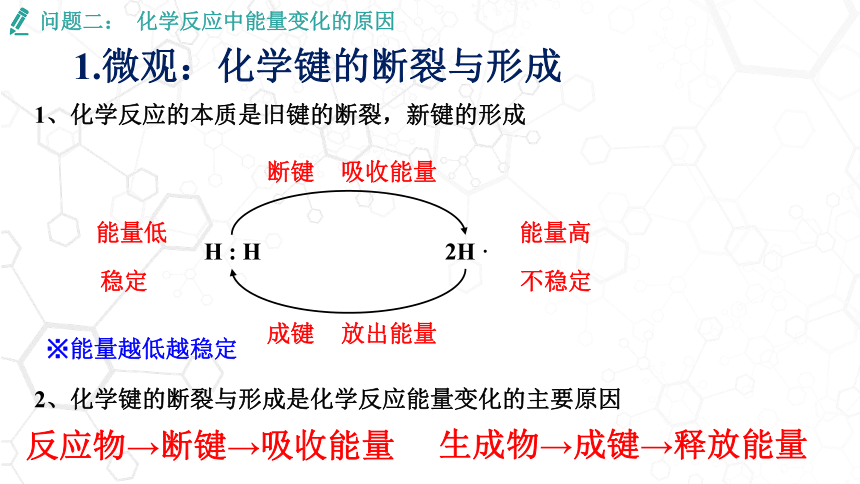
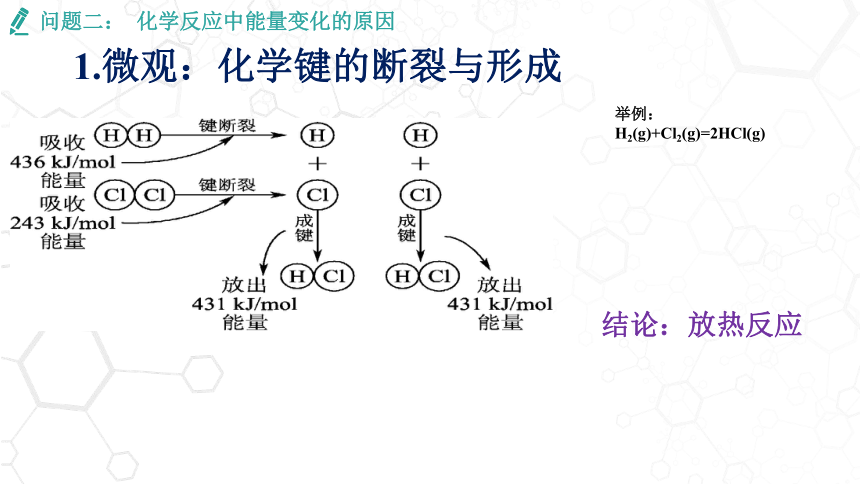
1.微观:化学键的断裂与形成
问题二: 化学反应中能量变化的原因
生成物→成键→释放能量
H : H
2H ·
断键
吸收能量
成键
放出能量
能量低
能量高
反应物→断键→吸收能量
※能量越低越稳定
2、化学键的断裂与形成是化学反应能量变化的主要原因
1、化学反应的本质是旧键的断裂,新键的形成
稳定
不稳定
1.微观:化学键的断裂与形成
举例:
H2(g)+Cl2(g)=2HCl(g)
结论:放热反应
问题二: 化学反应中能量变化的原因
2.宏观:反应物与生成物的总能量高低
放热反应
:反应物的总能量>生成物的总能量
问题二: 化学反应中能量变化的原因
2.宏观:反应物与生成物的总能量高低
吸热反应
:反应物的总能量<生成物的总能量
问题二: 化学反应中能量变化的原因
3.吸热反应和放热反应的判断方法
(1)根据反应物和生成物的总能量大小判断
(2)根据化学键断裂和形成时能量变化大小关系判断
(3)根据经验判断——常见的吸放热反应
(4)根据生成物和反应物的相对稳定性判断——由 稳定的物质(能量低)生成不稳定的物质(能量高)的反应为吸热反应,反之为放热反应
问题二: 化学反应中能量变化的原因
1.人类对化学反应中热能的利用——燃烧
(1)发现:始于火的发现
(2)早期:以树枝杂草为主要能源
(3)现代:以煤、石油和天然气为主要能源
问题三: 人类对能源的利用及能源现状
问题三: 人类对能源的利用及能源现状
能耗越来越高
化石燃料消耗占比88%
1.人类对化学反应中热能的利用——燃烧
(1)发现:始于火的发现
(2)早期:以树枝杂草为主要能源
(3)现代:以煤、石油和天然气为主要能源
2.利用最多的化石燃料面临的两个亟待解决的问题
(1)能源短缺问题日益突出
(2)燃烧排放的粉尘、SO2、NOX、CO等造成了大气污染
问题三: 人类对能源的利用及能源现状
问题三: 人类对能源的利用及能源现状
3.节能减排,寻找清洁的新能源
(1)节能:主要是充分有效地利用资源。如在燃料利用的过程中,节能的主要环节有两个:一是燃料燃烧阶段,提高燃料的燃烧效率;二是能量利用阶段,提高能源利用率
(2)理想新能源应具有资源丰富、可以再生、对环境无污染的特点。如太阳能、氢能、风能、地热能、海洋能
问题三: 人类对能源的利用及能源现状
小结
课堂测评
1.下列变化一定是吸热反应的是( )
A.凡需加热才能发生的反应
B.所有的分解反应
C.将化学能转变为热能的反应
D.生成物总能量大于反应物总能量的反应
课堂测评
2.下列过程中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解
B.乙醇燃烧
C.液态水汽化
D.氧化钙与水反应
课堂测评
3.下列说法中正确的是( )
A.物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C.吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多
D.因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
课堂测评
4.有专家提出,如果利用太阳能将燃料CH4、CH3OH、NH3等燃烧后的产物如CO2、H2O、N2等组合,使之重新变成CH4、CH3OH、NH3等的构思(如图所示)能够实现,那么在很大程度上可以缓解能源危机,在此过程中太阳能最终转化为( )
A.化学能 B.生物质能
C.热能 D.电能
课堂测评
5.下列叙述错误的是( )
A.化石能源物质内部蕴含着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在一定条件下转化为热能、电能,为人类所利用
D.吸热反应没有利用价值
课堂测评
6.已知2SO2+O2 2SO3为放热反应,对该反应的下列说法正确的是( )
A.O2的能量一定高于SO2的能量
B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
课堂测评
7.已知反应A2+B2=2AB,破坏1molA2中的化学键消耗的能量为Q1kJ,破坏1molB2中的化学键消耗的能量为Q2kJ,形成1 mol AB中的化学键释放的能量为Q3kJ, 则下列说法正确的是( )
A.若A2和B2的总能量之和大于生成的AB的总能量,则反应放热
B.若A2和B2的总能量之和小于生成的AB的总能量,则反应放热
C.若该反应放出能量,则Q1+Q2>Q3
D.若该反应吸收能量,则Q1+Q2D A D C D B A
谢谢!
我们下次见!
高中化学人教版必修第二册
第六章 第一节 第一课时
《化学反应与热能》
问题一:常见的吸、放热反应
自加热火锅.mp4
现象:
镁条表面产生大量气泡
温度由21℃,上升到51℃
【实验6-1】盐酸与镁反应P32.mp4
结论:
盐酸与镁反应放热
问题一:常见的吸、放热反应
现象:
3.产生有刺激性气味的气体
2.烧杯变凉,小木片粘到了烧杯底部
1.烧杯内产物呈糊状
【实验6-2】 氢氧化钡晶体与氯化铵晶体的反应P33.mp4
结论:
这是一个吸热反应
问题一:常见的吸、放热反应
1.放热反应:
(1)定义:
释放热量的化学反应称为放热反应
(2)常见的放热反应:
所有的燃烧反应和缓慢氧化反应、
所有的酸碱中和反应、
大多数化合反应、
铝热反应、
活泼金属与水或酸的反应
问题一:常见的吸、放热反应
2.吸热反应:
(1)定义:
吸收热量的化学反应称为吸热反应
(2)常见的吸热反应:
大多数的分解反应、C+CO2
C+H2O(g)
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
2CO
CO+H2
NaHCO3+HCl=H2O+CO2↑+NaCl
问题一:常见的吸、放热反应
注:
NaOH固体溶于水、浓硫酸的稀释,属于放热过程;
NH4NO3固体溶于水,升华、蒸发等属于吸热过程。
①吸热反应和放热反应均是化学反应
②需要加热的反应不一定是吸热反应
③在可逆反应中,如果正反应为吸热,
则逆反应为放热
问题一:常见的吸、放热反应
1.微观:化学键的断裂与形成
问题二: 化学反应中能量变化的原因
生成物→成键→释放能量
H : H
2H ·
断键
吸收能量
成键
放出能量
能量低
能量高
反应物→断键→吸收能量
※能量越低越稳定
2、化学键的断裂与形成是化学反应能量变化的主要原因
1、化学反应的本质是旧键的断裂,新键的形成
稳定
不稳定
1.微观:化学键的断裂与形成
举例:
H2(g)+Cl2(g)=2HCl(g)
结论:放热反应
问题二: 化学反应中能量变化的原因
2.宏观:反应物与生成物的总能量高低
放热反应
:反应物的总能量>生成物的总能量
问题二: 化学反应中能量变化的原因
2.宏观:反应物与生成物的总能量高低
吸热反应
:反应物的总能量<生成物的总能量
问题二: 化学反应中能量变化的原因
3.吸热反应和放热反应的判断方法
(1)根据反应物和生成物的总能量大小判断
(2)根据化学键断裂和形成时能量变化大小关系判断
(3)根据经验判断——常见的吸放热反应
(4)根据生成物和反应物的相对稳定性判断——由 稳定的物质(能量低)生成不稳定的物质(能量高)的反应为吸热反应,反之为放热反应
问题二: 化学反应中能量变化的原因
1.人类对化学反应中热能的利用——燃烧
(1)发现:始于火的发现
(2)早期:以树枝杂草为主要能源
(3)现代:以煤、石油和天然气为主要能源
问题三: 人类对能源的利用及能源现状
问题三: 人类对能源的利用及能源现状
能耗越来越高
化石燃料消耗占比88%
1.人类对化学反应中热能的利用——燃烧
(1)发现:始于火的发现
(2)早期:以树枝杂草为主要能源
(3)现代:以煤、石油和天然气为主要能源
2.利用最多的化石燃料面临的两个亟待解决的问题
(1)能源短缺问题日益突出
(2)燃烧排放的粉尘、SO2、NOX、CO等造成了大气污染
问题三: 人类对能源的利用及能源现状
问题三: 人类对能源的利用及能源现状
3.节能减排,寻找清洁的新能源
(1)节能:主要是充分有效地利用资源。如在燃料利用的过程中,节能的主要环节有两个:一是燃料燃烧阶段,提高燃料的燃烧效率;二是能量利用阶段,提高能源利用率
(2)理想新能源应具有资源丰富、可以再生、对环境无污染的特点。如太阳能、氢能、风能、地热能、海洋能
问题三: 人类对能源的利用及能源现状
小结
课堂测评
1.下列变化一定是吸热反应的是( )
A.凡需加热才能发生的反应
B.所有的分解反应
C.将化学能转变为热能的反应
D.生成物总能量大于反应物总能量的反应
课堂测评
2.下列过程中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解
B.乙醇燃烧
C.液态水汽化
D.氧化钙与水反应
课堂测评
3.下列说法中正确的是( )
A.物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C.吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多
D.因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
课堂测评
4.有专家提出,如果利用太阳能将燃料CH4、CH3OH、NH3等燃烧后的产物如CO2、H2O、N2等组合,使之重新变成CH4、CH3OH、NH3等的构思(如图所示)能够实现,那么在很大程度上可以缓解能源危机,在此过程中太阳能最终转化为( )
A.化学能 B.生物质能
C.热能 D.电能
课堂测评
5.下列叙述错误的是( )
A.化石能源物质内部蕴含着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在一定条件下转化为热能、电能,为人类所利用
D.吸热反应没有利用价值
课堂测评
6.已知2SO2+O2 2SO3为放热反应,对该反应的下列说法正确的是( )
A.O2的能量一定高于SO2的能量
B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
课堂测评
7.已知反应A2+B2=2AB,破坏1molA2中的化学键消耗的能量为Q1kJ,破坏1molB2中的化学键消耗的能量为Q2kJ,形成1 mol AB中的化学键释放的能量为Q3kJ, 则下列说法正确的是( )
A.若A2和B2的总能量之和大于生成的AB的总能量,则反应放热
B.若A2和B2的总能量之和小于生成的AB的总能量,则反应放热
C.若该反应放出能量,则Q1+Q2>Q3
D.若该反应吸收能量,则Q1+Q2
谢谢!
我们下次见!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
