(4)工艺流程中化学(离子)方程式的书写__高考化学工艺流程针对突破(含解析)
文档属性
| 名称 | (4)工艺流程中化学(离子)方程式的书写__高考化学工艺流程针对突破(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 888.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-19 17:29:20 | ||
图片预览




文档简介
(4)工艺流程中化学(离子)方程式的书写——高考化学工艺流程针对突破
1.书写思路
首先根据题给材料中的信息写出部分反应物和生成物的化学式,再根据反应前后元素化合价有无变化判断反应类型:
(1)元素化合价无变化则为非氧化还原反应,遵循质量守恒定律;
(2)元素化合价有变化则为氧化还原反应,既遵循质量守恒定律,又遵循得失电子守恒规律。
2.流程中陌生的氧化还原反应的书写流程
(1)首先根据题给材料中的信息确定氧化剂(或还原剂)与还原产物(或氧化产物),结合已学知识根据加入的还原剂(或氧化剂)判断氧化产物(或还原产物)。
(2)根据得失电子守恒配平氧化还原反应。
(3)根据电荷守恒和反应物的酸碱性,在方程式左边或右边补充H+、OH-或H2O等。
(4)根据质量守恒配平反应方程式。
【针对训练】1.被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为,含少量、和)为原料制备的流程如下:
已知:25℃时,,,;,。
回答下列问题:
(1)浸渣的主要成分为________和________(填化学式),“浸出”步骤中与溶液反应的原理为______________________________(用离子方程式表示)。
(2)“热解”步骤的化学方程式为________________________________________。
2.某废旧三元锂离子电池正极材料的主要成分是还有少量有机粘结剂和铝箔基底等,下图是处理电池正极材料回收锂、钴、镍、锰的一种流程。回答下列问题:
已知:①常温下,碳酸锂微溶于水,碳酸氢锂易溶于水。
中Ni和Co元素的化合价均为+2价。
③焙烧时没有发生变化,焙烧还原时Li元素转化为。
④常温时,氢氧化铝。。
(1)除杂时发生反应的离子方程式为_________________________________(任写一个)。
(2)焙烧还原时发生反应的化学方程式为___________________________________。
3.金属钛()因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。一种由钛铁矿[主要成分是钛酸亚铁,还含有少量、等杂质]为主要原料冶炼金属钛同时获得副产品绿矾的工业生产流程如下图所示。
已知:①易水解为。
②在时生成沉淀,时沉淀完全。
③高温下钛易与等反应.
(1)“酸浸”后钛主要以存在,写出相应反应的离子方程式____________________________________。
(2)“高温氯化”时生成和一种可燃性气体,反应的化学方程式为______________________________________;“高温氯化”反应理论计算结果显示,在条件下达到平衡时,几乎完全转化为,但实际生产中反应温度却远高于,其原因是________(写一种)。
4.六安市金寨县关庙沙坪沟的钼矿储量居亚洲第一。四钼酸铵是钼深加工的重要中间产品,具有广泛的用途。现以该钼精矿(主要含,还有Cu、Fe的化合物及等)为原料制备四钼酸铵的工艺流程如下图所示。
回答下列问题:
(1)“浸出”时,转化为的离子方程式为_____________________________。“浸出”也可用氨水,此时钼元素转化为,铜元素转化为(深蓝色)。已知:为蓝色。用沉钼时,溶液由深蓝色变为蓝色,从平衡移动角度说明其原因:_________________________________________________。
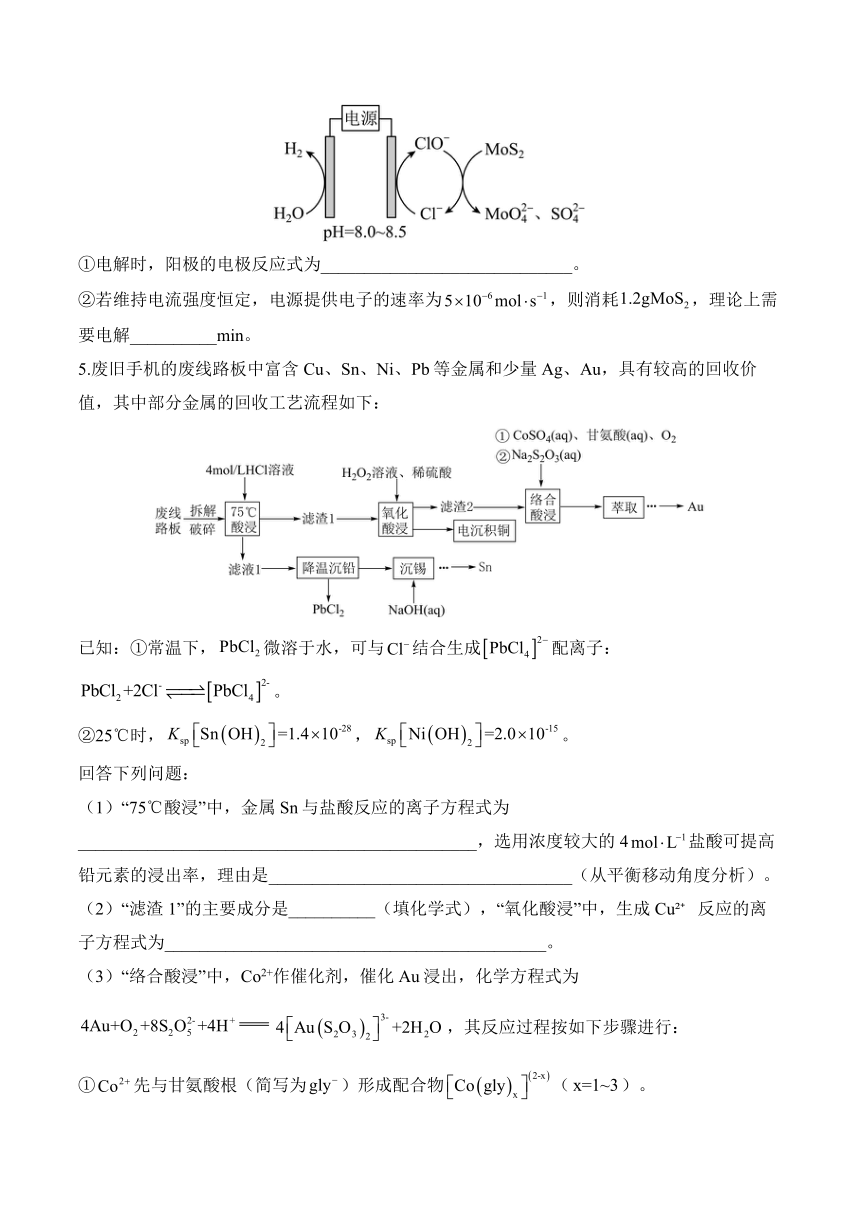
(2)钼精矿冶金工艺也可以采用电氧化法,其工作原理如图所示:
①电解时,阳极的电极反应式为_____________________________。
②若维持电流强度恒定,电源提供电子的速率为,则消耗,理论上需要电解__________min。
5.废旧手机的废线路板中富含Cu、Sn、Ni、Pb等金属和少量Ag、Au,具有较高的回收价值,其中部分金属的回收工艺流程如下:
已知:①常温下,微溶于水,可与结合生成配离子:。
②25℃时,,。
回答下列问题:
(1)“75℃酸浸”中,金属Sn与盐酸反应的离子方程式为______________________________________________,选用浓度较大的4盐酸可提高铅元素的浸出率,理由是___________________________________(从平衡移动角度分析)。
(2)“滤渣1”的主要成分是__________(填化学式),“氧化酸浸”中,生成Cu 反应的离子方程式为____________________________________________。
(3)“络合酸浸”中,Co2+作催化剂,催化Au浸出,化学方程式为,其反应过程按如下步骤进行:
①先与甘氨酸根(简写为)形成配合物()。
②在氧气作用下,Co(Ⅱ)被氧化成Co(Ⅲ):。
③Au溶解。
④加入硫代硫酸钠溶液,发生反应:。
步骤③Au溶解的离子方程式为________________________________。
6.工业上利用软锰矿和菱锰矿联合进行锅炉燃煤烟气脱硫,同时制备重要化工产品,工艺流程如下:
资料:i.软锰矿的主要成分是,含少量。
ⅱ.锅炉燃煤过程中空气过量。
ⅲ.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH。
金属离子
开始沉淀 1.5 6.3 7.6
完全沉淀 2.8 8.3 10.2
(1)将烟气通入吸收塔中,发生的主要反应的化学方程式是__________________________________________。
(2)经检测发现滤液1中仍含有少量,可加入进行“深度净化”,该过程中反应的离子方程式是_______________________________________。
(3)产品含量测定方法如下:
I.称取ag晶体,加足量硫酸溶解,将溶液定容于100mL容量瓶中。
Ⅱ.取25.00mL溶液于锥形瓶中,加入少量催化剂和过量溶液,加热、充分反应后,煮沸溶液使过量的分解。
Ⅲ.加入指示剂,用溶液滴定,滴定至终点时消耗cmL,重新变成。
①补全步骤Ⅱ中反应的离子方程式:__________________________________,。
②产品中的质量分数为________(的摩尔质量为151g/mol)。
7.阳极泥是电解精炼铜过程中产生的一种副产品,其中含Au、Pt、Ag、Cu、Se、CuAgSe和等。下图是全湿法处理铜阳极泥提取银的工艺:
回答下列问题:
(1)“分银”所得产物为,1mol该物质中含有的共价键数目为______________写出该产物电离的方程式是_________________________________。
(2)已知水合肼还原“分银”产物,“沉银”过程中有铵盐和一水合氨生成,写出该过程的化学方程式_________________________________________。
8.元素锑被广泛用于制造半导体和二极管,在电子工业中有重要地位。某企业想回收铜电解精炼过程形成的阳极泥中的锑和铋元素,工艺流程如下:
已知:
①脱铜阳极泥中锑、铋的存在形式为、、、;
②和水解生成和,二者均为白色沉淀;
③为浅黄色粉末,不溶于冷水。
回答下列问题:
(1)氯化浸出过程中,为了提高浸出率可采取的措施为_____________(任写一点);该过程中,主要转化成,反应的离子方程式为_____________________________________________。
(2)分步调节pH产生的常用于制备制药工业重要原料,写出向和混合浆液中通入氯气制备的离子方程式__________________________________________________。
答案以及解析
1.答案:(1);;,
(2)
解析:(1)根据分析可知,浸渣的主要成分为和,氯化铵水解产生氢离子可以溶解,反应的原理为,;
2.答案:(1)或
(2)
解析:(1)除杂时铝,或氧化铝与氢氧化钠反应生成四羟基合铝酸钠,离子方程式为:或。
(2)焙烧还原时Li元素转化为,同时有二氧化碳生成,反应的化学方程式为:。
3.答案:(1)
(2);为了提高反应速率,在相同时间内得到更多的产品,提高效益
解析:(1)根据流程可知,“酸浸”后生成了,相应反应的离子方程式为:;
(2)根据流程图,、、焦炭在高温条件先生成CO,则另一产物为,反应的化学方程式为;
实际生产需要考虑效益,所以为了提高反应速率,适当提高反应温度,可以在相同时间内得到更多的产品,故答案为:;为了提高反应速率,在相同时间内得到更多的产品,提高效益;
4.答案:(1);“沉钼”溶液中存在平衡,氨水与反应使平衡正向移动,溶液变为蓝色
(2);450
解析:(1)“浸出”时,转化为的离子方程式为:;由题给信息可知,“沉钼”溶液中存在平衡:,氨水与反应使平衡正向移动,溶液变为蓝色;
(2)①由图可知,阳极上氯离子失去电子生成,故电极反应式为:;
②由图可知,发生的反应方程式为:,所以消耗转移18mol电子,则消耗,理论上需要转移的电子为:,根据电源提供电子的速率为,理论上需要电解。
5.答案:(1);常温下,微溶于水,增大,使平衡正向移动,增大铅的浸出率
(2)Cu、Ag、Au;
(3)
解析:(1)“75℃酸浸”中,金属Sn与盐酸反应的化学方程式为:,则其离子方程式为,由题干信息可知,常温下,微溶于水,选用浓度较大的4盐酸,增大,使平衡正向移动,可提高铅元素的浸出率,故答案为:;常温下,微溶于水,增大,使平衡正向移动,增大铅的浸出率。
6.答案:(1)
(2)、或;abc
(3)
(4);
解析:(1)二氧化锰将二氧化硫氧化为硫酸根,Mn被还原为+2价:;
(2)①二氧化硫溶于水生成亚硫酸再被空气中的氧气氧化为硫酸、或使得溶液中氢离子浓度增大,溶液pH下降;
②a.吸收塔中吸收率下降的可能原因是pH减小抑制了的溶解,pH减小导致平衡逆向移动,而抑制了二氧化硫溶解,a正确;
b.图中信息可以看出pH=5.0时吸收率恰好为95%,菱锰矿调节pH升至5.0以上后,吸收率又可以恢复至95%左右,b正确;
c.加入菱锰矿能调节pH时和消耗酸离子的同时生成了,增加矿浆中的浓度,c正确;
(3)据分析,二氧化锰将亚铁离子氧化为氢氧化铁沉淀自身被还原为锰离子:;
(4)根据得失电子守恒有:,根据化学方程式及得失电子守恒有:,则样品中硫酸锰的质量分数为。
7.答案:(1)8;
(2)
解析:(1)“分银”所得产物为,为与氯离子形成的离子化合物,中Ag与形成配位键,中形成N-H键,1mol该物质中含有的共价键数目为8,该产物电离的方程式是:;
(2)“沉银”过程中有铵盐和一水合氨生成,该过程的化学方程式为:。
8.答案:(1)适当提高和溶液的浓度、搅拌、适当升温等;
(2)
解析:(1)氯化浸出过程中,为了提高浸出率可采取的措施为适当提高和溶液的浓度、搅拌、适当升温等;在酸性环境下溶解与氯离子结合,主要转化成,反应的离子方程式为:;
(2)出向和混合浆液中通入氯气,氯气将铋从+3价氧化生成+5价的,本身还原为氯离子,反应方程式为:。
1.书写思路
首先根据题给材料中的信息写出部分反应物和生成物的化学式,再根据反应前后元素化合价有无变化判断反应类型:
(1)元素化合价无变化则为非氧化还原反应,遵循质量守恒定律;
(2)元素化合价有变化则为氧化还原反应,既遵循质量守恒定律,又遵循得失电子守恒规律。
2.流程中陌生的氧化还原反应的书写流程
(1)首先根据题给材料中的信息确定氧化剂(或还原剂)与还原产物(或氧化产物),结合已学知识根据加入的还原剂(或氧化剂)判断氧化产物(或还原产物)。
(2)根据得失电子守恒配平氧化还原反应。
(3)根据电荷守恒和反应物的酸碱性,在方程式左边或右边补充H+、OH-或H2O等。
(4)根据质量守恒配平反应方程式。
【针对训练】1.被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为,含少量、和)为原料制备的流程如下:
已知:25℃时,,,;,。
回答下列问题:
(1)浸渣的主要成分为________和________(填化学式),“浸出”步骤中与溶液反应的原理为______________________________(用离子方程式表示)。
(2)“热解”步骤的化学方程式为________________________________________。
2.某废旧三元锂离子电池正极材料的主要成分是还有少量有机粘结剂和铝箔基底等,下图是处理电池正极材料回收锂、钴、镍、锰的一种流程。回答下列问题:
已知:①常温下,碳酸锂微溶于水,碳酸氢锂易溶于水。
中Ni和Co元素的化合价均为+2价。
③焙烧时没有发生变化,焙烧还原时Li元素转化为。
④常温时,氢氧化铝。。
(1)除杂时发生反应的离子方程式为_________________________________(任写一个)。
(2)焙烧还原时发生反应的化学方程式为___________________________________。
3.金属钛()因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。一种由钛铁矿[主要成分是钛酸亚铁,还含有少量、等杂质]为主要原料冶炼金属钛同时获得副产品绿矾的工业生产流程如下图所示。
已知:①易水解为。
②在时生成沉淀,时沉淀完全。
③高温下钛易与等反应.
(1)“酸浸”后钛主要以存在,写出相应反应的离子方程式____________________________________。
(2)“高温氯化”时生成和一种可燃性气体,反应的化学方程式为______________________________________;“高温氯化”反应理论计算结果显示,在条件下达到平衡时,几乎完全转化为,但实际生产中反应温度却远高于,其原因是________(写一种)。
4.六安市金寨县关庙沙坪沟的钼矿储量居亚洲第一。四钼酸铵是钼深加工的重要中间产品,具有广泛的用途。现以该钼精矿(主要含,还有Cu、Fe的化合物及等)为原料制备四钼酸铵的工艺流程如下图所示。
回答下列问题:
(1)“浸出”时,转化为的离子方程式为_____________________________。“浸出”也可用氨水,此时钼元素转化为,铜元素转化为(深蓝色)。已知:为蓝色。用沉钼时,溶液由深蓝色变为蓝色,从平衡移动角度说明其原因:_________________________________________________。
(2)钼精矿冶金工艺也可以采用电氧化法,其工作原理如图所示:
①电解时,阳极的电极反应式为_____________________________。
②若维持电流强度恒定,电源提供电子的速率为,则消耗,理论上需要电解__________min。
5.废旧手机的废线路板中富含Cu、Sn、Ni、Pb等金属和少量Ag、Au,具有较高的回收价值,其中部分金属的回收工艺流程如下:
已知:①常温下,微溶于水,可与结合生成配离子:。
②25℃时,,。
回答下列问题:
(1)“75℃酸浸”中,金属Sn与盐酸反应的离子方程式为______________________________________________,选用浓度较大的4盐酸可提高铅元素的浸出率,理由是___________________________________(从平衡移动角度分析)。
(2)“滤渣1”的主要成分是__________(填化学式),“氧化酸浸”中,生成Cu 反应的离子方程式为____________________________________________。
(3)“络合酸浸”中,Co2+作催化剂,催化Au浸出,化学方程式为,其反应过程按如下步骤进行:
①先与甘氨酸根(简写为)形成配合物()。
②在氧气作用下,Co(Ⅱ)被氧化成Co(Ⅲ):。
③Au溶解。
④加入硫代硫酸钠溶液,发生反应:。
步骤③Au溶解的离子方程式为________________________________。
6.工业上利用软锰矿和菱锰矿联合进行锅炉燃煤烟气脱硫,同时制备重要化工产品,工艺流程如下:
资料:i.软锰矿的主要成分是,含少量。
ⅱ.锅炉燃煤过程中空气过量。
ⅲ.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH。
金属离子
开始沉淀 1.5 6.3 7.6
完全沉淀 2.8 8.3 10.2
(1)将烟气通入吸收塔中,发生的主要反应的化学方程式是__________________________________________。
(2)经检测发现滤液1中仍含有少量,可加入进行“深度净化”,该过程中反应的离子方程式是_______________________________________。
(3)产品含量测定方法如下:
I.称取ag晶体,加足量硫酸溶解,将溶液定容于100mL容量瓶中。
Ⅱ.取25.00mL溶液于锥形瓶中,加入少量催化剂和过量溶液,加热、充分反应后,煮沸溶液使过量的分解。
Ⅲ.加入指示剂,用溶液滴定,滴定至终点时消耗cmL,重新变成。
①补全步骤Ⅱ中反应的离子方程式:__________________________________,。
②产品中的质量分数为________(的摩尔质量为151g/mol)。
7.阳极泥是电解精炼铜过程中产生的一种副产品,其中含Au、Pt、Ag、Cu、Se、CuAgSe和等。下图是全湿法处理铜阳极泥提取银的工艺:
回答下列问题:
(1)“分银”所得产物为,1mol该物质中含有的共价键数目为______________写出该产物电离的方程式是_________________________________。
(2)已知水合肼还原“分银”产物,“沉银”过程中有铵盐和一水合氨生成,写出该过程的化学方程式_________________________________________。
8.元素锑被广泛用于制造半导体和二极管,在电子工业中有重要地位。某企业想回收铜电解精炼过程形成的阳极泥中的锑和铋元素,工艺流程如下:
已知:
①脱铜阳极泥中锑、铋的存在形式为、、、;
②和水解生成和,二者均为白色沉淀;
③为浅黄色粉末,不溶于冷水。
回答下列问题:
(1)氯化浸出过程中,为了提高浸出率可采取的措施为_____________(任写一点);该过程中,主要转化成,反应的离子方程式为_____________________________________________。
(2)分步调节pH产生的常用于制备制药工业重要原料,写出向和混合浆液中通入氯气制备的离子方程式__________________________________________________。
答案以及解析
1.答案:(1);;,
(2)
解析:(1)根据分析可知,浸渣的主要成分为和,氯化铵水解产生氢离子可以溶解,反应的原理为,;
2.答案:(1)或
(2)
解析:(1)除杂时铝,或氧化铝与氢氧化钠反应生成四羟基合铝酸钠,离子方程式为:或。
(2)焙烧还原时Li元素转化为,同时有二氧化碳生成,反应的化学方程式为:。
3.答案:(1)
(2);为了提高反应速率,在相同时间内得到更多的产品,提高效益
解析:(1)根据流程可知,“酸浸”后生成了,相应反应的离子方程式为:;
(2)根据流程图,、、焦炭在高温条件先生成CO,则另一产物为,反应的化学方程式为;
实际生产需要考虑效益,所以为了提高反应速率,适当提高反应温度,可以在相同时间内得到更多的产品,故答案为:;为了提高反应速率,在相同时间内得到更多的产品,提高效益;
4.答案:(1);“沉钼”溶液中存在平衡,氨水与反应使平衡正向移动,溶液变为蓝色
(2);450
解析:(1)“浸出”时,转化为的离子方程式为:;由题给信息可知,“沉钼”溶液中存在平衡:,氨水与反应使平衡正向移动,溶液变为蓝色;
(2)①由图可知,阳极上氯离子失去电子生成,故电极反应式为:;
②由图可知,发生的反应方程式为:,所以消耗转移18mol电子,则消耗,理论上需要转移的电子为:,根据电源提供电子的速率为,理论上需要电解。
5.答案:(1);常温下,微溶于水,增大,使平衡正向移动,增大铅的浸出率
(2)Cu、Ag、Au;
(3)
解析:(1)“75℃酸浸”中,金属Sn与盐酸反应的化学方程式为:,则其离子方程式为,由题干信息可知,常温下,微溶于水,选用浓度较大的4盐酸,增大,使平衡正向移动,可提高铅元素的浸出率,故答案为:;常温下,微溶于水,增大,使平衡正向移动,增大铅的浸出率。
6.答案:(1)
(2)、或;abc
(3)
(4);
解析:(1)二氧化锰将二氧化硫氧化为硫酸根,Mn被还原为+2价:;
(2)①二氧化硫溶于水生成亚硫酸再被空气中的氧气氧化为硫酸、或使得溶液中氢离子浓度增大,溶液pH下降;
②a.吸收塔中吸收率下降的可能原因是pH减小抑制了的溶解,pH减小导致平衡逆向移动,而抑制了二氧化硫溶解,a正确;
b.图中信息可以看出pH=5.0时吸收率恰好为95%,菱锰矿调节pH升至5.0以上后,吸收率又可以恢复至95%左右,b正确;
c.加入菱锰矿能调节pH时和消耗酸离子的同时生成了,增加矿浆中的浓度,c正确;
(3)据分析,二氧化锰将亚铁离子氧化为氢氧化铁沉淀自身被还原为锰离子:;
(4)根据得失电子守恒有:,根据化学方程式及得失电子守恒有:,则样品中硫酸锰的质量分数为。
7.答案:(1)8;
(2)
解析:(1)“分银”所得产物为,为与氯离子形成的离子化合物,中Ag与形成配位键,中形成N-H键,1mol该物质中含有的共价键数目为8,该产物电离的方程式是:;
(2)“沉银”过程中有铵盐和一水合氨生成,该过程的化学方程式为:。
8.答案:(1)适当提高和溶液的浓度、搅拌、适当升温等;
(2)
解析:(1)氯化浸出过程中,为了提高浸出率可采取的措施为适当提高和溶液的浓度、搅拌、适当升温等;在酸性环境下溶解与氯离子结合,主要转化成,反应的离子方程式为:;
(2)出向和混合浆液中通入氯气,氯气将铋从+3价氧化生成+5价的,本身还原为氯离子,反应方程式为:。
同课章节目录
