(7)工艺流程中的图像分析__高考化学工艺流程针对突破(含解析)
文档属性
| 名称 | (7)工艺流程中的图像分析__高考化学工艺流程针对突破(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-19 17:33:44 | ||
图片预览


文档简介
(7)工艺流程中的图像分析——高考化学工艺流程针对突破
一、图像题类型
1.单一曲线型 2.多重曲线型
解决图像题的基本思路:
(1)会识图:一看面、二看线、三看点(弄清纵、横坐标的含义;弄清起点、拐点、终点的含义;看清曲线的变化趋势)。
(2)会析数:分析数据、图像中隐含的信息,弄清各数据的含义及变化规律,将数据和图像信息加工成化学语言,同时联系化学概念、化学原理等理论知识进行分析解答。
二、表格题类型
解决表格题的关键
(1)理解表格中各个列项中文字、数字信息点的意义,巧妙地将表格语言转换成化学语言。
(2)理顺表格中数据间的变化趋势,联系相关的化学知识,寻找其中的变化规律,快速准确地解决问题。
三、图表信息试题的问题解决的方法归纳:
应用分析归纳的方法,得出表格数据中蕴涵的具有本质性的规律:
应用观察方法,准确理解图示中纵横轴代表的含义,并能结合化学知识分析判断曲线的走向趋势及起点、拐点、水平线含义;
注意信息的情景化:理解所给信息作什么用?
注意信息与基础知识间的有机联系
四、解沉淀溶解平衡图像题三步骤
第一步:明确图像中纵、横坐标的含义。
纵、横坐标通常是难溶物溶解后电离出的离子浓度。
第二步:理解图像中线上点、线外点的含义。
(1)曲线上任意一点都达到了沉淀溶解平衡状态,此时Qc=Ksp。在
温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲
线上变化,不会出现在曲线以外。
(2)曲线上方区域的点均为过饱和溶液,此时Qc>Ksp。
(3)曲线下方区域的点均为不饱和溶液,此时Qc第三步:抓住Ksp的特点,结合选项分析判断。
(1)溶液在蒸发时,离子浓度的变化分两种情况:
①原溶液不饱和时,离子浓度都增大;
②原溶液饱和时,离子浓度都不变。
溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
【针对训练】
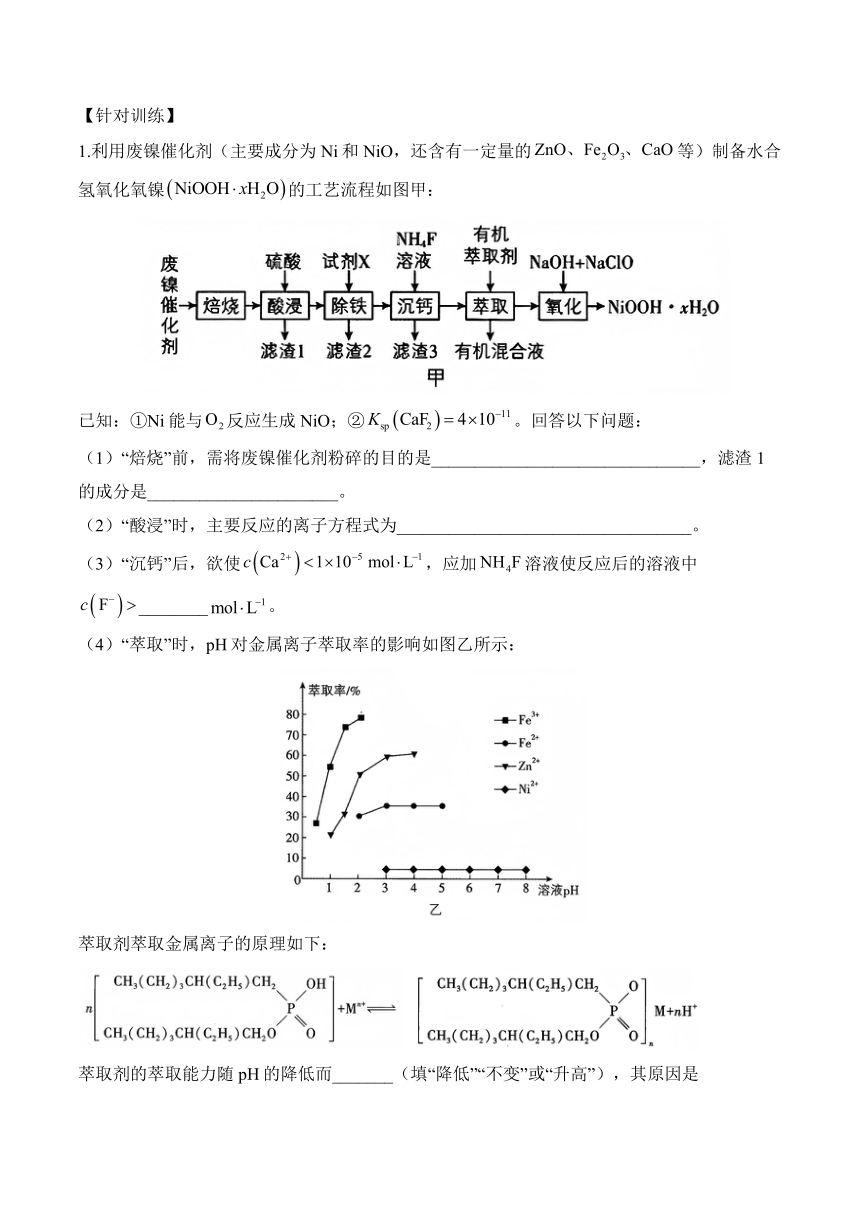
1.利用废镍催化剂(主要成分为Ni和NiO,还含有一定量的等)制备水合氢氧化氧镍的工艺流程如图甲:
已知:①Ni能与反应生成NiO;②。回答以下问题:
(1)“焙烧”前,需将废镍催化剂粉碎的目的是_______________________________,滤渣1的成分是______________________。
(2)“酸浸”时,主要反应的离子方程式为__________________________________。
(3)“沉钙”后,欲使,应加溶液使反应后的溶液中________。
(4)“萃取”时,pH对金属离子萃取率的影响如图乙所示:
萃取剂萃取金属离子的原理如下:
萃取剂的萃取能力随pH的降低而_______(填“降低”“不变”或“升高”),其原因是_____________________________________________________。
(5)“氧化”时,生成的离子方程式为__________________________。
(6)取10.1 g纯净干燥的,在空气中加强热,充分反应后生成,则_______。
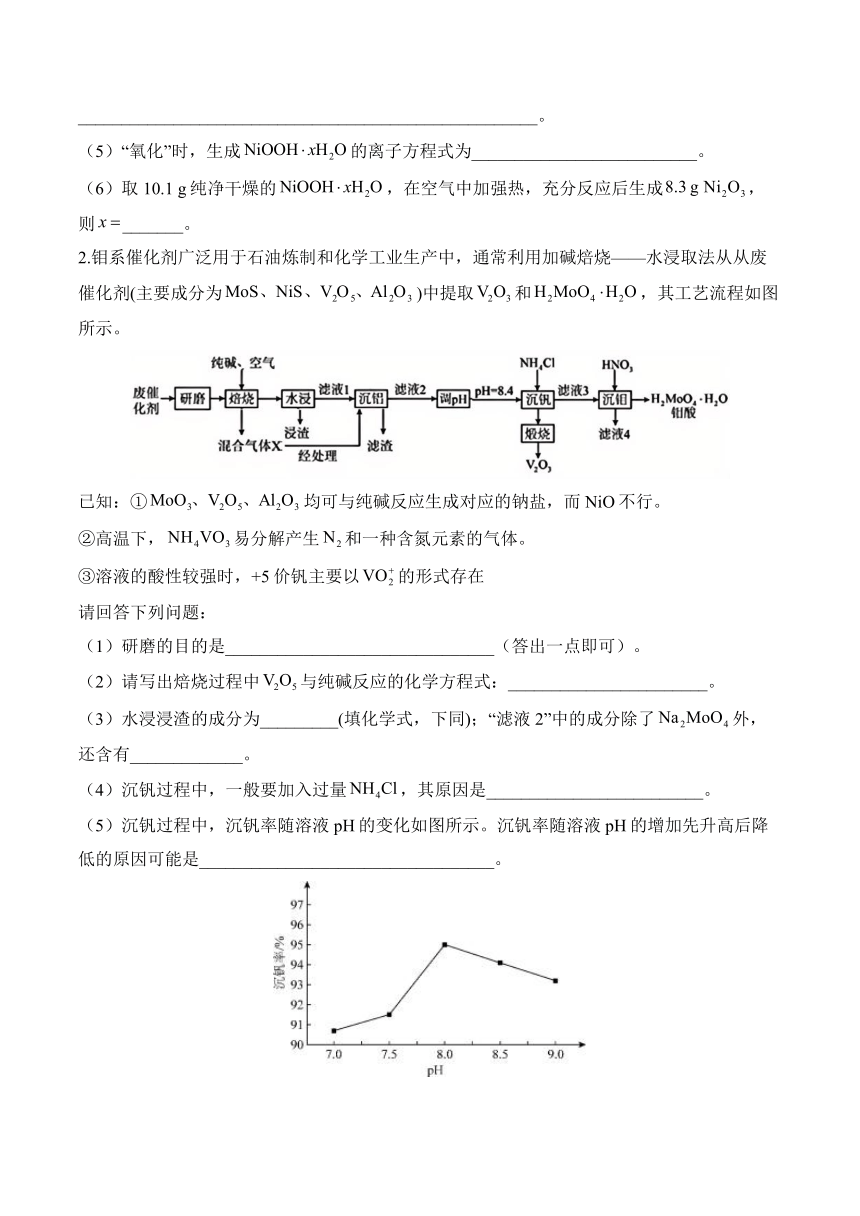
2.钼系催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧——水浸取法从从废催化剂(主要成分为)中提取和,其工艺流程如图所示。
已知:①均可与纯碱反应生成对应的钠盐,而NiO不行。
②高温下,易分解产生和一种含氮元素的气体。
③溶液的酸性较强时,+5价钒主要以的形式存在
请回答下列问题:
(1)研磨的目的是_______________________________(答出一点即可)。
(2)请写出焙烧过程中与纯碱反应的化学方程式:_______________________。
(3)水浸浸渣的成分为_________(填化学式,下同);“滤液2”中的成分除了外,还含有_____________。
(4)沉钒过程中,一般要加入过量,其原因是_________________________。
(5)沉钒过程中,沉钒率随溶液pH的变化如图所示。沉钒率随溶液pH的增加先升高后降低的原因可能是__________________________________。
(6)沉钒时生成沉淀,请写出“煅烧”中发生反应的化学方程式___________________________________________。
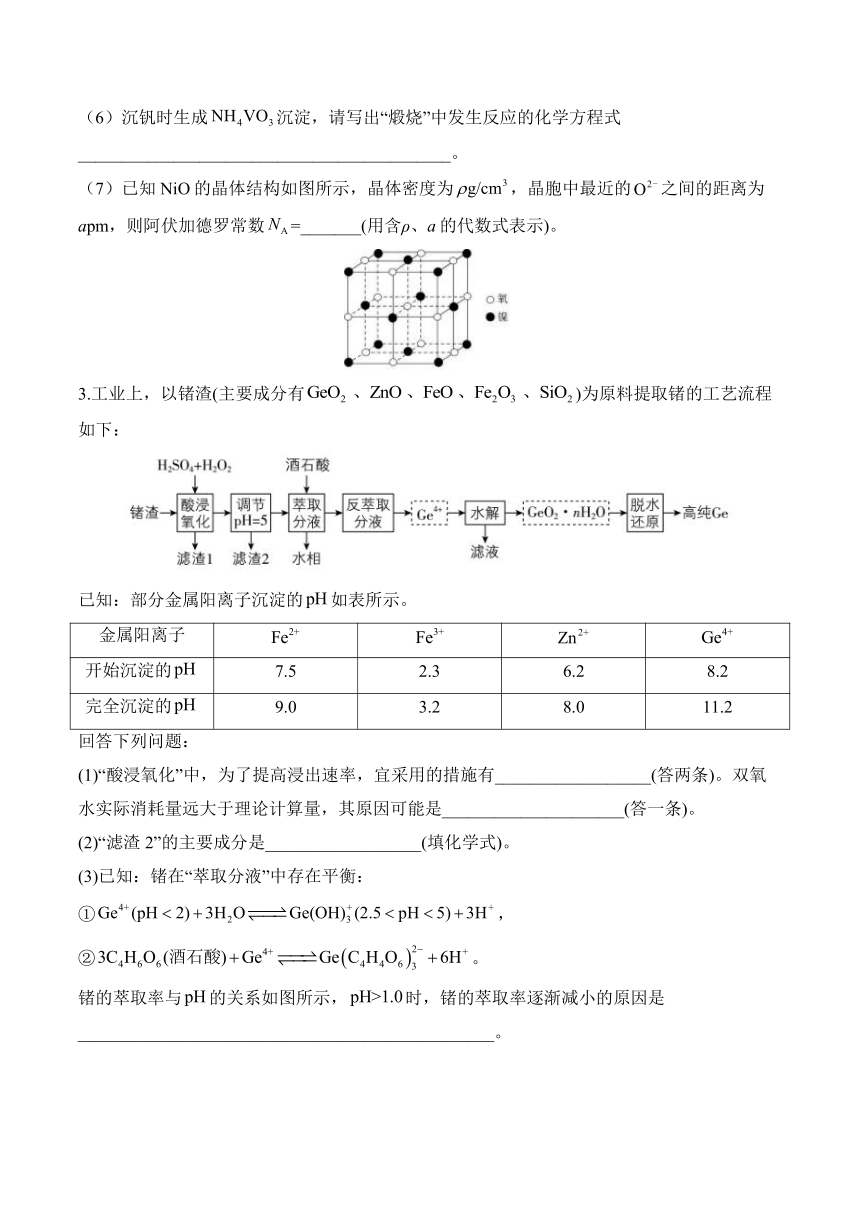
(7)已知NiO的晶体结构如图所示,晶体密度为,晶胞中最近的之间的距离为apm,则阿伏加德罗常数=_______(用含ρ、a的代数式表示)。
3.工业上,以锗渣(主要成分有)为原料提取锗的工艺流程如下:
已知:部分金属阳离子沉淀的如表所示。
金属阳离子
开始沉淀的 7.5 2.3 6.2 8.2
完全沉淀的 9.0 3.2 8.0 11.2
回答下列问题:
(1)“酸浸氧化”中,为了提高浸出速率,宜采用的措施有__________________(答两条)。双氧水实际消耗量远大于理论计算量,其原因可能是_____________________(答一条)。
(2)“滤渣2”的主要成分是__________________(填化学式)。
(3)已知:锗在“萃取分液”中存在平衡:
①,
②。
锗的萃取率与的关系如图所示,时,锗的萃取率逐渐减小的原因是________________________________________________。
(4)已知:“水解”中存在平衡,为了提高平衡水解率,可采用的措施有____________(答两条)。
(5)“水解”获得的“滤液”可循环用于_________(填序号)工序。
A.酸浸氧化 B.调节 C.萃取分液 D.反萃取分液
(6)“反萃取分液”中,反萃取效果与萃取剂的关系如图所示。工业上宜选择的萃取剂是_________(填序号)。
A.硫酸 B.NaOH C.氨水 D.双氧水
4.金属钒主要用于冶炼特种钢,被誉为“合金的维生素”。人们在化工实践中,以富钒炉渣(其中的钒以形式存在,还有少量的等)为原料制备的工艺流程如下:
已知:①酸浸后,转变成。
②钒元素的存在形式较多,部分四价钒和五价钒物种的分布分数与pH的关系如图甲所示。
(1)基态钒原子的价层电子排布式为_________________。
(2)富钒炉渣焙烧后,生成和,写出该反应的化学方程式:_____________________________________。
(3)滤渣成分除外,还有_____(填化学式)。
(4)氧化过程中溶液pH=0,写出该工序发生反应的离子方程式:_________________________________________。
(5)沉钒后得到偏钒酸铵,其阴离子呈如图乙所示的无限链状结构,则偏钒酸铵的化学式为_________。
(6)沉钒时沉钒率随温度变化如图丙,温度高于80 ℃,沉钒率下降的原因可能是____________________________________________。
(7)测定产品中的纯度。称取产品,先用硫酸溶解,得到溶液,再加入溶液(),最后用溶液滴定过量的至终点,消耗溶液的体积为。已知被还原为,假设杂质不参与反应,则产品中(摩尔质量:)的质量分数是____________________________(列出计算式)。
5.纳米氧化镁在陶瓷、催化等领域有着广泛应用。工业上以菱镁矿(主要成分为,含少量、、和铁的氧化物)为原料制备纳米氧化镁的工艺流程如图:
已知:①金属离子开始沉淀和沉淀完全的pH如表所示:
金属离子
开始沉淀的pH 2.7 3.5 8.1 6.3
沉淀完全(离子浓度等于)的pH 3.7 4.7 9.4 8.3
②草酸溶液是一种酸性溶液,有腐蚀作用,还具有一定的挥发性。
③实验证明纳米氧化镁的粒径越小性质越优良。
请按要求完成下列问题:
(1)“煅烧1”时,需将菱镁矿粉碎,并在底部鼓入热空气,该操作的优点是_______________________________________。
(2)“浸出”时若不加入试剂a造成的后果是_____________________。若“调pH”后所得的滤液2中,则________mol/L。
(3)下图是“沉镁”时反应温度对产物粒径影响,则“沉镁”操作中反应的最佳温度为_________,不宜过高,原因为______________________________________。“沉镁”过程中发生反应的离子方程式为_________________________________________。
(4)下图是煅烧2温度对产物二次粒径影响,“煅烧2”时,发生反应的化学方程式为________________________________。
(5)该流程中可循环使用物质的化学式为________。
6.锰废渣的硫酸浸出液含有大量、、以及少量的、、、。通过沉淀-萃取法可以回收其中的锰、钴、镍,流程如图所示。
已知:萃取剂a和b均为有机物,可用通式表示,萃取金属离子时,发生反应:(M代表被萃取的金属)。
(1)的作用是________________________________。
(2)该流程中涉及的实验操作有___________(填字母标号)。
A.过滤 B.蒸发结晶 C.分液 D.蒸馏
(3)加入调的目的是_____________________________。
(4)已知:,,向除铁后的溶液中加入,当溶液中时,___________。(保留1位有效数字)
(5)写出反萃取出的离子方程式_____________________________________。
(6)、利用萃取剂b进行分离,二者萃取率随无机相变化如图所示。无机相的控制在___________左右为宜。
(7)回收液中浓度的测定:取回收液,滴入几滴紫脲酸胺指示剂(遇显橙黄色),用浓度为的溶液进行滴定(),达到滴定终点时消耗溶液的体积。物质的量浓度为___________。
7.锰在汽车电池、高端装备制造、新材料等领域有广泛应用,利用软锰矿(主要成分为,含等杂质)和黄铁矿(主要成分为)联合制备绿矾和高纯并用所得制备的工艺流程如下:
已知:常温下,相关金属离子形成氢氧化物沉淀的如下:
金属离子
开始沉淀的 8.1 6.3 1.5 3.4
沉淀完全的 10.1 8.3 2.8 4.7
回答下列问题:
(1)将软锰矿和黄铁矿预先“粉碎”,并用水调至糊状的目的是_________________,浸渣中除了含不溶于酸的杂质外还有生成的,则“酸浸”时发生主要反应的离子方程式为__________。
(2)常温下,的溶度积__________,“调”的范围为__________。
(3)用相同量的软锰矿制备高纯,“沉锰”时溶液的对最终产量及纯度的影响如下:
①由图可知,时几乎不产生,原因为____________________________。
②“沉锰”时溶液的应调节为__________,过高时可能产生的杂质为__________(填化学式)。
(4)得到绿矾时需要在隔绝氧气的情况下进行一系列操作,原因为______________
____________________________。
(5)“电解”制锰的化学方程式为______________________________________。
8.以接触法制硫酸的废催化剂(主要成分是,含少量、、、NiO等)为原料回收金属化合物的工艺流程如图:
请回答下列问题:
(1)“灼烧”过程中与纯碱反应的化学方程式为_____________________________________。
(2)“除铝”中通入过量,发生反应的离子方程式为_______________________________________。
(3)如图所示曲线Ⅰ、曲线Ⅱ分别表示“沉钒”中钒的沉淀率与加铵系数(K)(指氯化铵与钒元素质量之比)、温度的关系。
最佳“沉钒”条件是________________。温度超过80℃时沉钒率下降的主要原因是__________________________________。
(4)钼酸铵的化学式为。取少量晶体,一定条件下受热分解的热重曲线如图所示:
则597℃时,钼酸铵热分解的产物为_________(填化学式)。钼酸铵在高温下通入可制得单质钼,该过程的化学方程式是______________________________。
(5)“水浸”中浸渣可制备高纯度铁红。操作过程包括酸溶、沉铁等。“沉铁”有两种方法:
方法1:调节溶液pH。
已知:沉铁的滤液中。当时被视为完全沉淀。用溶液调节pH分离、,pH范围为_________。(已知:,)
方法2:结合法。
已知:。从含、的溶液中提取的方法是_________、过滤、洗涤、干燥。
答案以及解析
1.答案:(1)增大接触面积,充分快速氧化,使Ni全都转化为NiO;
(2)
(3)
(4)降;pH降低,浓度增大,萃取平衡逆向移动
(5)
(6)0.5
解析:(1)将废镍催化剂粉碎可以增大反应物接触面积,加快氧化速率,使Ni全都转化为。
(3)由于,而,所以溶液中。
(4)由图乙可知萃取剂的萃取能力随pH的降低而降低。由萃取时的离子方程式可知当pH减小时,增大,平衡逆向移动,所以萃取剂的萃取能力降低。
(6)的物质的量,则由Ni原子守恒可知,,所以。
2.答案:(1)增大焙烧时与碳酸钠、的接触面积,加快反应速率,提高原料利用率
(2)
(3)NiO;
(4)增大浓度,使逆向移动,利于尽可能析出完全
(5)pH过低,转化为的程度较大;pH过高,化为的程度较大;两因素均使沉钒率降低
(6)
(7)
解析:(1)“研磨”的目的为增大焙烧时与碳酸钠、的接触面积,加快反应速率,提高原料利用率。
(2)硫化物焙烧时生成氧化物和二氧化硫,而不能与碳酸钠反应:可与纯碱反应生成对应的钠盐,。
(3)由于不能与碳酸钠反应,故“水浸”时以“浸渣”的形式沉淀出来,而与纯碱反应生成和,沉铝通入生成沉淀和,故"浸渣"的成分为;"滤液2"中的成分除了外,还含有。
(4)"沉钢"的目的是将完全转化为沉淀析出,加入过量的目的是利用同离子效应,促进尽可能析出完全,所以加入过量的,会增大浓度,使逆向移动,有利于尽可能析出完全。
(5)由已知③在水溶液中存在:,pH过低,该平衡正向移动,转化为的程度较大;pH过高,转化为的程度较大;两因素均使沉钒率降低。
(6)由信息和流程可知,沉淀煅烧时分解产生和两种气体,根据氧化还原反应原理可知,其中一种气体为氮气,另外一种只能是氨气,故反应的化学方程式为。
(7)晶胞中位于顶点和面心,一个晶胞中数目为,原子位于晶胞内部1个、棱心12个,一个晶胞中数目为,则晶胞质量为;晶胞中最近的之间的距离为面对角线长度的二分之一为,则晶胞边长为,则晶胞体积为,根据密度为,则。
3.答案:(1)粉碎锗渣,适当加热(或搅拌,适当增大酸、双氧水的浓度)金属离子催化双氧水分解
(2)
(3)增大,浓度增大,不利于萃取
(4)适当加热,加少量碱(合理即可)
(5)A
(6)B
解析:(1)为了加快浸出速率,可以将锗渣粉碎,增大固、液接触面积,也可适当加热或者搅拌,还可适当增大的浓度;由于等金属离子可以催化分解,导致的实际消耗量高于理论值。
(6)根据图乙可看出:在三种浓度的溶液中的反萃取效果均为最佳,故工业上宜选择溶液作为萃取剂。
4.答案:(1)
(2)
(3)
(4)
(5)
(6)温度升高,氨逸出溶液,与浓度下降,平衡逆向移动,导致浓度下降,沉钒率下降(合理即可)
(7)
解析:(1)V为23号元素,基态钒原子的价层电子排布式为。
(5)根据偏钒酸根离子的结构可知,每个V原子连接4个O原子,其中2个O原子被2个V原子共用,另外2个O原子为所连V原子独有,则可知重复结构中N(V):N(O)=1:3,且V元素的化合价为+5价,所以偏钒酸铵的化学式为。
(7)根据反应和所给数据,设的质量分数为w,与反应的的物质的量为 mol,与反应的的物质的量为 mol,可得:
综上可得:。
5.答案:(1)增大菱镁矿与空气的接触面积,提高效率
(2)会导致滤液2中存在,最终产物不纯;
(3)70℃;温度过高草酸易挥发,且易分解;
(4)
(5)
解析:(1)“煅烧1”时,需将菱镁矿粉碎,并在底部鼓入热空气,可增大菱镁矿与空气的接触面积,提高效率;
(3)纳米氧化镁的粒径越小性质越优良,由图可知,70℃时,产物粒径最小;温度不宜过高,温度过高草酸易挥发,且易分解;Mg2+与草酸反应生成草酸镁沉淀,反应离子方程式为:;
(4)煅烧2是将草酸镁煅烧得到MgO,反应的化学方程式为:;
(5)参与反应过程最后又生成的物质可以循环利用,该流程中可循环使用物质的化学式为。
6.答案:(1)氧化
(2)AC
(3)使转化成沉淀除去
(4)0.001
(5)
(6)5.4
(7)0.0250mol/L
解析:(1)根据题意可知,浸出液中含有二价铁,的作用是氧化;
(2)根据流程图可知,该流程涉及的实验过程有过滤,分液,故选AC;
(3)在用二氧化锰将二价铁氧化为三价铁后,加入碳酸钙调节pH使三价铁形成氢氧化铁沉淀,故目的是:使转化成沉淀除去;
(4)当溶液中时,,;
(5)根据信息可知,反萃取剂为酸,则反萃取出是加入适量的酸将锰离子反萃取出来,相应的方程式为:;
(6)根据图中信息可知,pH为5.4左右时,、的萃取率相差较大,故无机相的控制在5.4左右;
(7)根据滴定原理可知,与的物质的量之比为1∶1,则的物质的量为0.1000mol/L×0.0125L=0.00125mol,则的物质的量浓度为。
7.答案:(1)使固体充分混合,提高矿石的利用率;
(2);
(3)时溶液中浓度较低,不足以沉淀;7;
(4)亚铁离子容易被氧气氧化
(5)
解析:(1)将软锰矿和黄铁矿预先“粉碎”,并用水调至糊状的目的是:使固体充分混合,提高矿石的利用率;“浸渣”中除了含有不溶于酸的杂质外,还含有生成的S单质,说明和在酸性条件下发生氧化还原反应生成S、和水,离子方程式为:;
(2)当时,,的溶度积,“调”时沉淀,和不沉淀,范围为;
(3)①由图可知,时几乎不产生,原因:时溶液中浓度较低,不足以沉淀;
②由图可知“沉锰”时溶液的pH适宜控制为7,pH过高时可能产生的杂质为;
(4)得到绿矾时需要在隔绝氧气的情况下进行一系列操作,原因为亚铁离子容易被氧气氧化;
(5)“电解”制锰的化学方程式:。
8.答案:(1)
(2)
(3)K为4、80℃;温度过高,水解程度增大,生成的挥发,降低较快,故沉钒率下降
(4)、、;、
(5);向混合液加入过量氨水
解析:(1)“灼烧”过程中与纯碱反应生成偏钒酸钠和二氧化碳,反应的化学方程式为。
(2)“除铝”中通入过量,四羟基合铝酸钠转化为氢氧化铝,同时生成碳酸氢钠,反应的离子方程式为。
(3)加入溶液调节pH,将钒元素以偏钒酸铵的形式分离出来,根据图像可知,当K在4附近时,沉淀率可达到最大,则K最佳值约为4;再根据钒的沉淀率随温度的变化曲线可知,温度最佳值约为80℃;因为受热易分解,则温度过高因氯化铵分解,同时促进铵根离子水解,溶液中铵根离子浓度下降,会使沉钒率下降。
(4)设少量晶体为1mol,则其质量为340g,在597℃时,固体损失,因为铵盐受热易分解,结合分解前后固体质量变化分析可知,固体损失的质量为2mol与1mol的质量,则余下固体应为,则597℃时,钼酸铵热分解的产物为、和;钼酸铵在高温下通入制单质钼的化学方程式为或、。
(5)铁离子完全沉淀时溶液中;当镍离子开始沉淀时,pH=7.5,即沉铁的pH范围为,根据可知,氢氧化镍能溶于过量的氨水中,氢氧化铁不溶,则从含、的溶液中提取的方法是向混合液加入过量氨水、过滤、洗涤、干燥。
一、图像题类型
1.单一曲线型 2.多重曲线型
解决图像题的基本思路:
(1)会识图:一看面、二看线、三看点(弄清纵、横坐标的含义;弄清起点、拐点、终点的含义;看清曲线的变化趋势)。
(2)会析数:分析数据、图像中隐含的信息,弄清各数据的含义及变化规律,将数据和图像信息加工成化学语言,同时联系化学概念、化学原理等理论知识进行分析解答。
二、表格题类型
解决表格题的关键
(1)理解表格中各个列项中文字、数字信息点的意义,巧妙地将表格语言转换成化学语言。
(2)理顺表格中数据间的变化趋势,联系相关的化学知识,寻找其中的变化规律,快速准确地解决问题。
三、图表信息试题的问题解决的方法归纳:
应用分析归纳的方法,得出表格数据中蕴涵的具有本质性的规律:
应用观察方法,准确理解图示中纵横轴代表的含义,并能结合化学知识分析判断曲线的走向趋势及起点、拐点、水平线含义;
注意信息的情景化:理解所给信息作什么用?
注意信息与基础知识间的有机联系
四、解沉淀溶解平衡图像题三步骤
第一步:明确图像中纵、横坐标的含义。
纵、横坐标通常是难溶物溶解后电离出的离子浓度。
第二步:理解图像中线上点、线外点的含义。
(1)曲线上任意一点都达到了沉淀溶解平衡状态,此时Qc=Ksp。在
温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲
线上变化,不会出现在曲线以外。
(2)曲线上方区域的点均为过饱和溶液,此时Qc>Ksp。
(3)曲线下方区域的点均为不饱和溶液,此时Qc
(1)溶液在蒸发时,离子浓度的变化分两种情况:
①原溶液不饱和时,离子浓度都增大;
②原溶液饱和时,离子浓度都不变。
溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
【针对训练】
1.利用废镍催化剂(主要成分为Ni和NiO,还含有一定量的等)制备水合氢氧化氧镍的工艺流程如图甲:
已知:①Ni能与反应生成NiO;②。回答以下问题:
(1)“焙烧”前,需将废镍催化剂粉碎的目的是_______________________________,滤渣1的成分是______________________。
(2)“酸浸”时,主要反应的离子方程式为__________________________________。
(3)“沉钙”后,欲使,应加溶液使反应后的溶液中________。
(4)“萃取”时,pH对金属离子萃取率的影响如图乙所示:
萃取剂萃取金属离子的原理如下:
萃取剂的萃取能力随pH的降低而_______(填“降低”“不变”或“升高”),其原因是_____________________________________________________。
(5)“氧化”时,生成的离子方程式为__________________________。
(6)取10.1 g纯净干燥的,在空气中加强热,充分反应后生成,则_______。
2.钼系催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧——水浸取法从从废催化剂(主要成分为)中提取和,其工艺流程如图所示。
已知:①均可与纯碱反应生成对应的钠盐,而NiO不行。
②高温下,易分解产生和一种含氮元素的气体。
③溶液的酸性较强时,+5价钒主要以的形式存在
请回答下列问题:
(1)研磨的目的是_______________________________(答出一点即可)。
(2)请写出焙烧过程中与纯碱反应的化学方程式:_______________________。
(3)水浸浸渣的成分为_________(填化学式,下同);“滤液2”中的成分除了外,还含有_____________。
(4)沉钒过程中,一般要加入过量,其原因是_________________________。
(5)沉钒过程中,沉钒率随溶液pH的变化如图所示。沉钒率随溶液pH的增加先升高后降低的原因可能是__________________________________。
(6)沉钒时生成沉淀,请写出“煅烧”中发生反应的化学方程式___________________________________________。
(7)已知NiO的晶体结构如图所示,晶体密度为,晶胞中最近的之间的距离为apm,则阿伏加德罗常数=_______(用含ρ、a的代数式表示)。
3.工业上,以锗渣(主要成分有)为原料提取锗的工艺流程如下:
已知:部分金属阳离子沉淀的如表所示。
金属阳离子
开始沉淀的 7.5 2.3 6.2 8.2
完全沉淀的 9.0 3.2 8.0 11.2
回答下列问题:
(1)“酸浸氧化”中,为了提高浸出速率,宜采用的措施有__________________(答两条)。双氧水实际消耗量远大于理论计算量,其原因可能是_____________________(答一条)。
(2)“滤渣2”的主要成分是__________________(填化学式)。
(3)已知:锗在“萃取分液”中存在平衡:
①,
②。
锗的萃取率与的关系如图所示,时,锗的萃取率逐渐减小的原因是________________________________________________。
(4)已知:“水解”中存在平衡,为了提高平衡水解率,可采用的措施有____________(答两条)。
(5)“水解”获得的“滤液”可循环用于_________(填序号)工序。
A.酸浸氧化 B.调节 C.萃取分液 D.反萃取分液
(6)“反萃取分液”中,反萃取效果与萃取剂的关系如图所示。工业上宜选择的萃取剂是_________(填序号)。
A.硫酸 B.NaOH C.氨水 D.双氧水
4.金属钒主要用于冶炼特种钢,被誉为“合金的维生素”。人们在化工实践中,以富钒炉渣(其中的钒以形式存在,还有少量的等)为原料制备的工艺流程如下:
已知:①酸浸后,转变成。
②钒元素的存在形式较多,部分四价钒和五价钒物种的分布分数与pH的关系如图甲所示。
(1)基态钒原子的价层电子排布式为_________________。
(2)富钒炉渣焙烧后,生成和,写出该反应的化学方程式:_____________________________________。
(3)滤渣成分除外,还有_____(填化学式)。
(4)氧化过程中溶液pH=0,写出该工序发生反应的离子方程式:_________________________________________。
(5)沉钒后得到偏钒酸铵,其阴离子呈如图乙所示的无限链状结构,则偏钒酸铵的化学式为_________。
(6)沉钒时沉钒率随温度变化如图丙,温度高于80 ℃,沉钒率下降的原因可能是____________________________________________。
(7)测定产品中的纯度。称取产品,先用硫酸溶解,得到溶液,再加入溶液(),最后用溶液滴定过量的至终点,消耗溶液的体积为。已知被还原为,假设杂质不参与反应,则产品中(摩尔质量:)的质量分数是____________________________(列出计算式)。
5.纳米氧化镁在陶瓷、催化等领域有着广泛应用。工业上以菱镁矿(主要成分为,含少量、、和铁的氧化物)为原料制备纳米氧化镁的工艺流程如图:
已知:①金属离子开始沉淀和沉淀完全的pH如表所示:
金属离子
开始沉淀的pH 2.7 3.5 8.1 6.3
沉淀完全(离子浓度等于)的pH 3.7 4.7 9.4 8.3
②草酸溶液是一种酸性溶液,有腐蚀作用,还具有一定的挥发性。
③实验证明纳米氧化镁的粒径越小性质越优良。
请按要求完成下列问题:
(1)“煅烧1”时,需将菱镁矿粉碎,并在底部鼓入热空气,该操作的优点是_______________________________________。
(2)“浸出”时若不加入试剂a造成的后果是_____________________。若“调pH”后所得的滤液2中,则________mol/L。
(3)下图是“沉镁”时反应温度对产物粒径影响,则“沉镁”操作中反应的最佳温度为_________,不宜过高,原因为______________________________________。“沉镁”过程中发生反应的离子方程式为_________________________________________。
(4)下图是煅烧2温度对产物二次粒径影响,“煅烧2”时,发生反应的化学方程式为________________________________。
(5)该流程中可循环使用物质的化学式为________。
6.锰废渣的硫酸浸出液含有大量、、以及少量的、、、。通过沉淀-萃取法可以回收其中的锰、钴、镍,流程如图所示。
已知:萃取剂a和b均为有机物,可用通式表示,萃取金属离子时,发生反应:(M代表被萃取的金属)。
(1)的作用是________________________________。
(2)该流程中涉及的实验操作有___________(填字母标号)。
A.过滤 B.蒸发结晶 C.分液 D.蒸馏
(3)加入调的目的是_____________________________。
(4)已知:,,向除铁后的溶液中加入,当溶液中时,___________。(保留1位有效数字)
(5)写出反萃取出的离子方程式_____________________________________。
(6)、利用萃取剂b进行分离,二者萃取率随无机相变化如图所示。无机相的控制在___________左右为宜。
(7)回收液中浓度的测定:取回收液,滴入几滴紫脲酸胺指示剂(遇显橙黄色),用浓度为的溶液进行滴定(),达到滴定终点时消耗溶液的体积。物质的量浓度为___________。
7.锰在汽车电池、高端装备制造、新材料等领域有广泛应用,利用软锰矿(主要成分为,含等杂质)和黄铁矿(主要成分为)联合制备绿矾和高纯并用所得制备的工艺流程如下:
已知:常温下,相关金属离子形成氢氧化物沉淀的如下:
金属离子
开始沉淀的 8.1 6.3 1.5 3.4
沉淀完全的 10.1 8.3 2.8 4.7
回答下列问题:
(1)将软锰矿和黄铁矿预先“粉碎”,并用水调至糊状的目的是_________________,浸渣中除了含不溶于酸的杂质外还有生成的,则“酸浸”时发生主要反应的离子方程式为__________。
(2)常温下,的溶度积__________,“调”的范围为__________。
(3)用相同量的软锰矿制备高纯,“沉锰”时溶液的对最终产量及纯度的影响如下:
①由图可知,时几乎不产生,原因为____________________________。
②“沉锰”时溶液的应调节为__________,过高时可能产生的杂质为__________(填化学式)。
(4)得到绿矾时需要在隔绝氧气的情况下进行一系列操作,原因为______________
____________________________。
(5)“电解”制锰的化学方程式为______________________________________。
8.以接触法制硫酸的废催化剂(主要成分是,含少量、、、NiO等)为原料回收金属化合物的工艺流程如图:
请回答下列问题:
(1)“灼烧”过程中与纯碱反应的化学方程式为_____________________________________。
(2)“除铝”中通入过量,发生反应的离子方程式为_______________________________________。
(3)如图所示曲线Ⅰ、曲线Ⅱ分别表示“沉钒”中钒的沉淀率与加铵系数(K)(指氯化铵与钒元素质量之比)、温度的关系。
最佳“沉钒”条件是________________。温度超过80℃时沉钒率下降的主要原因是__________________________________。
(4)钼酸铵的化学式为。取少量晶体,一定条件下受热分解的热重曲线如图所示:
则597℃时,钼酸铵热分解的产物为_________(填化学式)。钼酸铵在高温下通入可制得单质钼,该过程的化学方程式是______________________________。
(5)“水浸”中浸渣可制备高纯度铁红。操作过程包括酸溶、沉铁等。“沉铁”有两种方法:
方法1:调节溶液pH。
已知:沉铁的滤液中。当时被视为完全沉淀。用溶液调节pH分离、,pH范围为_________。(已知:,)
方法2:结合法。
已知:。从含、的溶液中提取的方法是_________、过滤、洗涤、干燥。
答案以及解析
1.答案:(1)增大接触面积,充分快速氧化,使Ni全都转化为NiO;
(2)
(3)
(4)降;pH降低,浓度增大,萃取平衡逆向移动
(5)
(6)0.5
解析:(1)将废镍催化剂粉碎可以增大反应物接触面积,加快氧化速率,使Ni全都转化为。
(3)由于,而,所以溶液中。
(4)由图乙可知萃取剂的萃取能力随pH的降低而降低。由萃取时的离子方程式可知当pH减小时,增大,平衡逆向移动,所以萃取剂的萃取能力降低。
(6)的物质的量,则由Ni原子守恒可知,,所以。
2.答案:(1)增大焙烧时与碳酸钠、的接触面积,加快反应速率,提高原料利用率
(2)
(3)NiO;
(4)增大浓度,使逆向移动,利于尽可能析出完全
(5)pH过低,转化为的程度较大;pH过高,化为的程度较大;两因素均使沉钒率降低
(6)
(7)
解析:(1)“研磨”的目的为增大焙烧时与碳酸钠、的接触面积,加快反应速率,提高原料利用率。
(2)硫化物焙烧时生成氧化物和二氧化硫,而不能与碳酸钠反应:可与纯碱反应生成对应的钠盐,。
(3)由于不能与碳酸钠反应,故“水浸”时以“浸渣”的形式沉淀出来,而与纯碱反应生成和,沉铝通入生成沉淀和,故"浸渣"的成分为;"滤液2"中的成分除了外,还含有。
(4)"沉钢"的目的是将完全转化为沉淀析出,加入过量的目的是利用同离子效应,促进尽可能析出完全,所以加入过量的,会增大浓度,使逆向移动,有利于尽可能析出完全。
(5)由已知③在水溶液中存在:,pH过低,该平衡正向移动,转化为的程度较大;pH过高,转化为的程度较大;两因素均使沉钒率降低。
(6)由信息和流程可知,沉淀煅烧时分解产生和两种气体,根据氧化还原反应原理可知,其中一种气体为氮气,另外一种只能是氨气,故反应的化学方程式为。
(7)晶胞中位于顶点和面心,一个晶胞中数目为,原子位于晶胞内部1个、棱心12个,一个晶胞中数目为,则晶胞质量为;晶胞中最近的之间的距离为面对角线长度的二分之一为,则晶胞边长为,则晶胞体积为,根据密度为,则。
3.答案:(1)粉碎锗渣,适当加热(或搅拌,适当增大酸、双氧水的浓度)金属离子催化双氧水分解
(2)
(3)增大,浓度增大,不利于萃取
(4)适当加热,加少量碱(合理即可)
(5)A
(6)B
解析:(1)为了加快浸出速率,可以将锗渣粉碎,增大固、液接触面积,也可适当加热或者搅拌,还可适当增大的浓度;由于等金属离子可以催化分解,导致的实际消耗量高于理论值。
(6)根据图乙可看出:在三种浓度的溶液中的反萃取效果均为最佳,故工业上宜选择溶液作为萃取剂。
4.答案:(1)
(2)
(3)
(4)
(5)
(6)温度升高,氨逸出溶液,与浓度下降,平衡逆向移动,导致浓度下降,沉钒率下降(合理即可)
(7)
解析:(1)V为23号元素,基态钒原子的价层电子排布式为。
(5)根据偏钒酸根离子的结构可知,每个V原子连接4个O原子,其中2个O原子被2个V原子共用,另外2个O原子为所连V原子独有,则可知重复结构中N(V):N(O)=1:3,且V元素的化合价为+5价,所以偏钒酸铵的化学式为。
(7)根据反应和所给数据,设的质量分数为w,与反应的的物质的量为 mol,与反应的的物质的量为 mol,可得:
综上可得:。
5.答案:(1)增大菱镁矿与空气的接触面积,提高效率
(2)会导致滤液2中存在,最终产物不纯;
(3)70℃;温度过高草酸易挥发,且易分解;
(4)
(5)
解析:(1)“煅烧1”时,需将菱镁矿粉碎,并在底部鼓入热空气,可增大菱镁矿与空气的接触面积,提高效率;
(3)纳米氧化镁的粒径越小性质越优良,由图可知,70℃时,产物粒径最小;温度不宜过高,温度过高草酸易挥发,且易分解;Mg2+与草酸反应生成草酸镁沉淀,反应离子方程式为:;
(4)煅烧2是将草酸镁煅烧得到MgO,反应的化学方程式为:;
(5)参与反应过程最后又生成的物质可以循环利用,该流程中可循环使用物质的化学式为。
6.答案:(1)氧化
(2)AC
(3)使转化成沉淀除去
(4)0.001
(5)
(6)5.4
(7)0.0250mol/L
解析:(1)根据题意可知,浸出液中含有二价铁,的作用是氧化;
(2)根据流程图可知,该流程涉及的实验过程有过滤,分液,故选AC;
(3)在用二氧化锰将二价铁氧化为三价铁后,加入碳酸钙调节pH使三价铁形成氢氧化铁沉淀,故目的是:使转化成沉淀除去;
(4)当溶液中时,,;
(5)根据信息可知,反萃取剂为酸,则反萃取出是加入适量的酸将锰离子反萃取出来,相应的方程式为:;
(6)根据图中信息可知,pH为5.4左右时,、的萃取率相差较大,故无机相的控制在5.4左右;
(7)根据滴定原理可知,与的物质的量之比为1∶1,则的物质的量为0.1000mol/L×0.0125L=0.00125mol,则的物质的量浓度为。
7.答案:(1)使固体充分混合,提高矿石的利用率;
(2);
(3)时溶液中浓度较低,不足以沉淀;7;
(4)亚铁离子容易被氧气氧化
(5)
解析:(1)将软锰矿和黄铁矿预先“粉碎”,并用水调至糊状的目的是:使固体充分混合,提高矿石的利用率;“浸渣”中除了含有不溶于酸的杂质外,还含有生成的S单质,说明和在酸性条件下发生氧化还原反应生成S、和水,离子方程式为:;
(2)当时,,的溶度积,“调”时沉淀,和不沉淀,范围为;
(3)①由图可知,时几乎不产生,原因:时溶液中浓度较低,不足以沉淀;
②由图可知“沉锰”时溶液的pH适宜控制为7,pH过高时可能产生的杂质为;
(4)得到绿矾时需要在隔绝氧气的情况下进行一系列操作,原因为亚铁离子容易被氧气氧化;
(5)“电解”制锰的化学方程式:。
8.答案:(1)
(2)
(3)K为4、80℃;温度过高,水解程度增大,生成的挥发,降低较快,故沉钒率下降
(4)、、;、
(5);向混合液加入过量氨水
解析:(1)“灼烧”过程中与纯碱反应生成偏钒酸钠和二氧化碳,反应的化学方程式为。
(2)“除铝”中通入过量,四羟基合铝酸钠转化为氢氧化铝,同时生成碳酸氢钠,反应的离子方程式为。
(3)加入溶液调节pH,将钒元素以偏钒酸铵的形式分离出来,根据图像可知,当K在4附近时,沉淀率可达到最大,则K最佳值约为4;再根据钒的沉淀率随温度的变化曲线可知,温度最佳值约为80℃;因为受热易分解,则温度过高因氯化铵分解,同时促进铵根离子水解,溶液中铵根离子浓度下降,会使沉钒率下降。
(4)设少量晶体为1mol,则其质量为340g,在597℃时,固体损失,因为铵盐受热易分解,结合分解前后固体质量变化分析可知,固体损失的质量为2mol与1mol的质量,则余下固体应为,则597℃时,钼酸铵热分解的产物为、和;钼酸铵在高温下通入制单质钼的化学方程式为或、。
(5)铁离子完全沉淀时溶液中;当镍离子开始沉淀时,pH=7.5,即沉铁的pH范围为,根据可知,氢氧化镍能溶于过量的氨水中,氢氧化铁不溶,则从含、的溶液中提取的方法是向混合液加入过量氨水、过滤、洗涤、干燥。
同课章节目录
