1.2.2 分离 提纯-学案(无答案)
文档属性
| 名称 | 1.2.2 分离 提纯-学案(无答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-19 19:25:54 | ||
图片预览



文档简介
第一章 第二节 第一课时
《分离 提纯》学案
【学习目标】
通过对蒸馏、萃取和重结晶基本操作和相关知识的学习,掌握有机物分离提纯的一般方法。
通过具体不同物质的分离和提纯方法的选择,建立“通过物质性质差异选择分离提纯的方法”模型。
通过苯甲酸的实验探究,提高学生类比迁移能力、提取关键信息能力和实验探究能力。
【学习过程】
任务一:提纯工业酒精
【资料1】已知工业乙醇(主要成分是乙醇,含有水、甲醇杂质),通过蒸馏可获得95.6%乙醇和4.4%水的共沸混合物(沸点78.15℃)。共沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
物质 甲醇 乙醇 水
沸点/℃ 64.7 78.5 100
一、蒸馏
1.适用条件
(1)____________有机化合物且该有机化合物__________性较高;
(2)有机化合物的_________与杂质的__________相差较大。
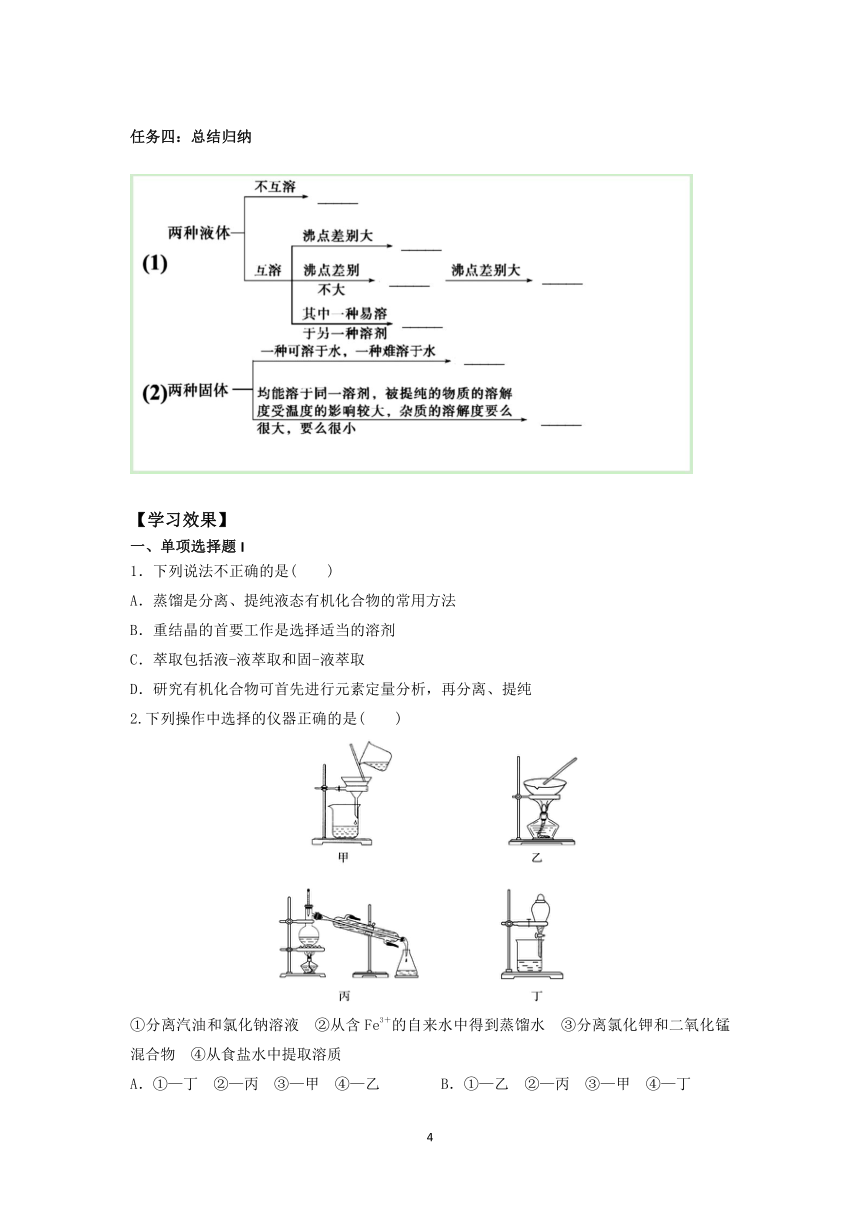
2.蒸馏装置及注意事项
(1)实验装置——写出相应仪器的名称
(2)注意事项
①温度计水银球位置:______________;②加碎瓷片的目的:___________________;
③冷凝管中水的流向:_____________________。
【思考】1.如何获得无水乙醇? 2.固液混合物分离为什么不用过滤而用蒸馏呢?
任务二:从碘水中提取碘单质
【资料2】
二、萃取
类型 液-液萃取:利用待分离组分在两种_____的溶剂中的_______不同,将其从一种溶剂转移到另一种溶剂的过程。
固-液萃取:用_____从______物质中溶解出待分离组分的过程
装置和仪器
萃取剂 对萃取剂的要求: ①萃取剂与原溶剂_________; ②溶质在萃取剂中的溶解度_________在原溶剂中的溶解度; ③萃取剂与原溶液中的成分不反应
常用萃取剂:__________________
分液 定义 将萃取后的两层液体分开的操作
操作 加入萃取剂后充分振荡,静置分层,然后打开分液漏斗上方的玻璃塞和下方的活塞将两层液体分离,下层液体从_______流出,并及时关闭活塞,上层液体从_________倒出
【思考】
1.碘易溶于酒精,能否用酒精将碘水中的碘萃取出来?为什么?
2.分液后应如何分离碘的四氯化碳有机溶液?
(已知:四氯化碳沸点:76.8 ℃ 碘单质沸点:184.35 ℃)
任务三:提纯苯甲酸
【资料3】苯甲酸可用作食品防腐剂,纯净的苯甲酸为无色结晶,其结构可表示为 ,熔点122℃,沸点249℃,苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸、氯化钠在水中的溶解度如下:
温度 25℃ 50℃ 95℃
苯甲酸 0.34g 0.85g 6.8g
NaCl 36.0 37.0 39.1
【思考】某粗苯甲酸样品中含有少量氯化钠和泥沙,如何提纯苯甲酸?
三、重结晶
【思考】
1.结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
2.溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
3.实验操作中多次用到了玻璃棒,分别起到了哪些作用?
如何检验提纯后的苯甲酸中氯化钠已被除净?
任务四:总结归纳
【学习效果】
一、单项选择题I
1.下列说法不正确的是( )
A.蒸馏是分离、提纯液态有机化合物的常用方法
B.重结晶的首要工作是选择适当的溶剂
C.萃取包括液-液萃取和固-液萃取
D.研究有机化合物可首先进行元素定量分析,再分离、提纯
2.下列操作中选择的仪器正确的是( )
①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中得到蒸馏水 ③分离氯化钾和二氧化锰混合物 ④从食盐水中提取溶质
A.①—丁 ②—丙 ③—甲 ④—乙 B.①—乙 ②—丙 ③—甲 ④—丁
C.①—丁 ②—丙 ③—乙 ④—甲 D.①—丙 ②—乙 ③—丁 ④—甲
3.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是
A.在组装蒸馏装置时,温度计的水银球应伸入液面下
B.用96%的工业酒精制取无水乙醇,可采用直接蒸馏的方法
C.在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水
D.在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后,要冷却到常温才过滤
4.下列实验中,所采取的分离方法与对应原理都正确的是
选项 目的 分离方法 原理
A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去KN03固体中混杂的NaCl 重结晶 NaCl在水中的溶解度很大
D 除去丁醇中的乙醇 蒸馏 丁醇与乙醇的沸点相差较大
5.间苯三酚和HCl的甲醇溶液反应生成3,5-二甲氧基苯酚和水。提纯3,5-二甲氧基苯酚时,先分离出甲醇,再加入乙醚进行萃取,分液后得到的有机层用饱和NaHCO3溶液、蒸馏水依次进行洗涤,再经蒸馏、重结晶等操作进行产品的纯化。相关物质的部分物理性质如下表:
物质 沸点/℃ 密度(20 ℃)/(g·cm-3) 溶解性
甲醇 64.7 0.7915 易溶于水
乙醚 34.5 0.7138 微溶于水
下列说法不正确的是
A.分离出甲醇的操作是蒸馏
B.用乙醚萃取后得到的有机层在分液漏斗的下层
C.用饱和NaHCO3溶液洗涤可以除去HCl
D.重结晶除去间苯三酚是利用不同物质在同一溶剂中的溶解度不同而将杂质除去
6.下列实验中,所选装置或实验设计合理的是
A.用图①所示装置可以趁热过滤提纯苯甲酸
B.用图②所示装置可以用乙醇提取溴水中的溴
C.用图③所示装置可以分离苯和甲苯的混合溶液
D.用图④所示装置可除去CO2中混有的少量HCl
7.实验室制溴苯的原理为+Br2+HBr,某实验小组按如图所示流程模拟提纯粗溴苯。
已知:①溴苯与苯互溶;
②各物质的沸点如下:
苯 液溴 溴苯
沸点 80℃ 59℃ 156℃
下列说法正确的是
A.水层①中加入KSCN溶液变红,说明溴化铁已完全被除尽
B.水层②中含有两种盐
C.操作II是分液,操作V是重结晶
D.操作I、IV用到的玻璃仪器不重复
二、单项选择题II
8.精油被誉为西方的中草药,其护肤和调养的功效非常显著。如图是工业常用的精油提取方法,下列说法错误的是
A.该提取方法其原理为蒸馏
B.提取过程中采用了水浴加热
C.在实验室中乙部分可以用蛇形冷凝管代替
D.丙部分利用水与精油的密度差异进行了分离
9.2015年10月,我国科学家屠呦呦获得诺贝尔奖生理学或医学奖,以表彰她发现青蒿素(C15H22O5),显著降低了疟疾患者的死亡率。右下图为青蒿素的分子结构模型和结构简式,则下列相关说法正确的是
A.受“青蒿一握,以水二升渍,绞取汁”启发,屠呦呦使用乙醚提取青蒿素属于化学变化
B.青蒿素分子中氧元素化合价均为+2价
C.青蒿素的发现、提纯、合成及修饰过程中体现了化学学科的重要特征
D.282 g的青蒿素中含碳原子数目为14NA
三、非选择题
10.某化学小组采用类似制乙酸乙酯的装置(如图),由环己醇制备环己烯。
密度/(g·cm-3) 熔点/℃ 沸点/℃ 溶解性
环己醇 0.96 25 161 能溶于水
环己烯 0.81 —103 83 难溶于水
(1)制备粗品:将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_______________________,导管B除了导气外还具有的作用是______________________________。
②试管C置于冰水浴中的目的是_______________________________。
(2)制备精品。
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是_____________________________。
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
《分离 提纯》学案
【学习目标】
通过对蒸馏、萃取和重结晶基本操作和相关知识的学习,掌握有机物分离提纯的一般方法。
通过具体不同物质的分离和提纯方法的选择,建立“通过物质性质差异选择分离提纯的方法”模型。
通过苯甲酸的实验探究,提高学生类比迁移能力、提取关键信息能力和实验探究能力。
【学习过程】
任务一:提纯工业酒精
【资料1】已知工业乙醇(主要成分是乙醇,含有水、甲醇杂质),通过蒸馏可获得95.6%乙醇和4.4%水的共沸混合物(沸点78.15℃)。共沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
物质 甲醇 乙醇 水
沸点/℃ 64.7 78.5 100
一、蒸馏
1.适用条件
(1)____________有机化合物且该有机化合物__________性较高;
(2)有机化合物的_________与杂质的__________相差较大。
2.蒸馏装置及注意事项
(1)实验装置——写出相应仪器的名称
(2)注意事项
①温度计水银球位置:______________;②加碎瓷片的目的:___________________;
③冷凝管中水的流向:_____________________。
【思考】1.如何获得无水乙醇? 2.固液混合物分离为什么不用过滤而用蒸馏呢?
任务二:从碘水中提取碘单质
【资料2】
二、萃取
类型 液-液萃取:利用待分离组分在两种_____的溶剂中的_______不同,将其从一种溶剂转移到另一种溶剂的过程。
固-液萃取:用_____从______物质中溶解出待分离组分的过程
装置和仪器
萃取剂 对萃取剂的要求: ①萃取剂与原溶剂_________; ②溶质在萃取剂中的溶解度_________在原溶剂中的溶解度; ③萃取剂与原溶液中的成分不反应
常用萃取剂:__________________
分液 定义 将萃取后的两层液体分开的操作
操作 加入萃取剂后充分振荡,静置分层,然后打开分液漏斗上方的玻璃塞和下方的活塞将两层液体分离,下层液体从_______流出,并及时关闭活塞,上层液体从_________倒出
【思考】
1.碘易溶于酒精,能否用酒精将碘水中的碘萃取出来?为什么?
2.分液后应如何分离碘的四氯化碳有机溶液?
(已知:四氯化碳沸点:76.8 ℃ 碘单质沸点:184.35 ℃)
任务三:提纯苯甲酸
【资料3】苯甲酸可用作食品防腐剂,纯净的苯甲酸为无色结晶,其结构可表示为 ,熔点122℃,沸点249℃,苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸、氯化钠在水中的溶解度如下:
温度 25℃ 50℃ 95℃
苯甲酸 0.34g 0.85g 6.8g
NaCl 36.0 37.0 39.1
【思考】某粗苯甲酸样品中含有少量氯化钠和泥沙,如何提纯苯甲酸?
三、重结晶
【思考】
1.结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
2.溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
3.实验操作中多次用到了玻璃棒,分别起到了哪些作用?
如何检验提纯后的苯甲酸中氯化钠已被除净?
任务四:总结归纳
【学习效果】
一、单项选择题I
1.下列说法不正确的是( )
A.蒸馏是分离、提纯液态有机化合物的常用方法
B.重结晶的首要工作是选择适当的溶剂
C.萃取包括液-液萃取和固-液萃取
D.研究有机化合物可首先进行元素定量分析,再分离、提纯
2.下列操作中选择的仪器正确的是( )
①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中得到蒸馏水 ③分离氯化钾和二氧化锰混合物 ④从食盐水中提取溶质
A.①—丁 ②—丙 ③—甲 ④—乙 B.①—乙 ②—丙 ③—甲 ④—丁
C.①—丁 ②—丙 ③—乙 ④—甲 D.①—丙 ②—乙 ③—丁 ④—甲
3.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是
A.在组装蒸馏装置时,温度计的水银球应伸入液面下
B.用96%的工业酒精制取无水乙醇,可采用直接蒸馏的方法
C.在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水
D.在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后,要冷却到常温才过滤
4.下列实验中,所采取的分离方法与对应原理都正确的是
选项 目的 分离方法 原理
A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去KN03固体中混杂的NaCl 重结晶 NaCl在水中的溶解度很大
D 除去丁醇中的乙醇 蒸馏 丁醇与乙醇的沸点相差较大
5.间苯三酚和HCl的甲醇溶液反应生成3,5-二甲氧基苯酚和水。提纯3,5-二甲氧基苯酚时,先分离出甲醇,再加入乙醚进行萃取,分液后得到的有机层用饱和NaHCO3溶液、蒸馏水依次进行洗涤,再经蒸馏、重结晶等操作进行产品的纯化。相关物质的部分物理性质如下表:
物质 沸点/℃ 密度(20 ℃)/(g·cm-3) 溶解性
甲醇 64.7 0.7915 易溶于水
乙醚 34.5 0.7138 微溶于水
下列说法不正确的是
A.分离出甲醇的操作是蒸馏
B.用乙醚萃取后得到的有机层在分液漏斗的下层
C.用饱和NaHCO3溶液洗涤可以除去HCl
D.重结晶除去间苯三酚是利用不同物质在同一溶剂中的溶解度不同而将杂质除去
6.下列实验中,所选装置或实验设计合理的是
A.用图①所示装置可以趁热过滤提纯苯甲酸
B.用图②所示装置可以用乙醇提取溴水中的溴
C.用图③所示装置可以分离苯和甲苯的混合溶液
D.用图④所示装置可除去CO2中混有的少量HCl
7.实验室制溴苯的原理为+Br2+HBr,某实验小组按如图所示流程模拟提纯粗溴苯。
已知:①溴苯与苯互溶;
②各物质的沸点如下:
苯 液溴 溴苯
沸点 80℃ 59℃ 156℃
下列说法正确的是
A.水层①中加入KSCN溶液变红,说明溴化铁已完全被除尽
B.水层②中含有两种盐
C.操作II是分液,操作V是重结晶
D.操作I、IV用到的玻璃仪器不重复
二、单项选择题II
8.精油被誉为西方的中草药,其护肤和调养的功效非常显著。如图是工业常用的精油提取方法,下列说法错误的是
A.该提取方法其原理为蒸馏
B.提取过程中采用了水浴加热
C.在实验室中乙部分可以用蛇形冷凝管代替
D.丙部分利用水与精油的密度差异进行了分离
9.2015年10月,我国科学家屠呦呦获得诺贝尔奖生理学或医学奖,以表彰她发现青蒿素(C15H22O5),显著降低了疟疾患者的死亡率。右下图为青蒿素的分子结构模型和结构简式,则下列相关说法正确的是
A.受“青蒿一握,以水二升渍,绞取汁”启发,屠呦呦使用乙醚提取青蒿素属于化学变化
B.青蒿素分子中氧元素化合价均为+2价
C.青蒿素的发现、提纯、合成及修饰过程中体现了化学学科的重要特征
D.282 g的青蒿素中含碳原子数目为14NA
三、非选择题
10.某化学小组采用类似制乙酸乙酯的装置(如图),由环己醇制备环己烯。
密度/(g·cm-3) 熔点/℃ 沸点/℃ 溶解性
环己醇 0.96 25 161 能溶于水
环己烯 0.81 —103 83 难溶于水
(1)制备粗品:将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_______________________,导管B除了导气外还具有的作用是______________________________。
②试管C置于冰水浴中的目的是_______________________________。
(2)制备精品。
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是_____________________________。
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
