北京市第三十五中学2024-2025北学年高一下学期3月月考化学试卷(图片版,含答案)
文档属性
| 名称 | 北京市第三十五中学2024-2025北学年高一下学期3月月考化学试卷(图片版,含答案) |

|
|
| 格式 | |||
| 文件大小 | 794.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-22 13:43:39 | ||
图片预览



文档简介
2025北京三十五中高一 3月月考
化 学
25.3
行政班 教学班 姓名
试卷说明:试卷分值 100,考试时间 60 分钟。I 卷为选择题,包括一、二两个大题,共 30 个小题,
II 卷为主观题,共两个题。
可能用到的原子量 H 1 C 12 N14 O 16 S 32 Na 23 Cl 35.5 Mn 55
I 卷
一、选择题(共 25 个小题,共 70 分。每小题只有 1 个选项符合题意,请.选.择.正.确.答.案.填.在.答.题.卡.相.应.的.
题.号.处.)
1.下列气体过量排放不.会.导致酸雨的是
A.NO2 B.SO2 C.CO2 D.NO
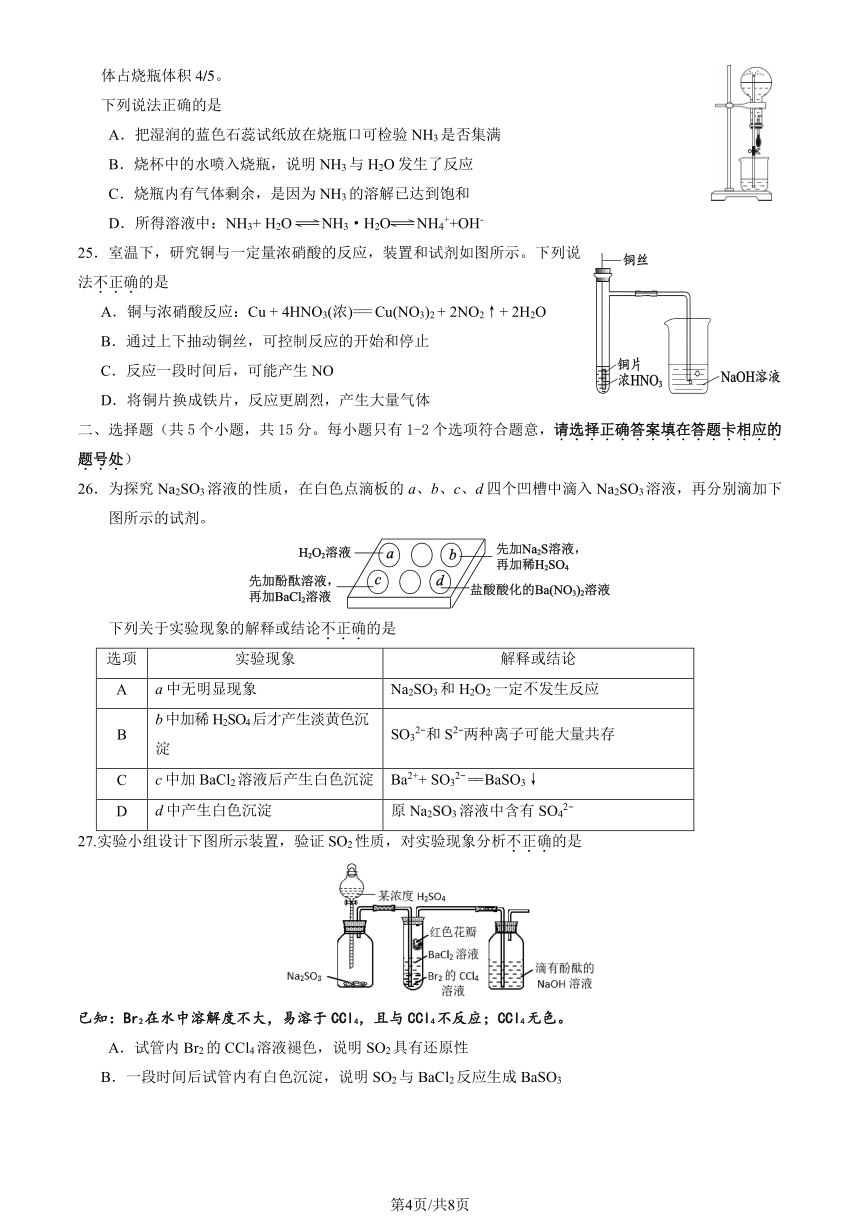
2.下列物质与 Cl2反应,能发出苍白色火焰的是
A.H2 B.Na C.Fe D.Cu
3.下列关于 NO 的描述不.正.确.的是
A.无色气体 B.可用排空气法收集
C.难溶于水 D.由 N2和 O2在雷电作用下合成
4.下列气体中颜色为红棕色的是
A.Cl2 B.NO2 C.NO D.NH3
5.实验室用氢氧化钙和氯化铵固体制备氨,选用的发生装置是
A B C D
6.下列物质中,酸性最强的是
A.H2CO3 B.H2SiO3 C.H3PO4 D.HClO4
7.下列物质中,含有非极性键的是
A. HCl B.H2O C.Na2O2 D.MgCl2
8.P2O5常用作气体的干燥剂,易吸水转化为 H3PO4。下列说法不.正.确.的是
A.P2O5中 P 元素化合价为+5 价 B.P2O5属于碱性氧化物
C.P2O5能与 CaO 反应 D.P2O5能与 NaOH 反应
9.下列操作不.符.合.实验安全要求或实验操作规范的是
A.金属钠着火时,立即用沙土覆盖
第1页/共8页
B.实验结束,将取用后剩余的氢氧化钠固体放回原试剂瓶
C.闻气体的气味时,用手在瓶口轻轻扇动,使少量气体飘进鼻孔
D.稀释浓硫酸时,将浓硫酸沿器壁缓慢倒入水中并用玻璃棒不断搅拌
10.常温下,下列物质可用铁制容器盛装的是
A.盐酸 B.硫酸铜溶液 C.氯化铁溶液 D.浓硫酸
11.下列变化不.涉.及.氧化还原反应的是
A.用 FeCl3溶液刻蚀铜板 B.实验室用 Na2SO3制取 SO2
C.工业用黄铁矿(FeS2)制备硫酸 D.Fe(OH)2在空气中变为红褐色
12.某无色溶液中,下列离子能大量共存的是
3+ + 2- - + + - - A.Fe 、Na 、SO4 、Cl B.Ag 、K 、Cl 、NO3
+ + 2- - + - - +
C.Na 、K 、CO3 、NO3 D.K 、MnO4 、I 、H
13.下列有关物质用途的说法中,不.正.确.的是
A.液氨可用作制冷剂 B.SO2是一种食品添加剂
C.Fe2O3常用作红色颜料 D.Na2O 可用作呼吸面具的供氧剂
14.下列有关浓硫酸的说法不.正.确.的是
A.具有脱水性 B.加热时能与碳反应
C.能用于干燥氨气 D.加热时能与铜反应
粗食盐水中常含有 Ca2+、Mg2+、SO2- 4 等杂质离子,某实验小组用粗食盐水制备 NaCl固体的流程如下图。回
答第 15 ~17 题。
15. ①②③中用到的分离方法是
A. 过滤 B. 冷却 C. 吸附 D. 蒸发
16. 在滤液 1 中,不.可.能.大量存在的离子是
A. Na+ B. Cl- C. OH- D. Mg2+
17. 下列说法正确的是
A. ②中加入的试剂 X 是 BaCl2
B. ③中生成的沉淀 3 的成分只有 CaCO3
C. ④中加入盐酸后,发生的反应仅有 H++OH- ==== H2O
D. 流程中的步骤可以调整为③①②④
18.下列化学用语或图示表达不.正.确.的是
A.Na2O2的电子式:
第2页/共8页
B.基态 Cr 原子的价层电子轨道表示式:
C.氯化钠溶液中的水合离子:
D.电负性:F>O>N
19.下列方程式与所给事实不.相.符.的是
-
A.金属钠与水反应:2Na + 2H2O === 2Na+ + 2OH + H2↑
催化剂
B.氨的催化氧化反应:4NH3 + 5O2 = ====== 4NO + 6H2O △
△
C.铁丝和氯气在加热条件下反应:Fe + Cl2 === FeCl2
D.铜与稀硝酸反应:3Cu+8HNO3 (稀) ==== 3Cu(NO3)2+2NO↑+4H2O
20.下列物质性质不.能.由元素周期律推测的是
A.热稳定性:NH3>PH3 B. 沸点:H2O>HF
C.氧化性:Br2>I2 D. 碱性:NaOH>Mg(OH)2
21.在一定条件下发生下列反应,其中反应后固体质量增加的是
A.氨气还原氧化铜 B.二氧化锰加入过氧化氢溶液中
C.次氯酸钙露置在空气中变质 D.过氧化钠吸收二氧化碳
22. 该反应 2Na 2S2O3+I2===2NaI+ Na2S4O6是定量分析中的常用反应。下列关于说法不.正.确.的是
A. 反应中,I2表现了氧化性
-
B. 反应中,每生成 1 mol Na2S4O6,有 4 mol e 发生转移
C. Na2S2O3是含有共价键的离子化合物
D. Na2S2O3在空气中放置会变质,产物可能有 Na2SO4
23.配制 1100 mL 0.100 mol·L Na2CO3溶液,部分过程示意图如下。
下列说法正确的是
A.步骤 1 中称取的固体为 10.6 g
B.步骤 1中 Na2CO3溶解后,应趁热进行步骤 2
C.若步骤 2烧杯中的液体洒到容量瓶外,则所配溶液 1c(Na2CO3)<0.100 mol L
D.步骤 4 摇匀后,若容量瓶中液面低于刻度线,应再滴加少量蒸馏水至刻度线
24.研究氨的喷泉实验。
①用向下排空气法收集一烧瓶氨;
②如图所示,打开弹簧夹,将滴管中的水挤入烧瓶内,烧杯中的水沿导管进入烧瓶形成喷泉,最终液
第3页/共8页
体占烧瓶体积 4/5。
下列说法正确的是
A.把湿润的蓝色石蕊试纸放在烧瓶口可检验 NH3是否集满
B.烧杯中的水喷入烧瓶,说明 NH3与 H2O 发生了反应
C.烧瓶内有气体剩余,是因为 NH3的溶解已达到饱和
D.所得溶液中:NH +3+ H2O NH3·H2O NH4 +OH-
25.室温下,研究铜与一定量浓硝酸的反应,装置和试剂如图所示。下列说
法不.正.确.的是
A.铜与浓硝酸反应:Cu + 4HNO3(浓)=== Cu(NO3)2 + 2NO2↑+ 2H2O
B.通过上下抽动铜丝,可控制反应的开始和停止
C.反应一段时间后,可能产生 NO
D.将铜片换成铁片,反应更剧烈,产生大量气体
二、选择题(共 5个小题,共 15分。每小题只有 1-2个选项符合题意,请.选.择.正.确.答.案.填.在.答.题.卡.相.应.的.
题.号.处.)
26.为探究 Na2SO3溶液的性质,在白色点滴板的 a、b、c、d 四个凹槽中滴入 Na2SO3溶液,再分别滴加下
图所示的试剂。
下列关于实验现象的解释或结论不.正.确.的是
选项 实验现象 解释或结论
A a 中无明显现象 Na2SO3和 H2O2一定不发生反应
b中加稀 H2SO4后才产生淡黄色沉
B SO 2 3 和 S2 两种离子可能大量共存
淀
C c 中加 BaCl 溶液后产生白色沉淀 Ba2+2 + SO 2 3 == BaSO3↓
D d 中产生白色沉淀 原 Na2SO3溶液中含有 SO 2 4
27.实验小组设计下图所示装置,验证 SO2性质,对实验现象分析不.正.确.的是
已知:Br2在水中溶解度不大,易溶于 CCl4,且与 CCl4不反应;CCl4无色。
A.试管内 Br2的 CCl4溶液褪色,说明 SO2具有还原性
B.一段时间后试管内有白色沉淀,说明 SO2与 BaCl2反应生成 BaSO3
第4页/共8页
C.试管中的红色花瓣褪色,说明 SO2具有漂白性
D.滴有酚酞的 NaOH 溶液红色变浅,说明 SO2能与碱溶液反应
28. 中国科学院科研团队研究表明,在常温常压和可见光下,基于 LDH(一种固体催化剂)合成 NH3 的原
理示意图如右。下列说法不.正.确.的是
A.该过程将太阳能转化成为化学能
B.该过程中,只涉及极性键的断裂与生成
C.氧化剂与还原剂的物质的量之比为 3∶1
D.原料气 N2可通过分离液态空气获得
29.可用 SnCl2-KMnO4滴定法测定赤铁矿(主要成分为 Fe2O3)中铁的含量,主要原理是利用 SnCl2将 Fe3+
转化为 Fe2+
-
,再用 KMnO4标准溶液滴定。为探究 KMnO4溶液滴定时,Cl 在不同 c(H+)下对 Fe2+测定结
果的影响,分别向下列溶液中加入 1 滴 0.1 mol L-1· KMnO4溶液,现象如下表:
溶液 现象
空白实验 2 mL 0.3 mol/LNaCl 溶液 + 0.5 mL 试剂 X 紫红色不褪去
实验 i 2 mL 0.3 mol/LNaCl 溶液 + 0.5 mL 0.3 mol/L 硫酸 紫红色不褪去
实验 ii 2 mL 0.3 mol/L NaCl 溶液 + 0.5 mL 6 mol/L 硫酸 紫红色明显变浅
注:滴定是通过两种溶液的定量反应来确定某种溶质的含量的定量分析实验方法。
下列说法不.正.确.的是
A.SnCl2为氧化剂
B.试剂 X 为蒸馏水
-
C.上述实验说明中性或 c(H+)较低时,Cl 不会干扰 Fe2+含量的测定
D.c(H+)较高时,SnCl2-KMnO4滴定法测定的铁含量偏低
30.实验小组同学探究 SO2与 AgNO3溶液的反应,实验如下:
① 将 SO2通入 AgNO3溶液(pH=5)中,得到无色溶液 A 和白色沉淀 B;
② 取洗涤后的沉淀 B,加入 3 mol/L HNO3,产生的无色气体遇空气变成红棕色;
③ 向溶液 A 中滴入过量盐酸,产生白色沉淀;取上层清液继续滴加 BaCl2溶液,未出现白色沉淀。
已知:ⅰ.经分析,沉淀 B 可能为 Ag2SO3、Ag2SO4或二者混合物
ⅱ.Ag2SO4微溶于水,Ag2SO3难溶于水
下列说法不.正.确.的是
A.通过测溶液 A 的 pH 可以判断①中硫元素是否被氧化
B.通过②可知:沉淀 B 具有还原性
C.③中加入过量盐酸的目的主要是除去溶液 A 中的 Ag+
D.通过上述实验可判断①中所得白色沉淀中有 Ag2SO4
II 卷
31.(7 分)铵盐和硝酸是重要的化工原料。
(1)铵盐可以作化肥。
第5页/共8页
①NH4NO3是含氮量较高的氮肥,可由 HNO3和 (填化学式)直接制取。
②写出工业合成氨的化学方程式
③检验某化肥中含有 +NH4 :取少量样品于试管中,加少量水溶解,再加入浓
+
NaOH 溶液,加热,产生的气体能使 ,说明含有 NH4 。
(2)利用硝酸制备硝酸铜。
某工厂利用固体废渣(主要含 Cu 和 CuO,还含有少量 Cu2O 和 SiO2)制取 Cu(NO3)2·3H2O
的部分工艺流程如图。
+ +
已知:①Cu 在酸性溶液中不稳定,会转变成 Cu 和 Cu2 。
②SiO2是酸性氧化物,难溶于水和酸。
①写出酸溶过程中产生 NO 的离子方程式 。
②试剂 X 应选用 (填序号)。
A.NaOH B.Cu(OH)2 C.CuO
③若除酸时加入的 X 恰好完全反应,则过滤后所得废渣的成分为 。
④将酸溶使用的稀硝酸改为 10% H2O2和 20%稀硝酸的混合液,其中 H2O2作氧化剂,基本无
氮氧化物排放,写出固体废渣中Cu 与该混合液反应的离子方程式 。
32.(8 分)
氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有
CoO(OH) 、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备
Co2O3的部分工艺过程如下:
Ⅰ.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡。
Ⅱ.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过
滤,分离除去沉淀a [主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b。
Ⅳ.Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
Ⅴ.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在
400 ℃~600 ℃煅烧,即得到Co2O3。
请回答:
(1)Ⅰ中,稀硫酸溶解CoCO3的化学方程式是________,加入Na2SO3溶液的主要作用是________。
(2)根据图1、图2分析:
第6页/共8页
图 1 浸出温度对铜、钴浸出率的影响 图 2 浸出 pH 对铜、钴浸出率的影响
①矿石粉末浸泡的适宜条件应是________。
(3)Ⅱ中,浸出液中的金属离子与NaClO3反应的离子方程式:
(4)Ⅱ、Ⅳ中,加入Na2CO3 的作用分别是________、________。
(5)Ⅲ中,沉淀b的成分是MgF2 、________(填化学式)。
第7页/共8页
参考答案
一、单项选择,1-5 每题 2 分,6-25 每题 3 分,共 70 分。
二、不定项 26-30,每题 3 分,少选给 1 分,错选多选均 0 分,共 15 分。
1 2 3 4 5 6 7 8 9 10
C A B B A D C B B D
11 12 13 14 15 16 17 18 19 20
B C D C A D A C C B
21 22 23 24 25 26 27 28 29 30
D B C D D AD B BC AD AD
31.(7 分)每空 1 分。
(1)① NH3
催化剂
② N2+3H2 2NH高温高压 3
③ 再加入浓 NaOH 溶液,加热,若产生的气体能使润的红色石蕊试纸变蓝
(2)① 3Cu + 2NO
-
3 + 8H
+ === 3Cu2+ + 2NO↑+ 4H2O
② B C
③ SiO2
④ Cu + H2O2+ 2H+ === Cu2+ + 2H2O
32.(8 分)
(1)CoCO3 + H2SO4 == CoSO4 + CO2↑+ H2O 1分
将Co3+还原为Co2+(或作还原剂) 1分
(2)①65 ℃~75 ℃ 1 分、 pH 0.5~1.5 1 分
(3)ClO 3 + 6Fe2+ + 6H+ == Cl
+ 6Fe3+ + 3H2O 1分
(4)调节溶液的 pH (1 分) 生成 CoCO3沉淀(1 分)
(5)CaF2 (1 分)
第8页/共8页
化 学
25.3
行政班 教学班 姓名
试卷说明:试卷分值 100,考试时间 60 分钟。I 卷为选择题,包括一、二两个大题,共 30 个小题,
II 卷为主观题,共两个题。
可能用到的原子量 H 1 C 12 N14 O 16 S 32 Na 23 Cl 35.5 Mn 55
I 卷
一、选择题(共 25 个小题,共 70 分。每小题只有 1 个选项符合题意,请.选.择.正.确.答.案.填.在.答.题.卡.相.应.的.
题.号.处.)
1.下列气体过量排放不.会.导致酸雨的是
A.NO2 B.SO2 C.CO2 D.NO
2.下列物质与 Cl2反应,能发出苍白色火焰的是
A.H2 B.Na C.Fe D.Cu
3.下列关于 NO 的描述不.正.确.的是
A.无色气体 B.可用排空气法收集
C.难溶于水 D.由 N2和 O2在雷电作用下合成
4.下列气体中颜色为红棕色的是
A.Cl2 B.NO2 C.NO D.NH3
5.实验室用氢氧化钙和氯化铵固体制备氨,选用的发生装置是
A B C D
6.下列物质中,酸性最强的是
A.H2CO3 B.H2SiO3 C.H3PO4 D.HClO4
7.下列物质中,含有非极性键的是
A. HCl B.H2O C.Na2O2 D.MgCl2
8.P2O5常用作气体的干燥剂,易吸水转化为 H3PO4。下列说法不.正.确.的是
A.P2O5中 P 元素化合价为+5 价 B.P2O5属于碱性氧化物
C.P2O5能与 CaO 反应 D.P2O5能与 NaOH 反应
9.下列操作不.符.合.实验安全要求或实验操作规范的是
A.金属钠着火时,立即用沙土覆盖
第1页/共8页
B.实验结束,将取用后剩余的氢氧化钠固体放回原试剂瓶
C.闻气体的气味时,用手在瓶口轻轻扇动,使少量气体飘进鼻孔
D.稀释浓硫酸时,将浓硫酸沿器壁缓慢倒入水中并用玻璃棒不断搅拌
10.常温下,下列物质可用铁制容器盛装的是
A.盐酸 B.硫酸铜溶液 C.氯化铁溶液 D.浓硫酸
11.下列变化不.涉.及.氧化还原反应的是
A.用 FeCl3溶液刻蚀铜板 B.实验室用 Na2SO3制取 SO2
C.工业用黄铁矿(FeS2)制备硫酸 D.Fe(OH)2在空气中变为红褐色
12.某无色溶液中,下列离子能大量共存的是
3+ + 2- - + + - - A.Fe 、Na 、SO4 、Cl B.Ag 、K 、Cl 、NO3
+ + 2- - + - - +
C.Na 、K 、CO3 、NO3 D.K 、MnO4 、I 、H
13.下列有关物质用途的说法中,不.正.确.的是
A.液氨可用作制冷剂 B.SO2是一种食品添加剂
C.Fe2O3常用作红色颜料 D.Na2O 可用作呼吸面具的供氧剂
14.下列有关浓硫酸的说法不.正.确.的是
A.具有脱水性 B.加热时能与碳反应
C.能用于干燥氨气 D.加热时能与铜反应
粗食盐水中常含有 Ca2+、Mg2+、SO2- 4 等杂质离子,某实验小组用粗食盐水制备 NaCl固体的流程如下图。回
答第 15 ~17 题。
15. ①②③中用到的分离方法是
A. 过滤 B. 冷却 C. 吸附 D. 蒸发
16. 在滤液 1 中,不.可.能.大量存在的离子是
A. Na+ B. Cl- C. OH- D. Mg2+
17. 下列说法正确的是
A. ②中加入的试剂 X 是 BaCl2
B. ③中生成的沉淀 3 的成分只有 CaCO3
C. ④中加入盐酸后,发生的反应仅有 H++OH- ==== H2O
D. 流程中的步骤可以调整为③①②④
18.下列化学用语或图示表达不.正.确.的是
A.Na2O2的电子式:
第2页/共8页
B.基态 Cr 原子的价层电子轨道表示式:
C.氯化钠溶液中的水合离子:
D.电负性:F>O>N
19.下列方程式与所给事实不.相.符.的是
-
A.金属钠与水反应:2Na + 2H2O === 2Na+ + 2OH + H2↑
催化剂
B.氨的催化氧化反应:4NH3 + 5O2 = ====== 4NO + 6H2O △
△
C.铁丝和氯气在加热条件下反应:Fe + Cl2 === FeCl2
D.铜与稀硝酸反应:3Cu+8HNO3 (稀) ==== 3Cu(NO3)2+2NO↑+4H2O
20.下列物质性质不.能.由元素周期律推测的是
A.热稳定性:NH3>PH3 B. 沸点:H2O>HF
C.氧化性:Br2>I2 D. 碱性:NaOH>Mg(OH)2
21.在一定条件下发生下列反应,其中反应后固体质量增加的是
A.氨气还原氧化铜 B.二氧化锰加入过氧化氢溶液中
C.次氯酸钙露置在空气中变质 D.过氧化钠吸收二氧化碳
22. 该反应 2Na 2S2O3+I2===2NaI+ Na2S4O6是定量分析中的常用反应。下列关于说法不.正.确.的是
A. 反应中,I2表现了氧化性
-
B. 反应中,每生成 1 mol Na2S4O6,有 4 mol e 发生转移
C. Na2S2O3是含有共价键的离子化合物
D. Na2S2O3在空气中放置会变质,产物可能有 Na2SO4
23.配制 1100 mL 0.100 mol·L Na2CO3溶液,部分过程示意图如下。
下列说法正确的是
A.步骤 1 中称取的固体为 10.6 g
B.步骤 1中 Na2CO3溶解后,应趁热进行步骤 2
C.若步骤 2烧杯中的液体洒到容量瓶外,则所配溶液 1c(Na2CO3)<0.100 mol L
D.步骤 4 摇匀后,若容量瓶中液面低于刻度线,应再滴加少量蒸馏水至刻度线
24.研究氨的喷泉实验。
①用向下排空气法收集一烧瓶氨;
②如图所示,打开弹簧夹,将滴管中的水挤入烧瓶内,烧杯中的水沿导管进入烧瓶形成喷泉,最终液
第3页/共8页
体占烧瓶体积 4/5。
下列说法正确的是
A.把湿润的蓝色石蕊试纸放在烧瓶口可检验 NH3是否集满
B.烧杯中的水喷入烧瓶,说明 NH3与 H2O 发生了反应
C.烧瓶内有气体剩余,是因为 NH3的溶解已达到饱和
D.所得溶液中:NH +3+ H2O NH3·H2O NH4 +OH-
25.室温下,研究铜与一定量浓硝酸的反应,装置和试剂如图所示。下列说
法不.正.确.的是
A.铜与浓硝酸反应:Cu + 4HNO3(浓)=== Cu(NO3)2 + 2NO2↑+ 2H2O
B.通过上下抽动铜丝,可控制反应的开始和停止
C.反应一段时间后,可能产生 NO
D.将铜片换成铁片,反应更剧烈,产生大量气体
二、选择题(共 5个小题,共 15分。每小题只有 1-2个选项符合题意,请.选.择.正.确.答.案.填.在.答.题.卡.相.应.的.
题.号.处.)
26.为探究 Na2SO3溶液的性质,在白色点滴板的 a、b、c、d 四个凹槽中滴入 Na2SO3溶液,再分别滴加下
图所示的试剂。
下列关于实验现象的解释或结论不.正.确.的是
选项 实验现象 解释或结论
A a 中无明显现象 Na2SO3和 H2O2一定不发生反应
b中加稀 H2SO4后才产生淡黄色沉
B SO 2 3 和 S2 两种离子可能大量共存
淀
C c 中加 BaCl 溶液后产生白色沉淀 Ba2+2 + SO 2 3 == BaSO3↓
D d 中产生白色沉淀 原 Na2SO3溶液中含有 SO 2 4
27.实验小组设计下图所示装置,验证 SO2性质,对实验现象分析不.正.确.的是
已知:Br2在水中溶解度不大,易溶于 CCl4,且与 CCl4不反应;CCl4无色。
A.试管内 Br2的 CCl4溶液褪色,说明 SO2具有还原性
B.一段时间后试管内有白色沉淀,说明 SO2与 BaCl2反应生成 BaSO3
第4页/共8页
C.试管中的红色花瓣褪色,说明 SO2具有漂白性
D.滴有酚酞的 NaOH 溶液红色变浅,说明 SO2能与碱溶液反应
28. 中国科学院科研团队研究表明,在常温常压和可见光下,基于 LDH(一种固体催化剂)合成 NH3 的原
理示意图如右。下列说法不.正.确.的是
A.该过程将太阳能转化成为化学能
B.该过程中,只涉及极性键的断裂与生成
C.氧化剂与还原剂的物质的量之比为 3∶1
D.原料气 N2可通过分离液态空气获得
29.可用 SnCl2-KMnO4滴定法测定赤铁矿(主要成分为 Fe2O3)中铁的含量,主要原理是利用 SnCl2将 Fe3+
转化为 Fe2+
-
,再用 KMnO4标准溶液滴定。为探究 KMnO4溶液滴定时,Cl 在不同 c(H+)下对 Fe2+测定结
果的影响,分别向下列溶液中加入 1 滴 0.1 mol L-1· KMnO4溶液,现象如下表:
溶液 现象
空白实验 2 mL 0.3 mol/LNaCl 溶液 + 0.5 mL 试剂 X 紫红色不褪去
实验 i 2 mL 0.3 mol/LNaCl 溶液 + 0.5 mL 0.3 mol/L 硫酸 紫红色不褪去
实验 ii 2 mL 0.3 mol/L NaCl 溶液 + 0.5 mL 6 mol/L 硫酸 紫红色明显变浅
注:滴定是通过两种溶液的定量反应来确定某种溶质的含量的定量分析实验方法。
下列说法不.正.确.的是
A.SnCl2为氧化剂
B.试剂 X 为蒸馏水
-
C.上述实验说明中性或 c(H+)较低时,Cl 不会干扰 Fe2+含量的测定
D.c(H+)较高时,SnCl2-KMnO4滴定法测定的铁含量偏低
30.实验小组同学探究 SO2与 AgNO3溶液的反应,实验如下:
① 将 SO2通入 AgNO3溶液(pH=5)中,得到无色溶液 A 和白色沉淀 B;
② 取洗涤后的沉淀 B,加入 3 mol/L HNO3,产生的无色气体遇空气变成红棕色;
③ 向溶液 A 中滴入过量盐酸,产生白色沉淀;取上层清液继续滴加 BaCl2溶液,未出现白色沉淀。
已知:ⅰ.经分析,沉淀 B 可能为 Ag2SO3、Ag2SO4或二者混合物
ⅱ.Ag2SO4微溶于水,Ag2SO3难溶于水
下列说法不.正.确.的是
A.通过测溶液 A 的 pH 可以判断①中硫元素是否被氧化
B.通过②可知:沉淀 B 具有还原性
C.③中加入过量盐酸的目的主要是除去溶液 A 中的 Ag+
D.通过上述实验可判断①中所得白色沉淀中有 Ag2SO4
II 卷
31.(7 分)铵盐和硝酸是重要的化工原料。
(1)铵盐可以作化肥。
第5页/共8页
①NH4NO3是含氮量较高的氮肥,可由 HNO3和 (填化学式)直接制取。
②写出工业合成氨的化学方程式
③检验某化肥中含有 +NH4 :取少量样品于试管中,加少量水溶解,再加入浓
+
NaOH 溶液,加热,产生的气体能使 ,说明含有 NH4 。
(2)利用硝酸制备硝酸铜。
某工厂利用固体废渣(主要含 Cu 和 CuO,还含有少量 Cu2O 和 SiO2)制取 Cu(NO3)2·3H2O
的部分工艺流程如图。
+ +
已知:①Cu 在酸性溶液中不稳定,会转变成 Cu 和 Cu2 。
②SiO2是酸性氧化物,难溶于水和酸。
①写出酸溶过程中产生 NO 的离子方程式 。
②试剂 X 应选用 (填序号)。
A.NaOH B.Cu(OH)2 C.CuO
③若除酸时加入的 X 恰好完全反应,则过滤后所得废渣的成分为 。
④将酸溶使用的稀硝酸改为 10% H2O2和 20%稀硝酸的混合液,其中 H2O2作氧化剂,基本无
氮氧化物排放,写出固体废渣中Cu 与该混合液反应的离子方程式 。
32.(8 分)
氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有
CoO(OH) 、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备
Co2O3的部分工艺过程如下:
Ⅰ.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡。
Ⅱ.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过
滤,分离除去沉淀a [主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b。
Ⅳ.Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
Ⅴ.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在
400 ℃~600 ℃煅烧,即得到Co2O3。
请回答:
(1)Ⅰ中,稀硫酸溶解CoCO3的化学方程式是________,加入Na2SO3溶液的主要作用是________。
(2)根据图1、图2分析:
第6页/共8页
图 1 浸出温度对铜、钴浸出率的影响 图 2 浸出 pH 对铜、钴浸出率的影响
①矿石粉末浸泡的适宜条件应是________。
(3)Ⅱ中,浸出液中的金属离子与NaClO3反应的离子方程式:
(4)Ⅱ、Ⅳ中,加入Na2CO3 的作用分别是________、________。
(5)Ⅲ中,沉淀b的成分是MgF2 、________(填化学式)。
第7页/共8页
参考答案
一、单项选择,1-5 每题 2 分,6-25 每题 3 分,共 70 分。
二、不定项 26-30,每题 3 分,少选给 1 分,错选多选均 0 分,共 15 分。
1 2 3 4 5 6 7 8 9 10
C A B B A D C B B D
11 12 13 14 15 16 17 18 19 20
B C D C A D A C C B
21 22 23 24 25 26 27 28 29 30
D B C D D AD B BC AD AD
31.(7 分)每空 1 分。
(1)① NH3
催化剂
② N2+3H2 2NH高温高压 3
③ 再加入浓 NaOH 溶液,加热,若产生的气体能使润的红色石蕊试纸变蓝
(2)① 3Cu + 2NO
-
3 + 8H
+ === 3Cu2+ + 2NO↑+ 4H2O
② B C
③ SiO2
④ Cu + H2O2+ 2H+ === Cu2+ + 2H2O
32.(8 分)
(1)CoCO3 + H2SO4 == CoSO4 + CO2↑+ H2O 1分
将Co3+还原为Co2+(或作还原剂) 1分
(2)①65 ℃~75 ℃ 1 分、 pH 0.5~1.5 1 分
(3)ClO 3 + 6Fe2+ + 6H+ == Cl
+ 6Fe3+ + 3H2O 1分
(4)调节溶液的 pH (1 分) 生成 CoCO3沉淀(1 分)
(5)CaF2 (1 分)
第8页/共8页
同课章节目录
