第四章 化学反应与电能 第一节 原电池原电池学案(无答案)高中化学 人教版(2019) 选择性必修1
文档属性
| 名称 | 第四章 化学反应与电能 第一节 原电池原电池学案(无答案)高中化学 人教版(2019) 选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-22 21:00:22 | ||
图片预览


文档简介
课题:第四章第一节 原电池
【学习目标】知识目标:能记住原电池概念、原理、组成及应用
能力目标:能说出化学能与电能相互转化的过程
【学习重点、难点】通过对原电池实验的研究,从电子转移角度理解化学能向电能转化的本质,以及这种转化的综合利用价值。
【学习过程】 自学教材P71~72,完成学案.
【课始检测】
1、原电池是______________________的装置。原电池反应的本质是____________反应。
2、如右图所示,组成的原电池,写出电极名称、电极反应式:
(1)当电解质溶液为稀H2SO4时:
(2)当电解质溶液为CuSO4溶液时:
【学习新知识】
一、对锌铜原电池工作原理的进一步探究
【自学指导一】观察实验4-1,说出实验现象。
【思考与交流】:上述原电池装置是将 反应的化学能转换成电能的,指出电池的正负极,并分别写出其中负极和正极的电极反应式以及该电池的总反应方程式。
负极( 片):
正极( 片):
电池反应(总化学方程式):
【思考与交流】改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?[附:盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。2)将KCl或NH4NO3的饱和溶液装入U形管,用棉花堵住管口即可]产生持续、稳定的电流的原因 .
盐桥的作用 .
二、由两个半电池组成原电池的工作原理
(1)把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
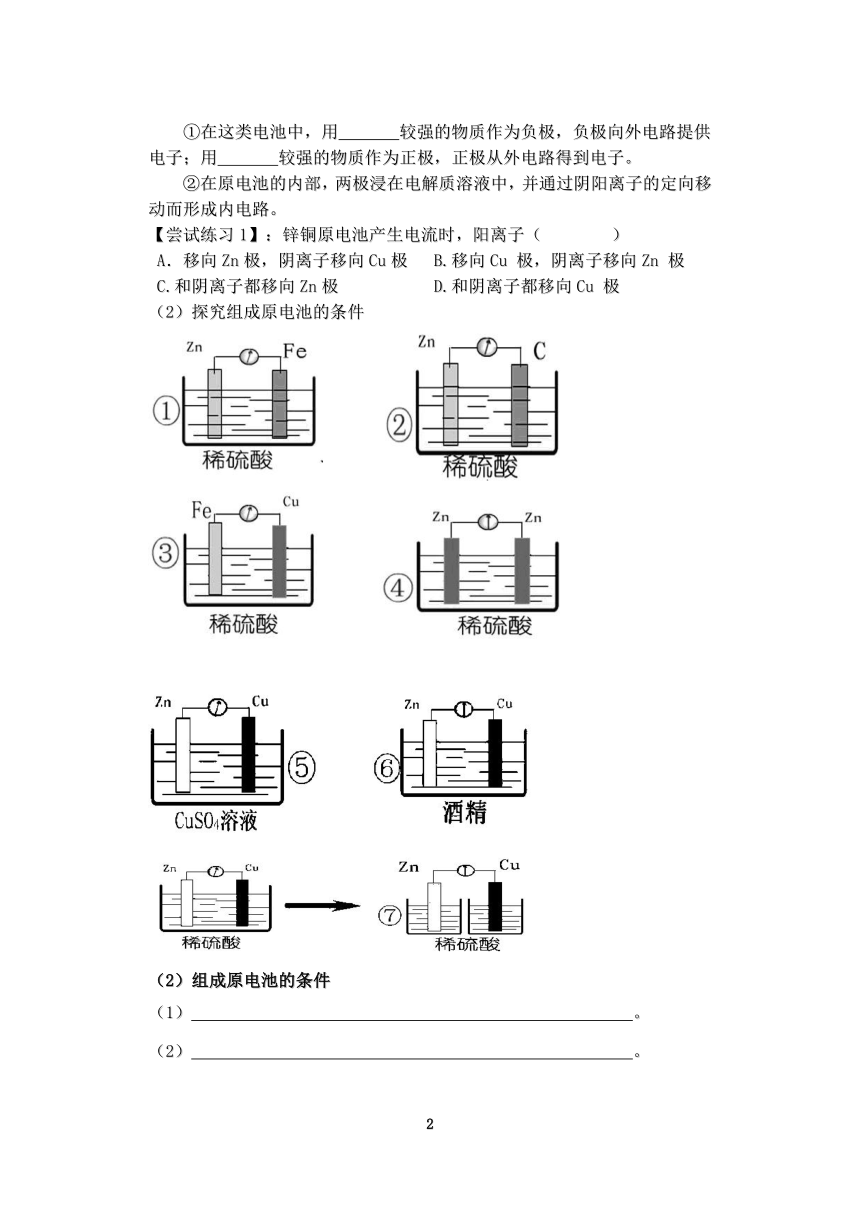
①在这类电池中,用 较强的物质作为负极,负极向外电路提供电子;用 较强的物质作为正极,正极从外电路得到电子。
②在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向移动而形成内电路。
【尝试练习1】:锌铜原电池产生电流时,阳离子( )
A.移向Zn极,阴离子移向Cu极 B.移向Cu 极,阴离子移向Zn 极
C.和阴离子都移向Zn极 D.和阴离子都移向Cu 极
(2)探究组成原电池的条件
(2)组成原电池的条件
(1) 。
(2) 。
(3) 。
(4)内部条件: 。
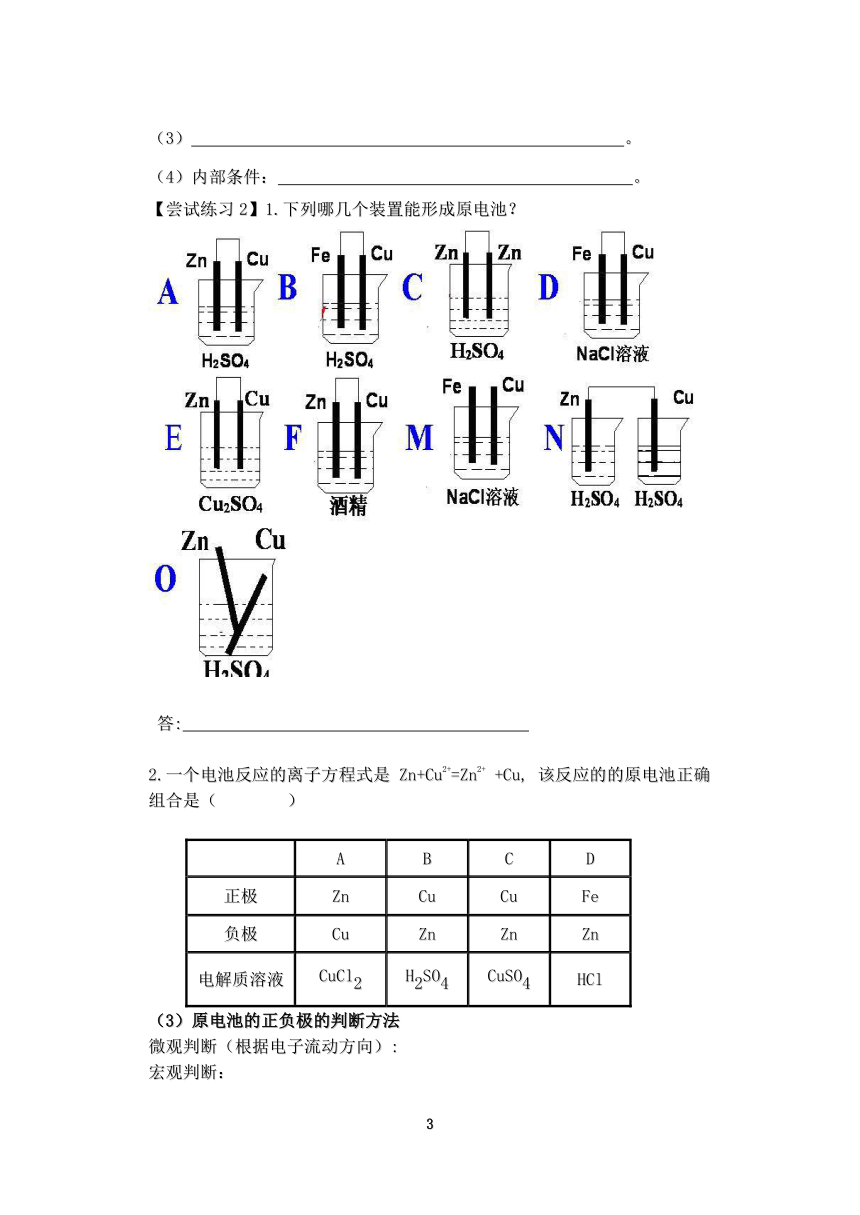
【尝试练习2】1.下列哪几个装置能形成原电池?
答:
2.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu, 该反应的的原电池正确组合是( )
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
(3)原电池的正负极的判断方法
微观判断(根据电子流动方向):
宏观判断:
①根据电极材料:
②根据原电池电极发生的反应:
③根据电极增重还是减重:
④根据电极有气泡冒出:
【尝试练习3】
1.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
2.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )
A.不变 B先变大后变小 C逐渐变大 D.逐渐变小
3.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 ( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
4. 请根据氧化还原反应 :Cu +2 Fe3+ = Cu2+ + 2Fe2+设计成原电池。并画出装置图指出正、负极,标出电子的流向。
负极: 正极:
电解质溶液:
若是采用烧杯和盐桥装置图,
采用的电解质溶液又是什么?
试画出原电池的装置简图。
三、原电池的主要应用:
1.利用原电池原理设计新型化学电池;
2.改变化学反应速率,如实验室用粗锌与硫酸反应制取氢气;
3.进行金属活动性强弱比较;
4.电化学保护法,即将金属作为原电池的正极而受到保护。如在铁器表面镀锌。
5.解释某些化学现象
【达标练习】
(1)比较金属活动性强弱。
练习1:下列叙述中,可以说明金属甲比乙活泼性强的是( )
A.甲和乙用导线连接插入盐酸溶液中乙溶解,甲上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
C.将甲乙作电极组成原电池时甲是负极;
D.同价态的阳离子,甲比乙的氧化性强;
(2)比较反应速率
练习2 :下列制氢气的反应速率最快的是( )
A纯锌和1mol/L 硫酸;
B纯锌和18 mol/L 硫酸;
C粗锌和 1mol/L 盐酸;
D粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。
(3)比较金属腐蚀的快慢
练习3:下列各情况,在其中Fe片腐蚀由快到慢的顺序是
练习4:下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
(4)判断溶液pH值变化
(5)原电池原理的综合应用
【拓展练习】(1)若烧杯中溶液为稀硫酸,
则观察到的现象:
两极反
应式为:正极
;负极 。
(2)若烧杯中溶液为氢氧化钠溶液,则观察到的现象
则负极为 ,
总反应方程为 。该装置是将 能转化为 能。
【小 结】原电池
1、定义:
2、原电池的工作原理
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。
(1)由两个半电池组成的锌铜原电池的工作原理
(2)形成原电池的条件
(3)原电池的正负极的判断方法
(4)电极材料的选择(电池的电极必须导电)
【课后作业】
一、选择题
.下列各变化中属于原电池反应的是
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓HNO3比稀HNO3更能氧化金属铜
.将等质量的两份锌粉a、b,分别加入过量的稀硫酸,同时向a中加少许胆矾晶体,下列各图表示产生氢气的体积V(升)与时间t(分)的关系,其中正确的是
.实验室有下列试剂①浓H2SO4 、②稀H2SO4、 ③稀HNO3 、④浓盐酸、⑤含硫、磷杂质的锌粒、⑥纯锌、⑦CuSO4溶液,为快速制取较纯的H2,试剂的最佳选择是
A.①⑥ B.③⑤ C.④⑥⑦ D.②⑥⑦
.下列关于金属腐蚀的说法正确的是
A.金属在潮湿空气中腐蚀的实质是:M + nH2O = M(OH)n + n/2 H2↑
B.金属的化学腐蚀的实质是M – n e- = M n+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀
.下列事实不用电化学理论解释的是
A.轮船水线以下的船壳上装一定数量的锌块
B.铝片不用特殊方法保护
C.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D.镀锌铁比镀锡铁耐用
.对右图所示装置的叙述,正确的是
A.Cu是负极,Cu片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
.电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液。电池总反应式为:Zn+Ag2O=ZnO+2Ag, 下列说法错误的是
A.该电池的正极是Zn,负极是Ag2O
B.该电池负极的电极反应式为:Zn+2OH―—2e―=ZnO+H2O
C.理论上该电池工作一段时间后,溶液中KOH的浓度不变
D.该电池工作时,电解质中的阴离子向负极移动
.钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H++2e―=H2 B.Fe2++2e―=Fe
C.2H2O+O2+4 e―=4OH― D.Fe3++e―=Fe2+
.把a、b、c、d四块金属板浸入稀H2SO4中,用导线两两相连,可以形成原电池。若a.b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c极上产生大量气泡,b、d相连时,b极上有大量气泡。则四块金属的活动顺序是
A.a>c>d>b B.c>a>b>d
C.a>c>b>d D.c>a>d>b
.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l) Zn(OH)2 (s)+Mn2O3(s)下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e—=Mn2O3(s)+2OH—(aq)
C.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
D.电池工作时,电子由正极通过外电路流向负极
.下列化学反应的化学能可直接转变成电能的是
A.2FeCl3+Cu=CuCl2+2FeCl2
B.AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
C.2Fe(OH)3 Fe2O3+3H2O
D.Na2O+CO2=Na2CO3
.下列产品的使用不会对环境造成明显污染的是
A.含磷洗衣粉 B.氢氧燃烧电池 C.氟利昂 D.含汞电池
.在盛有稀 H2SO4 的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A.正极附近的 SO4 2- 离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
Zn
Cu
×
V
a
b
A
t
V
a
b
B
t
V
b
a
C
t
V
a
b
D
t
PAGE
1
【学习目标】知识目标:能记住原电池概念、原理、组成及应用
能力目标:能说出化学能与电能相互转化的过程
【学习重点、难点】通过对原电池实验的研究,从电子转移角度理解化学能向电能转化的本质,以及这种转化的综合利用价值。
【学习过程】 自学教材P71~72,完成学案.
【课始检测】
1、原电池是______________________的装置。原电池反应的本质是____________反应。
2、如右图所示,组成的原电池,写出电极名称、电极反应式:
(1)当电解质溶液为稀H2SO4时:
(2)当电解质溶液为CuSO4溶液时:
【学习新知识】
一、对锌铜原电池工作原理的进一步探究
【自学指导一】观察实验4-1,说出实验现象。
【思考与交流】:上述原电池装置是将 反应的化学能转换成电能的,指出电池的正负极,并分别写出其中负极和正极的电极反应式以及该电池的总反应方程式。
负极( 片):
正极( 片):
电池反应(总化学方程式):
【思考与交流】改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?[附:盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。2)将KCl或NH4NO3的饱和溶液装入U形管,用棉花堵住管口即可]产生持续、稳定的电流的原因 .
盐桥的作用 .
二、由两个半电池组成原电池的工作原理
(1)把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
①在这类电池中,用 较强的物质作为负极,负极向外电路提供电子;用 较强的物质作为正极,正极从外电路得到电子。
②在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向移动而形成内电路。
【尝试练习1】:锌铜原电池产生电流时,阳离子( )
A.移向Zn极,阴离子移向Cu极 B.移向Cu 极,阴离子移向Zn 极
C.和阴离子都移向Zn极 D.和阴离子都移向Cu 极
(2)探究组成原电池的条件
(2)组成原电池的条件
(1) 。
(2) 。
(3) 。
(4)内部条件: 。
【尝试练习2】1.下列哪几个装置能形成原电池?
答:
2.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu, 该反应的的原电池正确组合是( )
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
(3)原电池的正负极的判断方法
微观判断(根据电子流动方向):
宏观判断:
①根据电极材料:
②根据原电池电极发生的反应:
③根据电极增重还是减重:
④根据电极有气泡冒出:
【尝试练习3】
1.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
2.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )
A.不变 B先变大后变小 C逐渐变大 D.逐渐变小
3.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 ( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
4. 请根据氧化还原反应 :Cu +2 Fe3+ = Cu2+ + 2Fe2+设计成原电池。并画出装置图指出正、负极,标出电子的流向。
负极: 正极:
电解质溶液:
若是采用烧杯和盐桥装置图,
采用的电解质溶液又是什么?
试画出原电池的装置简图。
三、原电池的主要应用:
1.利用原电池原理设计新型化学电池;
2.改变化学反应速率,如实验室用粗锌与硫酸反应制取氢气;
3.进行金属活动性强弱比较;
4.电化学保护法,即将金属作为原电池的正极而受到保护。如在铁器表面镀锌。
5.解释某些化学现象
【达标练习】
(1)比较金属活动性强弱。
练习1:下列叙述中,可以说明金属甲比乙活泼性强的是( )
A.甲和乙用导线连接插入盐酸溶液中乙溶解,甲上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
C.将甲乙作电极组成原电池时甲是负极;
D.同价态的阳离子,甲比乙的氧化性强;
(2)比较反应速率
练习2 :下列制氢气的反应速率最快的是( )
A纯锌和1mol/L 硫酸;
B纯锌和18 mol/L 硫酸;
C粗锌和 1mol/L 盐酸;
D粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。
(3)比较金属腐蚀的快慢
练习3:下列各情况,在其中Fe片腐蚀由快到慢的顺序是
练习4:下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
(4)判断溶液pH值变化
(5)原电池原理的综合应用
【拓展练习】(1)若烧杯中溶液为稀硫酸,
则观察到的现象:
两极反
应式为:正极
;负极 。
(2)若烧杯中溶液为氢氧化钠溶液,则观察到的现象
则负极为 ,
总反应方程为 。该装置是将 能转化为 能。
【小 结】原电池
1、定义:
2、原电池的工作原理
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。
(1)由两个半电池组成的锌铜原电池的工作原理
(2)形成原电池的条件
(3)原电池的正负极的判断方法
(4)电极材料的选择(电池的电极必须导电)
【课后作业】
一、选择题
.下列各变化中属于原电池反应的是
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓HNO3比稀HNO3更能氧化金属铜
.将等质量的两份锌粉a、b,分别加入过量的稀硫酸,同时向a中加少许胆矾晶体,下列各图表示产生氢气的体积V(升)与时间t(分)的关系,其中正确的是
.实验室有下列试剂①浓H2SO4 、②稀H2SO4、 ③稀HNO3 、④浓盐酸、⑤含硫、磷杂质的锌粒、⑥纯锌、⑦CuSO4溶液,为快速制取较纯的H2,试剂的最佳选择是
A.①⑥ B.③⑤ C.④⑥⑦ D.②⑥⑦
.下列关于金属腐蚀的说法正确的是
A.金属在潮湿空气中腐蚀的实质是:M + nH2O = M(OH)n + n/2 H2↑
B.金属的化学腐蚀的实质是M – n e- = M n+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀
.下列事实不用电化学理论解释的是
A.轮船水线以下的船壳上装一定数量的锌块
B.铝片不用特殊方法保护
C.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D.镀锌铁比镀锡铁耐用
.对右图所示装置的叙述,正确的是
A.Cu是负极,Cu片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
.电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液。电池总反应式为:Zn+Ag2O=ZnO+2Ag, 下列说法错误的是
A.该电池的正极是Zn,负极是Ag2O
B.该电池负极的电极反应式为:Zn+2OH―—2e―=ZnO+H2O
C.理论上该电池工作一段时间后,溶液中KOH的浓度不变
D.该电池工作时,电解质中的阴离子向负极移动
.钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H++2e―=H2 B.Fe2++2e―=Fe
C.2H2O+O2+4 e―=4OH― D.Fe3++e―=Fe2+
.把a、b、c、d四块金属板浸入稀H2SO4中,用导线两两相连,可以形成原电池。若a.b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c极上产生大量气泡,b、d相连时,b极上有大量气泡。则四块金属的活动顺序是
A.a>c>d>b B.c>a>b>d
C.a>c>b>d D.c>a>d>b
.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l) Zn(OH)2 (s)+Mn2O3(s)下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e—=Mn2O3(s)+2OH—(aq)
C.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
D.电池工作时,电子由正极通过外电路流向负极
.下列化学反应的化学能可直接转变成电能的是
A.2FeCl3+Cu=CuCl2+2FeCl2
B.AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
C.2Fe(OH)3 Fe2O3+3H2O
D.Na2O+CO2=Na2CO3
.下列产品的使用不会对环境造成明显污染的是
A.含磷洗衣粉 B.氢氧燃烧电池 C.氟利昂 D.含汞电池
.在盛有稀 H2SO4 的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A.正极附近的 SO4 2- 离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
Zn
Cu
×
V
a
b
A
t
V
a
b
B
t
V
b
a
C
t
V
a
b
D
t
PAGE
1
