九上化学一轮复习基础知识29天早背晚默
文档属性
| 名称 | 九上化学一轮复习基础知识29天早背晚默 |  | |
| 格式 | docx | ||
| 文件大小 | 237.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-25 18:51:34 | ||
图片预览




文档简介
(
九上化学
29 天
早背晚默
第
1
天
早背 DAY
1
1.空气主要是由
氧气
和
氮气
组成的,按体积分数计算各约占
21
%和
78
%,稀有气体占
0.94
%,
C
O2
占
0.03
%稀有气体包括
氦
、
氖
、
氩
、氪
、氙
、氡
。
2
.
写出下列物质的化学符号:氧气
O
2
;氮气
N
2
;水
H
2
O
;二氧化碳
CO
2
;磷
P
;五氧化
二
磷
P
2
O
5
;氦气
He
;氖气
Ne
;氩气
Ar
。
3
.
空气质量指数计入评价的主要污染物为:
SO
2
、
CO
、
NO
2
、可吸入颗粒物和
臭氧
等
。
4
. 目前环境污染问题:臭氧层破坏(
氟利昂
、氮的氧化物等)
、温室效应(
CO
2
、CH
4
等)
、
酸
雨(
NO
2
、
SO
2
等)
、白色污染(
塑料
垃
圾等)
5
.
由两种或两种以上物质生成另一种物质的反应叫做
化合反应
;物质跟氧发生的反应叫做
氧化反应
。
动植物呼吸
、食物的腐败
、酒和醋的酿造
、钢铁生锈等属于
缓慢氧化
。
6
.氧气的用途:
(
1
)
供给呼吸
(如潜水
、医疗急救
);
(2
)
支持燃烧
(如燃料燃烧
、炼钢
、气焊)
)
(
九上化学
29 天
早背晚默
第
1
天
晚默 DAY
1
1.空气主要是由
和
组成的,按体积分数计算各约占
%和
%,稀有气体占
%,
CO2
占
%稀有气体包括
、
、
、氪
、氙
、氡
。
2
.
写出下列物质的化学符号:氧气
;氮气
;水
;二氧化碳
;磷
;五氧化二
磷
;
氦气
;氖气
;氩气
。
3
.
空气质量指数计入评价的主要污染物为:
、
、
、可吸入颗粒物
和
等
。
4
. 目前环境污染问题:臭氧层破坏(
、氮的氧化物等)
、温室效应(
、CH4 等)
、
酸
雨(
、
等)
、白色污染(
垃圾等)
5
.
由两种或两种以上物质生成另一种物质的反应叫做
;物质跟氧发生的反应叫做
。
动植物呼吸
、食物的腐败
、酒和醋的酿造
、钢铁生锈等属于
。
6
.氧气的用途:
(
1
)
(
如潜水
、医疗急救
);
(2
)
(
如燃料燃烧
、炼钢
、气焊)
)
九上化学 29 天早背晚默 第 2 天
早背 DAY 2
7 .水的净化方法:静置沉淀 、吸附沉淀 、过滤 、活性炭吸附 、消毒杀菌 、蒸馏等 。
( 1 )静置沉淀:让较大的颗粒自然沉降 。
(2)吸附沉淀:加絮凝剂明矾,利用其溶于水生成的胶状物对杂质的吸附,使杂质沉降下来 (生成胶 状物的过程属于化学变化, 吸附杂质的过程属于物理变化) 。
(3 )过滤: 除去水中的不溶性杂质 。
(4 )活性炭吸附:活性炭的结构疏松多孔 ,具有吸附性 ,可以吸附水中的色素和异味等 。
(5 )投药消毒:一般用漂白粉 、氯气 、臭氧 、二氧化氯等 ,该过程属于化学变化 。
(6 )其中净化程度最高的是蒸馏 。 8 .硬水和软水:
( 1)定义:硬水是含有较多可溶性钙 、镁化合物的水;软水是不含或含较少可溶性钙 、镁化 合物的水 。
(2 )鉴别方法:加入等量的肥皂水 ,浮渣较多 、泡沫较少的是硬水 ,泡沫较多 、浮渣较少的 是软水 。
(3 )硬水软化的方法:实验室——蒸馏 、生活中——煮沸 。
九上化学 29 天早背晚默 第 2 天
早背 DAY 2
(
7 .水的净化方法:
、
、
、
、
、
。
(
1
)静置沉淀:让较大的颗粒
。
)
(2)吸附沉淀:加絮凝剂 ,利用其溶于水生成的胶状物对杂质的 ,使杂质沉降下来 (生成胶 状物的过程属于 变化, 吸附杂质的过程属于 变化) 。
(3 )过滤: 除去水中的 杂质 。
(4 )活性炭吸附:活性炭的结构疏松多孔 ,具有 性 ,可以吸附水中的 和 等 。
(5 )投药消毒:一般用漂白粉 、氯气 、臭氧 、二氧化氯等 ,该过程属于 变化 。
(6 )其中净化程度最高的是 。 8 .硬水和软水:
( 1)定义:硬水是含有较多可溶性钙 、镁化合物的水;软水是 可溶性钙 、镁化 合物的水 。
(2 )鉴别方法:加入等量的 、 的是硬水 ,泡沫较多 、浮渣较少的 是软水 。
(3 )硬水软化的方法:实验室—— 、生活中—— 。
九上化学 29 天早背晚默 第 3 天
早背 DAY 3
9 .氢气验纯时判断是否纯净:发出尖锐爆鸣声 ,表明气体不纯 ,声音很小则表示气体较纯 。 10 .单质和化合物
( 1 )单质: 由同种元素组成的纯净物 。
(2 )化合物: 由不同种元素组成的纯净物 。
(3 )氧化物: 由两种元素组成的化合物 ,其中一种是氧元素 。
11 . 写出元素符号 Fe 的意义:( 1 )铁元素;( 2) 1个铁原子;( 3 )铁这种物质 。
12 . 写出化学式 SO2的意义:
( 1 )二氧化硫这种物质;
(2 )二氧化硫由硫元素和氧元素组成;
(3) 1个二氧化硫分子;
(4) 1个二氧化硫分子由 1个硫原子和 2个氧原子构成 。
(
九上化学
29 天
早背晚默
第
3
天
)
(
9 .氢气验纯时判断是否纯净:发出
,表明气体不纯
,
则表示气体较纯
。
10
.单质和化合物
(
1
)单质:
由
元素组成的
。
(2
)化合物:
由
元素组成的
。
(3
)氧化物:
由
元素组成的化合物
,其中一种是
元素
。
11
.
写出元素符号 Fe 的意义
:(
1
)
;(
2
)
;(
3
)
。
12
.
写出化学式
SO
2
的意义:
(
1
)
;
(2
)
;
(3
)
;
(4
)
。
) (
晚默 DAY
3
)
(
九上化学
29 天
早背晚默
第
4
天
)
(
早背 DAY
4
)
(
13
.
写出下列化学符号中“2 ”表示的意义
。
(
1
)CO
2
1个二氧化碳分子中有
2个氧原子
;
(2
)Ca
2+
1个钙离子带
2个单位正电荷
;
(3
)
氧化镁中镁元素的化合价为+2价
(4
)2P
2个磷原子
14 .按要求写出下列化学符号
。
(
1
)+3
价的铁的氧化物
Fe
2
O
3
;
(2
)标出氯化锌中锌元素的化合价
;
(3
)2个氢原子
2H
;
(4
)硝酸根离子
NO
3
-
;
(5
)写出氢氧化镁的化学式并标出镁元素的化合价
)
(
九上化学
29 天
早背晚默
第
4
天
)
(
13
.
写出下列化学符号中“2 ”表示的意义
。
(
1
)CO
2
;
(2
)Ca
2+
;
(
3
)
(4
)2P
14 .按要求写出下列化学符号
。
(
1
)+3
价的铁的氧化物
;
(2
)标出氯化锌中锌元素的化合价
ZnCl
2
;
(3
)2个氢原子
;
(4
)硝酸根离子
;
(5
)写出氢氧化镁的化学式并标出镁元素的化合价
) (
晚默 DAY
4
)
九上化学 29 天早背晚默 第 5 天
早背 DAY 5
15 .化合价规律:
( 1 )单质中元素化合价为 0 。
(2 )化合物中 ,正负化合价代数和为零 。
(3 )原子团中 ,正负化合价代数和等于原子团的化合价 。
16 . 写出下列物质的化学式 。
氧化物:氧化钠 Na2O 氧化铜 CuO 氧化钙 CaO 氧化亚铁 FeO
氯化物:氯化钠 NaCl 氯化氢 HCl 氯化镁MgCl2 氯化铁 FeCl3
某酸(酸类) :硫酸 H2SO4 硝酸 HNO3 碳酸 H2CO3
(
氢氧化钙
Ca(OH)
2
氢氧化铝
Al(OH)
3
)氧化某:氢氧化钠 NaOH 氢氧化铁 Fe(OH)3
硝酸某:硝酸银AgNO3 硝酸钠 NaNO3 硝酸铜 Cu(NO3)2 硝酸铁 Fe(NO3)3
硫酸某:硫酸钠 Na2SO4 硫酸锌 ZnSO4 硫酸铁 Fe2(SO4)3 硫酸铝 Al2(SO4)3
碳酸某:碳酸钠 Na2CO3 碳酸钾 K2CO3 碳酸钙 CaCO3 碳酸钡 BaCO3
九上化学 29 天早背晚默 第 5 天
晚默 DAY 5
15 .化合价规律:
( 1 )单质中元素化合价为 。
(2 )化合物中 ,正负化合价代数和为 。
(3 )原子团中 ,正负化合价代数和等于 。
16 . 写出下列物质的化学式 。
氧化物:氧化钠 氧化铜 氧化钙 氧化亚铁
氯化物:氯化钠 氯化氢 氯化镁 氯化铁
某酸(酸类) :硫酸 硝酸 碳酸
(
氢氧化钙
氢氧化铝
)氧化某:氢氧化钠 氢氧化铁
硝酸某:硝酸银 硝酸钠 硝酸铜 硝酸铁
硫酸某:硫酸钠 硫酸锌 硫酸铁 硫酸铝
碳酸某:碳酸钠 碳酸钾 碳酸钙 碳酸钡
(
九上化学
29 天
早背晚默
第
6
天
早背 DAY
6
17.写出下物质的名称
。Fe
2
O
3
氧化铁
、AgCl
氯化银
、HCl
氯化氢
、Al(OH)
3
氢氧化铝
、Fe(NO
3
)
2
硝酸亚铁
、CuSO
4
硫酸铜
、MgSO
4
硫酸镁
、(NH
4
)
2
CO
3
碳酸铵
18
.构成物质的粒子有:
分子
、
原子
、
离子
。铁是由
铁原子
构成
,水由
水分子
构成
,氯化钠由
钠离子
和氯离子
构成
。
19.
由分子构成的物质
,分子是保持其
化学性质
的最小粒子
。保持氧气化学性质的最小粒子是
氧分子
保持二氧化碳化学性质的最小粒子是
二氧化
碳分子
注意:单个分子只能保持物质的化学性质,不能保持
物质的
物理性质
。物质的
物理性质
如颜色
、状态
、气味
、沸点等宏观性质,是
由大量分子聚集在一起表
现的性质
。
20
.分子是由
原子
构成的
,如:
1个二氧化碳(
CO
2
)分子是由
1个碳原子和
2
个氧原子
构成
。
1
个水分子(
H
2
O)是由
2个氢原子和 1
个氧原子
构成
。
21
.化学变化的实质:在化学变化中
,
分子
可以分裂成
原子
,
原子
又可以结
合成新的
分子
。
可见
,在化学变化中
,分子的种类
会
发生变化
,原子的种
类
不会
发生改变
。因此
,原子是化学变化 中
的
最小粒子
。
)
(
九上化学
29 天
早背晚默
第
6
天
晚默 DAY
6
17.写出下物质的名称
。
Fe
2
O
3
、AgCl
、HCl
、
Al(OH)
3
、
Fe(NO
3
)
2
、
CuSO
4
、
MgSO
4
、
(NH
4
)
2
CO
3
18
.构成物质的粒子有:
、
、
。铁是由
构成
,水由
构成
,氯化钠由
构成
。
19.
由分子构成的物质
,分子是保持其
的最小粒子
。保持氧气
化学性质的最小粒子是
保持二氧化碳化学性质的最小粒子是
注意:单个分子只能保持物质的化学性质,不能保持
物质的
。物质的
如颜色
、状态
、气味
、沸点等宏观性质,是
。
20
.分子是由
构成的
,如:
1个二氧化碳(
CO
2
)分子是由
构成
。
1
个水分子(
H
2
O
)是由
构成
。
21
.化学变化的实质:在化学变化中
,
可以分裂成
,
又可以结合成新的
。
可见
,在化学变化中
,分子的种类
发生变化
,
原子的种类
发生改变
。因此
,原子是化学变化
中
的
。
)
九上化学 29 天早背晚默 第 7 天
早背 DAY 7
22 .分子和原子的区别与联系:
( 1) 区别:化学变化中 ,分子要分成原子, 而原子却不能再分 。
(2 )联系:分子由原子构成 ,分子和原子都可直接构成物质 。
23 .用化学符号表示:3个二氧化碳分子 3CO2 ,2个氢原子 2H ,2个氧分子 2O2 。
24 .原子的结构:原子由居于原子中心的原子核和核外电子构成;原子核由质子和中子构成 。 25 .原子不显电性的原因:原子核所带的电荷与核外电子所带电荷电量相等, 电性相反 。
26 .原子核外电子的排布
( 1 )核外电子是_分层运动_ 的 。
(2 )核外电子排布的规律:第一层最多 2个 。第二层最多 8个 。最外层不超过 8个(只有一 层不超 过 2个)
27 .原子和离子的区别:
( 1 )原子:质子数= 电子数; (2 )离子:质子数≠电子数;
(3) 阳离子:质子数> 电子数; (4) 阴离子:质子数< 电子数 。
九上化学 29 天早背晚默 第 7 天
晚默 DAY 7
22 .分子和原子的区别与联系:
( 1) 区别:化学变化中 ,分子要分成 , 而原子却不能 。
(2 )联系:分子由 构成 ,分子和原子都可直接构成 。
23 .用化学符号表示:3个二氧化碳分子 ,2个氢原子 ,2个氧分子 。
24 .原子的结构:原子由居于原子中心的 和 构成;原子核由 和 构成 。 25 .原子不显电性的原因:原子核所带的电荷与核外电子所带电荷 。
26 .原子核外电子的排布
( 1 )核外电子是 _ 的 。
(2 )核外电子排布的规律:第一层最多 个 。第二层最多 个 。最外层不超过 个(只有一 层不超 过 个)
27 .原子和离子的区别:
( 1 )原子:质子数 电子数; (2 )离子:质子数 电子数;
(3) 阳离子:质子数 电子数; (4) 阴离子:质子数 电子数 。
(
九上化学
29 天
早背晚默
第
8
天
早背 DAY
8
28 .原子中的等量关系:核电荷数=
质子
数=
核外电子
数=原子序数
。
29 .相对原子质量 ≈
质子数
+
中子数
。
钠原子的相对原子质量为
23 ,核电荷数为 11 ,则中子
数为
12
。
30 .元素:
质子数
(即
核电荷数
)相同的一类原子的总称
。
31 .元素的种类由
质子数(或核电荷数)
决定,
不同种元素的本质区别是
质子数(或核电荷 数)不
同
。
32 .元素的化学性质主要是由
原子的最外层电子数
决定
。
33 .地壳中元素的含量:前四位的元素名称和符号
依次是氧(O)
、
硅(Si)
、
铝(Al)
、
铁(
Fe
)
,
其中最多的金属元素是
Al
,
它与最多的非金
属元素组成的物质符号是
Al
2
O
3
。
34
.
门捷列夫
发现了元素周期律并制作了元素
周期表
。
·
35 .元素所在的周期数等于原子的
电子层数
,元素所在的主族数等于原子的
最外层电子数
。
)
(
九上化学
29 天
早背晚默
第
8
天
晚默 DAY
8
28 .原子中的等量关系:核电荷数=
数=
数=原子序数
。
29
.相对原子质量 ≈
+
。
钠原子的相对原子质量为
23 ,核电荷数为 11 ,则中子数为
。
30 .元素
:
(
即
)相同的一类原子的总称
。
31 .元素的种类由
决定,
不同种元素的本质区别是
。
32 .元素的化学性质主要是由
决
定
。
33 .地壳中元素的含量:前四位的元素名称和
符号依次是氧(O)
、
、
、
,
其中最多的金属元素是
,
它与最多的非金属元素组成的物质符号
是
。
34
.
发现了元素周期律并制作了元素周期表
。
·
35 .元素所在的周期数等于原子的
,元素所在的主族
数等于原子的
。
)
九上化学 29 天早背晚默 第 9 天
早背 DAY 9
36 .元素周期表:
( 1)有 7 个横行,18 个纵行 。每一个横行叫一个周期(共 7个周期), · 每一个纵行叫一个族(8 , 9 , 10 三个纵行共同组成一个族)(共 16个族) 。.
(2 )排列规律:每周期从左往右依次为金属元素 、非金属元素 、稀有气体元素(第七周期例外) 37 .根据镁原子结构示意图回答有关问题:
( 1 )镁位于元素周期表第三周期;
(2 )镁位于元素周期表第 2 主族;
(3 )镁离子的最外层电子数是 8 。
38.物质都是由元素组成的 。如二氧化碳(CO2 )由碳元素和氧元素组成;高锰酸钾( KMnO4) 由钾 元素 、锰元素和氧元素组成 。
九上化学 29 天早背晚默 第 9 天
晚默 DAY 9
36 .元素周期表:
( 1)有 7 个横行,18 个纵行 。每一个横行叫一个 (共 个周期), · 每一个纵行叫一个 (8 , 9 , 10 三个纵行共同组成一个族)(共 个族) 。.
(2 )排列规律:每周期从左往右依次为 、 、 (第七周期例外) 37 .根据镁原子结构示意图回答有关问题:
( 1 )镁位于元素周期表第 周期;
(2 )镁位于元素周期表第 主族;
(3 )镁离子的最外层电子数是 。
38.物质都是由 组成的 。如二氧化碳(CO2 )由 组成;高锰酸钾( KMnO4) 由 、 组成 。
九上化学 29 天早背晚默 第 10 天
早背 DAY 10
39 .金刚石是天然存在的最硬的物质 ,可用于制钻石 、刻划玻璃 、钻探机钻头等 。
40 .石墨是最软的矿物之一 ,有优良的导电性 ,润滑性 。可用于制铅笔芯 、干电池的电极等 。
41 .金刚石和石墨都是由碳元素组成的单质 ,物理性质差别大的原因是碳原子的排列方式不 同, 它 们的化学性质相同 。
42 . 因为活性炭的结构疏松多孔 ,所以具有吸附性, 常用作防毒面具的吸附剂 。
43 .C60 分子是一种由60个碳原子构成的分子, 它形似足球 ,这种足球结构的碳分子很稳定 。
44 .物质与氧发生的反应叫氧化反应,含氧化合物里的氧被夺去的反应叫还原反应 。在化学 反应中, 供给氧的物质叫氧化剂 ,得氧的物质叫还原剂 。在化学反应中 ,物质供给氧的性质叫氧 化性 ,物质 夺取氧的性质叫还原性 。
45 .CO2的物理性质:标况下 ,一种无色 ,无味的气体 ,密度比空气大 ,能溶于水 ,高压低温下可得 固态二氧化碳(俗称干冰) 。
46 .CO 的物理性质:标况下 ,一种无色 ,无味的气体 ,密度比空气略小 ,难溶于水 ,只能用排水法 收集, 不能用向下排空气法收集 。
47 .CO 和 CO2 的化学性质有很大差异的原因是:分子的构成不同 。
(
九上化学
29 天
早背晚默
第
1
0
天
晚默 DAY
10
39 .金刚石是天然存在的
的物质
,可用于制钻石
、刻划玻璃
、钻探机
等
。
40 .石墨是
的矿物之一
,有优良的
性
,润滑性
。可用于制铅笔芯
、干电池的
等
。
41
.金刚石和石墨都是由碳元素组成的
,物理性质差别大的原因是
,
它
们的化学性质
。
42
.
因为活性炭的结构疏松多孔
,所以具有
性,
常用作防毒面具的
剂
。
43 .C
60
分子是一种由
构成的分子,
它形似足球
,这种足球结构的碳分子很
。
44
.物质与氧发生的反应叫
,含氧化合物里的氧被夺去的反应叫
。在化学 反应中,
供给氧的物质叫
,得氧的物质叫
。在化学反应中
,物质供给氧的性质叫
,物质
夺取氧的性质叫
。
45 .CO
2
的物理性质:标况下
,一种无色
,无味的气体
,密度比空气
,
溶于水
,
高压低温下可得
固态二氧化碳(俗称
)
。
46 .CO 的物理性质:标况下
,一种无色
,无味的气体
,密度比空气
,
溶于水
,只能用
收集,
不能用
收集
。
47 .CO 和 CO
2
的化学性质有很大差异的原因是:
。
)
九上化学 29 天早背晚默 第 11 天
早背 DAY 11
48 .CO2的用途
( 1 )灭火: 既利用了二氧化碳的物理性质( 二氧化碳的密度比空气大) ;又利用了二氧化碳的化学性 质( 一般情况下 ,二氧化碳既不能燃烧 ,也不能支持燃烧) 。
(2 )干冰(固体二氧化碳) :干冰升华吸收大量的热, 因此干冰可用于人工降雨 、制冷剂 。
(3 )光合作用:作气体肥料 ,可以提高农作物的产量 。
49 .CO的用途:( 1 )可燃性:作气体燃料( 2 )还原性: 冶炼金属 。
50 .燃烧
( 1 )定义:通常情况下 ,可燃物与氧气发生的一种发光 、放热的剧烈的氧化反应 。
(2 )影响燃烧现象的因素:可燃物的性质 、氧气的浓度与氧气的接触面积 。
51.燃烧需要三个条件:( 1 )可燃物;(2 )与氧气(或空气)接触;(3 )温度达到可燃物的着火点 。
灭火只需满足下列条件之一:①清除可燃物;② 隔绝氧气(或空气) ;③使温度降到着火点以下 。 灭火的根本就是要破坏燃烧的条件 。
52 . 图书 、档案等着火 ,应该用二氧化碳灭火器进行灭火 ,原因是灭火时不会留下任何痕迹 而使物 体损坏 。
九上化学 29 天早背晚默 第 11 天
晚默 DAY 11
48 .CO2的用途
( 1 )灭火: 既利用了二氧化碳的物理性质( ) ;又利用了二氧化碳的化学性 质( ) 。
(2 )干冰(固体二氧化碳) :干冰升华 大量的热, 因此干冰可用于 、 。
(3 )光合作用:作 ,可以提高农作物的产量 。
49 .CO的用途:( 1 )可燃性:作 ( 2 )还原性: 。
50 .燃烧
( 1 )定义:通常情况下 , 与 发生的一种 、 的剧烈的 。
(2 )影响燃烧现象的因素:可燃物的 、氧气的 与氧气的 。
51.燃烧需要三个条件:( 1) ;(2) ;(3) 。
灭火只需满足下列条件之一:① ; ② ; ③ 。 灭火的根本就是要 。
52 . 图书 、档案等着火 ,应该用 灭火器进行灭火 ,原因是
。
(
九上化学
29 天
早背晚默
第
1
2
天
早背 DAY
12
53 .用化学知识解释下列生活中的现象
。
(
1
)生煤炉火时,
需先引燃纸和木材,
因为
纸和木材的着火点比煤低
,容易点燃
。
(2
)室内起火不能打开门窗,
因为
会增加空气的流通
,增加氧气的浓度
,反应剧烈
,燃烧更旺
。
(3
)用扇子扇煤炉火越扇越旺
,因为
虽然降低了温度
,但没有降至着火点以下
,反
而增加了
空气的流
通
,所以越扇越旺
。而用扇子扇蜡烛火焰一扇就灭,
因为
虽然增加了空气的流通
,但却降低了温度至着
火点以下
,所以一扇就灭
。
(4)
电器着火
,应先
切断电源
,再
灭火
。
54
.
可燃性
气体(如 H
2
.CO
、甲烷等)
、面粉
、煤粉等粉尘和
空气(或氧气)
混合
,在
有限
的空间
里
,遇到明火就会急剧地燃烧
,可能发生爆炸
事故
。所以可燃性气体在点燃或加热前都要
验纯
,
防止发
生爆炸
。
55 .化石燃料包括
煤
、
石油
、
天然气
,
都是
混合物
,都是
不可
再生能源
。
56
.煤的干馏:将煤隔绝空气加强热,属于
化学
变化,主要产品有焦炭
、煤焦油
、煤气(主要成分为
CO
)
等
。
)
(
九上化学
29 天
早背晚默
第
1
2
天
晚默 DAY
12
53 .用化学知识解释下列生活中的现象
。
(
1
)生煤炉火时,
需先引燃纸和木材,
因为
。
(2
)室内起火不能打开门窗,
因为
。
(3
)用扇子扇煤炉火越扇越旺
,因为
。而用扇子扇蜡烛火焰一扇就灭,
因为
。
(4)
电器着火
,应先
,再
。
54
.
气体(如 H
2
.CO
、甲烷等)
、面粉
、煤粉等粉尘和
混合
,在
的空间
里
,遇到明火就会急剧地燃烧
,可能发生爆炸事故
。所以可燃性气体在点燃或加热前都要
,
防止发
生爆炸
。
55 .化石燃料包括
、
、
,都是
,都是
再生能源
。
5
6
.煤的干馏:将煤隔绝空气加强热,属于
变化,主要产品有焦炭
、煤焦油
、煤气(主要
成分为
)
等
。
)
九上化学 29 天早背晚默 第 13 天
早背 DAY 13
57 .石油的分馏:根据各成分的沸点不同 ,将它们分离 ,属于物理变化 ,主要产品有汽油 、煤 油 、柴 油 、润滑油等 。
58 .天然气的主要成分是甲烷 。甲烷是一种无色 、无味的气体 ,难溶于水 ,密度比空气小 。
59 .燃料充分燃烧要考虑两点:一是燃烧时空气充足;二是燃料与空气有足够大的接触面积 。
60 .造成酸雨的气体主要是二氧化硫( SO2 ) 、二氧化氮( NO2 ) 。 61 . 乙醇汽油属于混合物 。
用乙醇汽油作为燃料的主要优点:节省石油资源 、减少汽车尾气的污染 。 62 . 写出化学方程式
( 1) 甲烷燃烧:CH4+2O2 点燃 = CO2+2H2O 。
(2 )酒精燃烧:C2H5OH+3O2 点燃 = 2CO2+3H2O ;酒精是可再生能源 。
(
九上化学
29 天
早背晚默
第
1
3
天
晚默 DAY
1
3
57
.石油的分馏:根据各成分的
不同
,将它
们分离
,属于
变化
,主要产品有汽油
、煤
油
、柴
油
、润滑油等
。
58 .天然气的主要成分是
。甲烷是一种无色
、无味的气体
,
溶于水
,密度比空气
。
59 .燃料充分燃烧要考虑两点:一是
;二是
。
60 .造成酸雨的气体主要是
、
。
61
.
乙醇汽油属于
。
用乙醇汽油作为燃料的主要优点:
、
.
62
.
写出化学方程式
(
1)
甲烷燃烧:
。
(2
)酒精燃烧:
;酒精是
能源
。
)
九上化学 29 天早背晚默 第 14 天
早背 DAY 14 63 .检验某可燃物是否含碳 、氢元素的方法
( 1 )检验可燃物含氢元素的方法: 点燃 ,在可燃物上方罩一个冷而干燥的烧杯 ,烧杯内壁出 现水雾, 说明生成了水 ,证明含有氢元素;
(2 )检验可燃物含碳元素的方法:把上述烧杯迅速倒过来 ,立即注入澄清石灰水 ,振荡 ,变 浑浊 , 说明生成了二氧化碳 ,证明含有碳元素 。(或点燃 ,在可燃物上方罩一个内壁涂有澄清石灰水的烧杯, 变浑浊 ,说明生成了二氧化碳 ,证明含有碳元素 。)
64 .影响燃烧现象剧烈程度的因素:可燃物的性质 、氧气的浓度 、与氧气的接触面积 。 65 .燃料不充分燃烧的缺点:放出的热量少 ,浪费资源 、生成 CO 等污染空气的物质 。
66 .氢能源的优点:可用水作原料 ,有广泛的来源 、燃烧后产物无污染 、热值高 ,未能广泛 应用的 原因:制取成本高 、贮存困难 。
67 . 人们正利用和开发的新能源有太阳能 、风能 、地热能 、潮汐能 、生物质能 、核能 。 68 .金属材料分类:包括纯金属和合金 。
九上化学 29 天早背晚默 第 14 天
晚默 DAY 14 63 .检验某可燃物是否含碳 、氢元素的方法
( 1 )检验可燃物含氢元素的方法: 点燃 ,在可燃物上方罩一个 的烧杯 ,烧杯内壁出 现 , 说明生成了 ,证明含有氢元素;
(2 )检验可燃物含碳元素的方法:把上述烧杯迅速倒过来 ,立即注入 ,振荡 ,变 , 说明生成了 ,证明含有碳元素 。(或点燃 ,在可燃物上方罩一个 的烧杯, 变 ,说明生成了 ,证明含有碳元素 。)
64 .影响燃烧现象剧烈程度的因素: 、 、 。 65 .燃料不充分燃烧的缺点: 、 。
66 .氢能源的优点: 、 、 ,未能广泛 应用的 原因: 、 。
67 . 人们正利用和开发的新能源有 、 、 、 、 、 。 68 .金属材料分类:包括 和 。
(
九上化学
29 天
早背晚默
第
1
5
天
早背 DAY
15
69
.
人类利用金属的先后顺序是
铜
、
铁
、
铝
。
(
1
)物理特性:颜色:
大多数金属都呈
银白
色
,但金呈
金黄
色
,铜呈
紫红
色
,铁粉为
黑
色
。
(2
)状态:
常温下,
大多数金属都是
固体
,但汞是
液体
。
70
.金属之最生活中应用最广泛的金属是
铁
,导电
、导热性最好的金属是
银
,硬度最大的金属是
铬
,
地壳中含量最高的金属元素是
铝
,人体中含量最高的金属是
钙
,熔点最高的金属是
钨
,熔点最低的金属
是
汞
。
71
.合金
(
1
)定义:在金属中加热熔合某些
金属
或
非金属
,制得的具有
金
属
特性的
混合
物
。
(2
)特性:合金具有金属特性
,与组成合金纯金属相比
,
硬度
更大
、
熔点
更低
、
抗腐蚀性
更强
。
(3)铁合金:生铁和钢性能不同的原因是
含碳量不同
,其在生铁中的含量为
2%~4.3%
,在钢中的含
量为
0.03%~2%
。
72
.常见的金属矿石赤铁矿(主要成分是
Fe
2
O
3
)
、磁铁矿(主要成分是
Fe
3
O
4
)
、菱铁矿(主要
成分是 FeCO
3
)
、铝土矿(主要成分是
Al
2
O
3
)
。
)
(
九上化学
29 天
早背晚默
第
1
5
天
晚默
DAY
15
69
.
人类利用金属的先后顺序是
、
、
。
(
1
)物理特性:颜色:
大多数金属都呈
色
,但金呈
色
,铜呈
色
,铁粉为
色
。
(2
)状态:
常温下,
大多数金属都是
,但汞是
。
70
.金属之最生活中应用最广泛的金属是
,导电
、导热性最好的金属是
,硬度最大的金属是
,
地壳中含量最高的金属元素是
,人体中含量最高的金属是
,熔点最高的金属是
,熔点最
低的金属
是
。
71
.合金
(
1
)定义:在金属中加热熔合某些
或
,制得的具有
特性的
物
。
(2
)特性:合金具有金属特性
,与组成合金纯金属相比
,
更大
、
更低
、
更强
。
(3)铁合金:生铁和钢性能不同的原因是
,其在生铁中的含量为
,在钢中的含
量为
。
72
.常见的金属矿石赤铁矿(主要成分是
)
、磁铁矿(
主要成分是
)
、菱铁矿(主要
成分是
FeCO
3
)
、铝土矿(主要成分是
)
。
)
九上化学 29 天早背晚默 第 16 天
早背 DAY 16
73 .工业炼铁
( 1 )原料:铁矿石 、焦炭 、石灰石和空气等 。
(2 )主要设备:高炉 。
发生的化学反应:主要反应(以赤铁矿为原料) 。焦炭的作用: 燃烧提供热量( ) 、制取 CO( ) 。
石灰石的作用:将矿石中的二氧化硅转变为炉渣除去 。
(4 )产品: 生铁 。拓展:百炼成钢的主要化学反应是 74 .金属资源的腐蚀和防护
( 1) 防锈原理:破坏铁生锈的两个必备条件之一即可 。隔绝氧气或隔绝水 。
(2) 防锈措施:保持铁制品表面洁净干燥;
在铁制品表面覆盖保护层 ,如涂油 、刷漆 、烤蓝 、镀其他金属等;改变金属的内部结 构 ,如制成不锈钢等 。
九上化学 29 天早背晚默 第 16 天
晚默 DAY 16
73 .工业炼铁
( 1 )原料:铁矿石 、 、 和空气等 。
(2 )主要设备: 。
(3)发生的化学反应:主要反应(以赤铁矿为原料) 。焦炭的作用: 燃烧提供热量( ) 、制取 CO( ) 。石灰石的作用:将矿石中的二氧 化硅转变为 除去 。
(4 )产品: 。拓展:百炼成钢的主要化学反应是 。 74 .金属资源的腐蚀和防护
( 1) 防锈原理: 铁生锈的两个必备条件之一即可 。隔绝 或隔绝 。
(2) 防锈措施:保持铁制品表面 ;
在铁制品表面 ,如涂油 、刷漆 、烤蓝 、镀其他金属等;改变金属的 , 如制成不锈钢等 。
(
九上化学
29 天
早背晚默
第
1
7
天
早背 DAY
17
75 .铜绿主要成分是碱式碳酸铜 Cu
2
(OH)
2
CO
3
,
它是铜与空气中的
O
2
、
CO
2
、
H
2
O
反应得到
。
金属资源的保护
①有效途径:
防止
金属腐蚀
;
回收利用
废旧金属
;有计
划
、合理地
开采矿物
;寻找
金属的替代品
。
②回收利用废旧金属的优点:
节约金属资源和能源
、
保护环境
。
③铝抗腐蚀性好的原因是:
铝在空气中与氧气反应
,表面生成一层致密的氧化铝薄膜
,从而阻止铝进
一步被氧化
。
76
.溶液
(
1
)概念:一种或几种物质分散到另一种物质里
,形成
均一
、
稳定
的
混合
物
。
(2
)特征:
均一
性
、
稳定
性
、
混合
物
。
(3
)组成:①溶质:
被溶解
的物质
,可以是
固
体
、
液
体或
气
体
。
②溶剂:
能溶解其他物质
的物质
,
水
是最常用的溶剂
,汽油和酒精也可以作溶剂
。
)
(
九上化学
29 天
早背晚默
第
1
7
天
晚默 DAY
17
75 .铜绿主要成分是碱式碳酸铜 Cu
2
(OH)
2
CO
3
,
它是铜与空气中的
反
应得到
。
金属资源的保护
①有效途径:
防止
;
回收利用
;有计划
、合理地
;寻找
。
②回收利用废旧金属的优点:
、
。
③铝抗腐蚀性好的原因是:
。
76
.溶液
(
1
)概念:一种或几种物质分散到另一种物质里
,形成
、
的
物
。
(2
)特征:
性
、
性
、
物
。
(3
)组成:①溶质:
的物质
,可以是
体
、
体或
体
。
②溶剂:
的物质
,
是最常用的溶剂
,汽油和酒精也可以作溶剂
。
)
(
九上化学
29 天
早背晚默
第
1
8
天
早背 DAY
18
注意:
(
1)溶液不一定是无色的
。如:CuSO
4
溶液是
蓝
色的(因含有
Cu
2+
)
。FeCl3
是
黄
色的(因含有
Fe
3+
)。
FeCl
2
是
浅绿
色的(因含有
Fe
2+
)
。
(2
)溶液是均一
、稳定的
,但均一
、稳定的液体
不一定
是溶液
,如
:蒸馏水
、酒
精等纯净物
。
(3
)加速物质溶解的措施:
搅拌
、
升温
、将固体研碎
。
77 .溶解时的吸热或放热现象
(
1)放热:有些物质在溶解时使溶液温度升高
,如
NaOH
(固)
、
浓 H
2
SO
4
(液)等
。CaO
溶于水
时使溶液温度升高是由于
CaO与水发生化学反应
放出热量
。
(2)
吸热:有些物质在溶解时使溶液温度降低
,如
NH
4
NO
3
(固)等
。
(3)
吸放热不明显:有些物质在溶解时无明显的温度变化
,如
NaCl
(固)等
。
)
(
九上化学
29 天
早背晚默
第
1
8
天
晚默 DAY
18
注意:
(
1)溶液不一定是无色的
。如:Cu
S
O
4
溶液是
色的(因含有
)
。FeCl
3
是
色的(因含有
)。
FeCl
2
是
色的(因含有
)
。
(2
)溶液是均一
、稳定的
,但均一
、稳定的液体
是溶液
,如
:蒸馏水
、酒精等纯
净物
。
(3
)加速物质溶解的措施:
、
、将固体研碎
。
77 .溶解时的吸热或放热现象
(
1)放热:有些物质在溶解时使溶液温度升高
,如
(固)
、
(液)等
。CaO
溶于水
时使溶液温度升高是由于
。
(2)
吸热:有些物质在溶解时使溶液温度降低
,如
(固)等
。
(3)
吸放热不明显:有些物质在溶解时无明显的温度变化
,如
(固)等
。
)
九上化学 29 天早背晚默 第 19 天
早背 DAY 19
78 .乳化
( 1)乳浊液:一种液体以小液滴形式分散到另一种不相溶的液体里形成的混合物,如牛奶和 豆浆 。乳 浊液不稳定 ,静置后会分层 。
(2 )乳化剂: 能使乳浊液稳定性增强的物质 。
(3 )乳化现象:洗涤剂等乳化剂使植物油在水中分散成无数细小的液滴, 而不聚成大的液滴 ,从而使 油和水不再分层的现象 。其中洗涤剂所起的作用叫乳化作用 。注意:用乳化剂去油污是利用了乳化剂的 乳化作用;用汽油洗去衣物上的油渍用的是溶解原理;用氢氧化钠去油污利用的是NaOH 和油脂反应 。 79 .饱和溶液与不饱和溶液
( 1)定义:在一定温度下,一定量的溶剂里,不能继续溶解某种溶质的溶液 ,叫做这种溶质 的饱和溶 液;还能继续溶解某种溶质的溶液, 叫做这种溶质的不饱和溶液 。
(2 )判断:
①若有未溶解的溶质(充分搅拌后) ,则该溶液一定为该溶质的饱和溶液 。
②若无未溶解的溶质 ,保持温度 、溶剂的量不变, 向溶液中加入少量该溶质 ,若不溶解 ,则为该溶质 的饱和溶液 ,反之则为不饱和溶液 。
九上化学 29 天早背晚默 第 19 天
晚默 DAY 19
78 .乳化
( 1)乳浊液:一种液体以 形式分散到另一种不相溶的液体里形成的混合物,如牛奶和 豆浆 。乳 浊液不 ,静置后会 。
(2 )乳化剂: 能使乳浊液 增强的物质 。
(3 )乳化现象:洗涤剂等乳化剂使植物油在水中分散成无数细小的液滴, 而不聚成大的液滴 ,从而使 油和水不再分层的现象 。其中洗涤剂所起的作用叫 作用 。注意:用乳化剂去油污是利用了乳化剂的 作用;用汽油洗去衣物上的油渍用的是 原理;用氢氧化钠去油污利用的是 。 79 .饱和溶液与不饱和溶液
( 1)定义:在一定 下,一定量的 里, 继续溶解某种溶质的溶液 ,叫做这种溶质 的饱和溶 液; 继续溶解某种溶质的溶液, 叫做这种溶质的不饱和溶液 。
(2 )判断:
①若有未溶解的溶质(充分搅拌后) ,则该溶液一定为该溶质的 溶液 。
②若无未溶解的溶质 ,保持温度 、溶剂的量不变, 向溶液中 ,若 ,则为该溶质 的饱和溶液 ,反之则为不饱和溶液 。
(
九上化
学
29 天
早背晚默
第
2
0
天
)
(
早背 DAY
20
)
(
(3
)相互转化
①对大多数溶解度随温度升高而增大的物质:
)
(
②对极少数溶解度随温度升高而减小的物质[如
Ca(OH)2
]:
)
(
(4
)浓
、稀溶液与饱和
、不饱和溶液之间的关系
①饱和溶液
不一定
是浓溶液,
不饱和溶液
不一定
是
稀溶液
。
②在一定温度时,
同一种溶质的饱和溶液要比它的不饱和溶液
浓
。
80
.结晶
(
1
)定义:从溶液中
析出晶体
的过程
。
(2
)方法
①蒸发结晶:适用于所有溶质的溶液
,特别适用于溶解度受温度影响
较小
的物质
,如NaCl
。
②降温结晶(冷却
热饱和溶液
)
:
只适用于溶解度随温
度升高而
显著增大
的物质
,如KNO3
。
)
(
九上化
学
29 天
早背晚默
第
2
0
天
)
(
晚默 DAY
20
)
(
(3
)相互转化
①对大多数溶解度随温度升高而增大的物质:
)
(
②对极少数溶解度随温度升高而减小的物质[如
Ca(OH)2
]:
)
(
(4
)浓
、稀溶液与饱和
、不饱和溶液之间的关系
①饱和溶液
是浓溶液,
不饱和溶液
是稀溶液
。
②在一定温度时,
同一种溶质的饱和溶液要比它的不饱和溶液
。
80
.结晶
(
1
)定义:从溶液中
的过程
。
(2
)方法
①蒸发结晶:适用于所有溶质的溶液
,特别适用于溶解度受温度影响
的物质
,如NaCl
。
②降温结晶(冷却
)
:
只适用于溶解度随温度升高而
的物质
,如KNO3
。
)
九上化学 29 天早背晚默 第 21 天
早背 DAY21
81 .混合物的分离和提纯
( 1 )分离可溶物和不溶物:过滤法;
(2 )铁屑和其他固体:用磁铁反复吸引;
(3) 除去氯化钠中少量的硝酸钾:蒸发溶剂结晶法; 除去硝酸钾中少量的氯化钠: 冷却热饱和溶液结晶法 。 82 . 固体溶解度
( 1 )概念:在一定温度下 ,某固态物质在 100g 溶剂里达到饱和状态时所溶解的质量 。
(2 )影响因素: 内因:溶质 、溶剂本身的性质;
外因:温度 。多数固体物质的溶解度随温度的升高而显著增大 ,如 KNO3 。少数固 体物质的溶解度受温度的变化影响很小 ,如 NaCl 。
极少数固体物质的溶解度随温度的升高而减小 ,如 Ca(OH)2 。
九上化学 29 天早背晚默 第 21 天
晚默 DAY21
81 .混合物的分离和提纯
( 1 )分离可溶物和不溶物: 法;
(2 )铁屑和其他固体:用 反复吸引;
(3) 除去氯化钠中少量的硝酸钾: 法; 除去硝酸钾中少量的氯化钠: 法 。 82 . 固体溶解度
( 1 )概念:在一定 下 ,某固态物质在 g 溶剂里达到 状态时所溶解的 。
(2 )影响因素: 内因: 、 本身的性质;
外因: 。多数固体物质的溶解度随温度的升高而 ,如 KNO3 。少数固 体物质的溶解度受温度的变化影响 ,如 。
极少数固体物质的溶解度随温度的升高而 ,如 。
九上化学 29 天早背晚默 第 22 天
早背 DAY 22
83 .气体溶解度
( 1 )概念:在 101kPa 和一定温度下 ,在 1体积水里达到饱和状态时气体体积所溶解的气体体积 。 (2 )影响因素:影响气体溶解度的因素:温度和压强;温度越高 ,气体的溶解度越小 ;压强越大 ,气 体溶解度越大 。
84 .用固体和水配制溶液的一般步骤是:计算 、称量 、量取 、溶解 、装瓶贴标签 。用浓溶液 稀释配 制稀溶液的一般步骤是:计算 、量取 、混匀 、装瓶贴标签 。
85 .紫色石蕊溶液变色规律:酸红碱蓝中性紫 ;无色酚酞溶液变色规律:酸无碱红中性无 。
86. 写出常见酸化学式:盐酸 HCl ,硫酸 H2SO4 ,碳酸 H2CO3 ,硝酸 HNO3 ,醋酸 CH3COOH 。 87 .打开浓盐酸瓶盖可看到白雾 ,原因是浓盐酸具有挥发性 ,挥发出氯化氢跟水蒸气形成盐酸小液 滴 。浓盐酸暴露在空气中 ,溶液的质量减小 ,质量分数会减小 。
88 .浓硫酸具有吸水性 ,可作某些气体的干燥剂;可干燥 HCl、CO2、O2等, 不可干燥 NH3 。浓硫酸 暴露在空气中 ,溶液的质量增大 ,质量分数会减小 。
89 .盐酸和稀硫酸均可用于金属表面除锈, 人体胃液中含有的酸是盐酸 。
90 .稀释浓硫酸时 ,应将浓硫酸沿着烧杯内壁慢慢注入水中 ,并用玻璃棒不断搅拌 。
九上化学 29 天早背晚默 第 22 天
晚默 DAY 22
83 .气体溶解度
( 1 )概念:在 101kPa 和一定温度下 ,在 水里达到 状态时气体体积所溶解的气体 。 (2 )影响因素:影响气体溶解度的因素: 和 ;温度越高 ,气体的溶解度越 ;压强越大 ,气 体溶解度越 。
84 .用固体和水配制溶液的一般步骤是: 、 、 、 、装瓶贴标签 。用浓溶液 稀释配 制稀溶液的一般步骤是: 、 、 、装瓶贴标签 。
85 .紫色石蕊溶液变色规律:酸 碱 中性 ;无色酚酞溶液变色规律:酸 碱 中性 。
86. 写出常见酸化学式:盐酸 ,硫酸 ,碳酸 ,硝酸 ,醋酸 。 87 .打开浓盐酸瓶盖可看到 ,原因是浓盐酸具有 性 ,挥发出 跟水蒸气形成盐酸小液 滴 。浓盐酸暴露在空气中 ,溶液的质量 ,质量分数会 。
88 .浓硫酸具有 性 ,可作某些气体的 剂;可干燥 等, 不可干燥 。浓硫酸 暴露在空气中 ,溶液的质量 ,质量分数会 。
89 .盐酸和稀硫酸均可用于金属表面 , 人体胃液中含有的酸是 。
90 .稀释浓硫酸时 ,应将 沿着烧杯内壁慢慢注入 中 ,并用玻璃棒不断搅拌 。
(
九上化学
29 天
早背晚默
第
2
3
天
早背 DAY
23
91
.不慎将浓硫酸沾到皮肤或衣服上,应立即
用大量的水清洗
,然后涂上
3%~5%的
NaHCO
3
溶液
。
92
.
写出五种可溶于水的碱的化学式:
NaOH
、
KOH
、
Ba(OH)
2
、
NH
3
H
2
O
、
Ca(OH)
2
(微溶)
93 .NaOH 俗称
火碱
、
烧碱
、
苛性钠
。暴露在
空气里易吸水而
潮解
,还会吸收
CO2
而变质
,变质的
产物是
Na
2
CO
3
。可用
足量的稀盐酸
或
Ca(OH)
2
或
Ba(OH)
2
、
或
CaCl
2
或
BaCl
2
检验氢氧化钠是否变质
。
向部分变质的氢氧化钠溶液中滴加稀盐酸,稀盐酸先与
NaOH
反应,再与
Na
2
CO
3
反应,所以开始没
有气泡产生
。
94.NaOH
具有强烈的腐蚀性,用托盘天平称量时,应将
NaOH
放在
玻璃容器
中,
而不能放在
纸上
。
不慎将氢氧化钠沾到皮肤上要先用
大量的水冲洗
,再涂上
硼酸
。
95
.氢氧化钙俗称为
熟石灰
、
消石灰
,其水溶液叫
澄清石灰水
,悬浊液叫
石灰乳
、
石灰浆
。 在空气中
易与
CO
2
反应而变质,变质的产物是
CaCO
3
。装氢氧化钙溶液的瓶子上常
附有一层白膜,可用
稀盐酸
将其除去
。
96 .碱石灰是CaO和NaOH的混合物
,可作
干燥
剂
,但不能干燥
HCl
、
CO
2
等酸性气体
。 生石灰(
CaO)
常用于食品干燥剂
。
97
.用于配制波尔多液物质是
Ca(OH)
2
和
CuSO
4
。不能用铁桶装的原因
Fe会与
CuSO
4
反应
。
)
(
九上化学
29 天
早背晚默
第
2
3
天
晚默 DAY
23
91
.不慎将浓硫酸沾到皮肤或衣服上,应立即
,然后涂上 3%~5%的
溶液
。
92
.
写出五种可溶于水的碱的化学式:
、
、
、
93 .NaOH 俗称
、
、
。暴露在空气里易吸水而
,还会吸收
而变质
,变质的
产物是
。可用
检验氢氧化钠是否变质
。
向部分变质的氢氧化钠溶液中滴加稀盐酸,稀盐酸先与
反应,再与
反应,所以开始没
有气泡产生
。
94.NaOH
具有强烈的腐蚀性,用托盘天平称量时,应将 NaOH
放在
中,而不能放在
纸上
。
不慎将氢氧化钠沾到皮肤上要先用
,再涂上
。
95
.氢氧化钙俗称为
、
,其水溶液叫
,悬浊液叫
、
。 在空气中
易与
反应而变质,变质的产物是
。装氢氧化钙溶液的瓶子上常附
有一层白膜,可用
将其除去
。
96 .碱石灰是CaO和NaOH的混合物
,可作
剂
,但不能干燥
等酸性气体
。 生石灰(
CaO)
常用于食品干燥剂
。
98
.用于配制波尔多液物质是
。不能用铁桶装的原因
。
)
(
九上化学
29 天
早背晚默
第
2
4
天
早背 DAY
24
98 .溶液能导电的原因是
有自由移动的离子
。酒精能否导电?
否
,酒精是由分子构成的
。
99
.
中和反应:
酸
和
碱
作用生成
盐
和
水
的反应
。中和反应的
实质是:
酸中的
H
+
和碱中的
OH
-
结合成水分子
。
100
.
改良酸性土壤一般用
熟石灰,
中和工厂排
出的酸性污水
,一般用熟石灰
(
Ca(OH)
2
,
治疗胃酸过多一般
服用的碱是
Mg(OH)
2
、
Al(OH)
3
,一般服用的盐是
NaHCO
3
。蚁虫叮咬时分泌了蚁酸
,使皮肤瘙痒
,可
涂抹呈碱性的
肥皂水
。
101 .溶液的酸碱度可以用 pH表示,
pH的范围通常为
0-14
。
pH<7的溶液显
酸
性,
pH越小
,
酸
性越
强
;
pH=7的溶液显
中
性;
pH>7的溶液显
碱
性,
pH越大
,
碱
性越
强
。
注意:
(
1
)酸溶液 pH<7 ,但 pH<7 的溶液不一定是酸溶液
,如 CuSO
4
溶液 pH<7 ,属于盐
类;
(2
)碱溶液 pH>7 ,但 pH>7 的溶液不一定是碱溶液
,如 Na
2
CO
3
溶液 pH>7 ,属于盐类
。
102
.测定
pH
最简便的方法是使用
pH
试纸
,(
广泛
PH
试纸精确到
1
);
PH 试纸
不能
直接
放
入溶液中;如果润湿
pH
试纸
,测得酸性溶液的
pH
会偏
大
,测得酸性溶液的
pH
会偏
小
。
)
(
九上化学
29 天
早背晚默
第
2
4
天
晚默 DAY
24
98 .溶液能导电的原因是
。酒精能否导电?
。
99
.
中和反应:
和
作用生成
和
的反应
。中和反应的实质是:
。
100
.
改良酸性土壤一般用
, 治疗胃酸过多一般
服用的碱是
,一般服用的盐是
。蚁虫叮咬时分泌了蚁酸
,使皮肤瘙痒
,可
涂抹呈碱性的
。
101 .溶液的酸碱度可以用 pH表示,
pH的范围通常为
。
pH<7的溶液显
性,
pH越小
,
性越
;
pH=7的溶液显
性;
pH>7的溶液显
性,
pH越大
,
性越
。
注意:
(
1
)酸溶液 pH<7 ,但 pH<7 的溶液不一定是酸溶液
,如 CuSO
4
溶液 pH<7 ,属于盐
类;
(2
)碱溶液 pH>7 ,但 pH>7 的溶液不一定是碱溶液
,如 Na
2
CO
3
溶液 pH>7 ,属于盐类
。
102
.测定
pH
最简便的方法是使用
,(
广泛 PH
试纸精确到
);
PH
试纸
直接
放
入溶液中;如果润湿
pH
试纸
,测得酸性溶液的
pH
会偏
,测得酸性溶液的 pH 会偏
。
)
(
九上化学
29 天
早背晚默
第
2
5
天
早背 DAY
25
103
.正常雨水的
pH
约为
5.6
,
因为溶解了空气中的
CO
2
生成
H
2
CO
3
,酸雨是
pH<5.6
的雨水
。
SO
2
形成酸雨的化学方程式
SO
2
+H
2
O=H
2
SO
3
2H
2
SO
3
+O
2
=2H
2
SO
4
。
104
.盐类物质是指含有
金属
离子(或
NH
4
+
)和
酸根
离子的化合物
,按分类写出下列盐类的化学式
。
硫酸盐:硫酸钠
Na
2
SO
4
硫酸钡
BaSO
4
碳酸盐:碳酸钠
Na
2
CO
3
碳酸钙
CaCO
3
硝酸盐:硝酸钾
KNO
3
硝酸亚铁
Fe(NO
3
)
2
盐酸盐(氯化物
)
:
氯化钾
KCl
氯化钙
CaCl
2
铵盐:硝酸铵
NH
4
NO
3
氯化铵
NH
4
Cl
钠盐:硝酸钠
NaNO
3
氯化钠
NaCl
碳酸氢盐:碳酸氢钠
NaHCO
3
碳酸氢铵
NH
4
HCO
3
其它盐:高锰酸钾
KMnO
4
锰酸钾
K
2
MnO
4
氯酸
钾
KClO
3
105
.食盐主要成分是
NaCl
,可以消除积雪的原因:
降低水的凝固点
;生理盐水是
0
.09%
的氯化钠溶
液
,工业用盐如
亚硝酸钠
有毒
。
)
九上化学 29 天早背晚默 第 25 天
晚默 DAY 25
103 .正常雨水的 pH 约为 , 因为溶解了空气中的 生成 ,酸雨是 的雨水 。 SO2形成酸雨的化学方程式 SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4 。
104 .盐类物质是指含有 离子(或 )和 离子的化合物 ,按分类写出下列盐类的化学式 。
硫酸盐:硫酸钠
碳酸盐:碳酸钠
硝酸盐:硝酸钾
硫酸钡 碳酸钙
硝酸亚铁
盐酸盐(氯化物) :氯化钾 氯化钙 铵盐:硝酸铵 氯化铵 钠盐:硝酸钠 氯化钠
碳酸氢盐:碳酸氢钠 碳酸氢铵
其它盐:高锰酸钾 锰酸钾 氯酸钾
106 .食盐主要成分是 ,可以消除积雪的原因: ;生理盐水是 的氯化钠溶 液 ,工业用盐如 有毒 。
(
九上化学
29 天
早背晚默
第
2
6
天
早背 DAY
26
106
.
大理石
、石灰石的主要成分是
CaCO
3
,可用作
建筑材料
、
补钙剂
。
107.
Na
2
CO
3
,俗称为
纯碱
、
苏打
,水溶液呈
碱
性
,可用于
玻璃
,造纸
,纺织工业
,洗涤剂等
。
108
.碳酸氢钠的化学式为
NaHCO
3
,属于盐类,俗称
小苏打
,其溶液呈
碱
性,除了治疗
胃酸
过多症,
还用作
发酵粉
。
109 .检验碳酸盐的操作方法:取样,
向待测样品中加入适量的
稀盐酸
,将产生的气体通入到
澄清石
灰水
中
,如果
石灰水变浑浊
,证明含有
CO
3
2-
。
110
.复分解反应:在溶液中,
由
两种化合物
互相交换成分,
生成
另外两种化合物
的反应
。(通式:
AB+CD=AD+CB
,
口诀:双交换
,价不变)
复分解反应发生的条件:只有当两种化合物互相交换成分,
生成物中有
沉淀
或有
气体
或
有
水
生成时,
复分解反应才能发生
。
111 .我国制碱工业先驱侯德榜发明了“联合制碱法 ”(又称侯氏制碱法)制得的“碱
”是
纯碱
。
112 .植物生长需要量较大的元素是
氮
、
磷
、
钾
;如果含其中的两种或
以上元素叫
复合
肥
。
叶发黄
,缺
氮
肥;茎不壮易倒伏
,缺
钾
肥;抗寒抗旱靠
磷
肥;灰色粉末
是
磷
肥
,液体化肥是
氨水
,一
般难溶于水的肥是
磷
肥;
常温下有氨味的是
碳酸氢铵
。
)
(
九上化学
29 天
早背晚默
第
2
6
天
晚默 DAY
26
106
.
大理石
、石灰石的主要成分是
,可用作
、
。
107.
Na
2
CO
3
,俗称为
、
,水溶液呈
性
,可用于
,造纸
,纺织工业
,洗涤剂等
。
108
.碳酸氢钠的化学式为
,属于盐类,俗称
,其溶
液呈
性,除了治疗
过多症,
还用作
。
109 .检验碳酸盐的操作方法:取样,
向待测样
品中加入适量的
,将产生的气体通入到
中
,如果
,证明含有 CO
3
2-
。
110
.复分解反应:在溶液中,
由
互相交换成分,
生成
的反应
。(通式:
AB+CD=AD+CB
,
口诀:双交换
,价不变)
复分解反应发生的条件:只有当两种化合物互相交换成分,
生成物中
有
或有
或有
生成时,
复分解反应才能发生
。
111 .我国制碱工业先驱侯德榜发明了“联合制碱法 ”(又称侯氏制碱法)制得的“碱 ”是
。
112 .植物生长需要量较大的元素是
、
、
;如果含其中的两种
或以上元素叫
肥
。
叶发黄
,缺
肥;茎不壮易倒伏
,缺
肥;抗寒抗旱靠
肥;灰色粉末是
肥
,液体化肥是
,一
般难溶于水的肥是
肥;
常温下有氨味的是
。
)
九上化学 29 天早背晚默 第 27 天
早背 DAY 27
113 .铵态氮肥加熟石灰研磨:会放出具有刺激性气味的氨气 。(尿素是不是铵态氮肥?不是)
114 .草木灰主要成分是碳酸钾 ,其溶液呈碱性, 不能与铵态氮肥混用 ,这样会让化肥失去肥效 。
115.氨水化学式:NH3 ·H2O,属于碱类 。是 NH3溶于水得到的溶液,溶液存在的离子是 NH4+和 OH- 。 除去粗盐中难溶性杂质:
( 1 )主要步骤是:①溶解②过滤③蒸发④计算产率 。 玻璃棒在溶解过程的作用是搅拌 ,加速溶解, 过滤时玻璃棒的作用是引流, 防止液滴飞溅 。
(2 )在蒸发操作时 ,要用玻璃棒不断搅拌, 防止局部过热导致液滴飞溅, 当蒸发皿中有较多固体析出 时 ,停止加热 ,利用蒸发皿的余温使滤液蒸干 。
116 . 除去粗盐中可溶性杂质( MgCl2 .CaCl2. Na2SO4 ) 的一般方法
( 1 )先加过量的 NaOH除去 Mg2+;
(2 )加过量的 BaCl2除去 SO42-;
(3 )加过量的 Na2CO3除去 Ca2+和过量的 Ba2+;
(4 )这时滤液中含有 NaCl 和 NaOH 、Na2CO3 ,再加适量的稀盐酸, 除去过量的 OH-和 CO32-;
(5 )最后蒸发结晶得到精盐 。( Na2CO3 溶液一定要在 BaCl2 溶液之后)
九上化学 29 天早背晚默 第 27 天
晚默 DAY 27
113 .铵态氮肥加熟石灰研磨:会放出具有刺激性气味的 。(尿素是不是铵态氮肥? )
114 .草木灰主要成分是 ,其溶液呈 性, 不能与铵态氮肥混用 ,这样会让化肥失去肥效 。
115.氨水化学式: ,属于 类 。是 溶于水得到的溶液,溶液存在的离子是 和 。 除去粗盐中难溶性杂质:
( 1 )主要步骤是:① ② ③ ④ 。 玻璃棒在溶解过程的作用是 , 过滤时玻璃棒的作用是 。
(2 )在蒸发操作时 ,要用玻璃棒不断搅拌, 防止 , 当蒸发皿中 时 ,停止加热 ,利用 使滤液蒸干 。
116 . 除去粗盐中可溶性杂质(MgCl2 .CaCl2. Na2SO4) 的一般方法
( 1 )先加过量的 除去 Mg2+;
(2 )加过量的 除去 SO42-;
(3 )加过量的 除去 Ca2+和过量的 Ba2+;
(4 )这时滤液中含有 NaCl 和 NaOH 、Na2CO3 ,再加适量的 , 除去过量的 OH-和 CO32-;
(5 )最后 得到精盐 。( Na2CO3 溶液一定要在 BaCl2 溶液之后)
(
九上化学
29 天
早背晚默
第
2
8
天
早背 DAY
28
117
.
人类所需营养素有
蛋白质
、
糖类
、
油脂
、
维生素
、
无机盐
、
水
六大类
。其中能提供能量 的是:
蛋白质
、
糖类
、
油脂
。糖类由
C
、
H
、
O
元素组成;
人体需要
的能量主要来自:
糖类
。
118 .维生素不能提供能量;缺少维生素
A会引起
坏血病
;缺少维生素 C
会引起
夜盲症
。
119 .幼儿及青少年缺钙会得
佝偻病
,老年人缺钙会发生
骨质疏松
,容易骨折
。
120
.(
1
)主要存在于骨骼和牙齿中的元素
Ca
。
(2
)Fe元素是血红蛋白的成分
,摄入量过低会引起
贫血
。
(3
)缺乏
F
元素易产生龋齿
。
(4
)缺少会引起食欲不振,
生长迟缓
,发育不良的元素
Z
n
。
(5
)摄入碘不合理会引起
甲状腺肿大
。
)
(
九上化学
29 天
早背晚默
第
2
8
天
晚默 DAY
28
117
.
人类所需营养素有
、
、
、
、
、
六大类
。其中能提供能量
的是:
、
、
。糖类由
、
、
元素组成;
人体需要的能
量主要来自:
。
118 .维生素不能提供能量;缺少维生素 A会引起
;缺少
维生素 C 会引起
。
119 .幼儿及青少年缺钙会得
,老年人缺钙会发生
,容易骨折
。
120
.(
1
)主要存在于骨骼和牙齿中的元素
。
(2
)Fe元素是血红蛋白的成分
,摄入量过低会引起
。
(3
)缺乏
元素易产生龋齿
。
(4
)缺少会引起食欲不振,
生长迟缓
,发育不良的元素
。
(5
)摄入碘不合理会引起
。
)
(
九上化学
29 天
早背晚默
第
2
9
天
早背 DAY29
121 .甲烷
CH
4
乙醇
C
2
H
5
OH
葡萄糖
C
6
H
12
O
6
属于有机小分子;
蛋白质
、
淀粉
、
纤维素
属
于有机高
分子
。
122 .区别天然纤维和合成纤维的方法是
灼烧闻气味
,如果有
烧纸
气味的是棉纤维;有
烧焦羽毛
气味的
是羊毛
,真丝;如果有
刺激性
气味则是合成纤维(涤纶
,锦纶
,腈纶)等
。
123 .链状结构的高分子材料具有
热塑
性,
而多数网状结构材料不会受热熔化,
因而具有
热固
性
124 .三大合成材料(有机高分子合成材料):
塑料
、
合成纤维
、
合成橡胶
。金属材料包括:
纯金属
和
合金
。列举两种复合材料:
玻璃钢
、
钢筋混凝
土
、
碳纤维复合材料
。玻璃是
无机非金属
材料;有机
玻璃是
合成
材料
。合金是
金属材料
。
)
(
九上化学
29 天
早背晚默
第
2
9
天
晚默 DAY29
121 .甲烷
乙醇
葡萄糖
属于有
机小分子;
、
、
属于有机高
分子
。
122 .区别天然纤维和合成纤维的方法是
,如果有
气味的是棉纤维;有
气味的
是羊毛
,真丝;如果有
气味则是合成纤维(涤纶
,锦纶
,腈纶)等
。
123 .链状结构的高分子材料具有
性,
而多数网状结构材料不会受热熔化,
因而具
有
性
124 .三大合成材料(有机高分子合成材料
):
、
、
。金属材料包括:
和
。列举两种复合材料:
、
、
。玻璃是
材料;有机
玻璃是
材料
。合金是
。
)
九上化学
29 天
早背晚默
第
1
天
早背 DAY
1
1.空气主要是由
氧气
和
氮气
组成的,按体积分数计算各约占
21
%和
78
%,稀有气体占
0.94
%,
C
O2
占
0.03
%稀有气体包括
氦
、
氖
、
氩
、氪
、氙
、氡
。
2
.
写出下列物质的化学符号:氧气
O
2
;氮气
N
2
;水
H
2
O
;二氧化碳
CO
2
;磷
P
;五氧化
二
磷
P
2
O
5
;氦气
He
;氖气
Ne
;氩气
Ar
。
3
.
空气质量指数计入评价的主要污染物为:
SO
2
、
CO
、
NO
2
、可吸入颗粒物和
臭氧
等
。
4
. 目前环境污染问题:臭氧层破坏(
氟利昂
、氮的氧化物等)
、温室效应(
CO
2
、CH
4
等)
、
酸
雨(
NO
2
、
SO
2
等)
、白色污染(
塑料
垃
圾等)
5
.
由两种或两种以上物质生成另一种物质的反应叫做
化合反应
;物质跟氧发生的反应叫做
氧化反应
。
动植物呼吸
、食物的腐败
、酒和醋的酿造
、钢铁生锈等属于
缓慢氧化
。
6
.氧气的用途:
(
1
)
供给呼吸
(如潜水
、医疗急救
);
(2
)
支持燃烧
(如燃料燃烧
、炼钢
、气焊)
)
(
九上化学
29 天
早背晚默
第
1
天
晚默 DAY
1
1.空气主要是由
和
组成的,按体积分数计算各约占
%和
%,稀有气体占
%,
CO2
占
%稀有气体包括
、
、
、氪
、氙
、氡
。
2
.
写出下列物质的化学符号:氧气
;氮气
;水
;二氧化碳
;磷
;五氧化二
磷
;
氦气
;氖气
;氩气
。
3
.
空气质量指数计入评价的主要污染物为:
、
、
、可吸入颗粒物
和
等
。
4
. 目前环境污染问题:臭氧层破坏(
、氮的氧化物等)
、温室效应(
、CH4 等)
、
酸
雨(
、
等)
、白色污染(
垃圾等)
5
.
由两种或两种以上物质生成另一种物质的反应叫做
;物质跟氧发生的反应叫做
。
动植物呼吸
、食物的腐败
、酒和醋的酿造
、钢铁生锈等属于
。
6
.氧气的用途:
(
1
)
(
如潜水
、医疗急救
);
(2
)
(
如燃料燃烧
、炼钢
、气焊)
)
九上化学 29 天早背晚默 第 2 天
早背 DAY 2
7 .水的净化方法:静置沉淀 、吸附沉淀 、过滤 、活性炭吸附 、消毒杀菌 、蒸馏等 。
( 1 )静置沉淀:让较大的颗粒自然沉降 。
(2)吸附沉淀:加絮凝剂明矾,利用其溶于水生成的胶状物对杂质的吸附,使杂质沉降下来 (生成胶 状物的过程属于化学变化, 吸附杂质的过程属于物理变化) 。
(3 )过滤: 除去水中的不溶性杂质 。
(4 )活性炭吸附:活性炭的结构疏松多孔 ,具有吸附性 ,可以吸附水中的色素和异味等 。
(5 )投药消毒:一般用漂白粉 、氯气 、臭氧 、二氧化氯等 ,该过程属于化学变化 。
(6 )其中净化程度最高的是蒸馏 。 8 .硬水和软水:
( 1)定义:硬水是含有较多可溶性钙 、镁化合物的水;软水是不含或含较少可溶性钙 、镁化 合物的水 。
(2 )鉴别方法:加入等量的肥皂水 ,浮渣较多 、泡沫较少的是硬水 ,泡沫较多 、浮渣较少的 是软水 。
(3 )硬水软化的方法:实验室——蒸馏 、生活中——煮沸 。
九上化学 29 天早背晚默 第 2 天
早背 DAY 2
(
7 .水的净化方法:
、
、
、
、
、
。
(
1
)静置沉淀:让较大的颗粒
。
)
(2)吸附沉淀:加絮凝剂 ,利用其溶于水生成的胶状物对杂质的 ,使杂质沉降下来 (生成胶 状物的过程属于 变化, 吸附杂质的过程属于 变化) 。
(3 )过滤: 除去水中的 杂质 。
(4 )活性炭吸附:活性炭的结构疏松多孔 ,具有 性 ,可以吸附水中的 和 等 。
(5 )投药消毒:一般用漂白粉 、氯气 、臭氧 、二氧化氯等 ,该过程属于 变化 。
(6 )其中净化程度最高的是 。 8 .硬水和软水:
( 1)定义:硬水是含有较多可溶性钙 、镁化合物的水;软水是 可溶性钙 、镁化 合物的水 。
(2 )鉴别方法:加入等量的 、 的是硬水 ,泡沫较多 、浮渣较少的 是软水 。
(3 )硬水软化的方法:实验室—— 、生活中—— 。
九上化学 29 天早背晚默 第 3 天
早背 DAY 3
9 .氢气验纯时判断是否纯净:发出尖锐爆鸣声 ,表明气体不纯 ,声音很小则表示气体较纯 。 10 .单质和化合物
( 1 )单质: 由同种元素组成的纯净物 。
(2 )化合物: 由不同种元素组成的纯净物 。
(3 )氧化物: 由两种元素组成的化合物 ,其中一种是氧元素 。
11 . 写出元素符号 Fe 的意义:( 1 )铁元素;( 2) 1个铁原子;( 3 )铁这种物质 。
12 . 写出化学式 SO2的意义:
( 1 )二氧化硫这种物质;
(2 )二氧化硫由硫元素和氧元素组成;
(3) 1个二氧化硫分子;
(4) 1个二氧化硫分子由 1个硫原子和 2个氧原子构成 。
(
九上化学
29 天
早背晚默
第
3
天
)
(
9 .氢气验纯时判断是否纯净:发出
,表明气体不纯
,
则表示气体较纯
。
10
.单质和化合物
(
1
)单质:
由
元素组成的
。
(2
)化合物:
由
元素组成的
。
(3
)氧化物:
由
元素组成的化合物
,其中一种是
元素
。
11
.
写出元素符号 Fe 的意义
:(
1
)
;(
2
)
;(
3
)
。
12
.
写出化学式
SO
2
的意义:
(
1
)
;
(2
)
;
(3
)
;
(4
)
。
) (
晚默 DAY
3
)
(
九上化学
29 天
早背晚默
第
4
天
)
(
早背 DAY
4
)
(
13
.
写出下列化学符号中“2 ”表示的意义
。
(
1
)CO
2
1个二氧化碳分子中有
2个氧原子
;
(2
)Ca
2+
1个钙离子带
2个单位正电荷
;
(3
)
氧化镁中镁元素的化合价为+2价
(4
)2P
2个磷原子
14 .按要求写出下列化学符号
。
(
1
)+3
价的铁的氧化物
Fe
2
O
3
;
(2
)标出氯化锌中锌元素的化合价
;
(3
)2个氢原子
2H
;
(4
)硝酸根离子
NO
3
-
;
(5
)写出氢氧化镁的化学式并标出镁元素的化合价
)
(
九上化学
29 天
早背晚默
第
4
天
)
(
13
.
写出下列化学符号中“2 ”表示的意义
。
(
1
)CO
2
;
(2
)Ca
2+
;
(
3
)
(4
)2P
14 .按要求写出下列化学符号
。
(
1
)+3
价的铁的氧化物
;
(2
)标出氯化锌中锌元素的化合价
ZnCl
2
;
(3
)2个氢原子
;
(4
)硝酸根离子
;
(5
)写出氢氧化镁的化学式并标出镁元素的化合价
) (
晚默 DAY
4
)
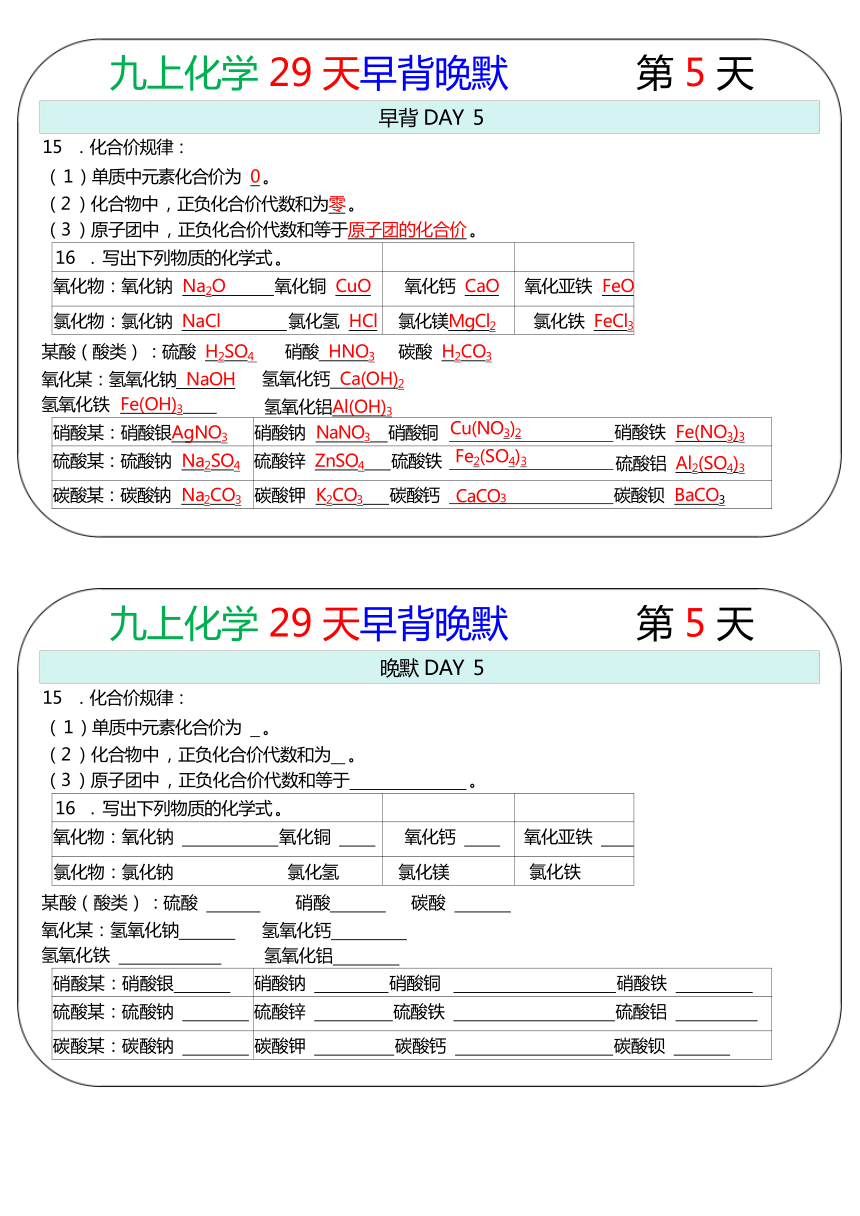
九上化学 29 天早背晚默 第 5 天
早背 DAY 5
15 .化合价规律:
( 1 )单质中元素化合价为 0 。
(2 )化合物中 ,正负化合价代数和为零 。
(3 )原子团中 ,正负化合价代数和等于原子团的化合价 。
16 . 写出下列物质的化学式 。
氧化物:氧化钠 Na2O 氧化铜 CuO 氧化钙 CaO 氧化亚铁 FeO
氯化物:氯化钠 NaCl 氯化氢 HCl 氯化镁MgCl2 氯化铁 FeCl3
某酸(酸类) :硫酸 H2SO4 硝酸 HNO3 碳酸 H2CO3
(
氢氧化钙
Ca(OH)
2
氢氧化铝
Al(OH)
3
)氧化某:氢氧化钠 NaOH 氢氧化铁 Fe(OH)3
硝酸某:硝酸银AgNO3 硝酸钠 NaNO3 硝酸铜 Cu(NO3)2 硝酸铁 Fe(NO3)3
硫酸某:硫酸钠 Na2SO4 硫酸锌 ZnSO4 硫酸铁 Fe2(SO4)3 硫酸铝 Al2(SO4)3
碳酸某:碳酸钠 Na2CO3 碳酸钾 K2CO3 碳酸钙 CaCO3 碳酸钡 BaCO3
九上化学 29 天早背晚默 第 5 天
晚默 DAY 5
15 .化合价规律:
( 1 )单质中元素化合价为 。
(2 )化合物中 ,正负化合价代数和为 。
(3 )原子团中 ,正负化合价代数和等于 。
16 . 写出下列物质的化学式 。
氧化物:氧化钠 氧化铜 氧化钙 氧化亚铁
氯化物:氯化钠 氯化氢 氯化镁 氯化铁
某酸(酸类) :硫酸 硝酸 碳酸
(
氢氧化钙
氢氧化铝
)氧化某:氢氧化钠 氢氧化铁
硝酸某:硝酸银 硝酸钠 硝酸铜 硝酸铁
硫酸某:硫酸钠 硫酸锌 硫酸铁 硫酸铝
碳酸某:碳酸钠 碳酸钾 碳酸钙 碳酸钡
(
九上化学
29 天
早背晚默
第
6
天
早背 DAY
6
17.写出下物质的名称
。Fe
2
O
3
氧化铁
、AgCl
氯化银
、HCl
氯化氢
、Al(OH)
3
氢氧化铝
、Fe(NO
3
)
2
硝酸亚铁
、CuSO
4
硫酸铜
、MgSO
4
硫酸镁
、(NH
4
)
2
CO
3
碳酸铵
18
.构成物质的粒子有:
分子
、
原子
、
离子
。铁是由
铁原子
构成
,水由
水分子
构成
,氯化钠由
钠离子
和氯离子
构成
。
19.
由分子构成的物质
,分子是保持其
化学性质
的最小粒子
。保持氧气化学性质的最小粒子是
氧分子
保持二氧化碳化学性质的最小粒子是
二氧化
碳分子
注意:单个分子只能保持物质的化学性质,不能保持
物质的
物理性质
。物质的
物理性质
如颜色
、状态
、气味
、沸点等宏观性质,是
由大量分子聚集在一起表
现的性质
。
20
.分子是由
原子
构成的
,如:
1个二氧化碳(
CO
2
)分子是由
1个碳原子和
2
个氧原子
构成
。
1
个水分子(
H
2
O)是由
2个氢原子和 1
个氧原子
构成
。
21
.化学变化的实质:在化学变化中
,
分子
可以分裂成
原子
,
原子
又可以结
合成新的
分子
。
可见
,在化学变化中
,分子的种类
会
发生变化
,原子的种
类
不会
发生改变
。因此
,原子是化学变化 中
的
最小粒子
。
)
(
九上化学
29 天
早背晚默
第
6
天
晚默 DAY
6
17.写出下物质的名称
。
Fe
2
O
3
、AgCl
、HCl
、
Al(OH)
3
、
Fe(NO
3
)
2
、
CuSO
4
、
MgSO
4
、
(NH
4
)
2
CO
3
18
.构成物质的粒子有:
、
、
。铁是由
构成
,水由
构成
,氯化钠由
构成
。
19.
由分子构成的物质
,分子是保持其
的最小粒子
。保持氧气
化学性质的最小粒子是
保持二氧化碳化学性质的最小粒子是
注意:单个分子只能保持物质的化学性质,不能保持
物质的
。物质的
如颜色
、状态
、气味
、沸点等宏观性质,是
。
20
.分子是由
构成的
,如:
1个二氧化碳(
CO
2
)分子是由
构成
。
1
个水分子(
H
2
O
)是由
构成
。
21
.化学变化的实质:在化学变化中
,
可以分裂成
,
又可以结合成新的
。
可见
,在化学变化中
,分子的种类
发生变化
,
原子的种类
发生改变
。因此
,原子是化学变化
中
的
。
)
九上化学 29 天早背晚默 第 7 天
早背 DAY 7
22 .分子和原子的区别与联系:
( 1) 区别:化学变化中 ,分子要分成原子, 而原子却不能再分 。
(2 )联系:分子由原子构成 ,分子和原子都可直接构成物质 。
23 .用化学符号表示:3个二氧化碳分子 3CO2 ,2个氢原子 2H ,2个氧分子 2O2 。
24 .原子的结构:原子由居于原子中心的原子核和核外电子构成;原子核由质子和中子构成 。 25 .原子不显电性的原因:原子核所带的电荷与核外电子所带电荷电量相等, 电性相反 。
26 .原子核外电子的排布
( 1 )核外电子是_分层运动_ 的 。
(2 )核外电子排布的规律:第一层最多 2个 。第二层最多 8个 。最外层不超过 8个(只有一 层不超 过 2个)
27 .原子和离子的区别:
( 1 )原子:质子数= 电子数; (2 )离子:质子数≠电子数;
(3) 阳离子:质子数> 电子数; (4) 阴离子:质子数< 电子数 。
九上化学 29 天早背晚默 第 7 天
晚默 DAY 7
22 .分子和原子的区别与联系:
( 1) 区别:化学变化中 ,分子要分成 , 而原子却不能 。
(2 )联系:分子由 构成 ,分子和原子都可直接构成 。
23 .用化学符号表示:3个二氧化碳分子 ,2个氢原子 ,2个氧分子 。
24 .原子的结构:原子由居于原子中心的 和 构成;原子核由 和 构成 。 25 .原子不显电性的原因:原子核所带的电荷与核外电子所带电荷 。
26 .原子核外电子的排布
( 1 )核外电子是 _ 的 。
(2 )核外电子排布的规律:第一层最多 个 。第二层最多 个 。最外层不超过 个(只有一 层不超 过 个)
27 .原子和离子的区别:
( 1 )原子:质子数 电子数; (2 )离子:质子数 电子数;
(3) 阳离子:质子数 电子数; (4) 阴离子:质子数 电子数 。
(
九上化学
29 天
早背晚默
第
8
天
早背 DAY
8
28 .原子中的等量关系:核电荷数=
质子
数=
核外电子
数=原子序数
。
29 .相对原子质量 ≈
质子数
+
中子数
。
钠原子的相对原子质量为
23 ,核电荷数为 11 ,则中子
数为
12
。
30 .元素:
质子数
(即
核电荷数
)相同的一类原子的总称
。
31 .元素的种类由
质子数(或核电荷数)
决定,
不同种元素的本质区别是
质子数(或核电荷 数)不
同
。
32 .元素的化学性质主要是由
原子的最外层电子数
决定
。
33 .地壳中元素的含量:前四位的元素名称和符号
依次是氧(O)
、
硅(Si)
、
铝(Al)
、
铁(
Fe
)
,
其中最多的金属元素是
Al
,
它与最多的非金
属元素组成的物质符号是
Al
2
O
3
。
34
.
门捷列夫
发现了元素周期律并制作了元素
周期表
。
·
35 .元素所在的周期数等于原子的
电子层数
,元素所在的主族数等于原子的
最外层电子数
。
)
(
九上化学
29 天
早背晚默
第
8
天
晚默 DAY
8
28 .原子中的等量关系:核电荷数=
数=
数=原子序数
。
29
.相对原子质量 ≈
+
。
钠原子的相对原子质量为
23 ,核电荷数为 11 ,则中子数为
。
30 .元素
:
(
即
)相同的一类原子的总称
。
31 .元素的种类由
决定,
不同种元素的本质区别是
。
32 .元素的化学性质主要是由
决
定
。
33 .地壳中元素的含量:前四位的元素名称和
符号依次是氧(O)
、
、
、
,
其中最多的金属元素是
,
它与最多的非金属元素组成的物质符号
是
。
34
.
发现了元素周期律并制作了元素周期表
。
·
35 .元素所在的周期数等于原子的
,元素所在的主族
数等于原子的
。
)
九上化学 29 天早背晚默 第 9 天
早背 DAY 9
36 .元素周期表:
( 1)有 7 个横行,18 个纵行 。每一个横行叫一个周期(共 7个周期), · 每一个纵行叫一个族(8 , 9 , 10 三个纵行共同组成一个族)(共 16个族) 。.
(2 )排列规律:每周期从左往右依次为金属元素 、非金属元素 、稀有气体元素(第七周期例外) 37 .根据镁原子结构示意图回答有关问题:
( 1 )镁位于元素周期表第三周期;
(2 )镁位于元素周期表第 2 主族;
(3 )镁离子的最外层电子数是 8 。
38.物质都是由元素组成的 。如二氧化碳(CO2 )由碳元素和氧元素组成;高锰酸钾( KMnO4) 由钾 元素 、锰元素和氧元素组成 。
九上化学 29 天早背晚默 第 9 天
晚默 DAY 9
36 .元素周期表:
( 1)有 7 个横行,18 个纵行 。每一个横行叫一个 (共 个周期), · 每一个纵行叫一个 (8 , 9 , 10 三个纵行共同组成一个族)(共 个族) 。.
(2 )排列规律:每周期从左往右依次为 、 、 (第七周期例外) 37 .根据镁原子结构示意图回答有关问题:
( 1 )镁位于元素周期表第 周期;
(2 )镁位于元素周期表第 主族;
(3 )镁离子的最外层电子数是 。
38.物质都是由 组成的 。如二氧化碳(CO2 )由 组成;高锰酸钾( KMnO4) 由 、 组成 。
九上化学 29 天早背晚默 第 10 天
早背 DAY 10
39 .金刚石是天然存在的最硬的物质 ,可用于制钻石 、刻划玻璃 、钻探机钻头等 。
40 .石墨是最软的矿物之一 ,有优良的导电性 ,润滑性 。可用于制铅笔芯 、干电池的电极等 。
41 .金刚石和石墨都是由碳元素组成的单质 ,物理性质差别大的原因是碳原子的排列方式不 同, 它 们的化学性质相同 。
42 . 因为活性炭的结构疏松多孔 ,所以具有吸附性, 常用作防毒面具的吸附剂 。
43 .C60 分子是一种由60个碳原子构成的分子, 它形似足球 ,这种足球结构的碳分子很稳定 。
44 .物质与氧发生的反应叫氧化反应,含氧化合物里的氧被夺去的反应叫还原反应 。在化学 反应中, 供给氧的物质叫氧化剂 ,得氧的物质叫还原剂 。在化学反应中 ,物质供给氧的性质叫氧 化性 ,物质 夺取氧的性质叫还原性 。
45 .CO2的物理性质:标况下 ,一种无色 ,无味的气体 ,密度比空气大 ,能溶于水 ,高压低温下可得 固态二氧化碳(俗称干冰) 。
46 .CO 的物理性质:标况下 ,一种无色 ,无味的气体 ,密度比空气略小 ,难溶于水 ,只能用排水法 收集, 不能用向下排空气法收集 。
47 .CO 和 CO2 的化学性质有很大差异的原因是:分子的构成不同 。
(
九上化学
29 天
早背晚默
第
1
0
天
晚默 DAY
10
39 .金刚石是天然存在的
的物质
,可用于制钻石
、刻划玻璃
、钻探机
等
。
40 .石墨是
的矿物之一
,有优良的
性
,润滑性
。可用于制铅笔芯
、干电池的
等
。
41
.金刚石和石墨都是由碳元素组成的
,物理性质差别大的原因是
,
它
们的化学性质
。
42
.
因为活性炭的结构疏松多孔
,所以具有
性,
常用作防毒面具的
剂
。
43 .C
60
分子是一种由
构成的分子,
它形似足球
,这种足球结构的碳分子很
。
44
.物质与氧发生的反应叫
,含氧化合物里的氧被夺去的反应叫
。在化学 反应中,
供给氧的物质叫
,得氧的物质叫
。在化学反应中
,物质供给氧的性质叫
,物质
夺取氧的性质叫
。
45 .CO
2
的物理性质:标况下
,一种无色
,无味的气体
,密度比空气
,
溶于水
,
高压低温下可得
固态二氧化碳(俗称
)
。
46 .CO 的物理性质:标况下
,一种无色
,无味的气体
,密度比空气
,
溶于水
,只能用
收集,
不能用
收集
。
47 .CO 和 CO
2
的化学性质有很大差异的原因是:
。
)
九上化学 29 天早背晚默 第 11 天
早背 DAY 11
48 .CO2的用途
( 1 )灭火: 既利用了二氧化碳的物理性质( 二氧化碳的密度比空气大) ;又利用了二氧化碳的化学性 质( 一般情况下 ,二氧化碳既不能燃烧 ,也不能支持燃烧) 。
(2 )干冰(固体二氧化碳) :干冰升华吸收大量的热, 因此干冰可用于人工降雨 、制冷剂 。
(3 )光合作用:作气体肥料 ,可以提高农作物的产量 。
49 .CO的用途:( 1 )可燃性:作气体燃料( 2 )还原性: 冶炼金属 。
50 .燃烧
( 1 )定义:通常情况下 ,可燃物与氧气发生的一种发光 、放热的剧烈的氧化反应 。
(2 )影响燃烧现象的因素:可燃物的性质 、氧气的浓度与氧气的接触面积 。
51.燃烧需要三个条件:( 1 )可燃物;(2 )与氧气(或空气)接触;(3 )温度达到可燃物的着火点 。
灭火只需满足下列条件之一:①清除可燃物;② 隔绝氧气(或空气) ;③使温度降到着火点以下 。 灭火的根本就是要破坏燃烧的条件 。
52 . 图书 、档案等着火 ,应该用二氧化碳灭火器进行灭火 ,原因是灭火时不会留下任何痕迹 而使物 体损坏 。
九上化学 29 天早背晚默 第 11 天
晚默 DAY 11
48 .CO2的用途
( 1 )灭火: 既利用了二氧化碳的物理性质( ) ;又利用了二氧化碳的化学性 质( ) 。
(2 )干冰(固体二氧化碳) :干冰升华 大量的热, 因此干冰可用于 、 。
(3 )光合作用:作 ,可以提高农作物的产量 。
49 .CO的用途:( 1 )可燃性:作 ( 2 )还原性: 。
50 .燃烧
( 1 )定义:通常情况下 , 与 发生的一种 、 的剧烈的 。
(2 )影响燃烧现象的因素:可燃物的 、氧气的 与氧气的 。
51.燃烧需要三个条件:( 1) ;(2) ;(3) 。
灭火只需满足下列条件之一:① ; ② ; ③ 。 灭火的根本就是要 。
52 . 图书 、档案等着火 ,应该用 灭火器进行灭火 ,原因是
。
(
九上化学
29 天
早背晚默
第
1
2
天
早背 DAY
12
53 .用化学知识解释下列生活中的现象
。
(
1
)生煤炉火时,
需先引燃纸和木材,
因为
纸和木材的着火点比煤低
,容易点燃
。
(2
)室内起火不能打开门窗,
因为
会增加空气的流通
,增加氧气的浓度
,反应剧烈
,燃烧更旺
。
(3
)用扇子扇煤炉火越扇越旺
,因为
虽然降低了温度
,但没有降至着火点以下
,反
而增加了
空气的流
通
,所以越扇越旺
。而用扇子扇蜡烛火焰一扇就灭,
因为
虽然增加了空气的流通
,但却降低了温度至着
火点以下
,所以一扇就灭
。
(4)
电器着火
,应先
切断电源
,再
灭火
。
54
.
可燃性
气体(如 H
2
.CO
、甲烷等)
、面粉
、煤粉等粉尘和
空气(或氧气)
混合
,在
有限
的空间
里
,遇到明火就会急剧地燃烧
,可能发生爆炸
事故
。所以可燃性气体在点燃或加热前都要
验纯
,
防止发
生爆炸
。
55 .化石燃料包括
煤
、
石油
、
天然气
,
都是
混合物
,都是
不可
再生能源
。
56
.煤的干馏:将煤隔绝空气加强热,属于
化学
变化,主要产品有焦炭
、煤焦油
、煤气(主要成分为
CO
)
等
。
)
(
九上化学
29 天
早背晚默
第
1
2
天
晚默 DAY
12
53 .用化学知识解释下列生活中的现象
。
(
1
)生煤炉火时,
需先引燃纸和木材,
因为
。
(2
)室内起火不能打开门窗,
因为
。
(3
)用扇子扇煤炉火越扇越旺
,因为
。而用扇子扇蜡烛火焰一扇就灭,
因为
。
(4)
电器着火
,应先
,再
。
54
.
气体(如 H
2
.CO
、甲烷等)
、面粉
、煤粉等粉尘和
混合
,在
的空间
里
,遇到明火就会急剧地燃烧
,可能发生爆炸事故
。所以可燃性气体在点燃或加热前都要
,
防止发
生爆炸
。
55 .化石燃料包括
、
、
,都是
,都是
再生能源
。
5
6
.煤的干馏:将煤隔绝空气加强热,属于
变化,主要产品有焦炭
、煤焦油
、煤气(主要
成分为
)
等
。
)
九上化学 29 天早背晚默 第 13 天
早背 DAY 13
57 .石油的分馏:根据各成分的沸点不同 ,将它们分离 ,属于物理变化 ,主要产品有汽油 、煤 油 、柴 油 、润滑油等 。
58 .天然气的主要成分是甲烷 。甲烷是一种无色 、无味的气体 ,难溶于水 ,密度比空气小 。
59 .燃料充分燃烧要考虑两点:一是燃烧时空气充足;二是燃料与空气有足够大的接触面积 。
60 .造成酸雨的气体主要是二氧化硫( SO2 ) 、二氧化氮( NO2 ) 。 61 . 乙醇汽油属于混合物 。
用乙醇汽油作为燃料的主要优点:节省石油资源 、减少汽车尾气的污染 。 62 . 写出化学方程式
( 1) 甲烷燃烧:CH4+2O2 点燃 = CO2+2H2O 。
(2 )酒精燃烧:C2H5OH+3O2 点燃 = 2CO2+3H2O ;酒精是可再生能源 。
(
九上化学
29 天
早背晚默
第
1
3
天
晚默 DAY
1
3
57
.石油的分馏:根据各成分的
不同
,将它
们分离
,属于
变化
,主要产品有汽油
、煤
油
、柴
油
、润滑油等
。
58 .天然气的主要成分是
。甲烷是一种无色
、无味的气体
,
溶于水
,密度比空气
。
59 .燃料充分燃烧要考虑两点:一是
;二是
。
60 .造成酸雨的气体主要是
、
。
61
.
乙醇汽油属于
。
用乙醇汽油作为燃料的主要优点:
、
.
62
.
写出化学方程式
(
1)
甲烷燃烧:
。
(2
)酒精燃烧:
;酒精是
能源
。
)
九上化学 29 天早背晚默 第 14 天
早背 DAY 14 63 .检验某可燃物是否含碳 、氢元素的方法
( 1 )检验可燃物含氢元素的方法: 点燃 ,在可燃物上方罩一个冷而干燥的烧杯 ,烧杯内壁出 现水雾, 说明生成了水 ,证明含有氢元素;
(2 )检验可燃物含碳元素的方法:把上述烧杯迅速倒过来 ,立即注入澄清石灰水 ,振荡 ,变 浑浊 , 说明生成了二氧化碳 ,证明含有碳元素 。(或点燃 ,在可燃物上方罩一个内壁涂有澄清石灰水的烧杯, 变浑浊 ,说明生成了二氧化碳 ,证明含有碳元素 。)
64 .影响燃烧现象剧烈程度的因素:可燃物的性质 、氧气的浓度 、与氧气的接触面积 。 65 .燃料不充分燃烧的缺点:放出的热量少 ,浪费资源 、生成 CO 等污染空气的物质 。
66 .氢能源的优点:可用水作原料 ,有广泛的来源 、燃烧后产物无污染 、热值高 ,未能广泛 应用的 原因:制取成本高 、贮存困难 。
67 . 人们正利用和开发的新能源有太阳能 、风能 、地热能 、潮汐能 、生物质能 、核能 。 68 .金属材料分类:包括纯金属和合金 。
九上化学 29 天早背晚默 第 14 天
晚默 DAY 14 63 .检验某可燃物是否含碳 、氢元素的方法
( 1 )检验可燃物含氢元素的方法: 点燃 ,在可燃物上方罩一个 的烧杯 ,烧杯内壁出 现 , 说明生成了 ,证明含有氢元素;
(2 )检验可燃物含碳元素的方法:把上述烧杯迅速倒过来 ,立即注入 ,振荡 ,变 , 说明生成了 ,证明含有碳元素 。(或点燃 ,在可燃物上方罩一个 的烧杯, 变 ,说明生成了 ,证明含有碳元素 。)
64 .影响燃烧现象剧烈程度的因素: 、 、 。 65 .燃料不充分燃烧的缺点: 、 。
66 .氢能源的优点: 、 、 ,未能广泛 应用的 原因: 、 。
67 . 人们正利用和开发的新能源有 、 、 、 、 、 。 68 .金属材料分类:包括 和 。
(
九上化学
29 天
早背晚默
第
1
5
天
早背 DAY
15
69
.
人类利用金属的先后顺序是
铜
、
铁
、
铝
。
(
1
)物理特性:颜色:
大多数金属都呈
银白
色
,但金呈
金黄
色
,铜呈
紫红
色
,铁粉为
黑
色
。
(2
)状态:
常温下,
大多数金属都是
固体
,但汞是
液体
。
70
.金属之最生活中应用最广泛的金属是
铁
,导电
、导热性最好的金属是
银
,硬度最大的金属是
铬
,
地壳中含量最高的金属元素是
铝
,人体中含量最高的金属是
钙
,熔点最高的金属是
钨
,熔点最低的金属
是
汞
。
71
.合金
(
1
)定义:在金属中加热熔合某些
金属
或
非金属
,制得的具有
金
属
特性的
混合
物
。
(2
)特性:合金具有金属特性
,与组成合金纯金属相比
,
硬度
更大
、
熔点
更低
、
抗腐蚀性
更强
。
(3)铁合金:生铁和钢性能不同的原因是
含碳量不同
,其在生铁中的含量为
2%~4.3%
,在钢中的含
量为
0.03%~2%
。
72
.常见的金属矿石赤铁矿(主要成分是
Fe
2
O
3
)
、磁铁矿(主要成分是
Fe
3
O
4
)
、菱铁矿(主要
成分是 FeCO
3
)
、铝土矿(主要成分是
Al
2
O
3
)
。
)
(
九上化学
29 天
早背晚默
第
1
5
天
晚默
DAY
15
69
.
人类利用金属的先后顺序是
、
、
。
(
1
)物理特性:颜色:
大多数金属都呈
色
,但金呈
色
,铜呈
色
,铁粉为
色
。
(2
)状态:
常温下,
大多数金属都是
,但汞是
。
70
.金属之最生活中应用最广泛的金属是
,导电
、导热性最好的金属是
,硬度最大的金属是
,
地壳中含量最高的金属元素是
,人体中含量最高的金属是
,熔点最高的金属是
,熔点最
低的金属
是
。
71
.合金
(
1
)定义:在金属中加热熔合某些
或
,制得的具有
特性的
物
。
(2
)特性:合金具有金属特性
,与组成合金纯金属相比
,
更大
、
更低
、
更强
。
(3)铁合金:生铁和钢性能不同的原因是
,其在生铁中的含量为
,在钢中的含
量为
。
72
.常见的金属矿石赤铁矿(主要成分是
)
、磁铁矿(
主要成分是
)
、菱铁矿(主要
成分是
FeCO
3
)
、铝土矿(主要成分是
)
。
)
九上化学 29 天早背晚默 第 16 天
早背 DAY 16
73 .工业炼铁
( 1 )原料:铁矿石 、焦炭 、石灰石和空气等 。
(2 )主要设备:高炉 。
发生的化学反应:主要反应(以赤铁矿为原料) 。焦炭的作用: 燃烧提供热量( ) 、制取 CO( ) 。
石灰石的作用:将矿石中的二氧化硅转变为炉渣除去 。
(4 )产品: 生铁 。拓展:百炼成钢的主要化学反应是 74 .金属资源的腐蚀和防护
( 1) 防锈原理:破坏铁生锈的两个必备条件之一即可 。隔绝氧气或隔绝水 。
(2) 防锈措施:保持铁制品表面洁净干燥;
在铁制品表面覆盖保护层 ,如涂油 、刷漆 、烤蓝 、镀其他金属等;改变金属的内部结 构 ,如制成不锈钢等 。
九上化学 29 天早背晚默 第 16 天
晚默 DAY 16
73 .工业炼铁
( 1 )原料:铁矿石 、 、 和空气等 。
(2 )主要设备: 。
(3)发生的化学反应:主要反应(以赤铁矿为原料) 。焦炭的作用: 燃烧提供热量( ) 、制取 CO( ) 。石灰石的作用:将矿石中的二氧 化硅转变为 除去 。
(4 )产品: 。拓展:百炼成钢的主要化学反应是 。 74 .金属资源的腐蚀和防护
( 1) 防锈原理: 铁生锈的两个必备条件之一即可 。隔绝 或隔绝 。
(2) 防锈措施:保持铁制品表面 ;
在铁制品表面 ,如涂油 、刷漆 、烤蓝 、镀其他金属等;改变金属的 , 如制成不锈钢等 。
(
九上化学
29 天
早背晚默
第
1
7
天
早背 DAY
17
75 .铜绿主要成分是碱式碳酸铜 Cu
2
(OH)
2
CO
3
,
它是铜与空气中的
O
2
、
CO
2
、
H
2
O
反应得到
。
金属资源的保护
①有效途径:
防止
金属腐蚀
;
回收利用
废旧金属
;有计
划
、合理地
开采矿物
;寻找
金属的替代品
。
②回收利用废旧金属的优点:
节约金属资源和能源
、
保护环境
。
③铝抗腐蚀性好的原因是:
铝在空气中与氧气反应
,表面生成一层致密的氧化铝薄膜
,从而阻止铝进
一步被氧化
。
76
.溶液
(
1
)概念:一种或几种物质分散到另一种物质里
,形成
均一
、
稳定
的
混合
物
。
(2
)特征:
均一
性
、
稳定
性
、
混合
物
。
(3
)组成:①溶质:
被溶解
的物质
,可以是
固
体
、
液
体或
气
体
。
②溶剂:
能溶解其他物质
的物质
,
水
是最常用的溶剂
,汽油和酒精也可以作溶剂
。
)
(
九上化学
29 天
早背晚默
第
1
7
天
晚默 DAY
17
75 .铜绿主要成分是碱式碳酸铜 Cu
2
(OH)
2
CO
3
,
它是铜与空气中的
反
应得到
。
金属资源的保护
①有效途径:
防止
;
回收利用
;有计划
、合理地
;寻找
。
②回收利用废旧金属的优点:
、
。
③铝抗腐蚀性好的原因是:
。
76
.溶液
(
1
)概念:一种或几种物质分散到另一种物质里
,形成
、
的
物
。
(2
)特征:
性
、
性
、
物
。
(3
)组成:①溶质:
的物质
,可以是
体
、
体或
体
。
②溶剂:
的物质
,
是最常用的溶剂
,汽油和酒精也可以作溶剂
。
)
(
九上化学
29 天
早背晚默
第
1
8
天
早背 DAY
18
注意:
(
1)溶液不一定是无色的
。如:CuSO
4
溶液是
蓝
色的(因含有
Cu
2+
)
。FeCl3
是
黄
色的(因含有
Fe
3+
)。
FeCl
2
是
浅绿
色的(因含有
Fe
2+
)
。
(2
)溶液是均一
、稳定的
,但均一
、稳定的液体
不一定
是溶液
,如
:蒸馏水
、酒
精等纯净物
。
(3
)加速物质溶解的措施:
搅拌
、
升温
、将固体研碎
。
77 .溶解时的吸热或放热现象
(
1)放热:有些物质在溶解时使溶液温度升高
,如
NaOH
(固)
、
浓 H
2
SO
4
(液)等
。CaO
溶于水
时使溶液温度升高是由于
CaO与水发生化学反应
放出热量
。
(2)
吸热:有些物质在溶解时使溶液温度降低
,如
NH
4
NO
3
(固)等
。
(3)
吸放热不明显:有些物质在溶解时无明显的温度变化
,如
NaCl
(固)等
。
)
(
九上化学
29 天
早背晚默
第
1
8
天
晚默 DAY
18
注意:
(
1)溶液不一定是无色的
。如:Cu
S
O
4
溶液是
色的(因含有
)
。FeCl
3
是
色的(因含有
)。
FeCl
2
是
色的(因含有
)
。
(2
)溶液是均一
、稳定的
,但均一
、稳定的液体
是溶液
,如
:蒸馏水
、酒精等纯
净物
。
(3
)加速物质溶解的措施:
、
、将固体研碎
。
77 .溶解时的吸热或放热现象
(
1)放热:有些物质在溶解时使溶液温度升高
,如
(固)
、
(液)等
。CaO
溶于水
时使溶液温度升高是由于
。
(2)
吸热:有些物质在溶解时使溶液温度降低
,如
(固)等
。
(3)
吸放热不明显:有些物质在溶解时无明显的温度变化
,如
(固)等
。
)
九上化学 29 天早背晚默 第 19 天
早背 DAY 19
78 .乳化
( 1)乳浊液:一种液体以小液滴形式分散到另一种不相溶的液体里形成的混合物,如牛奶和 豆浆 。乳 浊液不稳定 ,静置后会分层 。
(2 )乳化剂: 能使乳浊液稳定性增强的物质 。
(3 )乳化现象:洗涤剂等乳化剂使植物油在水中分散成无数细小的液滴, 而不聚成大的液滴 ,从而使 油和水不再分层的现象 。其中洗涤剂所起的作用叫乳化作用 。注意:用乳化剂去油污是利用了乳化剂的 乳化作用;用汽油洗去衣物上的油渍用的是溶解原理;用氢氧化钠去油污利用的是NaOH 和油脂反应 。 79 .饱和溶液与不饱和溶液
( 1)定义:在一定温度下,一定量的溶剂里,不能继续溶解某种溶质的溶液 ,叫做这种溶质 的饱和溶 液;还能继续溶解某种溶质的溶液, 叫做这种溶质的不饱和溶液 。
(2 )判断:
①若有未溶解的溶质(充分搅拌后) ,则该溶液一定为该溶质的饱和溶液 。
②若无未溶解的溶质 ,保持温度 、溶剂的量不变, 向溶液中加入少量该溶质 ,若不溶解 ,则为该溶质 的饱和溶液 ,反之则为不饱和溶液 。
九上化学 29 天早背晚默 第 19 天
晚默 DAY 19
78 .乳化
( 1)乳浊液:一种液体以 形式分散到另一种不相溶的液体里形成的混合物,如牛奶和 豆浆 。乳 浊液不 ,静置后会 。
(2 )乳化剂: 能使乳浊液 增强的物质 。
(3 )乳化现象:洗涤剂等乳化剂使植物油在水中分散成无数细小的液滴, 而不聚成大的液滴 ,从而使 油和水不再分层的现象 。其中洗涤剂所起的作用叫 作用 。注意:用乳化剂去油污是利用了乳化剂的 作用;用汽油洗去衣物上的油渍用的是 原理;用氢氧化钠去油污利用的是 。 79 .饱和溶液与不饱和溶液
( 1)定义:在一定 下,一定量的 里, 继续溶解某种溶质的溶液 ,叫做这种溶质 的饱和溶 液; 继续溶解某种溶质的溶液, 叫做这种溶质的不饱和溶液 。
(2 )判断:
①若有未溶解的溶质(充分搅拌后) ,则该溶液一定为该溶质的 溶液 。
②若无未溶解的溶质 ,保持温度 、溶剂的量不变, 向溶液中 ,若 ,则为该溶质 的饱和溶液 ,反之则为不饱和溶液 。
(
九上化
学
29 天
早背晚默
第
2
0
天
)
(
早背 DAY
20
)
(
(3
)相互转化
①对大多数溶解度随温度升高而增大的物质:
)
(
②对极少数溶解度随温度升高而减小的物质[如
Ca(OH)2
]:
)
(
(4
)浓
、稀溶液与饱和
、不饱和溶液之间的关系
①饱和溶液
不一定
是浓溶液,
不饱和溶液
不一定
是
稀溶液
。
②在一定温度时,
同一种溶质的饱和溶液要比它的不饱和溶液
浓
。
80
.结晶
(
1
)定义:从溶液中
析出晶体
的过程
。
(2
)方法
①蒸发结晶:适用于所有溶质的溶液
,特别适用于溶解度受温度影响
较小
的物质
,如NaCl
。
②降温结晶(冷却
热饱和溶液
)
:
只适用于溶解度随温
度升高而
显著增大
的物质
,如KNO3
。
)
(
九上化
学
29 天
早背晚默
第
2
0
天
)
(
晚默 DAY
20
)
(
(3
)相互转化
①对大多数溶解度随温度升高而增大的物质:
)
(
②对极少数溶解度随温度升高而减小的物质[如
Ca(OH)2
]:
)
(
(4
)浓
、稀溶液与饱和
、不饱和溶液之间的关系
①饱和溶液
是浓溶液,
不饱和溶液
是稀溶液
。
②在一定温度时,
同一种溶质的饱和溶液要比它的不饱和溶液
。
80
.结晶
(
1
)定义:从溶液中
的过程
。
(2
)方法
①蒸发结晶:适用于所有溶质的溶液
,特别适用于溶解度受温度影响
的物质
,如NaCl
。
②降温结晶(冷却
)
:
只适用于溶解度随温度升高而
的物质
,如KNO3
。
)
九上化学 29 天早背晚默 第 21 天
早背 DAY21
81 .混合物的分离和提纯
( 1 )分离可溶物和不溶物:过滤法;
(2 )铁屑和其他固体:用磁铁反复吸引;
(3) 除去氯化钠中少量的硝酸钾:蒸发溶剂结晶法; 除去硝酸钾中少量的氯化钠: 冷却热饱和溶液结晶法 。 82 . 固体溶解度
( 1 )概念:在一定温度下 ,某固态物质在 100g 溶剂里达到饱和状态时所溶解的质量 。
(2 )影响因素: 内因:溶质 、溶剂本身的性质;
外因:温度 。多数固体物质的溶解度随温度的升高而显著增大 ,如 KNO3 。少数固 体物质的溶解度受温度的变化影响很小 ,如 NaCl 。
极少数固体物质的溶解度随温度的升高而减小 ,如 Ca(OH)2 。
九上化学 29 天早背晚默 第 21 天
晚默 DAY21
81 .混合物的分离和提纯
( 1 )分离可溶物和不溶物: 法;
(2 )铁屑和其他固体:用 反复吸引;
(3) 除去氯化钠中少量的硝酸钾: 法; 除去硝酸钾中少量的氯化钠: 法 。 82 . 固体溶解度
( 1 )概念:在一定 下 ,某固态物质在 g 溶剂里达到 状态时所溶解的 。
(2 )影响因素: 内因: 、 本身的性质;
外因: 。多数固体物质的溶解度随温度的升高而 ,如 KNO3 。少数固 体物质的溶解度受温度的变化影响 ,如 。
极少数固体物质的溶解度随温度的升高而 ,如 。
九上化学 29 天早背晚默 第 22 天
早背 DAY 22
83 .气体溶解度
( 1 )概念:在 101kPa 和一定温度下 ,在 1体积水里达到饱和状态时气体体积所溶解的气体体积 。 (2 )影响因素:影响气体溶解度的因素:温度和压强;温度越高 ,气体的溶解度越小 ;压强越大 ,气 体溶解度越大 。
84 .用固体和水配制溶液的一般步骤是:计算 、称量 、量取 、溶解 、装瓶贴标签 。用浓溶液 稀释配 制稀溶液的一般步骤是:计算 、量取 、混匀 、装瓶贴标签 。
85 .紫色石蕊溶液变色规律:酸红碱蓝中性紫 ;无色酚酞溶液变色规律:酸无碱红中性无 。
86. 写出常见酸化学式:盐酸 HCl ,硫酸 H2SO4 ,碳酸 H2CO3 ,硝酸 HNO3 ,醋酸 CH3COOH 。 87 .打开浓盐酸瓶盖可看到白雾 ,原因是浓盐酸具有挥发性 ,挥发出氯化氢跟水蒸气形成盐酸小液 滴 。浓盐酸暴露在空气中 ,溶液的质量减小 ,质量分数会减小 。
88 .浓硫酸具有吸水性 ,可作某些气体的干燥剂;可干燥 HCl、CO2、O2等, 不可干燥 NH3 。浓硫酸 暴露在空气中 ,溶液的质量增大 ,质量分数会减小 。
89 .盐酸和稀硫酸均可用于金属表面除锈, 人体胃液中含有的酸是盐酸 。
90 .稀释浓硫酸时 ,应将浓硫酸沿着烧杯内壁慢慢注入水中 ,并用玻璃棒不断搅拌 。
九上化学 29 天早背晚默 第 22 天
晚默 DAY 22
83 .气体溶解度
( 1 )概念:在 101kPa 和一定温度下 ,在 水里达到 状态时气体体积所溶解的气体 。 (2 )影响因素:影响气体溶解度的因素: 和 ;温度越高 ,气体的溶解度越 ;压强越大 ,气 体溶解度越 。
84 .用固体和水配制溶液的一般步骤是: 、 、 、 、装瓶贴标签 。用浓溶液 稀释配 制稀溶液的一般步骤是: 、 、 、装瓶贴标签 。
85 .紫色石蕊溶液变色规律:酸 碱 中性 ;无色酚酞溶液变色规律:酸 碱 中性 。
86. 写出常见酸化学式:盐酸 ,硫酸 ,碳酸 ,硝酸 ,醋酸 。 87 .打开浓盐酸瓶盖可看到 ,原因是浓盐酸具有 性 ,挥发出 跟水蒸气形成盐酸小液 滴 。浓盐酸暴露在空气中 ,溶液的质量 ,质量分数会 。
88 .浓硫酸具有 性 ,可作某些气体的 剂;可干燥 等, 不可干燥 。浓硫酸 暴露在空气中 ,溶液的质量 ,质量分数会 。
89 .盐酸和稀硫酸均可用于金属表面 , 人体胃液中含有的酸是 。
90 .稀释浓硫酸时 ,应将 沿着烧杯内壁慢慢注入 中 ,并用玻璃棒不断搅拌 。
(
九上化学
29 天
早背晚默
第
2
3
天
早背 DAY
23
91
.不慎将浓硫酸沾到皮肤或衣服上,应立即
用大量的水清洗
,然后涂上
3%~5%的
NaHCO
3
溶液
。
92
.
写出五种可溶于水的碱的化学式:
NaOH
、
KOH
、
Ba(OH)
2
、
NH
3
H
2
O
、
Ca(OH)
2
(微溶)
93 .NaOH 俗称
火碱
、
烧碱
、
苛性钠
。暴露在
空气里易吸水而
潮解
,还会吸收
CO2
而变质
,变质的
产物是
Na
2
CO
3
。可用
足量的稀盐酸
或
Ca(OH)
2
或
Ba(OH)
2
、
或
CaCl
2
或
BaCl
2
检验氢氧化钠是否变质
。
向部分变质的氢氧化钠溶液中滴加稀盐酸,稀盐酸先与
NaOH
反应,再与
Na
2
CO
3
反应,所以开始没
有气泡产生
。
94.NaOH
具有强烈的腐蚀性,用托盘天平称量时,应将
NaOH
放在
玻璃容器
中,
而不能放在
纸上
。
不慎将氢氧化钠沾到皮肤上要先用
大量的水冲洗
,再涂上
硼酸
。
95
.氢氧化钙俗称为
熟石灰
、
消石灰
,其水溶液叫
澄清石灰水
,悬浊液叫
石灰乳
、
石灰浆
。 在空气中
易与
CO
2
反应而变质,变质的产物是
CaCO
3
。装氢氧化钙溶液的瓶子上常
附有一层白膜,可用
稀盐酸
将其除去
。
96 .碱石灰是CaO和NaOH的混合物
,可作
干燥
剂
,但不能干燥
HCl
、
CO
2
等酸性气体
。 生石灰(
CaO)
常用于食品干燥剂
。
97
.用于配制波尔多液物质是
Ca(OH)
2
和
CuSO
4
。不能用铁桶装的原因
Fe会与
CuSO
4
反应
。
)
(
九上化学
29 天
早背晚默
第
2
3
天
晚默 DAY
23
91
.不慎将浓硫酸沾到皮肤或衣服上,应立即
,然后涂上 3%~5%的
溶液
。
92
.
写出五种可溶于水的碱的化学式:
、
、
、
93 .NaOH 俗称
、
、
。暴露在空气里易吸水而
,还会吸收
而变质
,变质的
产物是
。可用
检验氢氧化钠是否变质
。
向部分变质的氢氧化钠溶液中滴加稀盐酸,稀盐酸先与
反应,再与
反应,所以开始没
有气泡产生
。
94.NaOH
具有强烈的腐蚀性,用托盘天平称量时,应将 NaOH
放在
中,而不能放在
纸上
。
不慎将氢氧化钠沾到皮肤上要先用
,再涂上
。
95
.氢氧化钙俗称为
、
,其水溶液叫
,悬浊液叫
、
。 在空气中
易与
反应而变质,变质的产物是
。装氢氧化钙溶液的瓶子上常附
有一层白膜,可用
将其除去
。
96 .碱石灰是CaO和NaOH的混合物
,可作
剂
,但不能干燥
等酸性气体
。 生石灰(
CaO)
常用于食品干燥剂
。
98
.用于配制波尔多液物质是
。不能用铁桶装的原因
。
)
(
九上化学
29 天
早背晚默
第
2
4
天
早背 DAY
24
98 .溶液能导电的原因是
有自由移动的离子
。酒精能否导电?
否
,酒精是由分子构成的
。
99
.
中和反应:
酸
和
碱
作用生成
盐
和
水
的反应
。中和反应的
实质是:
酸中的
H
+
和碱中的
OH
-
结合成水分子
。
100
.
改良酸性土壤一般用
熟石灰,
中和工厂排
出的酸性污水
,一般用熟石灰
(
Ca(OH)
2
,
治疗胃酸过多一般
服用的碱是
Mg(OH)
2
、
Al(OH)
3
,一般服用的盐是
NaHCO
3
。蚁虫叮咬时分泌了蚁酸
,使皮肤瘙痒
,可
涂抹呈碱性的
肥皂水
。
101 .溶液的酸碱度可以用 pH表示,
pH的范围通常为
0-14
。
pH<7的溶液显
酸
性,
pH越小
,
酸
性越
强
;
pH=7的溶液显
中
性;
pH>7的溶液显
碱
性,
pH越大
,
碱
性越
强
。
注意:
(
1
)酸溶液 pH<7 ,但 pH<7 的溶液不一定是酸溶液
,如 CuSO
4
溶液 pH<7 ,属于盐
类;
(2
)碱溶液 pH>7 ,但 pH>7 的溶液不一定是碱溶液
,如 Na
2
CO
3
溶液 pH>7 ,属于盐类
。
102
.测定
pH
最简便的方法是使用
pH
试纸
,(
广泛
PH
试纸精确到
1
);
PH 试纸
不能
直接
放
入溶液中;如果润湿
pH
试纸
,测得酸性溶液的
pH
会偏
大
,测得酸性溶液的
pH
会偏
小
。
)
(
九上化学
29 天
早背晚默
第
2
4
天
晚默 DAY
24
98 .溶液能导电的原因是
。酒精能否导电?
。
99
.
中和反应:
和
作用生成
和
的反应
。中和反应的实质是:
。
100
.
改良酸性土壤一般用
, 治疗胃酸过多一般
服用的碱是
,一般服用的盐是
。蚁虫叮咬时分泌了蚁酸
,使皮肤瘙痒
,可
涂抹呈碱性的
。
101 .溶液的酸碱度可以用 pH表示,
pH的范围通常为
。
pH<7的溶液显
性,
pH越小
,
性越
;
pH=7的溶液显
性;
pH>7的溶液显
性,
pH越大
,
性越
。
注意:
(
1
)酸溶液 pH<7 ,但 pH<7 的溶液不一定是酸溶液
,如 CuSO
4
溶液 pH<7 ,属于盐
类;
(2
)碱溶液 pH>7 ,但 pH>7 的溶液不一定是碱溶液
,如 Na
2
CO
3
溶液 pH>7 ,属于盐类
。
102
.测定
pH
最简便的方法是使用
,(
广泛 PH
试纸精确到
);
PH
试纸
直接
放
入溶液中;如果润湿
pH
试纸
,测得酸性溶液的
pH
会偏
,测得酸性溶液的 pH 会偏
。
)
(
九上化学
29 天
早背晚默
第
2
5
天
早背 DAY
25
103
.正常雨水的
pH
约为
5.6
,
因为溶解了空气中的
CO
2
生成
H
2
CO
3
,酸雨是
pH<5.6
的雨水
。
SO
2
形成酸雨的化学方程式
SO
2
+H
2
O=H
2
SO
3
2H
2
SO
3
+O
2
=2H
2
SO
4
。
104
.盐类物质是指含有
金属
离子(或
NH
4
+
)和
酸根
离子的化合物
,按分类写出下列盐类的化学式
。
硫酸盐:硫酸钠
Na
2
SO
4
硫酸钡
BaSO
4
碳酸盐:碳酸钠
Na
2
CO
3
碳酸钙
CaCO
3
硝酸盐:硝酸钾
KNO
3
硝酸亚铁
Fe(NO
3
)
2
盐酸盐(氯化物
)
:
氯化钾
KCl
氯化钙
CaCl
2
铵盐:硝酸铵
NH
4
NO
3
氯化铵
NH
4
Cl
钠盐:硝酸钠
NaNO
3
氯化钠
NaCl
碳酸氢盐:碳酸氢钠
NaHCO
3
碳酸氢铵
NH
4
HCO
3
其它盐:高锰酸钾
KMnO
4
锰酸钾
K
2
MnO
4
氯酸
钾
KClO
3
105
.食盐主要成分是
NaCl
,可以消除积雪的原因:
降低水的凝固点
;生理盐水是
0
.09%
的氯化钠溶
液
,工业用盐如
亚硝酸钠
有毒
。
)
九上化学 29 天早背晚默 第 25 天
晚默 DAY 25
103 .正常雨水的 pH 约为 , 因为溶解了空气中的 生成 ,酸雨是 的雨水 。 SO2形成酸雨的化学方程式 SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4 。
104 .盐类物质是指含有 离子(或 )和 离子的化合物 ,按分类写出下列盐类的化学式 。
硫酸盐:硫酸钠
碳酸盐:碳酸钠
硝酸盐:硝酸钾
硫酸钡 碳酸钙
硝酸亚铁
盐酸盐(氯化物) :氯化钾 氯化钙 铵盐:硝酸铵 氯化铵 钠盐:硝酸钠 氯化钠
碳酸氢盐:碳酸氢钠 碳酸氢铵
其它盐:高锰酸钾 锰酸钾 氯酸钾
106 .食盐主要成分是 ,可以消除积雪的原因: ;生理盐水是 的氯化钠溶 液 ,工业用盐如 有毒 。
(
九上化学
29 天
早背晚默
第
2
6
天
早背 DAY
26
106
.
大理石
、石灰石的主要成分是
CaCO
3
,可用作
建筑材料
、
补钙剂
。
107.
Na
2
CO
3
,俗称为
纯碱
、
苏打
,水溶液呈
碱
性
,可用于
玻璃
,造纸
,纺织工业
,洗涤剂等
。
108
.碳酸氢钠的化学式为
NaHCO
3
,属于盐类,俗称
小苏打
,其溶液呈
碱
性,除了治疗
胃酸
过多症,
还用作
发酵粉
。
109 .检验碳酸盐的操作方法:取样,
向待测样品中加入适量的
稀盐酸
,将产生的气体通入到
澄清石
灰水
中
,如果
石灰水变浑浊
,证明含有
CO
3
2-
。
110
.复分解反应:在溶液中,
由
两种化合物
互相交换成分,
生成
另外两种化合物
的反应
。(通式:
AB+CD=AD+CB
,
口诀:双交换
,价不变)
复分解反应发生的条件:只有当两种化合物互相交换成分,
生成物中有
沉淀
或有
气体
或
有
水
生成时,
复分解反应才能发生
。
111 .我国制碱工业先驱侯德榜发明了“联合制碱法 ”(又称侯氏制碱法)制得的“碱
”是
纯碱
。
112 .植物生长需要量较大的元素是
氮
、
磷
、
钾
;如果含其中的两种或
以上元素叫
复合
肥
。
叶发黄
,缺
氮
肥;茎不壮易倒伏
,缺
钾
肥;抗寒抗旱靠
磷
肥;灰色粉末
是
磷
肥
,液体化肥是
氨水
,一
般难溶于水的肥是
磷
肥;
常温下有氨味的是
碳酸氢铵
。
)
(
九上化学
29 天
早背晚默
第
2
6
天
晚默 DAY
26
106
.
大理石
、石灰石的主要成分是
,可用作
、
。
107.
Na
2
CO
3
,俗称为
、
,水溶液呈
性
,可用于
,造纸
,纺织工业
,洗涤剂等
。
108
.碳酸氢钠的化学式为
,属于盐类,俗称
,其溶
液呈
性,除了治疗
过多症,
还用作
。
109 .检验碳酸盐的操作方法:取样,
向待测样
品中加入适量的
,将产生的气体通入到
中
,如果
,证明含有 CO
3
2-
。
110
.复分解反应:在溶液中,
由
互相交换成分,
生成
的反应
。(通式:
AB+CD=AD+CB
,
口诀:双交换
,价不变)
复分解反应发生的条件:只有当两种化合物互相交换成分,
生成物中
有
或有
或有
生成时,
复分解反应才能发生
。
111 .我国制碱工业先驱侯德榜发明了“联合制碱法 ”(又称侯氏制碱法)制得的“碱 ”是
。
112 .植物生长需要量较大的元素是
、
、
;如果含其中的两种
或以上元素叫
肥
。
叶发黄
,缺
肥;茎不壮易倒伏
,缺
肥;抗寒抗旱靠
肥;灰色粉末是
肥
,液体化肥是
,一
般难溶于水的肥是
肥;
常温下有氨味的是
。
)
九上化学 29 天早背晚默 第 27 天
早背 DAY 27
113 .铵态氮肥加熟石灰研磨:会放出具有刺激性气味的氨气 。(尿素是不是铵态氮肥?不是)
114 .草木灰主要成分是碳酸钾 ,其溶液呈碱性, 不能与铵态氮肥混用 ,这样会让化肥失去肥效 。
115.氨水化学式:NH3 ·H2O,属于碱类 。是 NH3溶于水得到的溶液,溶液存在的离子是 NH4+和 OH- 。 除去粗盐中难溶性杂质:
( 1 )主要步骤是:①溶解②过滤③蒸发④计算产率 。 玻璃棒在溶解过程的作用是搅拌 ,加速溶解, 过滤时玻璃棒的作用是引流, 防止液滴飞溅 。
(2 )在蒸发操作时 ,要用玻璃棒不断搅拌, 防止局部过热导致液滴飞溅, 当蒸发皿中有较多固体析出 时 ,停止加热 ,利用蒸发皿的余温使滤液蒸干 。
116 . 除去粗盐中可溶性杂质( MgCl2 .CaCl2. Na2SO4 ) 的一般方法
( 1 )先加过量的 NaOH除去 Mg2+;
(2 )加过量的 BaCl2除去 SO42-;
(3 )加过量的 Na2CO3除去 Ca2+和过量的 Ba2+;
(4 )这时滤液中含有 NaCl 和 NaOH 、Na2CO3 ,再加适量的稀盐酸, 除去过量的 OH-和 CO32-;
(5 )最后蒸发结晶得到精盐 。( Na2CO3 溶液一定要在 BaCl2 溶液之后)
九上化学 29 天早背晚默 第 27 天
晚默 DAY 27
113 .铵态氮肥加熟石灰研磨:会放出具有刺激性气味的 。(尿素是不是铵态氮肥? )
114 .草木灰主要成分是 ,其溶液呈 性, 不能与铵态氮肥混用 ,这样会让化肥失去肥效 。
115.氨水化学式: ,属于 类 。是 溶于水得到的溶液,溶液存在的离子是 和 。 除去粗盐中难溶性杂质:
( 1 )主要步骤是:① ② ③ ④ 。 玻璃棒在溶解过程的作用是 , 过滤时玻璃棒的作用是 。
(2 )在蒸发操作时 ,要用玻璃棒不断搅拌, 防止 , 当蒸发皿中 时 ,停止加热 ,利用 使滤液蒸干 。
116 . 除去粗盐中可溶性杂质(MgCl2 .CaCl2. Na2SO4) 的一般方法
( 1 )先加过量的 除去 Mg2+;
(2 )加过量的 除去 SO42-;
(3 )加过量的 除去 Ca2+和过量的 Ba2+;
(4 )这时滤液中含有 NaCl 和 NaOH 、Na2CO3 ,再加适量的 , 除去过量的 OH-和 CO32-;
(5 )最后 得到精盐 。( Na2CO3 溶液一定要在 BaCl2 溶液之后)
(
九上化学
29 天
早背晚默
第
2
8
天
早背 DAY
28
117
.
人类所需营养素有
蛋白质
、
糖类
、
油脂
、
维生素
、
无机盐
、
水
六大类
。其中能提供能量 的是:
蛋白质
、
糖类
、
油脂
。糖类由
C
、
H
、
O
元素组成;
人体需要
的能量主要来自:
糖类
。
118 .维生素不能提供能量;缺少维生素
A会引起
坏血病
;缺少维生素 C
会引起
夜盲症
。
119 .幼儿及青少年缺钙会得
佝偻病
,老年人缺钙会发生
骨质疏松
,容易骨折
。
120
.(
1
)主要存在于骨骼和牙齿中的元素
Ca
。
(2
)Fe元素是血红蛋白的成分
,摄入量过低会引起
贫血
。
(3
)缺乏
F
元素易产生龋齿
。
(4
)缺少会引起食欲不振,
生长迟缓
,发育不良的元素
Z
n
。
(5
)摄入碘不合理会引起
甲状腺肿大
。
)
(
九上化学
29 天
早背晚默
第
2
8
天
晚默 DAY
28
117
.
人类所需营养素有
、
、
、
、
、
六大类
。其中能提供能量
的是:
、
、
。糖类由
、
、
元素组成;
人体需要的能
量主要来自:
。
118 .维生素不能提供能量;缺少维生素 A会引起
;缺少
维生素 C 会引起
。
119 .幼儿及青少年缺钙会得
,老年人缺钙会发生
,容易骨折
。
120
.(
1
)主要存在于骨骼和牙齿中的元素
。
(2
)Fe元素是血红蛋白的成分
,摄入量过低会引起
。
(3
)缺乏
元素易产生龋齿
。
(4
)缺少会引起食欲不振,
生长迟缓
,发育不良的元素
。
(5
)摄入碘不合理会引起
。
)
(
九上化学
29 天
早背晚默
第
2
9
天
早背 DAY29
121 .甲烷
CH
4
乙醇
C
2
H
5
OH
葡萄糖
C
6
H
12
O
6
属于有机小分子;
蛋白质
、
淀粉
、
纤维素
属
于有机高
分子
。
122 .区别天然纤维和合成纤维的方法是
灼烧闻气味
,如果有
烧纸
气味的是棉纤维;有
烧焦羽毛
气味的
是羊毛
,真丝;如果有
刺激性
气味则是合成纤维(涤纶
,锦纶
,腈纶)等
。
123 .链状结构的高分子材料具有
热塑
性,
而多数网状结构材料不会受热熔化,
因而具有
热固
性
124 .三大合成材料(有机高分子合成材料):
塑料
、
合成纤维
、
合成橡胶
。金属材料包括:
纯金属
和
合金
。列举两种复合材料:
玻璃钢
、
钢筋混凝
土
、
碳纤维复合材料
。玻璃是
无机非金属
材料;有机
玻璃是
合成
材料
。合金是
金属材料
。
)
(
九上化学
29 天
早背晚默
第
2
9
天
晚默 DAY29
121 .甲烷
乙醇
葡萄糖
属于有
机小分子;
、
、
属于有机高
分子
。
122 .区别天然纤维和合成纤维的方法是
,如果有
气味的是棉纤维;有
气味的
是羊毛
,真丝;如果有
气味则是合成纤维(涤纶
,锦纶
,腈纶)等
。
123 .链状结构的高分子材料具有
性,
而多数网状结构材料不会受热熔化,
因而具
有
性
124 .三大合成材料(有机高分子合成材料
):
、
、
。金属材料包括:
和
。列举两种复合材料:
、
、
。玻璃是
材料;有机
玻璃是
材料
。合金是
。
)
同课章节目录
