第一章 化学反应的热效应 章末拓展试题 2024-2025学年化学人教版(2019) 选择性必修第一册
文档属性
| 名称 | 第一章 化学反应的热效应 章末拓展试题 2024-2025学年化学人教版(2019) 选择性必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 876.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-27 16:06:22 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第一章 化学反应的热效应 章末拓展试题
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
1.2022年北京冬季奥运会的交通用车中,使用了氢燃料汽车。绿色交通工具是指在行驶中对环境不产生污染或只产生微量污染的载客工具。下列不属于绿色交通工具的是
A B C D
无轨电车 氢气动力车 太阳能汽车 柴油汽车
A.A B.B C.C D.D
2.下列反应中生成物总能量高于反应物总能量的是
A.氧化钙溶于水 B.铁粉与硫粉共热
C.强酸强碱中和 D.氢氧化钡晶体与氯化铵晶体的反应
3.用50mL0.50mol/L盐酸与50mL0.55mo/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。下列说法错误的是
A.a仪器为玻璃搅拌器
B.所用NaOH溶液要稍过量的目的是确保盐酸被完全中和
C.如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,测得的中和热的数值会偏大
D.用相同浓度和体积的稀醋酸代替稀盐酸进行上述实验,测得的中和热的数值会偏小
4.锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一。早在远古时代,人们便发现并使用锡了。灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①
②
③
下列说法正确的是
A.
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
5.下列说法或表示方法不正确的是
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H = –57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨)→C(金刚石);△H = +73 kJ/mol,可知石墨比金刚石稳定
D.在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H = –285.8kJ/mol
6.已知:①;
②;
③;
④;
⑤。
下列关于上述反应焓变的判断不正确的是
A. B.
C. D.
7.下列图像分别表示有关反应的反应过程与能量变化的关系:
据此判断下列说法正确的是
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH>0
D.S(g)+O2(g)=SO2(g)ΔH1;S(s)+O2(g)=SO2(g)ΔH2,则ΔH1>ΔH2
8.C和在生产、生活、科技中是非常重要的燃料。已知:
①
下列推断正确的是
A.C(s)的燃烧热为
B.
C.
D.将分解成和,反应体系至少需要从环境中吸收的热量
9.已知:
①
②
③
下列说法正确的是
A.的燃烧热为
B.同质量的和(1)完全燃烧,放出的热量多
C.
D.
10.在一定温度下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
A.2912kJ B.2953kJ C.3236kJ D.3867kJ
11.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:mCeO2(m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2mCeO2+xH2+xCO
下列说法不正确的是( )
A.该过程中CeO2没有消耗 B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3 D.H2(g)+O2(g)=H2O(g)的反应热大于ΔH3
12.已知,电离是一个吸热过程。下列有关的判断正确的是
①
②
③
④
A., B.,
C. D.
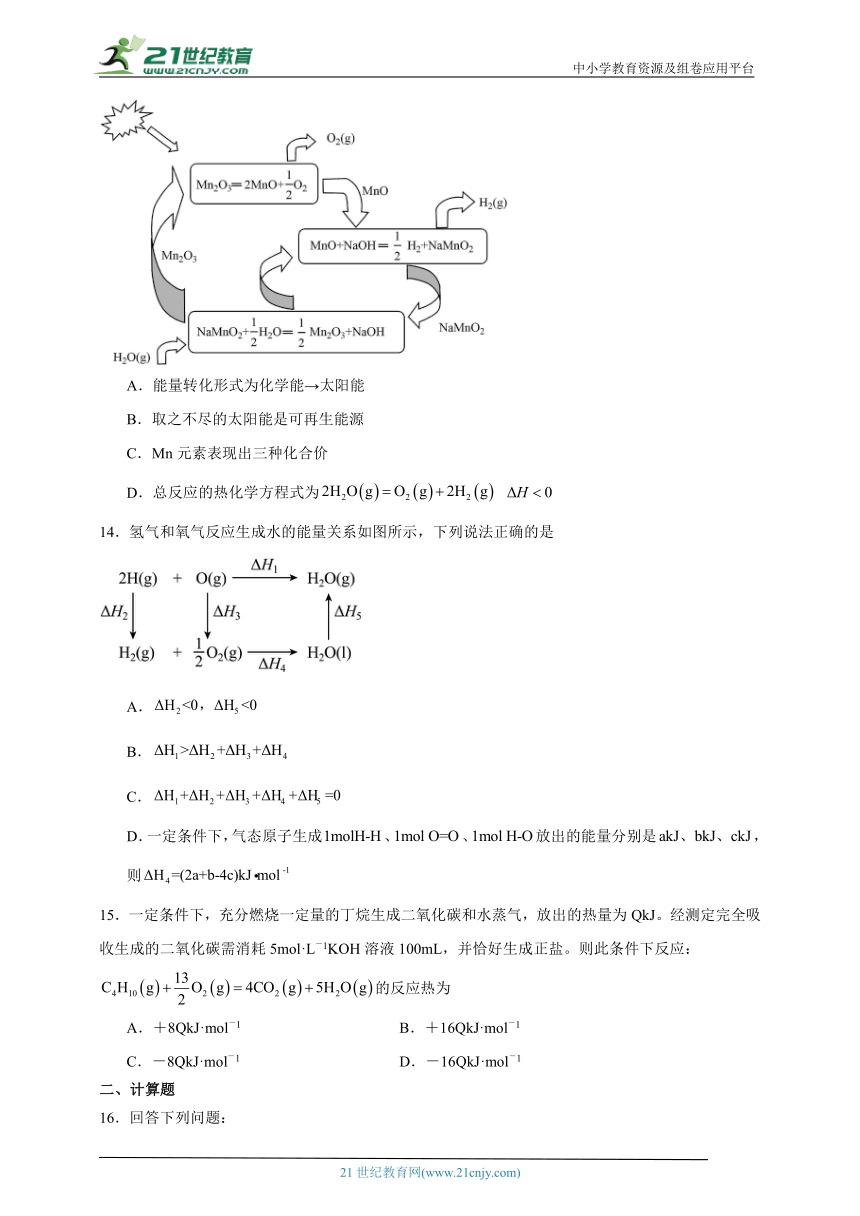
13.一种利用热化学循环制氢的原理如图所示。下列关于该循环的说法正确的是
A.能量转化形式为化学能→太阳能
B.取之不尽的太阳能是可再生能源
C.Mn元素表现出三种化合价
D.总反应的热化学方程式为
14.氢气和氧气反应生成水的能量关系如图所示,下列说法正确的是
A.
B.
C.
D.一定条件下,气态原子生成、、放出的能量分别是,则
15.一定条件下,充分燃烧一定量的丁烷生成二氧化碳和水蒸气,放出的热量为QkJ。经测定完全吸收生成的二氧化碳需消耗5mol·L-1KOH溶液100mL,并恰好生成正盐。则此条件下反应:的反应热为
A.+8QkJ·mol-1 B.+16QkJ·mol-1
C.-8QkJ·mol-1 D.-16QkJ·mol-1
二、计算题
16.回答下列问题:
(1)已知:① H1=-483.6kJ/mol
② H2=-128.3kJ/mol
③ H3=+206.1kJ/mol
属于吸热反应的是 (填序号)。
写出由甲烷和氧气合成液态甲醇的热化学方程式: 。
(2)通过化学键的键能计算。已知:
化学键 H—H N—H N≡N
键能(kJ/mol ) 436 391 945
则合成氨反应N2(g)+3H2(g)2NH3(g) △H=a kJ/mol,a为 。
(3)已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。写出H2O(g)转化为1 mol H2O(l)热化学方程式: 。H2O(l)的稳定性 填(“大于”“小于”)H2O(g)
三、解答题
17.某化学兴趣小组用50mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液进行中和反应反应热的测定实验,实验装置如图所示。试回答下列问题:
(1)实验时玻璃搅拌器的使用方法是 ;不能用铜质搅拌器代替玻璃搅拌器的理由是 。
(2)某同学记录的实验数据如表所示。(已知:实验中盐酸和氢氧化钠溶液的密度均为1g cm-3,中和反应后溶液的比热容c=4.18J g-1 ℃-1)
实验序号 起始温度T1/℃ 终止温度T2/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.3
2 20.2 20.4 23.4
3 20.4 20.6 23.8
依据该同学的实验数据计算,该实验测得反应放出的热量为 J。
(3)下列操作会导致实验结果出现偏差的是 (填字母)。
a.用量筒量取盐酸的体积时仰视读数
b.把量筒中的氢氧化钠溶液分多次倒入盐酸中
c.将50mL0.55mol L-1氢氧化钠溶液取成了50mL0.55mol L-1氢氧化钾溶液
d.做本实验的当天室温较高
(4)如果将NaOH溶液换成等量的NaOH固体,那么实验中测得的中和反应反应热(△H) (填“偏大”、“偏小”或“不变”)。
(5)如果用60mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液进行实验,与上述实验相比,二者所放出的热量 (填“相等”或“不相等”,下同),所求的中和反应反应热(△H) 。
参考答案
1.D
A.无轨电车消耗电能,没有污染,属于绿色交通工具,A错误;
B.氢气动力车消耗氢气,没有污染,属于绿色交通工具,B错误;
C.太阳能汽车消耗太阳能,没有污染,属于绿色交通工具,C错误;
D.柴油汽车消耗石油,会产生较多的污染物,不属于绿色交通工具,D正确。
故选D。
2.D
反应中生成物总能量高于反应物总能量的反应为吸热反应,以此解题。
A.氧化钙溶于水属于放热反应,A错误;
B.铁粉与硫粉共热的反应属于放热反应,B错误;
C.酸碱中和反应为放热反应,C错误;
D.氢氧化钡晶体与氯化铵晶体混合属于吸热反应,D正确;
故选D。
3.C
A.在测定过程中,需要搅拌使反应充分进行,而金属材质易导热使热量损失,所以a仪器为玻璃搅拌器,故A正确;
B.在测定过程中,为确保盐酸被完全中和,所用NaOH溶液要稍过量,故B正确;
C.反应放出的热量和所用酸以及碱的量多少有关,但中和热均是强酸与强碱反应生成1molH2O时放出的热,与酸碱的用量无关,所以测得的中和热数值相等,故C错误;
D.用相同浓度和体积的稀醋酸代替稀盐酸,由于醋酸电离吸热,放出的热量偏少,测得的中和热数值会偏小,故D正确;
故答案为:C。
4.D
A.根据(s,灰),说明灰锡能量小于白锡,等物质的量的白锡与盐酸反应放出的热量大于灰锡,则,A错误;
B.根据(s,灰),锡在常温下(温度高于13.2℃)以白锡状态存在,B错误;
C.根据(s,灰),灰锡转化为白锡的反应是吸热反应,C错误;
D.根据(s,灰),锡制器皿长期处在低于13.2℃的环境中,以灰锡的形式存在,而灰锡以粉末状存在,所以锡制器皿长期处在低于13.2℃的环境中,会自行毁坏,D正确;
答案选D。
5.D
A.盖斯定律实质上是能量守恒定律的体现,选项A正确;
B.浓硫酸稀释过程中也放出热量,所以放出的热量大于57.3 kJ,选项B正确;
C.能量越低的物质,越稳定,选项C正确;
D.热化学方程式表示的是4g氢气完全燃烧生成液态水放出的热量,所以反应热应为△H = –571.6kJ/mol,选项D不正确;
答案选D。
6.B
A.由气态硫的能量比固态硫的能量高,所以气态硫与反应时放出的热量多,即,A正确;
B.硫化氢不完全燃烧放出的热量比完全燃烧放出的热量少,所以有,B错误;
C.根据盖斯定律分析,由③-②可得热化学方程式:⑤ ,C正确;
D.根据盖斯定律分析,由可得热化学方程式:⑤ ,整理得,D正确;
答案选B。
7.A
A.根据图①可知金刚石的能量大于石墨,所以石墨转变为金刚石是吸热反应,故A正确;
B.根据图②可知白磷的能量大于红磷,红磷比白磷稳定,故B错误;
C.根据图④可知CO(g)和H2O(g)的总能量大于CO2(g)和H2(g)的总能量,CO(g)+H2O(g)=CO2(g)+H2(g)ΔH<0,故C错误;
D.根据图③可知S(g)的能量大于S(s),S(g)+O2(g)=SO2(g)ΔH1;S(s)+O2(g)=SO2(g)ΔH2,则ΔH1<ΔH2,故D错误;
选A。
8.C
A.101kPa下,1molC(s)完全燃烧生成指定产物即时所放出的热量为C(s)的燃烧热,反应①没有生成,所以C(s)的燃烧热不为,A错误;
B.断开化学键需要吸收的热量为断开化学键需要吸收的热量为,4molH原子和2molO原子形成时放出的热量为,根据反应物的总键能—生成物的总键能,可得,热化学方程式为,B错误;
C.分析题干可得,反应①:和反应根据盖斯定律,反应得,C正确;
D.根据可知,分解成和,反应体系需要从环境中吸收的热量为484kJ,D错误;
答案选C。
9.B
A.燃烧热是1mol物质完全燃烧产生指定产物时所放出的热量,方程式中给出的是2mol的甲醇完全燃烧所放出的热量为1452kJ,A项错误;
B.由方程式可知燃烧放出热量142.9kJ,1g(l)完全燃烧放出热量,则同质量的和(1)完全燃烧,放出的热量多,B项正确;
C.产生沉淀也会释放能量,在反应中除了反应生成水外,还有沉淀产生,放出热量不是57.3kJ,C项错误;
D.根据盖斯定律,将(①×3-②)÷2整理可得,D项错误;
答案选B。
10.B
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为
566kJ/molmol+890kJ/mol3mol=2953kJ。故选B。
11.C
A.通过太阳能实现总反应H2O+CO2→H2+CO+O2,反应中CeO2没有消耗,CeO2作催化剂,A正确;
B.该过程中在太阳能作用下将H2O、CO2转变为H2、CO,所以把太阳能转变成化学能,B正确;
C.由图中转化关系及据盖斯定律可知:-△H1为正值,△H2+△H3为负值,则-△H1=△H2+△H3,C错误;
D.①H2(g)+O2(g)=H2O(l) ΔH3;②H2O(l)=H2O(g) △H2,根据盖斯定律①+②得:H2(g)+O2(g)=H2O(g) △H=△H3+△H2;因②△H、△H3都小于0,而△H2大于0,故△H>△H3,D正确;
故合理选项是C。
12.C
A.为的电离,是吸热过程,①是其逆过程,可得;②为强碱的稀溶液与强酸的稀溶液的中和反应,为放热反应,,A错误;
B.③属于中和反应,放热,④是电离过程,吸热,则、,B错误;
C.③-②得④,,即,C正确;
D.③-②得④,,即,D错误;
故选C。
13.B
A.能量转化形式为太阳能→化学能,故A错误;
B.太阳能为取之不尽的可再生的清洁能源,故B正确;
C.中Mn的化合价为价,MnO中Mn的化合价为价,故C错误;
D.根据上述原理图可知,反应的实质为分解水,生成氢气和氧气,该反应为吸热反应,总反应的热化学方程式为,故D错误;
故选B。
14.B
A.2H生成H2形成化学键放热,液态水变为气态水需要吸热,,故A错误;
B.根据盖斯定律可知,由因为所以,故B正确;
C.根据盖斯定律可知,,故C错误;
D.根据上图循环可知,故D错误;
故答案为B
15.D
KOH与CO2反应生成正盐K2CO3的方程式为2KOH+CO2=K2CO3+H2O。KOH的物质的量为5mol·L-1×0.1L=0.5mol,与其生成正盐的CO2为0.25mol。根据方程式,生成0.25molCO2,消耗molC4H10,放出的热量为QkJ。故1molC4H10完全燃烧放出的热量为16QkJ,即ΔH=-16QkJ·mol-1,D符合题意;
答案为D。
16.(1) ③ H=-164.0kJ/mol
(2)-93
(3) H3=-44.0kJ/mol 大于
(1)吸热反应的焓变大于零,故选③;
已知:① H1=-483.6kJ/mol
② H2=-128.3kJ/mol
③ H3=+206.1kJ/mol
由甲烷和氧气合成液态甲醇的化学方程式为,由盖斯定律可知,×①+②+③得 H= H1+ H2+ H3=-164.0kJ/mol;
(2)反应的焓变等于反应物的键能和减去生成物的键能和,故a=945+3×436-6×391=-93;
(3)已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量,放热焓变为负值, H3=-44.0kJ/mol,能量越低物质越稳定,该过程中放出热量,故H2O(l)的稳定性大于H2O(g)。
17.(1) 上下匀速搅动 Cu是热的良导体,传热快,热量损失大
(2)1337.6
(3)ab
(4)偏小
(5) 不相等 相等
(1)中和反应反应热的测定实验,玻璃搅拌器的使用方法是上下匀速搅动;该实验成败的关键是防止热量损失,Cu是热的良导体,传热快,热量损失大,所以不能用铜质搅拌器代替玻璃搅拌器。
(2)三次温度差分别为,温度的平均值为,溶液的总质量为,该实验测得反应放出的热量为。
(3)a.用量筒量取盐酸的体积时仰视读数,量取盐酸体积偏大,生成的水偏多,放出的热量偏多,选a;
b.把量筒中的氢氧化钠溶液分多次倒入盐酸中,热量损失较多,选b;
c.将50mL0.55mol L-1氢氧化钠溶液取成了50mL0.55mol L-1氢氧化钾溶液,生成水的量不变,放出的热量不变,故不选c;
d.做本实验的当天室温较高,空气温度与放出的热量无关,不影响温度的变化,故不选d;
选ab。
(4)NaOH固体溶解放热,如果将NaOH溶液换成等量的NaOH固体,那么实验中放热偏多,测得的中和反应反应热(△H)偏小。
(5)如果用盐酸与溶液进行实验,由于试剂的量不同,所放出的热量与上述实验不相等,但中和反应反应热是换算成生成时放出的热量,所求的中和反应反应热与上述反应相等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第一章 化学反应的热效应 章末拓展试题
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
1.2022年北京冬季奥运会的交通用车中,使用了氢燃料汽车。绿色交通工具是指在行驶中对环境不产生污染或只产生微量污染的载客工具。下列不属于绿色交通工具的是
A B C D
无轨电车 氢气动力车 太阳能汽车 柴油汽车
A.A B.B C.C D.D
2.下列反应中生成物总能量高于反应物总能量的是
A.氧化钙溶于水 B.铁粉与硫粉共热
C.强酸强碱中和 D.氢氧化钡晶体与氯化铵晶体的反应
3.用50mL0.50mol/L盐酸与50mL0.55mo/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。下列说法错误的是
A.a仪器为玻璃搅拌器
B.所用NaOH溶液要稍过量的目的是确保盐酸被完全中和
C.如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,测得的中和热的数值会偏大
D.用相同浓度和体积的稀醋酸代替稀盐酸进行上述实验,测得的中和热的数值会偏小
4.锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一。早在远古时代,人们便发现并使用锡了。灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①
②
③
下列说法正确的是
A.
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
5.下列说法或表示方法不正确的是
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H = –57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨)→C(金刚石);△H = +73 kJ/mol,可知石墨比金刚石稳定
D.在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H = –285.8kJ/mol
6.已知:①;
②;
③;
④;
⑤。
下列关于上述反应焓变的判断不正确的是
A. B.
C. D.
7.下列图像分别表示有关反应的反应过程与能量变化的关系:
据此判断下列说法正确的是
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH>0
D.S(g)+O2(g)=SO2(g)ΔH1;S(s)+O2(g)=SO2(g)ΔH2,则ΔH1>ΔH2
8.C和在生产、生活、科技中是非常重要的燃料。已知:
①
下列推断正确的是
A.C(s)的燃烧热为
B.
C.
D.将分解成和,反应体系至少需要从环境中吸收的热量
9.已知:
①
②
③
下列说法正确的是
A.的燃烧热为
B.同质量的和(1)完全燃烧,放出的热量多
C.
D.
10.在一定温度下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
A.2912kJ B.2953kJ C.3236kJ D.3867kJ
11.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:mCeO2(m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2mCeO2+xH2+xCO
下列说法不正确的是( )
A.该过程中CeO2没有消耗 B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3 D.H2(g)+O2(g)=H2O(g)的反应热大于ΔH3
12.已知,电离是一个吸热过程。下列有关的判断正确的是
①
②
③
④
A., B.,
C. D.
13.一种利用热化学循环制氢的原理如图所示。下列关于该循环的说法正确的是
A.能量转化形式为化学能→太阳能
B.取之不尽的太阳能是可再生能源
C.Mn元素表现出三种化合价
D.总反应的热化学方程式为
14.氢气和氧气反应生成水的能量关系如图所示,下列说法正确的是
A.
B.
C.
D.一定条件下,气态原子生成、、放出的能量分别是,则
15.一定条件下,充分燃烧一定量的丁烷生成二氧化碳和水蒸气,放出的热量为QkJ。经测定完全吸收生成的二氧化碳需消耗5mol·L-1KOH溶液100mL,并恰好生成正盐。则此条件下反应:的反应热为
A.+8QkJ·mol-1 B.+16QkJ·mol-1
C.-8QkJ·mol-1 D.-16QkJ·mol-1
二、计算题
16.回答下列问题:
(1)已知:① H1=-483.6kJ/mol
② H2=-128.3kJ/mol
③ H3=+206.1kJ/mol
属于吸热反应的是 (填序号)。
写出由甲烷和氧气合成液态甲醇的热化学方程式: 。
(2)通过化学键的键能计算。已知:
化学键 H—H N—H N≡N
键能(kJ/mol ) 436 391 945
则合成氨反应N2(g)+3H2(g)2NH3(g) △H=a kJ/mol,a为 。
(3)已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。写出H2O(g)转化为1 mol H2O(l)热化学方程式: 。H2O(l)的稳定性 填(“大于”“小于”)H2O(g)
三、解答题
17.某化学兴趣小组用50mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液进行中和反应反应热的测定实验,实验装置如图所示。试回答下列问题:
(1)实验时玻璃搅拌器的使用方法是 ;不能用铜质搅拌器代替玻璃搅拌器的理由是 。
(2)某同学记录的实验数据如表所示。(已知:实验中盐酸和氢氧化钠溶液的密度均为1g cm-3,中和反应后溶液的比热容c=4.18J g-1 ℃-1)
实验序号 起始温度T1/℃ 终止温度T2/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.3
2 20.2 20.4 23.4
3 20.4 20.6 23.8
依据该同学的实验数据计算,该实验测得反应放出的热量为 J。
(3)下列操作会导致实验结果出现偏差的是 (填字母)。
a.用量筒量取盐酸的体积时仰视读数
b.把量筒中的氢氧化钠溶液分多次倒入盐酸中
c.将50mL0.55mol L-1氢氧化钠溶液取成了50mL0.55mol L-1氢氧化钾溶液
d.做本实验的当天室温较高
(4)如果将NaOH溶液换成等量的NaOH固体,那么实验中测得的中和反应反应热(△H) (填“偏大”、“偏小”或“不变”)。
(5)如果用60mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液进行实验,与上述实验相比,二者所放出的热量 (填“相等”或“不相等”,下同),所求的中和反应反应热(△H) 。
参考答案
1.D
A.无轨电车消耗电能,没有污染,属于绿色交通工具,A错误;
B.氢气动力车消耗氢气,没有污染,属于绿色交通工具,B错误;
C.太阳能汽车消耗太阳能,没有污染,属于绿色交通工具,C错误;
D.柴油汽车消耗石油,会产生较多的污染物,不属于绿色交通工具,D正确。
故选D。
2.D
反应中生成物总能量高于反应物总能量的反应为吸热反应,以此解题。
A.氧化钙溶于水属于放热反应,A错误;
B.铁粉与硫粉共热的反应属于放热反应,B错误;
C.酸碱中和反应为放热反应,C错误;
D.氢氧化钡晶体与氯化铵晶体混合属于吸热反应,D正确;
故选D。
3.C
A.在测定过程中,需要搅拌使反应充分进行,而金属材质易导热使热量损失,所以a仪器为玻璃搅拌器,故A正确;
B.在测定过程中,为确保盐酸被完全中和,所用NaOH溶液要稍过量,故B正确;
C.反应放出的热量和所用酸以及碱的量多少有关,但中和热均是强酸与强碱反应生成1molH2O时放出的热,与酸碱的用量无关,所以测得的中和热数值相等,故C错误;
D.用相同浓度和体积的稀醋酸代替稀盐酸,由于醋酸电离吸热,放出的热量偏少,测得的中和热数值会偏小,故D正确;
故答案为:C。
4.D
A.根据(s,灰),说明灰锡能量小于白锡,等物质的量的白锡与盐酸反应放出的热量大于灰锡,则,A错误;
B.根据(s,灰),锡在常温下(温度高于13.2℃)以白锡状态存在,B错误;
C.根据(s,灰),灰锡转化为白锡的反应是吸热反应,C错误;
D.根据(s,灰),锡制器皿长期处在低于13.2℃的环境中,以灰锡的形式存在,而灰锡以粉末状存在,所以锡制器皿长期处在低于13.2℃的环境中,会自行毁坏,D正确;
答案选D。
5.D
A.盖斯定律实质上是能量守恒定律的体现,选项A正确;
B.浓硫酸稀释过程中也放出热量,所以放出的热量大于57.3 kJ,选项B正确;
C.能量越低的物质,越稳定,选项C正确;
D.热化学方程式表示的是4g氢气完全燃烧生成液态水放出的热量,所以反应热应为△H = –571.6kJ/mol,选项D不正确;
答案选D。
6.B
A.由气态硫的能量比固态硫的能量高,所以气态硫与反应时放出的热量多,即,A正确;
B.硫化氢不完全燃烧放出的热量比完全燃烧放出的热量少,所以有,B错误;
C.根据盖斯定律分析,由③-②可得热化学方程式:⑤ ,C正确;
D.根据盖斯定律分析,由可得热化学方程式:⑤ ,整理得,D正确;
答案选B。
7.A
A.根据图①可知金刚石的能量大于石墨,所以石墨转变为金刚石是吸热反应,故A正确;
B.根据图②可知白磷的能量大于红磷,红磷比白磷稳定,故B错误;
C.根据图④可知CO(g)和H2O(g)的总能量大于CO2(g)和H2(g)的总能量,CO(g)+H2O(g)=CO2(g)+H2(g)ΔH<0,故C错误;
D.根据图③可知S(g)的能量大于S(s),S(g)+O2(g)=SO2(g)ΔH1;S(s)+O2(g)=SO2(g)ΔH2,则ΔH1<ΔH2,故D错误;
选A。
8.C
A.101kPa下,1molC(s)完全燃烧生成指定产物即时所放出的热量为C(s)的燃烧热,反应①没有生成,所以C(s)的燃烧热不为,A错误;
B.断开化学键需要吸收的热量为断开化学键需要吸收的热量为,4molH原子和2molO原子形成时放出的热量为,根据反应物的总键能—生成物的总键能,可得,热化学方程式为,B错误;
C.分析题干可得,反应①:和反应根据盖斯定律,反应得,C正确;
D.根据可知,分解成和,反应体系需要从环境中吸收的热量为484kJ,D错误;
答案选C。
9.B
A.燃烧热是1mol物质完全燃烧产生指定产物时所放出的热量,方程式中给出的是2mol的甲醇完全燃烧所放出的热量为1452kJ,A项错误;
B.由方程式可知燃烧放出热量142.9kJ,1g(l)完全燃烧放出热量,则同质量的和(1)完全燃烧,放出的热量多,B项正确;
C.产生沉淀也会释放能量,在反应中除了反应生成水外,还有沉淀产生,放出热量不是57.3kJ,C项错误;
D.根据盖斯定律,将(①×3-②)÷2整理可得,D项错误;
答案选B。
10.B
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为
566kJ/molmol+890kJ/mol3mol=2953kJ。故选B。
11.C
A.通过太阳能实现总反应H2O+CO2→H2+CO+O2,反应中CeO2没有消耗,CeO2作催化剂,A正确;
B.该过程中在太阳能作用下将H2O、CO2转变为H2、CO,所以把太阳能转变成化学能,B正确;
C.由图中转化关系及据盖斯定律可知:-△H1为正值,△H2+△H3为负值,则-△H1=△H2+△H3,C错误;
D.①H2(g)+O2(g)=H2O(l) ΔH3;②H2O(l)=H2O(g) △H2,根据盖斯定律①+②得:H2(g)+O2(g)=H2O(g) △H=△H3+△H2;因②△H、△H3都小于0,而△H2大于0,故△H>△H3,D正确;
故合理选项是C。
12.C
A.为的电离,是吸热过程,①是其逆过程,可得;②为强碱的稀溶液与强酸的稀溶液的中和反应,为放热反应,,A错误;
B.③属于中和反应,放热,④是电离过程,吸热,则、,B错误;
C.③-②得④,,即,C正确;
D.③-②得④,,即,D错误;
故选C。
13.B
A.能量转化形式为太阳能→化学能,故A错误;
B.太阳能为取之不尽的可再生的清洁能源,故B正确;
C.中Mn的化合价为价,MnO中Mn的化合价为价,故C错误;
D.根据上述原理图可知,反应的实质为分解水,生成氢气和氧气,该反应为吸热反应,总反应的热化学方程式为,故D错误;
故选B。
14.B
A.2H生成H2形成化学键放热,液态水变为气态水需要吸热,,故A错误;
B.根据盖斯定律可知,由因为所以,故B正确;
C.根据盖斯定律可知,,故C错误;
D.根据上图循环可知,故D错误;
故答案为B
15.D
KOH与CO2反应生成正盐K2CO3的方程式为2KOH+CO2=K2CO3+H2O。KOH的物质的量为5mol·L-1×0.1L=0.5mol,与其生成正盐的CO2为0.25mol。根据方程式,生成0.25molCO2,消耗molC4H10,放出的热量为QkJ。故1molC4H10完全燃烧放出的热量为16QkJ,即ΔH=-16QkJ·mol-1,D符合题意;
答案为D。
16.(1) ③ H=-164.0kJ/mol
(2)-93
(3) H3=-44.0kJ/mol 大于
(1)吸热反应的焓变大于零,故选③;
已知:① H1=-483.6kJ/mol
② H2=-128.3kJ/mol
③ H3=+206.1kJ/mol
由甲烷和氧气合成液态甲醇的化学方程式为,由盖斯定律可知,×①+②+③得 H= H1+ H2+ H3=-164.0kJ/mol;
(2)反应的焓变等于反应物的键能和减去生成物的键能和,故a=945+3×436-6×391=-93;
(3)已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量,放热焓变为负值, H3=-44.0kJ/mol,能量越低物质越稳定,该过程中放出热量,故H2O(l)的稳定性大于H2O(g)。
17.(1) 上下匀速搅动 Cu是热的良导体,传热快,热量损失大
(2)1337.6
(3)ab
(4)偏小
(5) 不相等 相等
(1)中和反应反应热的测定实验,玻璃搅拌器的使用方法是上下匀速搅动;该实验成败的关键是防止热量损失,Cu是热的良导体,传热快,热量损失大,所以不能用铜质搅拌器代替玻璃搅拌器。
(2)三次温度差分别为,温度的平均值为,溶液的总质量为,该实验测得反应放出的热量为。
(3)a.用量筒量取盐酸的体积时仰视读数,量取盐酸体积偏大,生成的水偏多,放出的热量偏多,选a;
b.把量筒中的氢氧化钠溶液分多次倒入盐酸中,热量损失较多,选b;
c.将50mL0.55mol L-1氢氧化钠溶液取成了50mL0.55mol L-1氢氧化钾溶液,生成水的量不变,放出的热量不变,故不选c;
d.做本实验的当天室温较高,空气温度与放出的热量无关,不影响温度的变化,故不选d;
选ab。
(4)NaOH固体溶解放热,如果将NaOH溶液换成等量的NaOH固体,那么实验中放热偏多,测得的中和反应反应热(△H)偏小。
(5)如果用盐酸与溶液进行实验,由于试剂的量不同,所放出的热量与上述实验不相等,但中和反应反应热是换算成生成时放出的热量,所求的中和反应反应热与上述反应相等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
