4.1.1 原电池的工作原理 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册
文档属性
| 名称 | 4.1.1 原电池的工作原理 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 636.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-27 16:06:22 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
4.1.1 原电池的工作原理 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
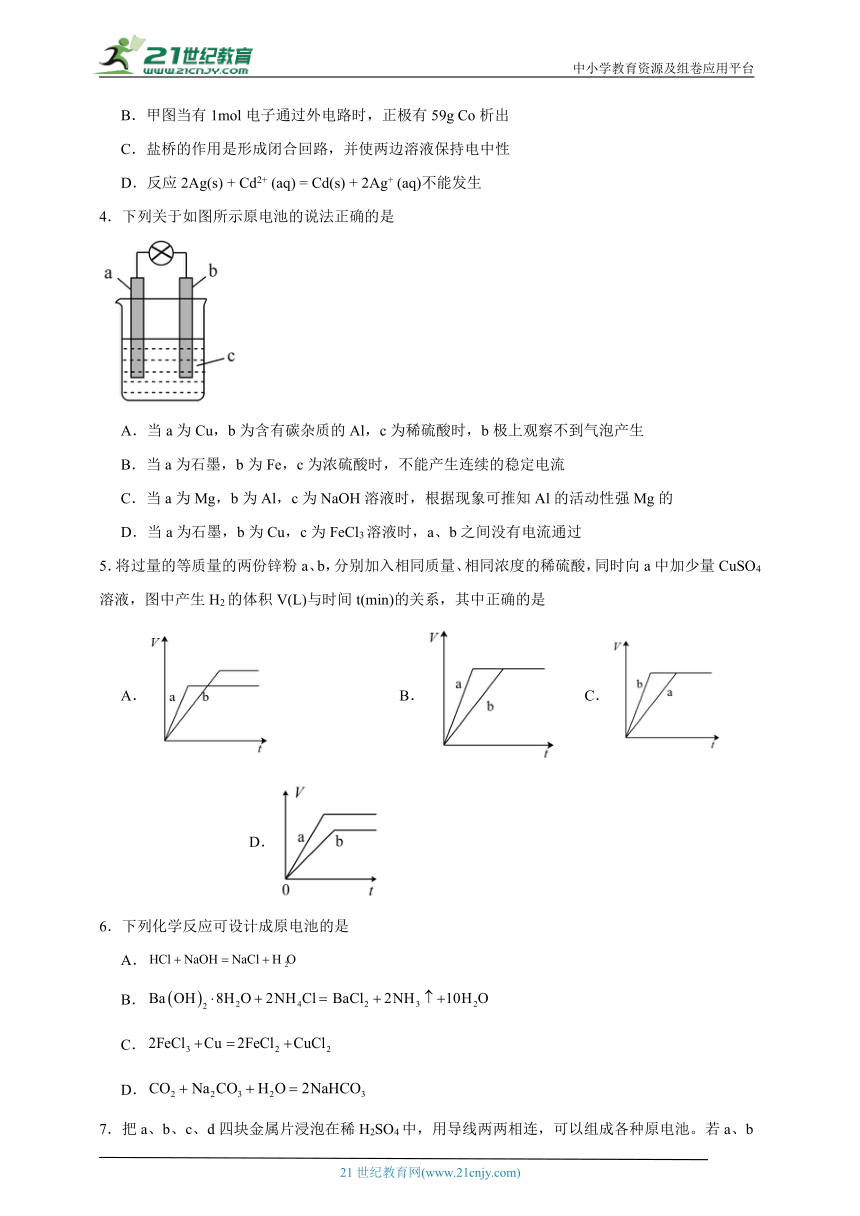
1.某原电池的总反应是,该原电池的正确组成是
A. B.
C. D.
2.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是
A.电流从铜电极通过灵敏电流计流向银电极
B.盐桥中的阴离子向AgNO3溶液中迁移
C.银片上发生的电极反应是:Ag-e-=Ag+
D.铜片插入硝酸银溶液中发生的化学反应与该原电池总反应相同
3.下图甲和乙是双液原电池装置。由图可判断下列说法错误的是
A.乙图电池反应的离子方程式为: Co(s) + 2Ag+ (aq) = 2Ag(s) + Co2+(aq)
B.甲图当有1mol电子通过外电路时,正极有59g Co析出
C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D.反应2Ag(s) + Cd2+ (aq) = Cd(s) + 2Ag+ (aq)不能发生
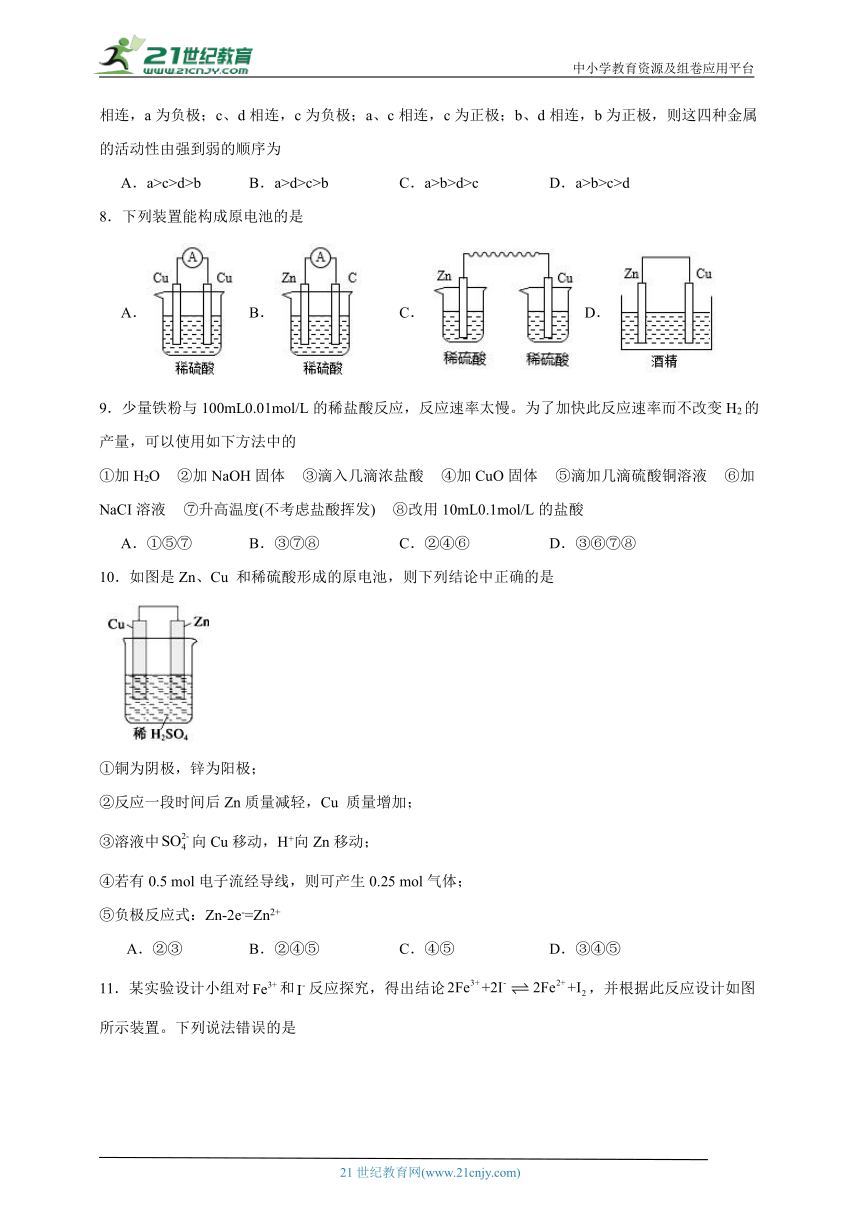
4.下列关于如图所示原电池的说法正确的是
A.当a为Cu,b为含有碳杂质的Al,c为稀硫酸时,b极上观察不到气泡产生
B.当a为石墨,b为Fe,c为浓硫酸时,不能产生连续的稳定电流
C.当a为Mg,b为Al,c为NaOH溶液时,根据现象可推知Al的活动性强Mg的
D.当a为石墨,b为Cu,c为FeCl3溶液时,a、b之间没有电流通过
5.将过量的等质量的两份锌粉a、b,分别加入相同质量、相同浓度的稀硫酸,同时向a中加少量CuSO4溶液,图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是
A. B. C. D.
6.下列化学反应可设计成原电池的是
A.
B.
C.
D.
7.把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连,可以组成各种原电池。若a、b相连,a为负极;c、d相连,c为负极;a、c相连,c为正极;b、d相连,b为正极,则这四种金属的活动性由强到弱的顺序为
A.a>c>d>b B.a>d>c>b C.a>b>d>c D.a>b>c>d
8.下列装置能构成原电池的是
A. B. C. D.
9.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CuO固体 ⑤滴加几滴硫酸铜溶液 ⑥加NaCI溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L的盐酸
A.①⑤⑦ B.③⑦⑧ C.②④⑥ D.③⑥⑦⑧
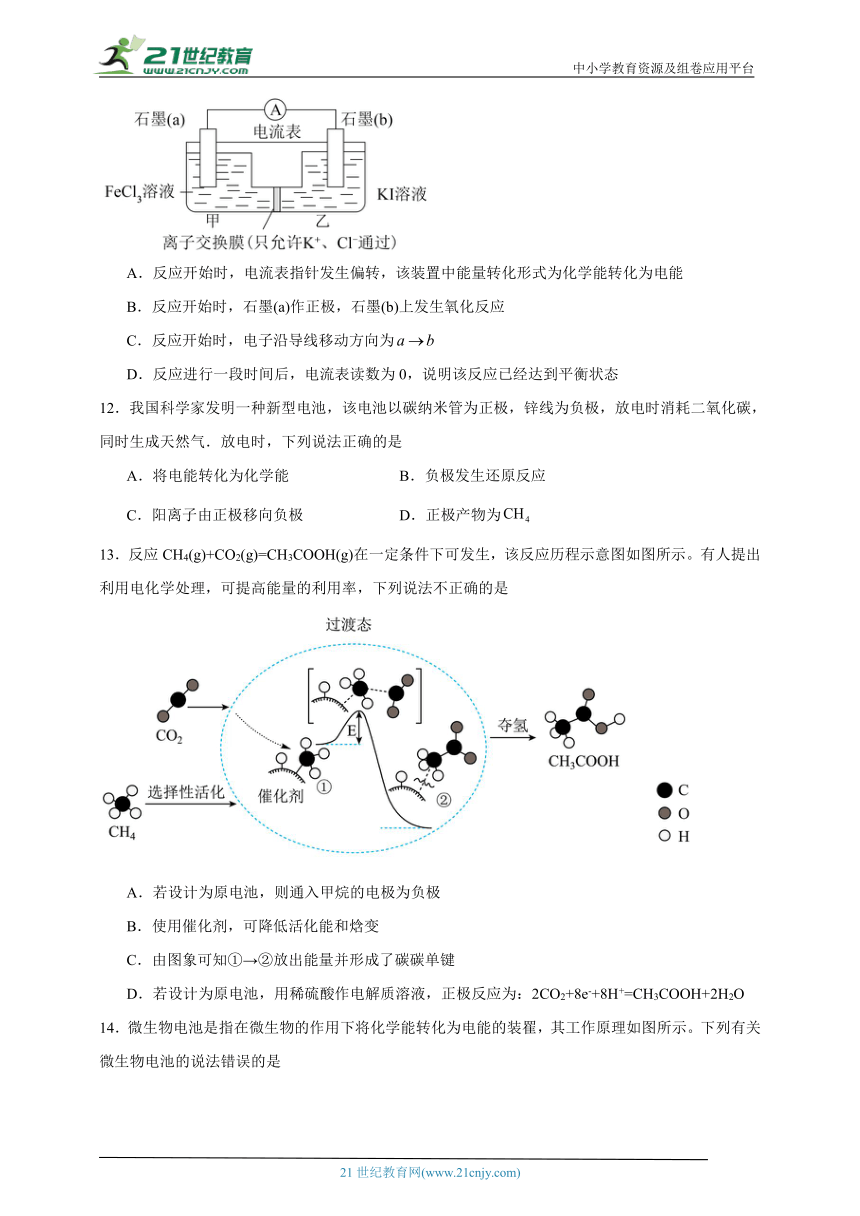
10.如图是Zn、Cu 和稀硫酸形成的原电池,则下列结论中正确的是
①铜为阴极,锌为阳极;
②反应一段时间后Zn质量减轻,Cu 质量增加;
③溶液中向Cu移动,H+向Zn移动;
④若有0.5 mol电子流经导线,则可产生0.25 mol气体;
⑤负极反应式:Zn-2e-=Zn2+
A.②③ B.②④⑤ C.④⑤ D.③④⑤
11.某实验设计小组对和反应探究,得出结论,并根据此反应设计如图所示装置。下列说法错误的是
A.反应开始时,电流表指针发生偏转,该装置中能量转化形式为化学能转化为电能
B.反应开始时,石墨(a)作正极,石墨(b)上发生氧化反应
C.反应开始时,电子沿导线移动方向为
D.反应进行一段时间后,电流表读数为0,说明该反应已经达到平衡状态
12.我国科学家发明一种新型电池,该电池以碳纳米管为正极,锌线为负极,放电时消耗二氧化碳,同时生成天然气.放电时,下列说法正确的是
A.将电能转化为化学能 B.负极发生还原反应
C.阳离子由正极移向负极 D.正极产物为
13.反应CH4(g)+CO2(g)=CH3COOH(g)在一定条件下可发生,该反应历程示意图如图所示。有人提出利用电化学处理,可提高能量的利用率,下列说法不正确的是
A.若设计为原电池,则通入甲烷的电极为负极
B.使用催化剂,可降低活化能和焓变
C.由图象可知①→②放出能量并形成了碳碳单键
D.若设计为原电池,用稀硫酸作电解质溶液,正极反应为:2CO2+8e-+8H+=CH3COOH+2H2O
14.微生物电池是指在微生物的作用下将化学能转化为电能的装 ,其工作原理如图所示。下列有关微生物电池的说法错误的是
A.正极有生成
B.电池总反应:
C.微生物促进了反应中电子的转移
D.质子通过交换膜从负极移向正极
15.某原电池的工作原理如图所示,总反应为Zn+2=Zn2++2NH3↑+H2↑,下列说法正确的是
A.石墨为电池的正极
B.电池工作时石墨逐渐被消耗
C.电子由石墨电极经外电路流向Zn电极
D.反应2+2e-=2NH3↑+H2↑在负极上发生
二、填空题
16.化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是_______(填字母)。
A.
B.
C.
D.
(2)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图实验。
①该实验过程涉及的能量变化是 。
②Zn棒是 极,电流方向是从 棒流向 棒。
(3)若将两个金属棒用导线相连在一起,总质量为80.00g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为47.5g,则装置工作时锌片上的电极反应式为 ,工作时间内装置所产生氢气的体积为 L(标准状况)。
17.回答下列问题。
Ⅰ.中国杭州举行的第19届亚运会倡导:绿色能源引领科技与环保,氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)根据下图写出a极反应式 。
Ⅱ.氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如图所示。
(2)a电极的电极反应式是 。
(3)一段时间后,溶液的浓度如何变化 (填“增大”、“减小”或“不变”)。
Ⅲ.运用电解溶液制备小苏打和烧碱,原理如图所示。
(4)B处排出的溶液主要溶质为 (写化学式)。电解槽中的离子交换膜为 (填“阴”或“阳”)离子交换膜。
(5)当阳极区收集到气体(标准状况下),通过离子交换膜的离子数目为 。
参考答案
1.C
由题干某原电池的总反应为可知,Fe在反应中由0价转化为+2价,化合价升高,发生氧化反应,故Fe作负极,Cu2+在反应中化合价由+2价降低为0价,化合价降低,发生还原反应,故在正极上发生该反应,据此分析解题。
A.由于Zn比Cu活泼,故Zn作负极,Cu为正极,电解质中的Cu2+被还原,A错误;
B.装置中没有自发的发生氧化还原反应,B错误;
C.由于Fe比Cu活泼,故Fe作负极,Cu为正极,电解质中的Cu2+被还原,C正确;
D.装置中没有自发的发生氧化还原反应,D错误;
故选C。
2.D
铜比银活泼,则铜为负极,铜片上发生的反应是:Cu-2e-=Cu2+,银片是原电池的正极,溶液中的银离子得到电子发生还原反应,电极反应是Ag++e-=Ag;原电池总反应为Cu+2Ag+=2Ag+Cu2+。
A.据分析,电流从银电极通过灵敏电流计流向铜电极,故A错误;
B. 盐桥中的阴离子向负极、硝酸铜溶液中迁移,故B错误;
C. 银片上发生的电极反应是:Ag++e-=Ag,故C错误;
D. 据分析,铜片插入硝酸银溶液中发生的化学反应与该原电池总反应相同:Cu+2Ag+=2Ag+Cu2+,故D正确。
答案选D。
3.B
A.乙装置中,Co为负极,Co极电极反应式为Co-2e-=Co2+,Ag为正极,Ag极电极反应式为2Ag++2e-=2Ag,电池总反应的离子方程式为Co(s)+2Ag+(aq)=Co2+(aq)+2Ag(s),A正确;
B.甲装置中,Co为正极,Co极电极反应式为Co2++2e-=Co,当有1 mol电子通过外电路时正极析出0.5 molCo,即有29.5 gCo析出,B错误;
C.盐桥的作用是形成闭合回路和平衡电荷,原电池工作时,盐桥中的阳离子向正极移动,阴离子向负极移动,使两边溶液保持电中性,C正确;
D.甲装置中,Cd为负极,Co为正极,金属活动性:Cd>Co,乙装置中,Co为负极,Ag为正极,金属活动性:Co>Ag,则金属活动性:Cd>Co>Ag,反应2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)不能发生,D正确;
故答案选B。
4.B
A.a为原电池的正极,b为原电池的负极,铜上有气泡,因b为含有碳杂质的Al,自身构成原电池,碳为正极,铝为负极,b可观察到气泡,故A错误;
B.铁与浓硫酸反应生成致密的氧化物保护膜,发生钝化现象,当a为石墨,b为Fe,c为浓硫酸时,不能产生连续的稳定电流,故B正确;
C.Al可与NaOH溶液反应,Mg、Al在氢氧化钠溶液中可以构成原电池,Al做原电池的负极,但实际上Mg的活泼性强于Al的活泼性,故C错误;
D.2Fe3++Cu=2Fe2++Cu2+,当a为石墨,b为Cu,c为FeCl3溶液时,b为负极失去电子,a为正极,a、b之间有电流通过,故D错误;
故选:B。
5.B
足量的锌和相同量的稀硫酸反应,a中加入硫酸铜溶液,会置换出金属铜,形成锌、铜、稀硫酸原电池,加速金属铁和硫酸反应的速率,所以反应速率:a>b,速率越大,锌完全反应时所用的时间越短,所以a所用的时间小于b所用的时间;产生氢气的量取决于稀硫酸的物质的量,而a、b中金属锌均过量,和相同量的硫酸反应生成氢气的量相等,所以氢气的体积:a=b,综上所述,故选B。
6.C
能被设计成原电池的反应一般是氧化还原反应,A、B、D都是非氧化还原反应,只有C是氧化还原反应,故本题答案C。
7.A
把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连可以组成各种原电池,若a、b相连时,a为溶解,则a为负极,为活泼金属,b为正极,是较活泼的金属,因此活泼性a>b;c、d相连时c为负极,则c为活泼金属,d为正极,是较活泼金属,因此活泼性c>d;a、c相连时c为正极,则c为较活泼金属,a为负极,是活泼金属,因此活泼性a>c;b、d相连时b为正极,则b为较活泼金属,d为负极,是活泼金属,因此活泼性d>b,则这四种金属活动性顺序a>c>d>b,故答案为A。
8.B
构成原电池需具备以下条件:两个活性不同的电极;电解质溶液;形成闭合电路;存在能自动发生的氧化还原反应,据此分析判断。
A.两电极均为Cu,不能构成原电池,A不符合题意;
B.Zn为负极,C为正极,电解质为稀硫酸,可发生自发进行的氧化还原反应,可以构成原电池,B符合题意;
C.没有构成闭合回路,不能构成原电池,C不符合题意;
D.酒精不是电解质,不能转移电子,不能构成原电池,D不符合题意;
故答案选B。
9.B
①加水,稀释了盐酸的浓度,反应速率变慢,故①不符合题意;
②加NaOH固体会消耗H+,降低H2产量,故②不符合题意;
③滴入几滴浓盐酸,使H+浓度变大,由于Fe少量,不影响H2产量,故③符合题意;
④加CuO固体与盐酸反应生成氯化铜和水,氯化铜再与铁发生置换反应生成铜,构成原电池,反应速率加快,但由于消耗铁影响氢气总量,故④不符合题意;
⑤滴加几滴硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量,故⑤不符合题意;
⑥加NaCI溶液相当于加水,稀释了盐酸的浓度,反应速率变慢,故⑥不符合题意;
⑦升高温度,可加快反应速率,不考虑盐酸挥发,不影响H2产量,故⑦符合题意;
⑧改用10mL0.1mol/L的盐酸,增大了盐酸的浓度,反应速率加快,由于Fe少量,不影响H2产量,故⑧符合题意;
综上分析,答案选B。
10.C
该图为铜锌原电池,Zn作负极,Cu作正极,负极上电极反应为:Zn-2e-=Zn2+,正极上电极反应为:2H++2e-=H2↑。
①根据分析,铜为正极,锌为负极,故①错误;
②根据分析中电极反应可知,反应一段时间后Zn质量减轻,Cu 质量不变,故②错误;
③原电池中,阳离子向正极移动,阴离子向负极移动,溶液中向Zn移动,H+向Cu移动,故③错误;
④若有0.5 mol电子流经导线,根据正极上电极反应:2H++2e-=H2↑,则可产生0.25 mol气体,故④正确;
⑤根据分析,负极反应式:Zn-2e-=Zn2+,故⑤正确;
综上分析,结论正确的为④⑤,答案选C。
11.C
由总反应可知,I-发生氧化反应生成I2,则石墨(b)极为负极,那么石墨(a)极为正极。
A.该装置形成原电池,原电池是将化学能转化为电能的装置,A正确;
B.由上述分析可知,石墨(a)为正极,石墨(b)为负极, 负极上发生氧化反应,B正确;
C.原电池中,电子由负极经导线流向正极,即电子沿导线移动方向为b→a,C错误;
D.反应进行一段时间后,电流表读数为0,电路中不再产生电流,此时反应达到平衡状态,D正确;
故选C。
12.D
该电池以碳纳米管为正极、锌线为负极,放电时消耗二氧化碳,同时生成天然气,二氧化碳转化为天然气,C元素化合价由+4价变为-4价,二氧化碳发生还原反应,则二氧化碳在正极得电子,Zn在负极失电子;
A.由题干可知,为原电池装置,将化学能转化为电能,A错误;
B.原电池的负极失去电子发生氧化反应,B错误;
C.原电池中,阳离子向正极移动,C错误;
D.由分析可知,正极上二氧化碳得电子生成甲烷,故正极产物为甲烷,D正确;
故选D。
13.B
A.CH4中碳原子化合价-4,CO2中碳原子化合价+4,CH3COOH中碳原子平均化合价为0价,CH4发生失电子的氧化反应,若设计为原电池,通入甲烷的电极为负极,A正确;
B.催化剂只能降低活化能,不可能改变焓变,B错误;
C.①→②反应物能量高,生成物能量低,该过程放出的能量,且反应过程中甲烷分子中的碳氢键断裂,与二氧化碳分子形成的碳碳单键,C正确;
D.若设计为原电池,用稀硫酸作电解质溶液,正极为二氧化碳发生还原反应生成乙酸,正极电极反应式:2CO2+8e-+8H+=CH3COOH+2H2O,D正确;
答案选B。
14.A
C6H12O6在微生物的作用下将化学能转化为电能,形成原电池,根据图示可知,负极上C6H12O6失电子,其电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极上氧气得电子,其电极反应式为O2+4e-+4H+=2H2O。
A.负极上C6H12O6失电子,其电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,因此在负极生成,故A错误;
B.正极上氧气得电子,其电极反应式为O2+4e-+4H+=2H2O,负极上C6H12O6失电子,其电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,电池总反应为,故B正确;
C.C6H12O6在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,故C正确;
D.原电池内电路中,阳离子向正极移动,所以质子通过交换膜从负极移向正极,故D正确;
故答案为:A。
15.A
根据电池总反应反应Zn+2=Zn2++2NH3↑+H2↑,可知Zn从0价升高到+2价,失电子,作负极,石墨为正极,由此分析回答;
A.由分析可知,石墨为电池的正极,A正确;
B.石墨为正极,不参与反应,不被消耗,B错误;
C.电子由Zn电极经外电路流向石墨电极,C错误;
D.反应2+2e-=2NH3↑+H2↑在正极上发生,D错误;
故选A。
16.(1)C
(2) 将化学能转化为电能 负极 铜棒 锌棒
(3) 11.2
(1)只有自发的氧化还原反应能设计成原电池。
A.是非氧化还原反应,不能设计成原电池,A错误;
B.是吸热的氧化还原反应,反应不能自发进行,因此不能设计为原电池,B错误;
C.是自发的氧化还原反应,能设计成原电池,C正确;
D.是非氧化还原反应,不能设计成原电池,D正确;
故选C;
(2)该实验装置构成了原电池,由于金属活动性Zn>Cu,所以在构成的原电池反应中,Zn为负极,Cu为正极。负极上Zn失去电子,发生氧化反应,电极反应式为:Zn-2e-=Zn2+,在正极Cu上溶液中的H+得到电子发生还原反应,电极反应式为2H++2e-=H2↑。
①则该实验过程涉及的主要的能量变化是将化学能转化为电能;
②Zn棒是负极,电流方向是从铜棒流向锌棒;
(3)由于金属活动性Zn>Ag,所以在构成的原电池反应中,Zn为负极,Ag为正极。负极上Zn失去电子,发生氧化反应,电极反应式为:Zn-2e-=Zn2+,在正极Ag上溶液中的H+得到电子发生还原反应,电极反应式为2H++2e-=H2↑。总反应方程式为Zn+2H+=Zn2++H2↑,反应消耗Zn的质量为m(Zn)=80.00 g-47.5 g=32.5 g,n(Zn)=,根据方程式中物质反应转化关系可知:产生H2的物质的量是0.5 mol,其在标准状况下的体积V(H2)=0.5 mol×22.4 L/mol=11.2 L。
17.(1)H2-2e-+2OH-=2H2O
(2)
(3)减小
(4) 阳
(5)或
(1)根据图中信息可知,a极上氢气失电子在碱性条件下产生水,电极反应式为H2-2e-+2OH-=2H2O;
(2)氨氧燃料电池中,由图知,a电极上氨气失去电子转变为氮气,被氧化,则a电极上的反应式为;
(3)燃料电池b电极反应为:O2+2H2O+4e-=4OH-可知,工作一段时间后,氢氧根离子数目不会发生改变,但水不断生成,则电解质溶液中的c(OH-)将减小;
(4)电解Na2CO3溶液,结合图可知,阳极上碳酸根离子失去电子生成碳酸氢根离子和氧气,阴极上氢离子得到电子生成氢气,则A为NaHCO3;电解使钠离子向阴极移动,应用阳离子交换膜;
(5)当阳极区收集到1.12L气体在标准状况下的物质的量,由O2~4e-~2H2,n(H2)=2n(O2)=0.1mol,m=nM=0.1mol2g/mol=0.2g,由阴极电解反应式2H2O+2e-= H2↑+2OH-,流入0.2molNa+进入阴极区,微粒数目为0.2NA或1.2041023。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
4.1.1 原电池的工作原理 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
1.某原电池的总反应是,该原电池的正确组成是
A. B.
C. D.
2.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是
A.电流从铜电极通过灵敏电流计流向银电极
B.盐桥中的阴离子向AgNO3溶液中迁移
C.银片上发生的电极反应是:Ag-e-=Ag+
D.铜片插入硝酸银溶液中发生的化学反应与该原电池总反应相同
3.下图甲和乙是双液原电池装置。由图可判断下列说法错误的是
A.乙图电池反应的离子方程式为: Co(s) + 2Ag+ (aq) = 2Ag(s) + Co2+(aq)
B.甲图当有1mol电子通过外电路时,正极有59g Co析出
C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D.反应2Ag(s) + Cd2+ (aq) = Cd(s) + 2Ag+ (aq)不能发生
4.下列关于如图所示原电池的说法正确的是
A.当a为Cu,b为含有碳杂质的Al,c为稀硫酸时,b极上观察不到气泡产生
B.当a为石墨,b为Fe,c为浓硫酸时,不能产生连续的稳定电流
C.当a为Mg,b为Al,c为NaOH溶液时,根据现象可推知Al的活动性强Mg的
D.当a为石墨,b为Cu,c为FeCl3溶液时,a、b之间没有电流通过
5.将过量的等质量的两份锌粉a、b,分别加入相同质量、相同浓度的稀硫酸,同时向a中加少量CuSO4溶液,图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是
A. B. C. D.
6.下列化学反应可设计成原电池的是
A.
B.
C.
D.
7.把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连,可以组成各种原电池。若a、b相连,a为负极;c、d相连,c为负极;a、c相连,c为正极;b、d相连,b为正极,则这四种金属的活动性由强到弱的顺序为
A.a>c>d>b B.a>d>c>b C.a>b>d>c D.a>b>c>d
8.下列装置能构成原电池的是
A. B. C. D.
9.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CuO固体 ⑤滴加几滴硫酸铜溶液 ⑥加NaCI溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L的盐酸
A.①⑤⑦ B.③⑦⑧ C.②④⑥ D.③⑥⑦⑧
10.如图是Zn、Cu 和稀硫酸形成的原电池,则下列结论中正确的是
①铜为阴极,锌为阳极;
②反应一段时间后Zn质量减轻,Cu 质量增加;
③溶液中向Cu移动,H+向Zn移动;
④若有0.5 mol电子流经导线,则可产生0.25 mol气体;
⑤负极反应式:Zn-2e-=Zn2+
A.②③ B.②④⑤ C.④⑤ D.③④⑤
11.某实验设计小组对和反应探究,得出结论,并根据此反应设计如图所示装置。下列说法错误的是
A.反应开始时,电流表指针发生偏转,该装置中能量转化形式为化学能转化为电能
B.反应开始时,石墨(a)作正极,石墨(b)上发生氧化反应
C.反应开始时,电子沿导线移动方向为
D.反应进行一段时间后,电流表读数为0,说明该反应已经达到平衡状态
12.我国科学家发明一种新型电池,该电池以碳纳米管为正极,锌线为负极,放电时消耗二氧化碳,同时生成天然气.放电时,下列说法正确的是
A.将电能转化为化学能 B.负极发生还原反应
C.阳离子由正极移向负极 D.正极产物为
13.反应CH4(g)+CO2(g)=CH3COOH(g)在一定条件下可发生,该反应历程示意图如图所示。有人提出利用电化学处理,可提高能量的利用率,下列说法不正确的是
A.若设计为原电池,则通入甲烷的电极为负极
B.使用催化剂,可降低活化能和焓变
C.由图象可知①→②放出能量并形成了碳碳单键
D.若设计为原电池,用稀硫酸作电解质溶液,正极反应为:2CO2+8e-+8H+=CH3COOH+2H2O
14.微生物电池是指在微生物的作用下将化学能转化为电能的装 ,其工作原理如图所示。下列有关微生物电池的说法错误的是
A.正极有生成
B.电池总反应:
C.微生物促进了反应中电子的转移
D.质子通过交换膜从负极移向正极
15.某原电池的工作原理如图所示,总反应为Zn+2=Zn2++2NH3↑+H2↑,下列说法正确的是
A.石墨为电池的正极
B.电池工作时石墨逐渐被消耗
C.电子由石墨电极经外电路流向Zn电极
D.反应2+2e-=2NH3↑+H2↑在负极上发生
二、填空题
16.化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是_______(填字母)。
A.
B.
C.
D.
(2)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图实验。
①该实验过程涉及的能量变化是 。
②Zn棒是 极,电流方向是从 棒流向 棒。
(3)若将两个金属棒用导线相连在一起,总质量为80.00g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为47.5g,则装置工作时锌片上的电极反应式为 ,工作时间内装置所产生氢气的体积为 L(标准状况)。
17.回答下列问题。
Ⅰ.中国杭州举行的第19届亚运会倡导:绿色能源引领科技与环保,氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)根据下图写出a极反应式 。
Ⅱ.氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如图所示。
(2)a电极的电极反应式是 。
(3)一段时间后,溶液的浓度如何变化 (填“增大”、“减小”或“不变”)。
Ⅲ.运用电解溶液制备小苏打和烧碱,原理如图所示。
(4)B处排出的溶液主要溶质为 (写化学式)。电解槽中的离子交换膜为 (填“阴”或“阳”)离子交换膜。
(5)当阳极区收集到气体(标准状况下),通过离子交换膜的离子数目为 。
参考答案
1.C
由题干某原电池的总反应为可知,Fe在反应中由0价转化为+2价,化合价升高,发生氧化反应,故Fe作负极,Cu2+在反应中化合价由+2价降低为0价,化合价降低,发生还原反应,故在正极上发生该反应,据此分析解题。
A.由于Zn比Cu活泼,故Zn作负极,Cu为正极,电解质中的Cu2+被还原,A错误;
B.装置中没有自发的发生氧化还原反应,B错误;
C.由于Fe比Cu活泼,故Fe作负极,Cu为正极,电解质中的Cu2+被还原,C正确;
D.装置中没有自发的发生氧化还原反应,D错误;
故选C。
2.D
铜比银活泼,则铜为负极,铜片上发生的反应是:Cu-2e-=Cu2+,银片是原电池的正极,溶液中的银离子得到电子发生还原反应,电极反应是Ag++e-=Ag;原电池总反应为Cu+2Ag+=2Ag+Cu2+。
A.据分析,电流从银电极通过灵敏电流计流向铜电极,故A错误;
B. 盐桥中的阴离子向负极、硝酸铜溶液中迁移,故B错误;
C. 银片上发生的电极反应是:Ag++e-=Ag,故C错误;
D. 据分析,铜片插入硝酸银溶液中发生的化学反应与该原电池总反应相同:Cu+2Ag+=2Ag+Cu2+,故D正确。
答案选D。
3.B
A.乙装置中,Co为负极,Co极电极反应式为Co-2e-=Co2+,Ag为正极,Ag极电极反应式为2Ag++2e-=2Ag,电池总反应的离子方程式为Co(s)+2Ag+(aq)=Co2+(aq)+2Ag(s),A正确;
B.甲装置中,Co为正极,Co极电极反应式为Co2++2e-=Co,当有1 mol电子通过外电路时正极析出0.5 molCo,即有29.5 gCo析出,B错误;
C.盐桥的作用是形成闭合回路和平衡电荷,原电池工作时,盐桥中的阳离子向正极移动,阴离子向负极移动,使两边溶液保持电中性,C正确;
D.甲装置中,Cd为负极,Co为正极,金属活动性:Cd>Co,乙装置中,Co为负极,Ag为正极,金属活动性:Co>Ag,则金属活动性:Cd>Co>Ag,反应2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)不能发生,D正确;
故答案选B。
4.B
A.a为原电池的正极,b为原电池的负极,铜上有气泡,因b为含有碳杂质的Al,自身构成原电池,碳为正极,铝为负极,b可观察到气泡,故A错误;
B.铁与浓硫酸反应生成致密的氧化物保护膜,发生钝化现象,当a为石墨,b为Fe,c为浓硫酸时,不能产生连续的稳定电流,故B正确;
C.Al可与NaOH溶液反应,Mg、Al在氢氧化钠溶液中可以构成原电池,Al做原电池的负极,但实际上Mg的活泼性强于Al的活泼性,故C错误;
D.2Fe3++Cu=2Fe2++Cu2+,当a为石墨,b为Cu,c为FeCl3溶液时,b为负极失去电子,a为正极,a、b之间有电流通过,故D错误;
故选:B。
5.B
足量的锌和相同量的稀硫酸反应,a中加入硫酸铜溶液,会置换出金属铜,形成锌、铜、稀硫酸原电池,加速金属铁和硫酸反应的速率,所以反应速率:a>b,速率越大,锌完全反应时所用的时间越短,所以a所用的时间小于b所用的时间;产生氢气的量取决于稀硫酸的物质的量,而a、b中金属锌均过量,和相同量的硫酸反应生成氢气的量相等,所以氢气的体积:a=b,综上所述,故选B。
6.C
能被设计成原电池的反应一般是氧化还原反应,A、B、D都是非氧化还原反应,只有C是氧化还原反应,故本题答案C。
7.A
把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连可以组成各种原电池,若a、b相连时,a为溶解,则a为负极,为活泼金属,b为正极,是较活泼的金属,因此活泼性a>b;c、d相连时c为负极,则c为活泼金属,d为正极,是较活泼金属,因此活泼性c>d;a、c相连时c为正极,则c为较活泼金属,a为负极,是活泼金属,因此活泼性a>c;b、d相连时b为正极,则b为较活泼金属,d为负极,是活泼金属,因此活泼性d>b,则这四种金属活动性顺序a>c>d>b,故答案为A。
8.B
构成原电池需具备以下条件:两个活性不同的电极;电解质溶液;形成闭合电路;存在能自动发生的氧化还原反应,据此分析判断。
A.两电极均为Cu,不能构成原电池,A不符合题意;
B.Zn为负极,C为正极,电解质为稀硫酸,可发生自发进行的氧化还原反应,可以构成原电池,B符合题意;
C.没有构成闭合回路,不能构成原电池,C不符合题意;
D.酒精不是电解质,不能转移电子,不能构成原电池,D不符合题意;
故答案选B。
9.B
①加水,稀释了盐酸的浓度,反应速率变慢,故①不符合题意;
②加NaOH固体会消耗H+,降低H2产量,故②不符合题意;
③滴入几滴浓盐酸,使H+浓度变大,由于Fe少量,不影响H2产量,故③符合题意;
④加CuO固体与盐酸反应生成氯化铜和水,氯化铜再与铁发生置换反应生成铜,构成原电池,反应速率加快,但由于消耗铁影响氢气总量,故④不符合题意;
⑤滴加几滴硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量,故⑤不符合题意;
⑥加NaCI溶液相当于加水,稀释了盐酸的浓度,反应速率变慢,故⑥不符合题意;
⑦升高温度,可加快反应速率,不考虑盐酸挥发,不影响H2产量,故⑦符合题意;
⑧改用10mL0.1mol/L的盐酸,增大了盐酸的浓度,反应速率加快,由于Fe少量,不影响H2产量,故⑧符合题意;
综上分析,答案选B。
10.C
该图为铜锌原电池,Zn作负极,Cu作正极,负极上电极反应为:Zn-2e-=Zn2+,正极上电极反应为:2H++2e-=H2↑。
①根据分析,铜为正极,锌为负极,故①错误;
②根据分析中电极反应可知,反应一段时间后Zn质量减轻,Cu 质量不变,故②错误;
③原电池中,阳离子向正极移动,阴离子向负极移动,溶液中向Zn移动,H+向Cu移动,故③错误;
④若有0.5 mol电子流经导线,根据正极上电极反应:2H++2e-=H2↑,则可产生0.25 mol气体,故④正确;
⑤根据分析,负极反应式:Zn-2e-=Zn2+,故⑤正确;
综上分析,结论正确的为④⑤,答案选C。
11.C
由总反应可知,I-发生氧化反应生成I2,则石墨(b)极为负极,那么石墨(a)极为正极。
A.该装置形成原电池,原电池是将化学能转化为电能的装置,A正确;
B.由上述分析可知,石墨(a)为正极,石墨(b)为负极, 负极上发生氧化反应,B正确;
C.原电池中,电子由负极经导线流向正极,即电子沿导线移动方向为b→a,C错误;
D.反应进行一段时间后,电流表读数为0,电路中不再产生电流,此时反应达到平衡状态,D正确;
故选C。
12.D
该电池以碳纳米管为正极、锌线为负极,放电时消耗二氧化碳,同时生成天然气,二氧化碳转化为天然气,C元素化合价由+4价变为-4价,二氧化碳发生还原反应,则二氧化碳在正极得电子,Zn在负极失电子;
A.由题干可知,为原电池装置,将化学能转化为电能,A错误;
B.原电池的负极失去电子发生氧化反应,B错误;
C.原电池中,阳离子向正极移动,C错误;
D.由分析可知,正极上二氧化碳得电子生成甲烷,故正极产物为甲烷,D正确;
故选D。
13.B
A.CH4中碳原子化合价-4,CO2中碳原子化合价+4,CH3COOH中碳原子平均化合价为0价,CH4发生失电子的氧化反应,若设计为原电池,通入甲烷的电极为负极,A正确;
B.催化剂只能降低活化能,不可能改变焓变,B错误;
C.①→②反应物能量高,生成物能量低,该过程放出的能量,且反应过程中甲烷分子中的碳氢键断裂,与二氧化碳分子形成的碳碳单键,C正确;
D.若设计为原电池,用稀硫酸作电解质溶液,正极为二氧化碳发生还原反应生成乙酸,正极电极反应式:2CO2+8e-+8H+=CH3COOH+2H2O,D正确;
答案选B。
14.A
C6H12O6在微生物的作用下将化学能转化为电能,形成原电池,根据图示可知,负极上C6H12O6失电子,其电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极上氧气得电子,其电极反应式为O2+4e-+4H+=2H2O。
A.负极上C6H12O6失电子,其电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,因此在负极生成,故A错误;
B.正极上氧气得电子,其电极反应式为O2+4e-+4H+=2H2O,负极上C6H12O6失电子,其电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,电池总反应为,故B正确;
C.C6H12O6在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,故C正确;
D.原电池内电路中,阳离子向正极移动,所以质子通过交换膜从负极移向正极,故D正确;
故答案为:A。
15.A
根据电池总反应反应Zn+2=Zn2++2NH3↑+H2↑,可知Zn从0价升高到+2价,失电子,作负极,石墨为正极,由此分析回答;
A.由分析可知,石墨为电池的正极,A正确;
B.石墨为正极,不参与反应,不被消耗,B错误;
C.电子由Zn电极经外电路流向石墨电极,C错误;
D.反应2+2e-=2NH3↑+H2↑在正极上发生,D错误;
故选A。
16.(1)C
(2) 将化学能转化为电能 负极 铜棒 锌棒
(3) 11.2
(1)只有自发的氧化还原反应能设计成原电池。
A.是非氧化还原反应,不能设计成原电池,A错误;
B.是吸热的氧化还原反应,反应不能自发进行,因此不能设计为原电池,B错误;
C.是自发的氧化还原反应,能设计成原电池,C正确;
D.是非氧化还原反应,不能设计成原电池,D正确;
故选C;
(2)该实验装置构成了原电池,由于金属活动性Zn>Cu,所以在构成的原电池反应中,Zn为负极,Cu为正极。负极上Zn失去电子,发生氧化反应,电极反应式为:Zn-2e-=Zn2+,在正极Cu上溶液中的H+得到电子发生还原反应,电极反应式为2H++2e-=H2↑。
①则该实验过程涉及的主要的能量变化是将化学能转化为电能;
②Zn棒是负极,电流方向是从铜棒流向锌棒;
(3)由于金属活动性Zn>Ag,所以在构成的原电池反应中,Zn为负极,Ag为正极。负极上Zn失去电子,发生氧化反应,电极反应式为:Zn-2e-=Zn2+,在正极Ag上溶液中的H+得到电子发生还原反应,电极反应式为2H++2e-=H2↑。总反应方程式为Zn+2H+=Zn2++H2↑,反应消耗Zn的质量为m(Zn)=80.00 g-47.5 g=32.5 g,n(Zn)=,根据方程式中物质反应转化关系可知:产生H2的物质的量是0.5 mol,其在标准状况下的体积V(H2)=0.5 mol×22.4 L/mol=11.2 L。
17.(1)H2-2e-+2OH-=2H2O
(2)
(3)减小
(4) 阳
(5)或
(1)根据图中信息可知,a极上氢气失电子在碱性条件下产生水,电极反应式为H2-2e-+2OH-=2H2O;
(2)氨氧燃料电池中,由图知,a电极上氨气失去电子转变为氮气,被氧化,则a电极上的反应式为;
(3)燃料电池b电极反应为:O2+2H2O+4e-=4OH-可知,工作一段时间后,氢氧根离子数目不会发生改变,但水不断生成,则电解质溶液中的c(OH-)将减小;
(4)电解Na2CO3溶液,结合图可知,阳极上碳酸根离子失去电子生成碳酸氢根离子和氧气,阴极上氢离子得到电子生成氢气,则A为NaHCO3;电解使钠离子向阴极移动,应用阳离子交换膜;
(5)当阳极区收集到1.12L气体在标准状况下的物质的量,由O2~4e-~2H2,n(H2)=2n(O2)=0.1mol,m=nM=0.1mol2g/mol=0.2g,由阴极电解反应式2H2O+2e-= H2↑+2OH-,流入0.2molNa+进入阴极区,微粒数目为0.2NA或1.2041023。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
