4.1.2 化学电源 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册
文档属性
| 名称 | 4.1.2 化学电源 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-27 16:06:22 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
4.1.2 化学电源 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
1.常见锌锰干电池的构造如下图所示,该电池放电时的电池总反应方程式为:Zn+2MnO2+2=Zn2++Mn2O3+2NH3+H2O,下列说法错误的是
A.该电池属于一次电池
B.电池正极反应式为:2MnO2+2NH+2e-=Mn2O3+2NH3+H2O
C.电池工作时,电子从锌筒经糊流向石墨棒
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
2.铁在一定条件下能够和水反应,最近科学家利用常见金属铁研发了一种新型可充电池,简易装置如图。下列说法错误的是
A.该电池不能在低温环境下使用
B.充电时,石墨烯a应连接电源的负极
C.放电时,电池内部O2﹣向石墨烯b移动
D.充电时,石墨烯b极发生反应:FeOx+2xe﹣=Fe+xO2﹣
3.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池采用弱酸性电解质溶液,工作原理如图所示,下列说法正确的是
A.电池工作一段时间后,正极区溶液的增大
B.转化为的反应为
C.该电池在工作时,升高温度有利于提高工作效率
D.若该电池中有参加反应,则有从向迁移
4.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应如下:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。在负极发生反应的物质是
A.Zn B.K2FeO4 C.Zn(OH)2 D.Fe(OH)3
5.铅蓄电池构造如图所示,放电时正极和负极均会生成。当导线中有电子通过时,则理论上两极共生成
A. B. C. D.
6.锌溴液流电池是液流电池的一种,能够大容量、长时间的充放电。放电时总反应为Zn+Br2= ZnBr2。下列说法正确的是
A.放电时电极M为负极
B.放电时负极的电极反应式为Zn-2e-=Zn2+
C.充电时ZnBr2溶液的浓度增大
D.电池中间使用阳离子交换膜或阴离子交换膜都可以
7.科学家开发了基于压电催化和能带弯曲的力场辅助超声波激活电池,电池反应为,电池示意图如图所示。下列叙述正确的是
A.极为负极,发生氧化反应
B.金属Li在中燃烧可生成
C.锂电极的电极反应式为
D.2.24 L (标准状况)完全反应时转移0.2 mol电子
8.我国学者自主研发了一种Al-N2二次电池,以离子液体为电解质,其工作原理如图所示。石墨烯/Pd作为电极催化剂,可吸附N2。下列说法正确的是
A.充电时可实现“氮的固定”
B.充电时阳极发生还原反应
C.Al箔为原电池的正极
D.放电时负极反应式:
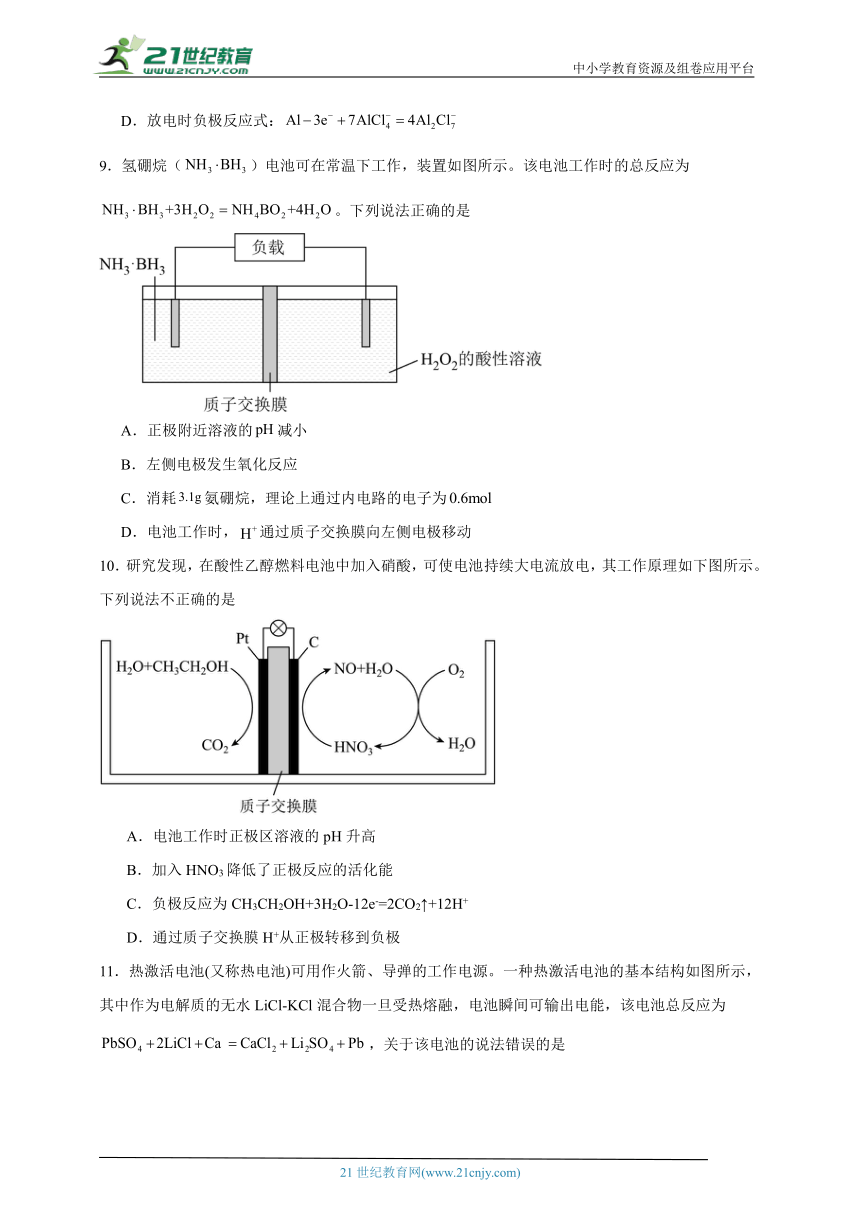
9.氢硼烷()电池可在常温下工作,装置如图所示。该电池工作时的总反应为。下列说法正确的是
A.正极附近溶液的减小
B.左侧电极发生氧化反应
C.消耗氨硼烷,理论上通过内电路的电子为
D.电池工作时,通过质子交换膜向左侧电极移动
10.研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如下图所示。下列说法不正确的是
A.电池工作时正极区溶液的pH升高
B.加入HNO3降低了正极反应的活化能
C.负极反应为CH3CH2OH+3H2O-12e-=2CO2↑+12H+
D.通过质子交换膜H+从正极转移到负极
11.热激活电池(又称热电池)可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物一旦受热熔融,电池瞬间可输出电能,该电池总反应为,关于该电池的说法错误的是
A.正极反应物为 B.放电过程中,向钙电极移动
C.负极的电极反应为 D.常温时,在正负极之间连上电流计,指针不偏转
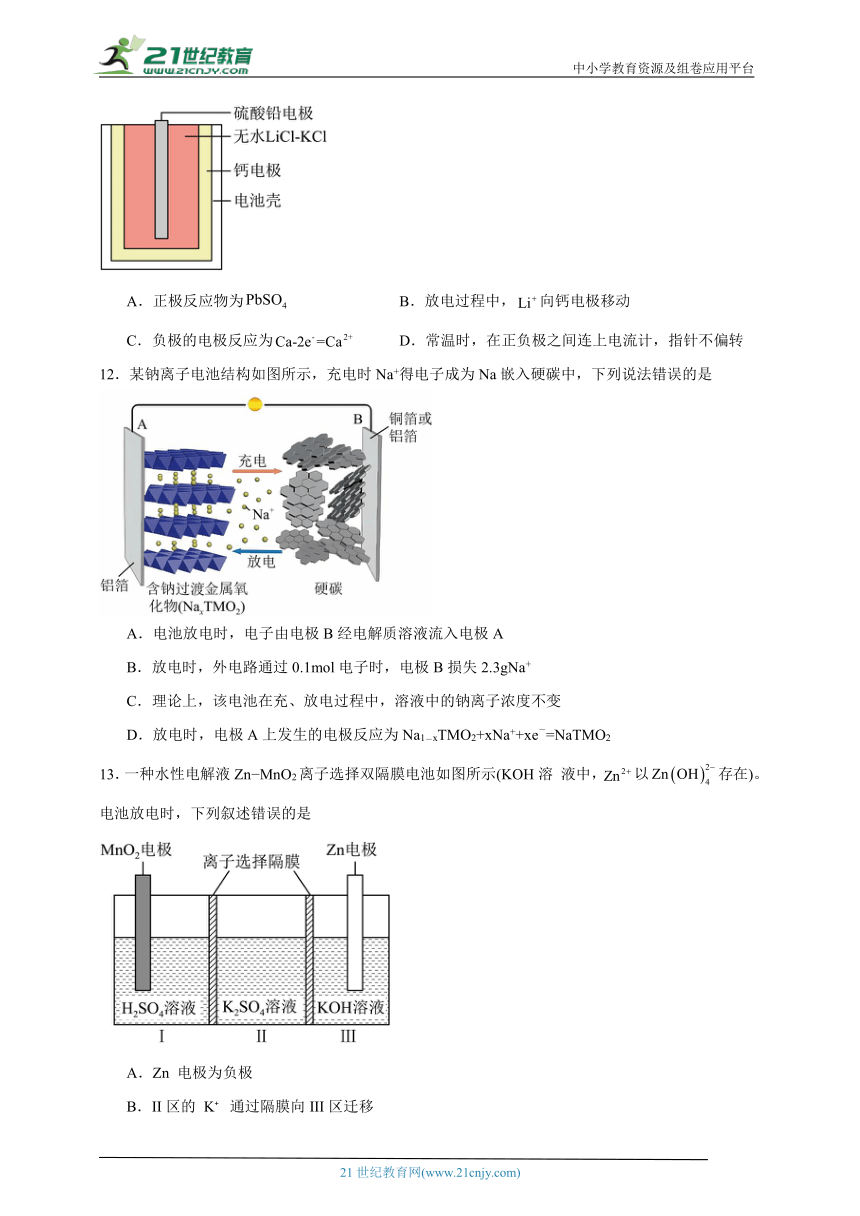
12.某钠离子电池结构如图所示,充电时Na+得电子成为Na嵌入硬碳中,下列说法错误的是
A.电池放电时,电子由电极B经电解质溶液流入电极A
B.放电时,外电路通过0.1mol电子时,电极B损失2.3gNa+
C.理论上,该电池在充、放电过程中,溶液中的钠离子浓度不变
D.放电时,电极A上发生的电极反应为Na1-xTMO2+xNa++xe-=NaTMO2
13.一种水性电解液Zn MnO2离子选择双隔膜电池如图所示(KOH溶 液中,以存在)。电池放电时,下列叙述错误的是
A.Zn 电极为负极
B.II区的 K 通过隔膜向III区迁移
C.MnO2电极反应:
D.电池总反应:
14.我国科学家利用废弃塑料设计了微生物燃料电池(A、B电极材料均为石墨烯),其工作原理如图所示。下列说法错误的是
A.A电极作负极
B.经过质子交换膜从A电极向B电极移动
C.B电极采用疏松多孔的石墨烯,主要是为了增强溶液的导电性
D.若废弃塑料为聚乙烯,A电极的电极反应式为
15.一种NO-空气燃料电池的工作原理如图所示,该电池工作时,下列说法正确的是
A.H+通过质子交换膜向左侧多孔石墨棒移动
B.负极的电极反应式为NO-3e-+2H2O=NO+4H+
C.若产生lmolHNO3,则通入O2的体积等于16.8L
D.电子的流动方向为从负极经电解质溶液流向正极
二、填空题
16.由锌片、铜片和200 mL稀H2SO4组成的原电池如下图所示:
(1)原电池的负极反应式为 ,正极反应式为 。
(2)一段时间后,当在铜片上放出1.68 L(标准状况)气体时,H2SO4恰好消耗一半,则产生这些气体的同时,共消耗 g锌,有 mol电子通过了导线,原硫酸的物质的量浓度是 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为 。
参考答案
1.C
A.锌锰干电池不能充电,为一次电池,故A正确;
B.由总反应可知负极反应为:,结合总反应式:Zn+2MnO2+2=Zn2++Mn2O3+2NH3+H2O,可得原电池正极反应式为2MnO2+2+2e-=Mn2O3+2NH3+H2O,故B正确;
C.电池工作时,电子从负极锌筒流出,但电子不能经过电解质溶液,即氯化铵糊中不可能有电子通过,故C错误;
D.负极反应为:,电路中每通过0.2mol电子,锌的质量理论上减小6.5g,故D正确;
故答案为:C。
2.B
根据图示,放电时石墨烯a极上O2发生得电子的还原反应,则石墨烯a极为正极、石墨烯b极为负极;充电时石墨烯b极为阴极、石墨烯a为阳极。
A.熔融氧化物需要高温,所以该电池不能在低温环境下使用,A项正确;
B.根据分析,充电时,石墨烯a作阳极、石墨烯b作阴极,石墨烯a应连接电源的正极,石墨烯b连接电源负极,B项错误;
C.放电时电池内部阴离子向负极移动,则放电时电池内部O2-向石墨烯b移动,C项正确;
D.充电时石墨烯b电极上铁的氧化物得电子发生还原反应,电极反应式为FeOx+2xe﹣=Fe+xO2-,D项正确;
故选:B。
3.A
A.b电极为正极,电极反应式为,且每消耗,有通过质子交换膜进入到正极区,所以不变;又因为正极反应有水生成,溶液体积增大,所以减小,增大,故A正确;
B.电解质溶液显酸性,不能大量存在,故B错误;
C.高温环境不利于微生物保持活性,故C错误;
D.没有说明在标准状况下,无法换算成物质的量,故D错误;
故选A。
4.A
根据电池反应式知,放电时,锌失电子而作负极,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钾得电子而作正极,电极反应式为FeO+4H2O+3e-=Fe(OH)3+5OH-,在负极发生反应的物质是Zn,A选项符合。
答案选A。
5.B
铅蓄电池总反应为:,电子转移情况为,则当导线中有电子通过时,则理论上两极共生成1.0mol;
故选B。
6.B
根据图示,Zn2+由N极移向M极,N是负极、M是正极。
A.放电时,Zn2+由N极移向M极,电极N为负极,故A错误;
B.放电时负极发生氧化反应,根据总反应Zn+Br2= ZnBr2,负极的电极反应式为Zn-2e-=Zn2+,故B正确;
C.放电时总反应为Zn+Br2= ZnBr2,则充电时ZnBr2生成锌和溴单质,ZnBr2溶液的浓度减小,故C错误;
D.根据图示,Zn2+由N极移向M极,电池中间需使用阳离子交换膜,故D错误;
选B。
7.D
由电池的总反应可知,金属Li为负极,发生氧化反应,电极反应为,为正极,发生还原反应,电极反应为。
A.依分析可知为正极,发生还原反应,A项错误;
B.Li在中燃烧只生成,B项错误;
C.锂电极的电极反应式为,C项错误;
D.由正极的反应,可知当2.24 L (标准状况),即0.1mol完全反应时转移0.2 mol电子,D项正确;
故选D。
8.D
A.氮元素从游离态变为化合态的过程称为氮的固定,放电时氮气在正极得电子发生还原反应转化为氮化铝,实现氮的固定;充电时,氮元素由游离态变为化合态,不是氮的固定,A项错误;
B.充电时,阳极失电子发生氧化反应,故B错误;
C.放电时,Al失电子发生氧化反应,Al箔为原电池的负极,故C错误;
D.放电时,Al失电子发生氧化反应,负极反应式为,故D正确;
选D。
9.B
由图可知,B元素由-3价升高为+3价失电子,故左侧电极为负极,电极反应式为NH3·BH3+2H2O -6e-=+6H+,右侧电极为正极,电极反应式为H2O2+2e-+2H+=2H2O,据此分析解题。
A.根据电池的总反应,正极上H2O2发生还原反应:H2O2+2e-+2H+=2H2O,正极附近c(H+)减小,溶液pH增大,A错误;
B.NH3·BH3转化为NH4BO2,化合价升高是氧化反应,B正确;
C.根据NH3·BH3NH4BO2可知,消耗3.1 g(0.1 mol)氨硼烷,反应中转移0.6 mol电子,但电子不通过内电路,C错误;
D.原电池工作时,阳离子向正极移动,故H+通过质子交换膜向右侧电极移动,D错误;
故选D。
10.D
该原电池中加入乙醇一侧为负极区,Pt为负极,加入氧气的一侧为正极区,C为正极。该燃料电池负极区电极反应为:,正极区O2+4H++4e-=2H2O,正极区HNO3为催化剂,NO和H2O为中间产物。
A.根据正极的电极反应,电池工作时正极区溶液的pH升高,A正确;
B.根据分析,正极区HNO3为催化剂,加入降低了正极反应的活化能,B正确;
C.根据分析,负极反应为,C正确;
D.电池工作时阳离子移向正极,则通过质子交换膜H+从负极转移到正极,D错误;
故选D。
11.B
由电池总反应可知,钙电极为热激活电池的负极,钙失去电子发生氧化反应生成钙离子,硫酸铅为正极,硫酸铅得到电子发生还原反应生成铅和硫酸根离子。
A.由分析可知,硫酸铅为正极,硫酸铅得到电子发生还原反应生成铅和硫酸根离子,故A正确;
B.由分析可知,钙电极为热激活电池的负极,硫酸铅为正极,放电过程中,阳离子锂离子向硫酸铅电极移动,故B错误;
C.由分析可知,钙电极为热激活电池的负极,钙失去电子发生氧化反应生成钙离子,电极反应式为,故C正确;
D.常温下,电解质不能熔融电离出自由移动的离子,不能形成闭合回路,不能构成原电池,所以电流表或检流计指针不偏转,故D正确;
故选B。
12.A
由充电时钠离子得电子成为钠嵌入硬碳中可知,B电极为阴极、A电极为阳极,则放电时A电极为正极、B电极为负极。
A.由分析可知,放电时A为正极、B为负极,则放电时,电子从电极B经外电路流向电极A,电子不能通过电解质溶液,故A错误;
B.由分析可知,放电时B为负极,钠离子在负极失去电子发生氧化反应生成钠离子,电极反应式为NaxC—xe—=xNa++C,则外电路通过0.1mol电子时,电极B损失钠离子的质量为0.1mol×23g/mol=2.3g,故B正确;
C.由题意可知,充电时,B电极为阴极,钠离子得到电子成为钠嵌入硬碳中,电极反应式为xNa++C+xe-=NaxC,A电极为阳极,NaTMO2在阳极失去电子发生氧化反应生成Na1-xTMO2和钠离子,电极反应式为NaTMO2—xe—=Na1-xTMO2+xNa+,由得失电子数目守恒可知,阳极生成的钠离子与阴极得到电子成为钠的钠离子的物质的量相等,溶液中的钠离子浓度不变,放电过程与充电过程相反,所以该电池在充、放电过程中,溶液中的钠离子浓度始终不变,故C正确;
D.由分析可知,放电时A为正极,钠离子作用下Na1-xTMO2在正极得到电子发生还原反应生成NaTMO2,电极反应式为Na1-xTMO2+xNa++xe-=NaTMO2,故D正确;
故选A。
13.B
根据题干,Zn失电子生成,则Zn为负极,负极电极反应为:,MnO2为正极,正极MnO2得电子生成Mn2+,正极电极反应为,本题隔膜没有说明是阴离子交换膜还是阳离子交换膜,Ⅲ区阴离子减少,Ⅰ区阳离子减少,则可能是Ⅱ区通过离子交换膜向Ⅲ区移动,Ⅰ区的通过隔膜向Ⅱ区迁移,也可能是Ⅲ区的K+通过隔膜向Ⅱ区移动,Ⅱ区K+通过隔膜向Ⅰ区移动;
A.根据分析Zn 电极为负极,A正确;
B.原电池中阳离子移向正极,III区为负极区,B错误;
C.根据分析,MnO2电极反应:,C正确;
D.正负极电极反应相加,得到电池总反应:,D正确;
故选B。
14.C
由图可知,B电极通入空气,氧气在B电极上得电子,B为正极,则A电极作负极,若废弃塑料为聚乙烯,A电极的电极反应式为-12ne-+4nH2O═2nCO2↑+12nH+,据此分析解题。
A.由分析可知,A电极作负极,废弃塑料在A电极失去电子,A正确;
B.阳离子移向正极,即H+经过质子交换膜从A电极向B电极移动,B正确;
C.B电极采用疏松多孔的石墨烯,原因是多孔石墨烯电极具有三维多孔结构,表面积大,有利于气体、电极和电解质溶液充分接触,C错误;
D.若废弃塑料为聚乙烯,A电极上聚乙烯失电子,电极反应式为-12ne-+4nH2O═2nCO2↑+12nH+,D正确;
故答案为C。
15.B
由题干图示装置可知,NO失去电子转化为HNO3,即被氧化,电极反应为:NO-3e-+2H2O=+4H+,故左侧多孔石墨电极为负极,O2在右侧多孔石墨电极上得到电子,发生还原反应,即右侧多孔石墨电极为正极,电极反应为:O2+4H++4e-=2H2O,据此分析解题。
A.在原电池中,阳离子向正极移动,所以H+ 通过质子交换膜从左侧向右侧多孔石墨棒移动,A错误;
B.根据题目信息,NO在负极放电,电极反应式为:NO-3e-+2H2O=+4H+,B正确;
C.计算O2的体积,需要在标准状况下才能用摩尔体积22.4L/mol计算,C错误;
D.原电池中电子从负极经导线流向正极,电子不能进入溶液,D错误;
故答案为:B。
16.(1) Zn-2e-=Zn2+ 2H++2e-=H2↑
(2) 4.875 0.15 0.75 mol·L-1
(3)2+6e—+5H2O=Fe2O3+10OH-
由图可知,比铜金属性强的锌为原电池的负极,锌失去电子发生氧化反应生成锌离子,电极反应式为Zn-2e-=Zn2+,铜为正极,氢离子在正极得到电子发生还原反应生成氢气,电极反应式为2H++2e-=H2↑。
(1)由分析可知,负极的电极反应式为Zn-2e-=Zn2+,正极的电极反应式为2H++2e-=H2↑;
(2)由电极反应式可知,标准状况下铜片上放出1.68 L氢气时,反应转移电子和消耗氢离子的物质的量都为×2=0.15mol,则原硫酸的浓度为=0.75mol/L,由得失电子数目守恒可知,反应消耗锌的质量为×65g/mol=4.875g;
(3)由电池反应可知,高铁酸钾为原电池的正极,水分子作用下高铁酸根离子在正极得到电子发生还原反应生成氧化铁和氢氧根离子,电极反应式为2+6e—+5H2O=Fe2O3+10OH-。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
4.1.2 化学电源 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
1.常见锌锰干电池的构造如下图所示,该电池放电时的电池总反应方程式为:Zn+2MnO2+2=Zn2++Mn2O3+2NH3+H2O,下列说法错误的是
A.该电池属于一次电池
B.电池正极反应式为:2MnO2+2NH+2e-=Mn2O3+2NH3+H2O
C.电池工作时,电子从锌筒经糊流向石墨棒
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
2.铁在一定条件下能够和水反应,最近科学家利用常见金属铁研发了一种新型可充电池,简易装置如图。下列说法错误的是
A.该电池不能在低温环境下使用
B.充电时,石墨烯a应连接电源的负极
C.放电时,电池内部O2﹣向石墨烯b移动
D.充电时,石墨烯b极发生反应:FeOx+2xe﹣=Fe+xO2﹣
3.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池采用弱酸性电解质溶液,工作原理如图所示,下列说法正确的是
A.电池工作一段时间后,正极区溶液的增大
B.转化为的反应为
C.该电池在工作时,升高温度有利于提高工作效率
D.若该电池中有参加反应,则有从向迁移
4.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应如下:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。在负极发生反应的物质是
A.Zn B.K2FeO4 C.Zn(OH)2 D.Fe(OH)3
5.铅蓄电池构造如图所示,放电时正极和负极均会生成。当导线中有电子通过时,则理论上两极共生成
A. B. C. D.
6.锌溴液流电池是液流电池的一种,能够大容量、长时间的充放电。放电时总反应为Zn+Br2= ZnBr2。下列说法正确的是
A.放电时电极M为负极
B.放电时负极的电极反应式为Zn-2e-=Zn2+
C.充电时ZnBr2溶液的浓度增大
D.电池中间使用阳离子交换膜或阴离子交换膜都可以
7.科学家开发了基于压电催化和能带弯曲的力场辅助超声波激活电池,电池反应为,电池示意图如图所示。下列叙述正确的是
A.极为负极,发生氧化反应
B.金属Li在中燃烧可生成
C.锂电极的电极反应式为
D.2.24 L (标准状况)完全反应时转移0.2 mol电子
8.我国学者自主研发了一种Al-N2二次电池,以离子液体为电解质,其工作原理如图所示。石墨烯/Pd作为电极催化剂,可吸附N2。下列说法正确的是
A.充电时可实现“氮的固定”
B.充电时阳极发生还原反应
C.Al箔为原电池的正极
D.放电时负极反应式:
9.氢硼烷()电池可在常温下工作,装置如图所示。该电池工作时的总反应为。下列说法正确的是
A.正极附近溶液的减小
B.左侧电极发生氧化反应
C.消耗氨硼烷,理论上通过内电路的电子为
D.电池工作时,通过质子交换膜向左侧电极移动
10.研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如下图所示。下列说法不正确的是
A.电池工作时正极区溶液的pH升高
B.加入HNO3降低了正极反应的活化能
C.负极反应为CH3CH2OH+3H2O-12e-=2CO2↑+12H+
D.通过质子交换膜H+从正极转移到负极
11.热激活电池(又称热电池)可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物一旦受热熔融,电池瞬间可输出电能,该电池总反应为,关于该电池的说法错误的是
A.正极反应物为 B.放电过程中,向钙电极移动
C.负极的电极反应为 D.常温时,在正负极之间连上电流计,指针不偏转
12.某钠离子电池结构如图所示,充电时Na+得电子成为Na嵌入硬碳中,下列说法错误的是
A.电池放电时,电子由电极B经电解质溶液流入电极A
B.放电时,外电路通过0.1mol电子时,电极B损失2.3gNa+
C.理论上,该电池在充、放电过程中,溶液中的钠离子浓度不变
D.放电时,电极A上发生的电极反应为Na1-xTMO2+xNa++xe-=NaTMO2
13.一种水性电解液Zn MnO2离子选择双隔膜电池如图所示(KOH溶 液中,以存在)。电池放电时,下列叙述错误的是
A.Zn 电极为负极
B.II区的 K 通过隔膜向III区迁移
C.MnO2电极反应:
D.电池总反应:
14.我国科学家利用废弃塑料设计了微生物燃料电池(A、B电极材料均为石墨烯),其工作原理如图所示。下列说法错误的是
A.A电极作负极
B.经过质子交换膜从A电极向B电极移动
C.B电极采用疏松多孔的石墨烯,主要是为了增强溶液的导电性
D.若废弃塑料为聚乙烯,A电极的电极反应式为
15.一种NO-空气燃料电池的工作原理如图所示,该电池工作时,下列说法正确的是
A.H+通过质子交换膜向左侧多孔石墨棒移动
B.负极的电极反应式为NO-3e-+2H2O=NO+4H+
C.若产生lmolHNO3,则通入O2的体积等于16.8L
D.电子的流动方向为从负极经电解质溶液流向正极
二、填空题
16.由锌片、铜片和200 mL稀H2SO4组成的原电池如下图所示:
(1)原电池的负极反应式为 ,正极反应式为 。
(2)一段时间后,当在铜片上放出1.68 L(标准状况)气体时,H2SO4恰好消耗一半,则产生这些气体的同时,共消耗 g锌,有 mol电子通过了导线,原硫酸的物质的量浓度是 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为 。
参考答案
1.C
A.锌锰干电池不能充电,为一次电池,故A正确;
B.由总反应可知负极反应为:,结合总反应式:Zn+2MnO2+2=Zn2++Mn2O3+2NH3+H2O,可得原电池正极反应式为2MnO2+2+2e-=Mn2O3+2NH3+H2O,故B正确;
C.电池工作时,电子从负极锌筒流出,但电子不能经过电解质溶液,即氯化铵糊中不可能有电子通过,故C错误;
D.负极反应为:,电路中每通过0.2mol电子,锌的质量理论上减小6.5g,故D正确;
故答案为:C。
2.B
根据图示,放电时石墨烯a极上O2发生得电子的还原反应,则石墨烯a极为正极、石墨烯b极为负极;充电时石墨烯b极为阴极、石墨烯a为阳极。
A.熔融氧化物需要高温,所以该电池不能在低温环境下使用,A项正确;
B.根据分析,充电时,石墨烯a作阳极、石墨烯b作阴极,石墨烯a应连接电源的正极,石墨烯b连接电源负极,B项错误;
C.放电时电池内部阴离子向负极移动,则放电时电池内部O2-向石墨烯b移动,C项正确;
D.充电时石墨烯b电极上铁的氧化物得电子发生还原反应,电极反应式为FeOx+2xe﹣=Fe+xO2-,D项正确;
故选:B。
3.A
A.b电极为正极,电极反应式为,且每消耗,有通过质子交换膜进入到正极区,所以不变;又因为正极反应有水生成,溶液体积增大,所以减小,增大,故A正确;
B.电解质溶液显酸性,不能大量存在,故B错误;
C.高温环境不利于微生物保持活性,故C错误;
D.没有说明在标准状况下,无法换算成物质的量,故D错误;
故选A。
4.A
根据电池反应式知,放电时,锌失电子而作负极,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钾得电子而作正极,电极反应式为FeO+4H2O+3e-=Fe(OH)3+5OH-,在负极发生反应的物质是Zn,A选项符合。
答案选A。
5.B
铅蓄电池总反应为:,电子转移情况为,则当导线中有电子通过时,则理论上两极共生成1.0mol;
故选B。
6.B
根据图示,Zn2+由N极移向M极,N是负极、M是正极。
A.放电时,Zn2+由N极移向M极,电极N为负极,故A错误;
B.放电时负极发生氧化反应,根据总反应Zn+Br2= ZnBr2,负极的电极反应式为Zn-2e-=Zn2+,故B正确;
C.放电时总反应为Zn+Br2= ZnBr2,则充电时ZnBr2生成锌和溴单质,ZnBr2溶液的浓度减小,故C错误;
D.根据图示,Zn2+由N极移向M极,电池中间需使用阳离子交换膜,故D错误;
选B。
7.D
由电池的总反应可知,金属Li为负极,发生氧化反应,电极反应为,为正极,发生还原反应,电极反应为。
A.依分析可知为正极,发生还原反应,A项错误;
B.Li在中燃烧只生成,B项错误;
C.锂电极的电极反应式为,C项错误;
D.由正极的反应,可知当2.24 L (标准状况),即0.1mol完全反应时转移0.2 mol电子,D项正确;
故选D。
8.D
A.氮元素从游离态变为化合态的过程称为氮的固定,放电时氮气在正极得电子发生还原反应转化为氮化铝,实现氮的固定;充电时,氮元素由游离态变为化合态,不是氮的固定,A项错误;
B.充电时,阳极失电子发生氧化反应,故B错误;
C.放电时,Al失电子发生氧化反应,Al箔为原电池的负极,故C错误;
D.放电时,Al失电子发生氧化反应,负极反应式为,故D正确;
选D。
9.B
由图可知,B元素由-3价升高为+3价失电子,故左侧电极为负极,电极反应式为NH3·BH3+2H2O -6e-=+6H+,右侧电极为正极,电极反应式为H2O2+2e-+2H+=2H2O,据此分析解题。
A.根据电池的总反应,正极上H2O2发生还原反应:H2O2+2e-+2H+=2H2O,正极附近c(H+)减小,溶液pH增大,A错误;
B.NH3·BH3转化为NH4BO2,化合价升高是氧化反应,B正确;
C.根据NH3·BH3NH4BO2可知,消耗3.1 g(0.1 mol)氨硼烷,反应中转移0.6 mol电子,但电子不通过内电路,C错误;
D.原电池工作时,阳离子向正极移动,故H+通过质子交换膜向右侧电极移动,D错误;
故选D。
10.D
该原电池中加入乙醇一侧为负极区,Pt为负极,加入氧气的一侧为正极区,C为正极。该燃料电池负极区电极反应为:,正极区O2+4H++4e-=2H2O,正极区HNO3为催化剂,NO和H2O为中间产物。
A.根据正极的电极反应,电池工作时正极区溶液的pH升高,A正确;
B.根据分析,正极区HNO3为催化剂,加入降低了正极反应的活化能,B正确;
C.根据分析,负极反应为,C正确;
D.电池工作时阳离子移向正极,则通过质子交换膜H+从负极转移到正极,D错误;
故选D。
11.B
由电池总反应可知,钙电极为热激活电池的负极,钙失去电子发生氧化反应生成钙离子,硫酸铅为正极,硫酸铅得到电子发生还原反应生成铅和硫酸根离子。
A.由分析可知,硫酸铅为正极,硫酸铅得到电子发生还原反应生成铅和硫酸根离子,故A正确;
B.由分析可知,钙电极为热激活电池的负极,硫酸铅为正极,放电过程中,阳离子锂离子向硫酸铅电极移动,故B错误;
C.由分析可知,钙电极为热激活电池的负极,钙失去电子发生氧化反应生成钙离子,电极反应式为,故C正确;
D.常温下,电解质不能熔融电离出自由移动的离子,不能形成闭合回路,不能构成原电池,所以电流表或检流计指针不偏转,故D正确;
故选B。
12.A
由充电时钠离子得电子成为钠嵌入硬碳中可知,B电极为阴极、A电极为阳极,则放电时A电极为正极、B电极为负极。
A.由分析可知,放电时A为正极、B为负极,则放电时,电子从电极B经外电路流向电极A,电子不能通过电解质溶液,故A错误;
B.由分析可知,放电时B为负极,钠离子在负极失去电子发生氧化反应生成钠离子,电极反应式为NaxC—xe—=xNa++C,则外电路通过0.1mol电子时,电极B损失钠离子的质量为0.1mol×23g/mol=2.3g,故B正确;
C.由题意可知,充电时,B电极为阴极,钠离子得到电子成为钠嵌入硬碳中,电极反应式为xNa++C+xe-=NaxC,A电极为阳极,NaTMO2在阳极失去电子发生氧化反应生成Na1-xTMO2和钠离子,电极反应式为NaTMO2—xe—=Na1-xTMO2+xNa+,由得失电子数目守恒可知,阳极生成的钠离子与阴极得到电子成为钠的钠离子的物质的量相等,溶液中的钠离子浓度不变,放电过程与充电过程相反,所以该电池在充、放电过程中,溶液中的钠离子浓度始终不变,故C正确;
D.由分析可知,放电时A为正极,钠离子作用下Na1-xTMO2在正极得到电子发生还原反应生成NaTMO2,电极反应式为Na1-xTMO2+xNa++xe-=NaTMO2,故D正确;
故选A。
13.B
根据题干,Zn失电子生成,则Zn为负极,负极电极反应为:,MnO2为正极,正极MnO2得电子生成Mn2+,正极电极反应为,本题隔膜没有说明是阴离子交换膜还是阳离子交换膜,Ⅲ区阴离子减少,Ⅰ区阳离子减少,则可能是Ⅱ区通过离子交换膜向Ⅲ区移动,Ⅰ区的通过隔膜向Ⅱ区迁移,也可能是Ⅲ区的K+通过隔膜向Ⅱ区移动,Ⅱ区K+通过隔膜向Ⅰ区移动;
A.根据分析Zn 电极为负极,A正确;
B.原电池中阳离子移向正极,III区为负极区,B错误;
C.根据分析,MnO2电极反应:,C正确;
D.正负极电极反应相加,得到电池总反应:,D正确;
故选B。
14.C
由图可知,B电极通入空气,氧气在B电极上得电子,B为正极,则A电极作负极,若废弃塑料为聚乙烯,A电极的电极反应式为-12ne-+4nH2O═2nCO2↑+12nH+,据此分析解题。
A.由分析可知,A电极作负极,废弃塑料在A电极失去电子,A正确;
B.阳离子移向正极,即H+经过质子交换膜从A电极向B电极移动,B正确;
C.B电极采用疏松多孔的石墨烯,原因是多孔石墨烯电极具有三维多孔结构,表面积大,有利于气体、电极和电解质溶液充分接触,C错误;
D.若废弃塑料为聚乙烯,A电极上聚乙烯失电子,电极反应式为-12ne-+4nH2O═2nCO2↑+12nH+,D正确;
故答案为C。
15.B
由题干图示装置可知,NO失去电子转化为HNO3,即被氧化,电极反应为:NO-3e-+2H2O=+4H+,故左侧多孔石墨电极为负极,O2在右侧多孔石墨电极上得到电子,发生还原反应,即右侧多孔石墨电极为正极,电极反应为:O2+4H++4e-=2H2O,据此分析解题。
A.在原电池中,阳离子向正极移动,所以H+ 通过质子交换膜从左侧向右侧多孔石墨棒移动,A错误;
B.根据题目信息,NO在负极放电,电极反应式为:NO-3e-+2H2O=+4H+,B正确;
C.计算O2的体积,需要在标准状况下才能用摩尔体积22.4L/mol计算,C错误;
D.原电池中电子从负极经导线流向正极,电子不能进入溶液,D错误;
故答案为:B。
16.(1) Zn-2e-=Zn2+ 2H++2e-=H2↑
(2) 4.875 0.15 0.75 mol·L-1
(3)2+6e—+5H2O=Fe2O3+10OH-
由图可知,比铜金属性强的锌为原电池的负极,锌失去电子发生氧化反应生成锌离子,电极反应式为Zn-2e-=Zn2+,铜为正极,氢离子在正极得到电子发生还原反应生成氢气,电极反应式为2H++2e-=H2↑。
(1)由分析可知,负极的电极反应式为Zn-2e-=Zn2+,正极的电极反应式为2H++2e-=H2↑;
(2)由电极反应式可知,标准状况下铜片上放出1.68 L氢气时,反应转移电子和消耗氢离子的物质的量都为×2=0.15mol,则原硫酸的浓度为=0.75mol/L,由得失电子数目守恒可知,反应消耗锌的质量为×65g/mol=4.875g;
(3)由电池反应可知,高铁酸钾为原电池的正极,水分子作用下高铁酸根离子在正极得到电子发生还原反应生成氧化铁和氢氧根离子,电极反应式为2+6e—+5H2O=Fe2O3+10OH-。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
