4.3.2 金属的防护 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册
文档属性
| 名称 | 4.3.2 金属的防护 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 866.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-27 00:00:00 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
4.3.2 金属的防护 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
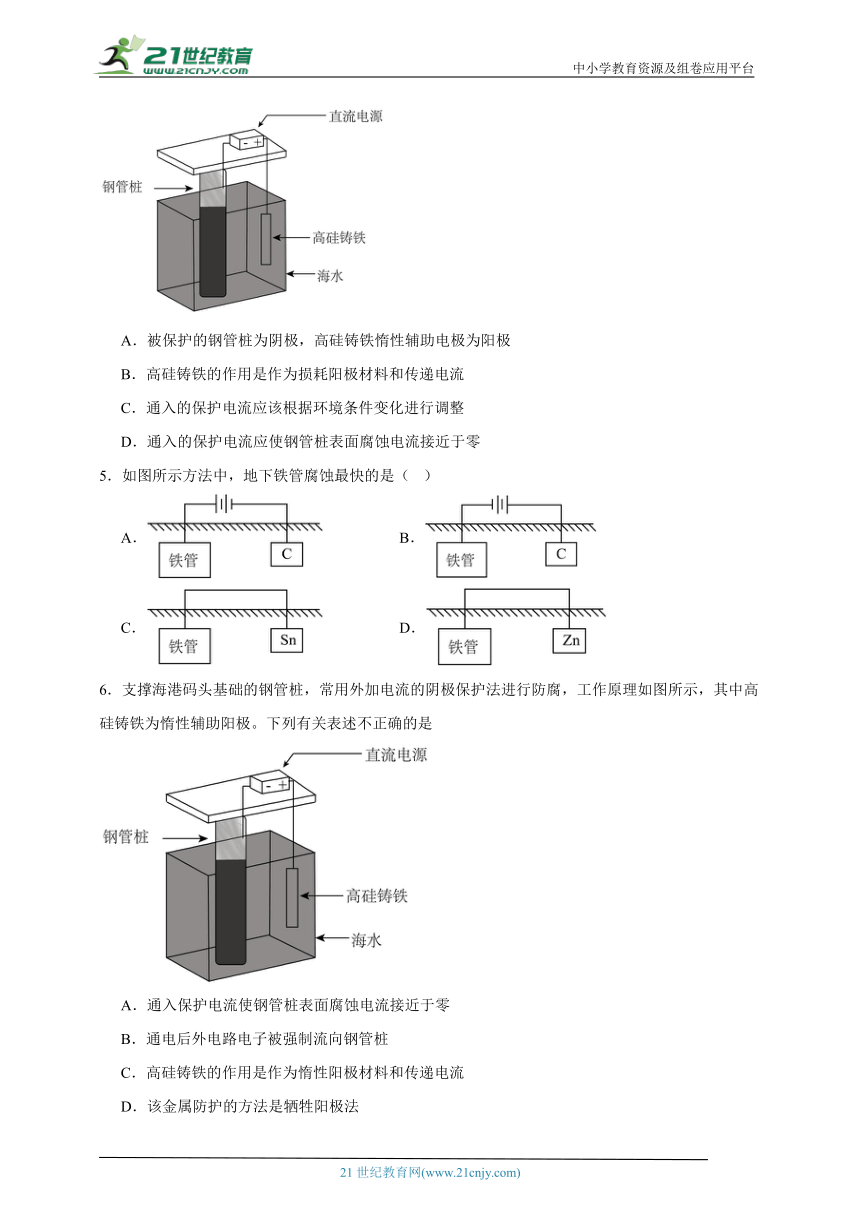
1.下列方法不能减缓钢铁腐蚀速率的是( )
A.将钢铁制品与铜、锡等金属叠放在一起保存
B.将钢铁制品表面进行烤蓝处理
C.采用外加电流法,将钢铁制品连接电源的负极
D.在钢铁中加入锰、铬等金属,以改变钢铁结构
2.最近,考古学家在江苏建湖发现一处钱币窖藏遗存,出土钱币约1.0吨,除少量的唐代开元通宝钱币外,大部分为宋代钱币,钱币主要成分是铜合金。下列叙述错误的是
A.钱币表面绿色物质的主要成分是
B.钱币中铜在地下主要发生吸氧腐蚀和析氢腐蚀
C.钱币在窖藏中发生电化学腐蚀时铜被氧化
D.保护钱币措施有保持干燥、涂保护层等
3.如图是牺牲阳极法保护金属的实验装置图,烧杯内为经过酸化的溶液。
下列关于该装置的叙述错误的是
A.铁作正极被保护
B.将换成,也可以保护铁不被腐蚀
C.向试管中加入溶液,无明显现象
D.正极反应式为
4.支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助电极。下列有关表述不正确的是
A.被保护的钢管桩为阴极,高硅铸铁惰性辅助电极为阳极
B.高硅铸铁的作用是作为损耗阳极材料和传递电流
C.通入的保护电流应该根据环境条件变化进行调整
D.通入的保护电流应使钢管桩表面腐蚀电流接近于零
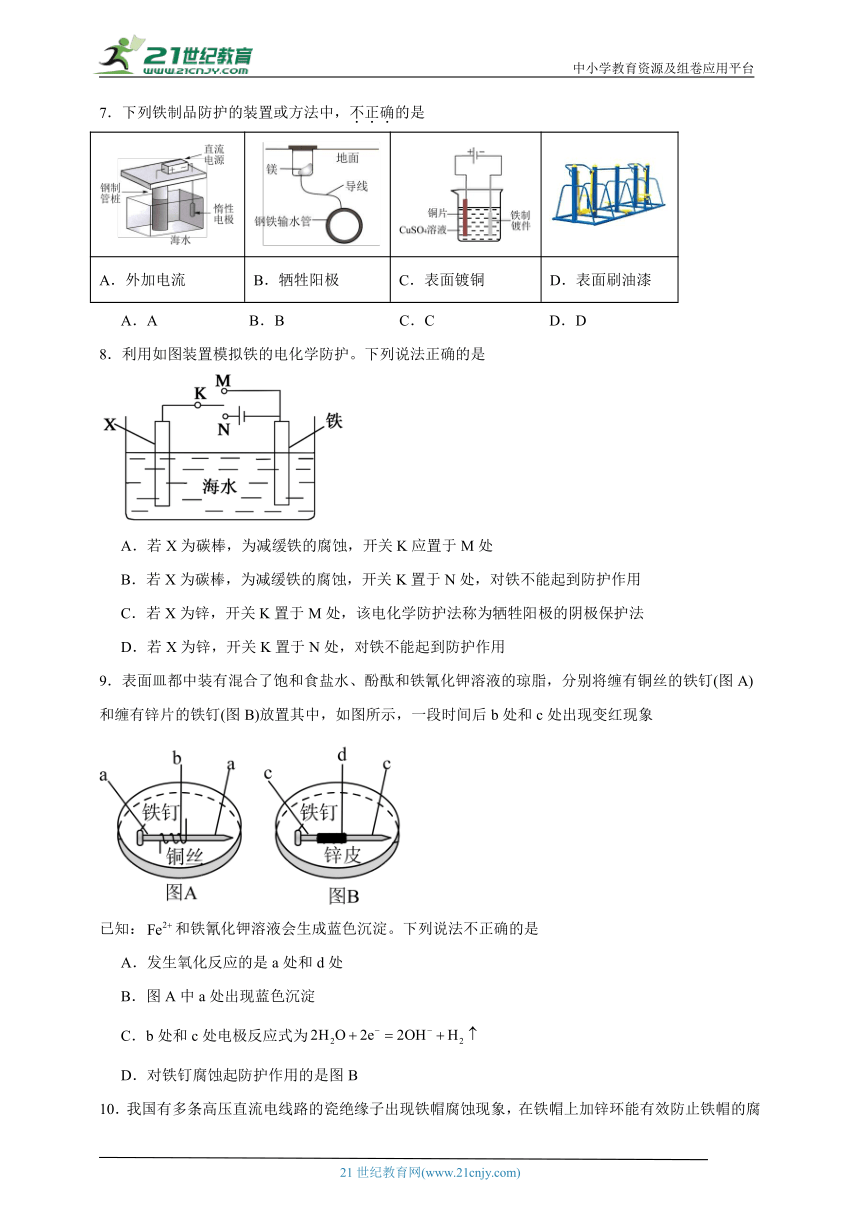
5.如图所示方法中,地下铁管腐蚀最快的是( )
A. B.
C. D.
6.支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制流向钢管桩
C.高硅铸铁的作用是作为惰性阳极材料和传递电流
D.该金属防护的方法是牺牲阳极法
7.下列铁制品防护的装置或方法中,不正确的是
A.外加电流 B.牺牲阳极 C.表面镀铜 D.表面刷油漆
A.A B.B C.C D.D
8.利用如图装置模拟铁的电化学防护。下列说法正确的是
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为碳棒,为减缓铁的腐蚀,开关K置于N处,对铁不能起到防护作用
C.若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法
D.若X为锌,开关K置于N处,对铁不能起到防护作用
9.表面皿都中装有混合了饱和食盐水、酚酞和铁氰化钾溶液的琼脂,分别将缠有铜丝的铁钉(图A)和缠有锌片的铁钉(图B)放置其中,如图所示,一段时间后b处和c处出现变红现象
已知:和铁氰化钾溶液会生成蓝色沉淀。下列说法不正确的是
A.发生氧化反应的是a处和d处
B.图A中a处出现蓝色沉淀
C.b处和c处电极反应式为
D.对铁钉腐蚀起防护作用的是图B
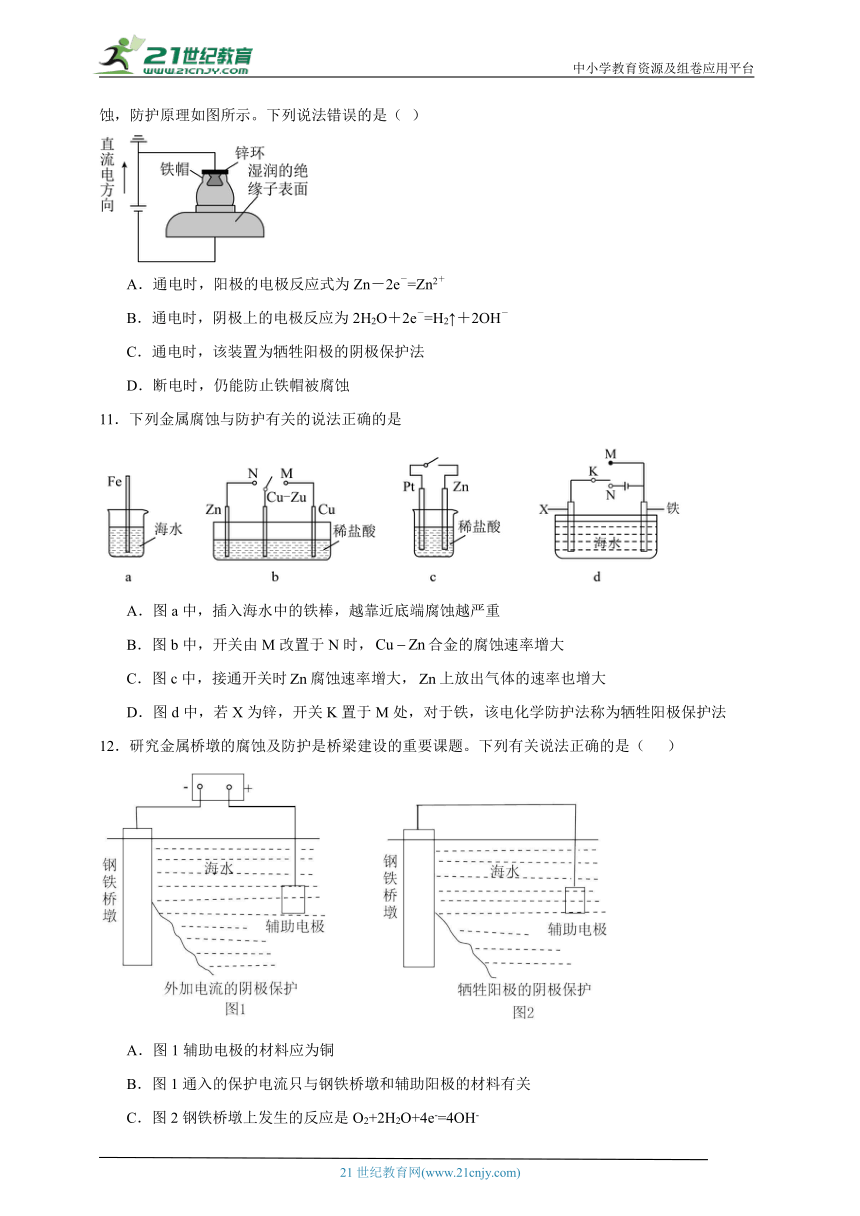
10.我国有多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )
A.通电时,阳极的电极反应式为Zn-2e-=Zn2+
B.通电时,阴极上的电极反应为2H2O+2e-=H2↑+2OH-
C.通电时,该装置为牺牲阳极的阴极保护法
D.断电时,仍能防止铁帽被腐蚀
11.下列金属腐蚀与防护有关的说法正确的是
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,合金的腐蚀速率增大
C.图c中,接通开关时腐蚀速率增大,上放出气体的速率也增大
D.图d中,若X为锌,开关K置于M处,对于铁,该电化学防护法称为牺牲阳极保护法
12.研究金属桥墩的腐蚀及防护是桥梁建设的重要课题。下列有关说法正确的是( )
A.图1辅助电极的材料应为铜
B.图1通入的保护电流只与钢铁桥墩和辅助阳极的材料有关
C.图2钢铁桥墩上发生的反应是O2+2H2O+4e-=4OH-
D.钢铁桥墩在河水的腐蚀比海水中更快
13.某学科组设计的对海水中钢闸门进行防护的四个方案如图所示,其中能达到目的的是
A. B.
C. D.
二、填空题
14.回答下列问题
(1)下列反应是氧化还原反应且是吸热反应的是 。
A.稀醋酸与烧碱溶液的反应
B.灼热的炭与CO2的反应
C.铁片与稀盐酸反应
D.Ba(OH)2 8H2O与NH4Cl反应
E.干冰汽化
(2)实际生产生活中,钢铁等金属因电化学腐蚀损失巨大,而电化学在金属制备和加工中也发挥着重要的作用。生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为 。金属的两种常见电化学防护方法如下图所示,图甲中铁闸门连接电源的 (填“正极”或“负极”),图乙所示金属的防护方法称为 。
(3)将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是___________ 。
A.铁棒AB段发生的反应为O2+2H2O+4e-=4OH-
B.腐蚀过程中在铁棒上会产生微电流,且方向是从BC段到AB段
C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响
D.产生这种现象的本质是铁棒所处的化学环境不同
15.我国古代青铜器工艺精湛,有很高的艺术价值和历史价值。但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(2)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
(3)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是 (填“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉铜锈Cu2(OH)3Cl,其离子方程式为 ;
③若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
16.钢铁在自然界中的腐蚀比较普遍。
(1)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的 腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的 (填“正”或“负”)极相连。
(2)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中的正极反应式为 。
(3)铁器深埋地下,也会发生严重的电化学腐蚀,原因是一种称为硫酸盐还原菌的细菌,能提供正极反应的催化剂,将土壤中的还原为S2-,试写出该电化学腐蚀的正极反应式 。
(4)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。
参考答案
1.A
A.将钢铁制品与铜、锡等金属叠放在一起保存,因为铁比铜、锡更活泼,发生电化学腐蚀的时候,铁做负极被腐蚀,不能减缓钢铁的腐蚀速率,A选项符合题意;
B.将钢铁制品表面进行烤蓝处理,会在钢铁制品表面生成一层致密的氧化膜,可以减缓钢铁腐蚀速率,B选项不符合题意;
C.采用外加电流法,将钢铁制品连接电源的负极,采用了外加电流的阴极保护法,可以减缓钢铁腐蚀速率,C选项不符合题意;
D.在钢铁中加入锰、铬等金属,以改变钢铁结构,可以减缓钢铁腐蚀速率,D选项不符合题意;
答案选A。
2.B
A.钱币是铜合金,钱币表面绿色物质是铜绿,主要成分是碱式碳酸铜,其化学式是Cu2(OH)2CO3,故A说法正确;
B.吸氧腐蚀正极反应式O2+2H2O+4e-=4OH-,析氢腐蚀是电解质溶液显酸性,正极反应式为2H++2e-=H2↑,根据金属活动顺序表,铜没有氢活泼,不能置换出氢气,即不能发生吸氢腐蚀,故B说法错误;
C.在潮湿环境会发生电化学腐蚀,铜作负极,发生氧化反应,故C说法正确;
D.保护钱币,应防止铜发生腐蚀,可采取的措施保持干燥环境、涂保护层等,故D说法正确;
答案为B。
3.B
A.铁和锌形成原电池,锌作为负极,锌被腐蚀,铁作正极被保护,A正确;
B.将换成,铁作为负极,被腐蚀,B错误;
C.铁不发生反应,向试管中加入溶液,无明显现象,C正确;
D.酸性溶液中,正极反应式为,D正确;
故选B。
4.B
外加电流阴极保护是通过外加直流电源以及辅助阳极,被保护金属与电源的负极相连作为阴极。
A、被保护的钢管桩与电源的负极相连作为阴极,高硅铸铁惰性辅助电极为阳极钢管桩,阴极不参与反应,起到了保护作用,A正确,不符合题意;
B、高硅铸铁为惰性辅助阳极,所以高硅铸铁不损耗,B错误,符合题意;
C、在保护过程中要使被保护金属结构电位低于周围环境,则通入的保护电流应该根据环境条件变化进行调整,C正确,不符合题意;
D、被保护的钢管桩应作为阴极,从而使得金属腐蚀发生的电子迁移得到抑制,使钢管桩表面腐蚀电流接近于零,避免或减弱电化学腐蚀的发生,D正确,不符合题意;
答案选B。
5.A
图A铁管做阳极,腐蚀速度加快;图B中铁管做阴极,被保护,不被腐蚀;图C中形成原电池,铁比锡活泼做负极,腐蚀速度加快;图D中形成原电池,锌作负极,铁管做正极,正极金属被保护,不被腐蚀,而电解原理引起的腐蚀速率大于原电池原理引起的腐蚀速率,故A的腐蚀速率最快。
故选:A。
6.D
使用的是外加电流的阴极保护法,钢管柱与电源的负极相连,被保护。
A.外加强大的电流可以抑制金属电化学腐蚀产生的电流,从而保护钢管柱,A正确;
B.通电后,被保护的钢管柱作阴极,高硅铸铁作阳极,因此电路电子被强制流向钢管桩,B正确;
C.高硅铸铁为惰性辅助阳极,为惰性阳极材料且起到传递电流的作用,C正确;
D.该金属防护的方法是外加电流的阴极保护法,D错误;
故选D。
7.A
A.此为外加电源的阴极保护法,被保护金属钢制管桩应与电源负极相连,故A错误;
B.镁比铁活泼,此为牺牲阳极的阴极保护法,故B正确;
C.铁上镀铜,铁质镀件接电源负极,铜接电源正极,硫酸铜作电镀液,故C正确;
D.表面刷漆可以隔绝空气,起到防护作用,故D正确;
故答案为A
8.C
A.若X为碳棒,开关K置于M处,构成原电池,铁作负极,加快了铁的腐蚀,A项错误;
B.若X为碳棒,开关K置于N处,形成电解池,此时金属铁为阴极,铁被保护,为外加电源的阴极保护法,可减缓铁的腐蚀,B项错误;
C.若X为锌,开关K置于M处,构成原电池,锌作负极,铁作正极,该电化学防护法称为牺牲阳极的阴极保护法,C项正确;
D.若X为锌,开关K置于N处,构成电解池,锌作阳极,铁作阴极,可以减缓铁的腐蚀,D项错误;
故选C。
9.C
一段时间后b处和c处出现变红现象,说明b、c处生成氢氧根离子即b、c处发生还原反应。
A.根据前面分析b、c处发生还原反应,则说明发生氧化反应的是a处和d处,故A正确;
B.a处是铁失去电子变为亚铁离子,和铁氰化钾溶液会生成蓝色沉淀,因此图A中a处出现蓝色沉淀,故B正确;
C.根据前面分析b、c处发生还原反应即b处和c处电极反应式为,故C错误;
D.A中铁为负极,铜为正极,对铁有腐蚀性,而B中铁为正极,锌为负极,因此对铁钉腐蚀起防护作用的是图B,是牺牲阳极的阴极保护法,故D正确。
综上所述,答案为C。
10.C
A.锌环与电源的正极相连,为阳极,电极反应式为Zn-2e-=Zn2+,A不符合题意;
B.通电时,阴极上H+放电,电极反应为2H2O+2e-=H2↑+2OH-,B不符合题意;
C.通电时,该装置是电解池,为外接电流的阴极保护法,C符合题意;
D.断电时,该装置为原电池,锌做负极,仍能防止铁帽被腐蚀,D不符合题意;
故选C。
11.D
A.图a中,插入海水中的铁棒,越靠近底端,海水中氧气的浓度越小,越不易腐蚀,故A错误;
B.图b中,开关由M改置于N时,锌为原电池的负极,铜锌合金为正极被保护,则合金的腐蚀速率减慢,故B错误;
C.图c中,接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt上放出,故C错误;
D.图d中,若X为锌,开关K置于M处,形成原电池,锌做负极失电子,铁做正极得电子被保护,该电化学防护法称为牺牲阳极保护法,故D正确;
故选D。
12.C
图1有外接电源,是外加电流的阴极保护法,图2没有外接电源,是牺牲阳极的阴极保护法。
A.辅助电极与电源正极相连,作阳极,Cu在阳极失电子被腐蚀消耗,成本增大,不能用Cu作阳极,A错误;
B.在保护过程中要使被保护金属结构电位低于周围环境,通入的保护电流应该根据环境条件变化(pH值,离子浓度,温度等)进行调整,B错误;
C.图2是牺牲阳极的阴极保护法,钢铁桥墩作正极被保护,正极上氧气得电子发生还原反应O2+2H2O+4e-=4OH-,C正确;
D.河水中的电解质少于海水中的电解质,所以钢铁桥墩在海水中比在河水中腐蚀更快,D错误。
答案选C。
13.A
A.Zn比Fe活泼,钢闸门与Zn块连接,形成原电池,钢闸门作正极,被保护,A能达到目的;
B.钢闸门与石墨相连,形成原电池,钢闸门作负极,加速腐蚀,B不能达到目的;
C.钢闸门与电源正极相连,作电解池阳极,加速腐蚀,C不能达到目的;
D.钢闸门与电源正极相连,作电解池阳极,加速腐蚀,D不能达到目的;
答案选A。
14.(1)B
(2) O2+4e-+2H2O=4OH- 负极 牺牲阳极的阴极保护法
(3)BC
(1)A.稀醋酸与烧碱溶液的反应,不是氧化还原反应,错误;B.灼热的炭与CO2的反应,是氧化还原反应且是吸热反应,正确;C.铁片与稀盐酸反应,是氧化还原反应且是放热反应,错误;D.Ba(OH)2 8H2O与NH4Cl反应,不是氧化还原反应,错误;E.干冰汽化,不是化学反应,错误;故选B;
(2)吸氧腐蚀正极的电极反应式为O2+4e-+2H2O=4OH-;图甲是外加电流阴极保护法,铁闸门连接电源的负极,图乙所示金属的防护方法称为牺牲阳极的阴极保护法;
(3)A. AB段产生较多铁锈,则铁棒AB段为正极,发生的反应为O2+2H2O+4e-=4OH-,正确;B. 腐蚀过程中在铁棒上会产生微电流,且方向是从AB段(正极)到BC段(负极),错误;C. 向水中加入一定量硫酸钾固体后,增加了溶液的导电能力,增加了铁棒的生锈速率,错误;D. 产生这种现象的本质是铁棒所处的化学环境不同,即AB段氧气浓度大,为正极,BC段氧气浓度小,为负极,正确;故选BC。
15.(1)10∶1
(2)Ag2O+2CuCl=2AgCl+Cu2O
(3) c 2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ 0.448
(1)根据N=×NA,青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子数目之比为:=10:1;
(2)复分解反应为相互交换成分的反应,因此该反应的化学方程式为Ag2O+2CuCl=2AgCl+Cu2O;
(3)①负极发生失电子的反应,铜作负极失电子,因此负极为c,其中负极反应:Cu-2e-=Cu2+,正极反应:O2+2H2O+4e-=4OH-;
②正极产物为OH-,负极产物为Cu2+,两者与Cl-反应生成Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
③4.29 g Cu2(OH)3Cl的物质的量为0.02 mol,由Cu元素守恒知,发生电化学腐蚀失电子的Cu单质的物质的量为0.04 mol,失去电子0.08 mol,根据电子守恒可得,消耗O2的物质的量为=0.02 mol,所以理论上消耗氧气的体积为0.448 L(标准状况)。
16.(1) 吸氧腐蚀 负
(2)ClO-+H2O+2e-=Cl-+2OH-
(3)+8e-+4H2O=S2-+8OH-
(4) N 牺牲阳极的阴极保护法
(1)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的吸氧腐蚀;原电池中的正极和电解池中的阴极得到电子,被保护,所以为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的负极相连;故答案为:吸氧腐蚀;负;
(2)若用钢铁(含Fe、C)制品盛装NaClO溶液构成原电池,铁作负极,碳作正极,正极上次氯酸根离子得电子生成氯离子和氢氧根离子,电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,故答案为:ClO-+H2O+2e-=Cl-+2OH-;
(3)将土壤中的还原为S2-,可知得到电子,该电化学腐蚀的正极反应式为+8e-+4H2O=S2-+8OH-;
(4)若X为碳棒,则只能用外加电源的阴极保护法,此进K应置于N处;若X为Zn,K置于M处,其保护原理称为牺牲阳极的阴极保护法。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
4.3.2 金属的防护 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
1.下列方法不能减缓钢铁腐蚀速率的是( )
A.将钢铁制品与铜、锡等金属叠放在一起保存
B.将钢铁制品表面进行烤蓝处理
C.采用外加电流法,将钢铁制品连接电源的负极
D.在钢铁中加入锰、铬等金属,以改变钢铁结构
2.最近,考古学家在江苏建湖发现一处钱币窖藏遗存,出土钱币约1.0吨,除少量的唐代开元通宝钱币外,大部分为宋代钱币,钱币主要成分是铜合金。下列叙述错误的是
A.钱币表面绿色物质的主要成分是
B.钱币中铜在地下主要发生吸氧腐蚀和析氢腐蚀
C.钱币在窖藏中发生电化学腐蚀时铜被氧化
D.保护钱币措施有保持干燥、涂保护层等
3.如图是牺牲阳极法保护金属的实验装置图,烧杯内为经过酸化的溶液。
下列关于该装置的叙述错误的是
A.铁作正极被保护
B.将换成,也可以保护铁不被腐蚀
C.向试管中加入溶液,无明显现象
D.正极反应式为
4.支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助电极。下列有关表述不正确的是
A.被保护的钢管桩为阴极,高硅铸铁惰性辅助电极为阳极
B.高硅铸铁的作用是作为损耗阳极材料和传递电流
C.通入的保护电流应该根据环境条件变化进行调整
D.通入的保护电流应使钢管桩表面腐蚀电流接近于零
5.如图所示方法中,地下铁管腐蚀最快的是( )
A. B.
C. D.
6.支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制流向钢管桩
C.高硅铸铁的作用是作为惰性阳极材料和传递电流
D.该金属防护的方法是牺牲阳极法
7.下列铁制品防护的装置或方法中,不正确的是
A.外加电流 B.牺牲阳极 C.表面镀铜 D.表面刷油漆
A.A B.B C.C D.D
8.利用如图装置模拟铁的电化学防护。下列说法正确的是
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为碳棒,为减缓铁的腐蚀,开关K置于N处,对铁不能起到防护作用
C.若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法
D.若X为锌,开关K置于N处,对铁不能起到防护作用
9.表面皿都中装有混合了饱和食盐水、酚酞和铁氰化钾溶液的琼脂,分别将缠有铜丝的铁钉(图A)和缠有锌片的铁钉(图B)放置其中,如图所示,一段时间后b处和c处出现变红现象
已知:和铁氰化钾溶液会生成蓝色沉淀。下列说法不正确的是
A.发生氧化反应的是a处和d处
B.图A中a处出现蓝色沉淀
C.b处和c处电极反应式为
D.对铁钉腐蚀起防护作用的是图B
10.我国有多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )
A.通电时,阳极的电极反应式为Zn-2e-=Zn2+
B.通电时,阴极上的电极反应为2H2O+2e-=H2↑+2OH-
C.通电时,该装置为牺牲阳极的阴极保护法
D.断电时,仍能防止铁帽被腐蚀
11.下列金属腐蚀与防护有关的说法正确的是
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,合金的腐蚀速率增大
C.图c中,接通开关时腐蚀速率增大,上放出气体的速率也增大
D.图d中,若X为锌,开关K置于M处,对于铁,该电化学防护法称为牺牲阳极保护法
12.研究金属桥墩的腐蚀及防护是桥梁建设的重要课题。下列有关说法正确的是( )
A.图1辅助电极的材料应为铜
B.图1通入的保护电流只与钢铁桥墩和辅助阳极的材料有关
C.图2钢铁桥墩上发生的反应是O2+2H2O+4e-=4OH-
D.钢铁桥墩在河水的腐蚀比海水中更快
13.某学科组设计的对海水中钢闸门进行防护的四个方案如图所示,其中能达到目的的是
A. B.
C. D.
二、填空题
14.回答下列问题
(1)下列反应是氧化还原反应且是吸热反应的是 。
A.稀醋酸与烧碱溶液的反应
B.灼热的炭与CO2的反应
C.铁片与稀盐酸反应
D.Ba(OH)2 8H2O与NH4Cl反应
E.干冰汽化
(2)实际生产生活中,钢铁等金属因电化学腐蚀损失巨大,而电化学在金属制备和加工中也发挥着重要的作用。生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为 。金属的两种常见电化学防护方法如下图所示,图甲中铁闸门连接电源的 (填“正极”或“负极”),图乙所示金属的防护方法称为 。
(3)将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是___________ 。
A.铁棒AB段发生的反应为O2+2H2O+4e-=4OH-
B.腐蚀过程中在铁棒上会产生微电流,且方向是从BC段到AB段
C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响
D.产生这种现象的本质是铁棒所处的化学环境不同
15.我国古代青铜器工艺精湛,有很高的艺术价值和历史价值。但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(2)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
(3)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是 (填“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉铜锈Cu2(OH)3Cl,其离子方程式为 ;
③若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
16.钢铁在自然界中的腐蚀比较普遍。
(1)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的 腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的 (填“正”或“负”)极相连。
(2)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中的正极反应式为 。
(3)铁器深埋地下,也会发生严重的电化学腐蚀,原因是一种称为硫酸盐还原菌的细菌,能提供正极反应的催化剂,将土壤中的还原为S2-,试写出该电化学腐蚀的正极反应式 。
(4)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。
参考答案
1.A
A.将钢铁制品与铜、锡等金属叠放在一起保存,因为铁比铜、锡更活泼,发生电化学腐蚀的时候,铁做负极被腐蚀,不能减缓钢铁的腐蚀速率,A选项符合题意;
B.将钢铁制品表面进行烤蓝处理,会在钢铁制品表面生成一层致密的氧化膜,可以减缓钢铁腐蚀速率,B选项不符合题意;
C.采用外加电流法,将钢铁制品连接电源的负极,采用了外加电流的阴极保护法,可以减缓钢铁腐蚀速率,C选项不符合题意;
D.在钢铁中加入锰、铬等金属,以改变钢铁结构,可以减缓钢铁腐蚀速率,D选项不符合题意;
答案选A。
2.B
A.钱币是铜合金,钱币表面绿色物质是铜绿,主要成分是碱式碳酸铜,其化学式是Cu2(OH)2CO3,故A说法正确;
B.吸氧腐蚀正极反应式O2+2H2O+4e-=4OH-,析氢腐蚀是电解质溶液显酸性,正极反应式为2H++2e-=H2↑,根据金属活动顺序表,铜没有氢活泼,不能置换出氢气,即不能发生吸氢腐蚀,故B说法错误;
C.在潮湿环境会发生电化学腐蚀,铜作负极,发生氧化反应,故C说法正确;
D.保护钱币,应防止铜发生腐蚀,可采取的措施保持干燥环境、涂保护层等,故D说法正确;
答案为B。
3.B
A.铁和锌形成原电池,锌作为负极,锌被腐蚀,铁作正极被保护,A正确;
B.将换成,铁作为负极,被腐蚀,B错误;
C.铁不发生反应,向试管中加入溶液,无明显现象,C正确;
D.酸性溶液中,正极反应式为,D正确;
故选B。
4.B
外加电流阴极保护是通过外加直流电源以及辅助阳极,被保护金属与电源的负极相连作为阴极。
A、被保护的钢管桩与电源的负极相连作为阴极,高硅铸铁惰性辅助电极为阳极钢管桩,阴极不参与反应,起到了保护作用,A正确,不符合题意;
B、高硅铸铁为惰性辅助阳极,所以高硅铸铁不损耗,B错误,符合题意;
C、在保护过程中要使被保护金属结构电位低于周围环境,则通入的保护电流应该根据环境条件变化进行调整,C正确,不符合题意;
D、被保护的钢管桩应作为阴极,从而使得金属腐蚀发生的电子迁移得到抑制,使钢管桩表面腐蚀电流接近于零,避免或减弱电化学腐蚀的发生,D正确,不符合题意;
答案选B。
5.A
图A铁管做阳极,腐蚀速度加快;图B中铁管做阴极,被保护,不被腐蚀;图C中形成原电池,铁比锡活泼做负极,腐蚀速度加快;图D中形成原电池,锌作负极,铁管做正极,正极金属被保护,不被腐蚀,而电解原理引起的腐蚀速率大于原电池原理引起的腐蚀速率,故A的腐蚀速率最快。
故选:A。
6.D
使用的是外加电流的阴极保护法,钢管柱与电源的负极相连,被保护。
A.外加强大的电流可以抑制金属电化学腐蚀产生的电流,从而保护钢管柱,A正确;
B.通电后,被保护的钢管柱作阴极,高硅铸铁作阳极,因此电路电子被强制流向钢管桩,B正确;
C.高硅铸铁为惰性辅助阳极,为惰性阳极材料且起到传递电流的作用,C正确;
D.该金属防护的方法是外加电流的阴极保护法,D错误;
故选D。
7.A
A.此为外加电源的阴极保护法,被保护金属钢制管桩应与电源负极相连,故A错误;
B.镁比铁活泼,此为牺牲阳极的阴极保护法,故B正确;
C.铁上镀铜,铁质镀件接电源负极,铜接电源正极,硫酸铜作电镀液,故C正确;
D.表面刷漆可以隔绝空气,起到防护作用,故D正确;
故答案为A
8.C
A.若X为碳棒,开关K置于M处,构成原电池,铁作负极,加快了铁的腐蚀,A项错误;
B.若X为碳棒,开关K置于N处,形成电解池,此时金属铁为阴极,铁被保护,为外加电源的阴极保护法,可减缓铁的腐蚀,B项错误;
C.若X为锌,开关K置于M处,构成原电池,锌作负极,铁作正极,该电化学防护法称为牺牲阳极的阴极保护法,C项正确;
D.若X为锌,开关K置于N处,构成电解池,锌作阳极,铁作阴极,可以减缓铁的腐蚀,D项错误;
故选C。
9.C
一段时间后b处和c处出现变红现象,说明b、c处生成氢氧根离子即b、c处发生还原反应。
A.根据前面分析b、c处发生还原反应,则说明发生氧化反应的是a处和d处,故A正确;
B.a处是铁失去电子变为亚铁离子,和铁氰化钾溶液会生成蓝色沉淀,因此图A中a处出现蓝色沉淀,故B正确;
C.根据前面分析b、c处发生还原反应即b处和c处电极反应式为,故C错误;
D.A中铁为负极,铜为正极,对铁有腐蚀性,而B中铁为正极,锌为负极,因此对铁钉腐蚀起防护作用的是图B,是牺牲阳极的阴极保护法,故D正确。
综上所述,答案为C。
10.C
A.锌环与电源的正极相连,为阳极,电极反应式为Zn-2e-=Zn2+,A不符合题意;
B.通电时,阴极上H+放电,电极反应为2H2O+2e-=H2↑+2OH-,B不符合题意;
C.通电时,该装置是电解池,为外接电流的阴极保护法,C符合题意;
D.断电时,该装置为原电池,锌做负极,仍能防止铁帽被腐蚀,D不符合题意;
故选C。
11.D
A.图a中,插入海水中的铁棒,越靠近底端,海水中氧气的浓度越小,越不易腐蚀,故A错误;
B.图b中,开关由M改置于N时,锌为原电池的负极,铜锌合金为正极被保护,则合金的腐蚀速率减慢,故B错误;
C.图c中,接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt上放出,故C错误;
D.图d中,若X为锌,开关K置于M处,形成原电池,锌做负极失电子,铁做正极得电子被保护,该电化学防护法称为牺牲阳极保护法,故D正确;
故选D。
12.C
图1有外接电源,是外加电流的阴极保护法,图2没有外接电源,是牺牲阳极的阴极保护法。
A.辅助电极与电源正极相连,作阳极,Cu在阳极失电子被腐蚀消耗,成本增大,不能用Cu作阳极,A错误;
B.在保护过程中要使被保护金属结构电位低于周围环境,通入的保护电流应该根据环境条件变化(pH值,离子浓度,温度等)进行调整,B错误;
C.图2是牺牲阳极的阴极保护法,钢铁桥墩作正极被保护,正极上氧气得电子发生还原反应O2+2H2O+4e-=4OH-,C正确;
D.河水中的电解质少于海水中的电解质,所以钢铁桥墩在海水中比在河水中腐蚀更快,D错误。
答案选C。
13.A
A.Zn比Fe活泼,钢闸门与Zn块连接,形成原电池,钢闸门作正极,被保护,A能达到目的;
B.钢闸门与石墨相连,形成原电池,钢闸门作负极,加速腐蚀,B不能达到目的;
C.钢闸门与电源正极相连,作电解池阳极,加速腐蚀,C不能达到目的;
D.钢闸门与电源正极相连,作电解池阳极,加速腐蚀,D不能达到目的;
答案选A。
14.(1)B
(2) O2+4e-+2H2O=4OH- 负极 牺牲阳极的阴极保护法
(3)BC
(1)A.稀醋酸与烧碱溶液的反应,不是氧化还原反应,错误;B.灼热的炭与CO2的反应,是氧化还原反应且是吸热反应,正确;C.铁片与稀盐酸反应,是氧化还原反应且是放热反应,错误;D.Ba(OH)2 8H2O与NH4Cl反应,不是氧化还原反应,错误;E.干冰汽化,不是化学反应,错误;故选B;
(2)吸氧腐蚀正极的电极反应式为O2+4e-+2H2O=4OH-;图甲是外加电流阴极保护法,铁闸门连接电源的负极,图乙所示金属的防护方法称为牺牲阳极的阴极保护法;
(3)A. AB段产生较多铁锈,则铁棒AB段为正极,发生的反应为O2+2H2O+4e-=4OH-,正确;B. 腐蚀过程中在铁棒上会产生微电流,且方向是从AB段(正极)到BC段(负极),错误;C. 向水中加入一定量硫酸钾固体后,增加了溶液的导电能力,增加了铁棒的生锈速率,错误;D. 产生这种现象的本质是铁棒所处的化学环境不同,即AB段氧气浓度大,为正极,BC段氧气浓度小,为负极,正确;故选BC。
15.(1)10∶1
(2)Ag2O+2CuCl=2AgCl+Cu2O
(3) c 2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ 0.448
(1)根据N=×NA,青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子数目之比为:=10:1;
(2)复分解反应为相互交换成分的反应,因此该反应的化学方程式为Ag2O+2CuCl=2AgCl+Cu2O;
(3)①负极发生失电子的反应,铜作负极失电子,因此负极为c,其中负极反应:Cu-2e-=Cu2+,正极反应:O2+2H2O+4e-=4OH-;
②正极产物为OH-,负极产物为Cu2+,两者与Cl-反应生成Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
③4.29 g Cu2(OH)3Cl的物质的量为0.02 mol,由Cu元素守恒知,发生电化学腐蚀失电子的Cu单质的物质的量为0.04 mol,失去电子0.08 mol,根据电子守恒可得,消耗O2的物质的量为=0.02 mol,所以理论上消耗氧气的体积为0.448 L(标准状况)。
16.(1) 吸氧腐蚀 负
(2)ClO-+H2O+2e-=Cl-+2OH-
(3)+8e-+4H2O=S2-+8OH-
(4) N 牺牲阳极的阴极保护法
(1)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的吸氧腐蚀;原电池中的正极和电解池中的阴极得到电子,被保护,所以为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的负极相连;故答案为:吸氧腐蚀;负;
(2)若用钢铁(含Fe、C)制品盛装NaClO溶液构成原电池,铁作负极,碳作正极,正极上次氯酸根离子得电子生成氯离子和氢氧根离子,电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,故答案为:ClO-+H2O+2e-=Cl-+2OH-;
(3)将土壤中的还原为S2-,可知得到电子,该电化学腐蚀的正极反应式为+8e-+4H2O=S2-+8OH-;
(4)若X为碳棒,则只能用外加电源的阴极保护法,此进K应置于N处;若X为Zn,K置于M处,其保护原理称为牺牲阳极的阴极保护法。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
