1.2.2 反应热的计算 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册
文档属性
| 名称 | 1.2.2 反应热的计算 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 701.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-27 16:06:39 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
1.2.2 反应热的计算 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
1.已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+O2(g)=H2O(g) ΔH=-241.5 kJ·mol-1
欲得到相同热量,需充分燃烧C和H2的质量比约为
A.12∶3.25 B.3.25∶12 C.1∶1 D.6∶1
2.已知1mol下列物质分解为气态原子消耗能量与热化学方程式信息如下表:
物质 NO CO N2
能量/(kJ/mol) 632 1076 946
热化学方程式 2NO(g)+2CO(g)=N2(g)+2CO2(g) H=-742kJ/mol
则CO2的碳氧双键能为
A.-1606kJ/mol B.1606kJ/mol C.803kJ/mol D.-803kJ/mol
3.二氧化碳甲烷化技术是资源化利用的有效手段之一,其反应原理为 。已知298 K时,有关物质的相对能量如表所示:
物质
相对能量/() 0 -75 -242 -393
下列说法正确的是
A.该反应的
B.相对能量:
C.该反应的
D. ,则
4.根据以下热化学方程式,和的大小比较错误的是
A. , ,则
B. , ,则
C. , ,则
D. , 则
5.图像法是研究化学反应的一种常用方法。已知化学反应A2(g)+B2(g)=2AB(g)的能量变化曲线如图所示,则下列叙述中正确的是
A.A2(g)+B2(g)=2AB(g)是一个放热反应
B.A2(g)与B2(g)每生成2molAB(g)时吸收bkJ能量
C.该反应中反应物的总能量低于生成物的总能量
D.断裂1molA-A键和1molB-B键时放出akJ能量
6.化学反应的能量变化如图所示,下列热化学方程式正确的为
A.
B.
C.
D.
7.氯原子对O3分解有催化作用:O3+Cl=ClO+O2 ΔH1,ClO+O=Cl+O2 ΔH2。大气臭氧层的分解反应是O3+O=2O2 ΔH,该反应的能量变化如图:
下列叙述中,正确的是
A.反应O3+O=2O2的ΔH=E1-E3 B.O3+O=2O2是吸热反应
C.ΔH=ΔH1-ΔH2 D.ΔH=E3-E2<0
8.已知:298K时,相关物质的相对能量如下表所示:
物质
相对能量/(kJ/mol) 0 0 0 -110 -393 -242 -286
下列说法不正确的是
A.1完全燃烧生成放出的热量为286
B.
C.已知 , ,则
D.将碳先与水蒸气作用转化成水煤气再燃烧,与直接燃烧等质量的碳,反应后都恢复至室温,两个过程的热效应是一样的
9.由下列键能数据大小,不能得出的事实是
化学键 O-H H-H O-O
键能kJ·mol-1 463 436 498.3
A.1molH2和molO2总能量大于1molH2O总能量
B.断开1molH2中的化学键所吸收的能量是436kJ
C.H2(g)+O2(g)=H2O(g) ΔH= 240.85kJ·mol-1
D.生成1molH2O的化学键所放出热量是463kJ
10.通常人们把气态分子中化学键解离成气态原子所吸收的能量看成该化学键的键能。键能可以用于估算化学反应的反应热,化学反应的等于反应中断裂旧化学键吸收的能量之和与反应中形成新化学键释放的能量之和的差。
化学键
生成化学键时放出的能量
根据上表中给出的数据判断,下列热化学方程式不正确的是
A.
B.
C.
D.
11.卤化铵(NH4X)的能量关系如图所示,下列说法正确的是
A.ΔH1>0,ΔH2<0
B.相同条件下,NH4Cl的ΔH2比NH4I的小
C.相同条件下,NH4Cl的ΔH3+ΔH4比NH4I的小
D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0
12.下图为反应的能量变化示意图。下列说法正确的是
A.拆开2 mol 和1 mol 中的化学键成为H、O原子,共放出1368 kJ能量
B.
C.2mol 和1 mol 反应生成2 mol ,放出能量小于484 kJ
D.
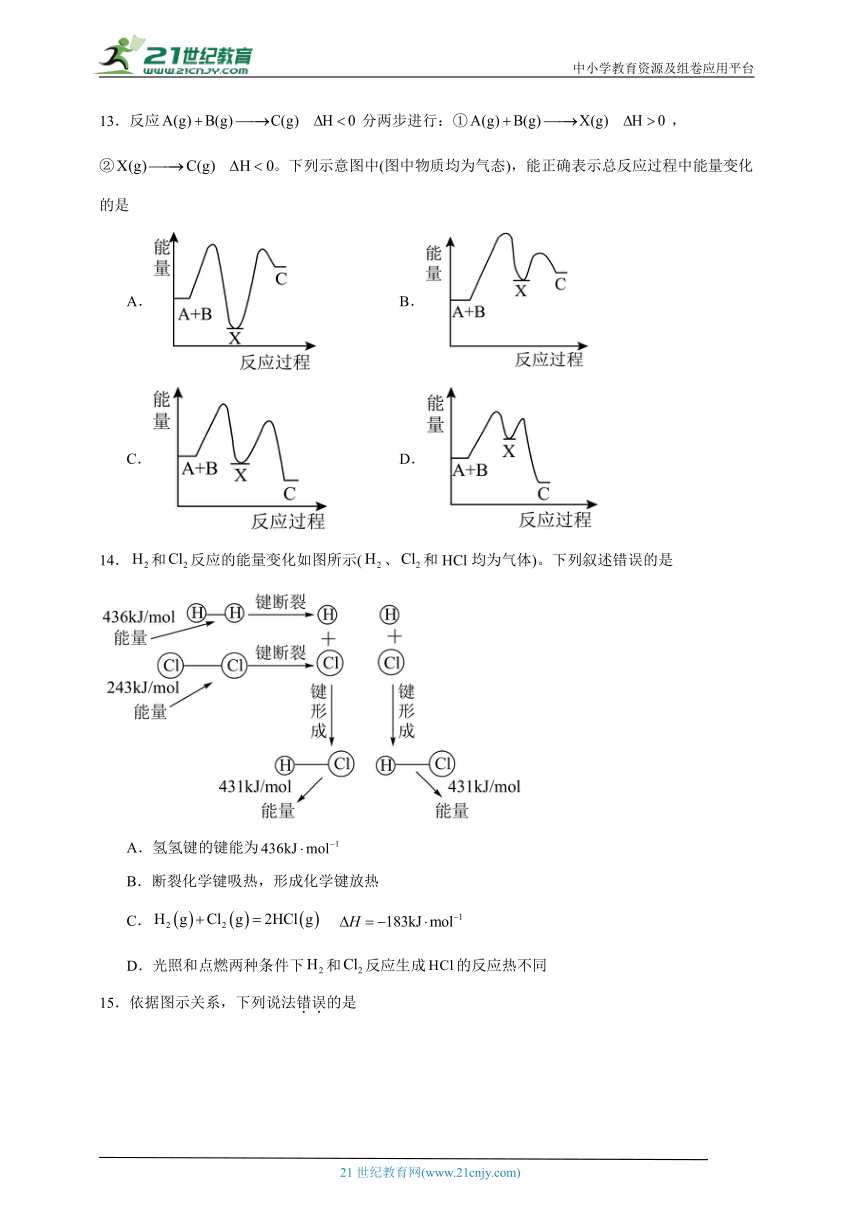
13.反应分两步进行:①,②。下列示意图中(图中物质均为气态),能正确表示总反应过程中能量变化的是
A. B.
C. D.
14.和反应的能量变化如图所示(、和HCl均为气体)。下列叙述错误的是
A.氢氢键的键能为
B.断裂化学键吸热,形成化学键放热
C.
D.光照和点燃两种条件下和反应生成的反应热不同
15.依据图示关系,下列说法错误的是
A.
B.石墨比金刚石稳定
C.
D.
二、填空题
16.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
(1)写出该反应的热化学方程式: 。
(2)已知H2O(l)= H2O(g);△H=+44kJ mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是 kJ。
(3)已知N2(g)+2O2(g)= 2NO2(g);△H=+67.7kJ mol-1,N2H4(g)+O2(g)= N2(g)+2H2O (g);△H=-534kJ mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 。
17.2020年3月26日,我国在南海成功实现了可燃冰的第二轮试采。可燃冰分布于深海沉积物或陆域的永久冻土中,是天然气与水形成的冰样结晶物,如果能实现商业化开采,将会大大改变我国的能源结构,减少对石油资源的依赖。
已知:ⅰ.条件下,1.6克甲烷完全燃烧生成二氧化碳和气态水放出能量。
ⅱ.键能是指共价键解离成气态原子A和气态原子B所吸收的能量。常见共价键的键能数据如下表:
共价键
键能 413 498 464
(1)可燃冰形成的条件是 (填序号)
a.高温、高压 b.高温、低压 c.低温、高压 d.低温、低压
(2)①写出甲烷完全燃烧生成二氧化碳和气态水的热化学方程式 。
②估算二氧化碳分子中的键能为 。
(3)甲烷水蒸气催化重整是制备高纯度氢气的方法之一。
①反应器中初始反应的生成物为和,其物质的量之比为,甲烷和水蒸气反应的方程式为 。
②反应器中还存在如下反应:
ⅰ.
ⅱ.
ⅲ.
ⅲ为积炭反应,利用和计算时,还需要利用 反应的。
三、计算题
18.(1)已知在298K时下述反应的有关数据:
C(s)+O2(g)=CO(g) ΔH1= -110.5 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2= -393.5 kJ·mol-1
则C(s)+CO2(g)=2CO(g)的ΔH为 。
(2)实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH1,根据盖斯定律求ΔH4。
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1= -890.3 kJ·mol-1
C(石墨)+O2(g)=CO2(g) ΔH2= -393.5 kJ·mol-1
H2(g)+O2(g)=H2O(l) ΔH3= -285.8 kJ·mol-1
C(石墨)+2H2(g)=CH4(g) ΔH4= 。
参考答案
1.A
设得到的相同热量为QkJ,则由反应C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1可得,放出QkJ的热量,需燃烧C的质量为g;放出QkJ的热量,需燃烧H2的质量为g,由此得出,欲得到相同热量,需充分燃烧C和H2的质量比为∶≈12∶3.25,故选A。
2.C
1mol下列物质分解为气态原子消耗能量即该物质的键能,设CO2的碳氧双键能为x,由 H=反应物的总键能-生成物的总键能=(2×632+2×1076)-(946+2×2x)= -742,解得x=803,故选:C。
3.C
A.由反应可知反应物的气体分子数多于生成物气体分子数,则,故A错误;
B.相同条件下,同种物质相对能量:气态>液态,则相对能量:,故B错误;
C.该反应的,故C正确;
D.相对能量:,生成液态水时放出的热量多于生成气态水时的热量,放热越多越小,则,故D错误;
故选:C。
4.B
A.已知 ,根据盖斯定律可得,即,故A正确;
B.已知为放热反应,根据盖斯定律可得,即,故B错误;
C.已知为吸热反应,,为放热反应,,即,故C正确;
D.已知氯元素的非金属性强于溴元素,因此氯气与氢气反应放出的热量多余溴与氢气,又因放热焓变为负值,放热越多焓变值越小,即,故D正确;
故答案选B选项。
5.C
据图像可知,反应物的总能量小于生成物的总能量,反应为吸热反应。
A.根据分析,反应吸热,焓变大于0,反应热=反应物能量总和-生成物能量总和= +(a-b) kJ/mol,属于吸热反应,A错误;
B.由图中信息可知,每生成2mol AB(g)吸收的热量应为(a-b)kJ,B错误;
C.由图像可知,反应吸热,反应物总能量小于生成物总能量,C正确;
D.断键应吸收能量,断裂1mol A-A和1mol B-B键,吸收akJ能量,D错误;
故选:C。
6.D
根据能量图中各步骤反应物的量和该步骤的能量变化关系来判断各反应的热化学方程式书写是否正确。
A.反应的,A错误;
B.反应的,B错误;
C.反应的,C错误;
D.反应的或,D正确;
故选D。
7.D
A.ΔH=生成物的总能量-反应物的总能量,由图可知,反应O3+O=2O2的ΔH= E3-E2,故A错误;
B.由图可知,O3+O的总能量大于2O2的总能量,则O3+O=2O2是放热反应,故B错误;
C.记①O3+Cl=ClO+O2 ΔH1,②ClO+O=Cl+O2 ΔH2,③O3+O=2O2 ΔH,根据盖斯定律有:①+②=③,则ΔH=ΔH1+ΔH2,故C错误;
D.O3+O=2O2是放热反应,且ΔH=生成物的总能量-反应物的总能量,则ΔH=E3-E2<0,故D正确;
故答案选D。
8.D
A.反应焓变等于生成物的能量和减去反应物的能量和;,则反应放出热量为286,A正确;
B.,B正确;
C.两个反应均为放热反应,焓变为负值,且反应放热更多,焓变更负,故,C正确;
D.根据盖斯定律,两个过程若均生成气态水则热效应是一样的,若反应后都恢复至室温,水蒸气液化释放热量,则两个过程的热效应是不一样的,D错误;
故选D。
9.D
反应焓变等于反应物键能和减去生成物键能和,则H2(g)+O2(g)=H2O(g) ΔH=(436 kJ·mol-1)+×(498.3 kJ·mol-1)-2×(463 kJ·mol-1)= 240.85kJ·mol-1;
A.由分析可知,反应放热,则反应物能量和大于生成物能量和,A正确;
B.1分子氢气中含有1个H-H键,断开1molH2中的化学键所吸收的能量是436kJ,B正确;
C.由分析可知,H2(g)+O2(g)=H2O(g) ΔH= 240.85kJ·mol-1,C正确;
D.1分子水中含有2个O-H键,生成1molH2O的化学键所放出热量是2×463kJ,D错误;
故选D。
10.C
反应物的键能之和-生成物的键能之和。
A.的,A正确;
B.的,B正确;
C.是 的逆反应,其,C错误;
D.是 的逆反应,其,D正确;
故选C。
11.C
A.卤化铵的分解为吸热反应,ΔH2对应的为HX化学键断裂过程,断裂化学键吸收热量,焓变也为正值,则ΔH1>0、ΔH2>0,故A错误;
B.氯原子半径小于碘原子,所以H-Cl的键能大于H-I的键能,断键吸收热量焓变大于0,所以相同条件下,NH4Cl的ΔH2比NH4I的大,故B错误;
C.ΔH3+ΔH4为原子变为离子需要的能量,Cl(g) Cl-(aq)比I(g) I-(aq)放出的热量多,所以相同条件下,NH4Cl的ΔH3+ΔH4比NH4I的小,故C正确;
D.途径5与途径1、2、3、4之和的起点和终点相同,结合盖斯定律可知ΔH1+ΔH2+ΔH3+ΔH4=ΔH5,故D错误;
答案选C。
12.D
A.断开化学键吸收能量,则拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子共吸收1368kJ能量,A错误;
B.根据题目信息可知,,B错误;
C.由图可知,2molH2(g)和1molO2(g)反应生成2molH2O(g)共放出484kJ能量,则反应生成2 mol H2O(l),放出能量大于484 kJ,C错误;
D.根据题目信息可知,,D正确;
故选D。
13.D
由,可知A和B的能量之和大于C的能量;由①,可知这步反应是吸热反应,故X的能量大于A和B的能量之和,反应②为放热反应,X的能量高于C,故D符合题意,故选D。
14.D
A.由图可知氢氢键的键能为,A正确;
B.断裂化学键吸热,形成化学键放热,B正确;
C.1mol和1mol反应生成2mol 共放出2×431-243-436kJ=183kJ能量,故的,C正确;
D.和反应生成的反应热只与反应物和生成物的能量有关,与反应路径无关,D错误。
故选D。
15.C
A.按盖斯定律,反应Ⅴ=反应Ⅰ+反应Ⅳ,ΔH5=ΔH1+ΔH4,则ΔH4<ΔH5,A正确;
B.由反应Ⅰ:C(金刚石,s)= C(石墨,s) ΔH1=+1.9 kJ mol-1知,等量的石墨能量比金刚石低,石墨比金刚石稳定,B正确;
C.由盖斯定律知,反应Ⅲ=反应Ⅰ+反应Ⅳ-反应Ⅱ,则ΔH4=ΔH3-ΔH1-ΔH2=[(-393.5)-(+1.9)-(-283.0) ]kJ mol-1=-112.4kJ mol-1,C错误;
D.结合选项A和选项C,ΔH5=ΔH1+ΔH4=(+1.9-112.4)kJ mol-1=-110.5 kJ mol-1,由盖斯定律,2×反应Ⅴ-反应Ⅲ得目标反应:C(石墨,s)+CO2(g)=2CO(g)ΔH=2ΔH5-ΔH3=+172.5 kJ mol-1,D正确;
故答案为:C。
16. N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-640kJ/mol 408 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol
(1)计算1mol液态肼与足量液态双氧水反应时放出的热量,可写出反应的热化学方程式。
(1)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ mol-1,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ mol-1;
(2)因①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ mol-1,②H2O(l)═H2O(g)△H=+44kJ mol-1,根据盖斯定律,①-②×4,得N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625 kJ mol-1,所以16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量为408.8kJ;
故答案为:408.8;
(3)①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
依据盖斯定律计算②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol。
17.(1)c
(2) CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJ/mol 797
(3) CH4+2H2O 4H2+CO2 C(s)+2H2O(g)=CO2(g)+2H2(g)或C(s)+CO2(g)=2CO(g)
(1)可燃冰是天然气和水在海底300~3000米的深度形成的固体,是低温高压条件下许多天然气被包进水分子中,在海底的低温(2~5℃)与压力下结晶,可燃冰形成的条件是低温、高压;故答案为:c;
(2)①条件下,1.6克甲烷完全燃烧生成二氧化碳和气态水放出能量,1mol甲烷反应燃烧反应的△H==-802kJ/mol;反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJ/mol。故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJ/mol;
②反应热△H=反应物总键能-生成物总键能=4×413kJ/mol+2×498kJ/mol-2EC=O-464kJ/mol×4=-802kJ/mol,EC=O=797kJ/mol,估算二氧化碳分子中的键能为797。故答案为:797;
(3)①反应物为CH4和H2O(g),生成物为H2和CO2,且物质的量之比为4∶1,据此结合质量守恒定律,CH4+2H2O 4H2+CO2,故答案为:CH4+2H2O 4H2+CO2;
②根据盖斯定律,ⅰ式+ⅱ式可得:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH1+ΔH2,则(ⅰ式+ⅱ式)-ⅲ式可得:C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH;ⅰ式-ⅱ式可得:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH1-ΔH2,则(ⅰ式-ⅱ式)-ⅲ式可得:C(s)+CO2(g)=2CO(g) ΔH。因此,要求反应ⅲ式的ΔH3,还必须利用反应C(s)+2H2O(g)=CO2(g)+2H2(g)或C(s)+CO2(g)=2CO(g)的ΔH。故答案为:C(s)+2H2O(g)=CO2(g)+2H2(g)或C(s)+CO2(g)=2CO(g)。
18. +172.5 kJ·mol-1 -74.8 kJ·mol-1
(1)已知:①C(s)+O2(g)=CO(g) ΔH1= -110.5 kJ·mol-1,②C(s)+O2(g)=CO2(g) ΔH2= -393.5 kJ·mol-1,根据盖斯定律,①×2-②可得C(s)+CO2(g)=2CO(g) ΔH=[(-110.5)×2-(-393.5)] kJ mol-1=+172.5 kJ·mol-1;
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1= -890.3 kJ·mol-1,②C(石墨)+O2(g)=CO2(g) ΔH2= -393.5 kJ·mol-1,③H2(g)+O2(g)=H2O(l) ΔH3= -285.8 kJ·mol-1,
根据盖斯定律,将②+③×2-①可得C(石墨)+2H2(g)=CH4(g) ΔH4=[(-393·5)+(-285.8)×2-(-890.3)] kJ·mol-1= -74.8 kJ·mol-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
1.2.2 反应热的计算 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
1.已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+O2(g)=H2O(g) ΔH=-241.5 kJ·mol-1
欲得到相同热量,需充分燃烧C和H2的质量比约为
A.12∶3.25 B.3.25∶12 C.1∶1 D.6∶1
2.已知1mol下列物质分解为气态原子消耗能量与热化学方程式信息如下表:
物质 NO CO N2
能量/(kJ/mol) 632 1076 946
热化学方程式 2NO(g)+2CO(g)=N2(g)+2CO2(g) H=-742kJ/mol
则CO2的碳氧双键能为
A.-1606kJ/mol B.1606kJ/mol C.803kJ/mol D.-803kJ/mol
3.二氧化碳甲烷化技术是资源化利用的有效手段之一,其反应原理为 。已知298 K时,有关物质的相对能量如表所示:
物质
相对能量/() 0 -75 -242 -393
下列说法正确的是
A.该反应的
B.相对能量:
C.该反应的
D. ,则
4.根据以下热化学方程式,和的大小比较错误的是
A. , ,则
B. , ,则
C. , ,则
D. , 则
5.图像法是研究化学反应的一种常用方法。已知化学反应A2(g)+B2(g)=2AB(g)的能量变化曲线如图所示,则下列叙述中正确的是
A.A2(g)+B2(g)=2AB(g)是一个放热反应
B.A2(g)与B2(g)每生成2molAB(g)时吸收bkJ能量
C.该反应中反应物的总能量低于生成物的总能量
D.断裂1molA-A键和1molB-B键时放出akJ能量
6.化学反应的能量变化如图所示,下列热化学方程式正确的为
A.
B.
C.
D.
7.氯原子对O3分解有催化作用:O3+Cl=ClO+O2 ΔH1,ClO+O=Cl+O2 ΔH2。大气臭氧层的分解反应是O3+O=2O2 ΔH,该反应的能量变化如图:
下列叙述中,正确的是
A.反应O3+O=2O2的ΔH=E1-E3 B.O3+O=2O2是吸热反应
C.ΔH=ΔH1-ΔH2 D.ΔH=E3-E2<0
8.已知:298K时,相关物质的相对能量如下表所示:
物质
相对能量/(kJ/mol) 0 0 0 -110 -393 -242 -286
下列说法不正确的是
A.1完全燃烧生成放出的热量为286
B.
C.已知 , ,则
D.将碳先与水蒸气作用转化成水煤气再燃烧,与直接燃烧等质量的碳,反应后都恢复至室温,两个过程的热效应是一样的
9.由下列键能数据大小,不能得出的事实是
化学键 O-H H-H O-O
键能kJ·mol-1 463 436 498.3
A.1molH2和molO2总能量大于1molH2O总能量
B.断开1molH2中的化学键所吸收的能量是436kJ
C.H2(g)+O2(g)=H2O(g) ΔH= 240.85kJ·mol-1
D.生成1molH2O的化学键所放出热量是463kJ
10.通常人们把气态分子中化学键解离成气态原子所吸收的能量看成该化学键的键能。键能可以用于估算化学反应的反应热,化学反应的等于反应中断裂旧化学键吸收的能量之和与反应中形成新化学键释放的能量之和的差。
化学键
生成化学键时放出的能量
根据上表中给出的数据判断,下列热化学方程式不正确的是
A.
B.
C.
D.
11.卤化铵(NH4X)的能量关系如图所示,下列说法正确的是
A.ΔH1>0,ΔH2<0
B.相同条件下,NH4Cl的ΔH2比NH4I的小
C.相同条件下,NH4Cl的ΔH3+ΔH4比NH4I的小
D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0
12.下图为反应的能量变化示意图。下列说法正确的是
A.拆开2 mol 和1 mol 中的化学键成为H、O原子,共放出1368 kJ能量
B.
C.2mol 和1 mol 反应生成2 mol ,放出能量小于484 kJ
D.
13.反应分两步进行:①,②。下列示意图中(图中物质均为气态),能正确表示总反应过程中能量变化的是
A. B.
C. D.
14.和反应的能量变化如图所示(、和HCl均为气体)。下列叙述错误的是
A.氢氢键的键能为
B.断裂化学键吸热,形成化学键放热
C.
D.光照和点燃两种条件下和反应生成的反应热不同
15.依据图示关系,下列说法错误的是
A.
B.石墨比金刚石稳定
C.
D.
二、填空题
16.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
(1)写出该反应的热化学方程式: 。
(2)已知H2O(l)= H2O(g);△H=+44kJ mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是 kJ。
(3)已知N2(g)+2O2(g)= 2NO2(g);△H=+67.7kJ mol-1,N2H4(g)+O2(g)= N2(g)+2H2O (g);△H=-534kJ mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 。
17.2020年3月26日,我国在南海成功实现了可燃冰的第二轮试采。可燃冰分布于深海沉积物或陆域的永久冻土中,是天然气与水形成的冰样结晶物,如果能实现商业化开采,将会大大改变我国的能源结构,减少对石油资源的依赖。
已知:ⅰ.条件下,1.6克甲烷完全燃烧生成二氧化碳和气态水放出能量。
ⅱ.键能是指共价键解离成气态原子A和气态原子B所吸收的能量。常见共价键的键能数据如下表:
共价键
键能 413 498 464
(1)可燃冰形成的条件是 (填序号)
a.高温、高压 b.高温、低压 c.低温、高压 d.低温、低压
(2)①写出甲烷完全燃烧生成二氧化碳和气态水的热化学方程式 。
②估算二氧化碳分子中的键能为 。
(3)甲烷水蒸气催化重整是制备高纯度氢气的方法之一。
①反应器中初始反应的生成物为和,其物质的量之比为,甲烷和水蒸气反应的方程式为 。
②反应器中还存在如下反应:
ⅰ.
ⅱ.
ⅲ.
ⅲ为积炭反应,利用和计算时,还需要利用 反应的。
三、计算题
18.(1)已知在298K时下述反应的有关数据:
C(s)+O2(g)=CO(g) ΔH1= -110.5 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2= -393.5 kJ·mol-1
则C(s)+CO2(g)=2CO(g)的ΔH为 。
(2)实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH1,根据盖斯定律求ΔH4。
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1= -890.3 kJ·mol-1
C(石墨)+O2(g)=CO2(g) ΔH2= -393.5 kJ·mol-1
H2(g)+O2(g)=H2O(l) ΔH3= -285.8 kJ·mol-1
C(石墨)+2H2(g)=CH4(g) ΔH4= 。
参考答案
1.A
设得到的相同热量为QkJ,则由反应C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1可得,放出QkJ的热量,需燃烧C的质量为g;放出QkJ的热量,需燃烧H2的质量为g,由此得出,欲得到相同热量,需充分燃烧C和H2的质量比为∶≈12∶3.25,故选A。
2.C
1mol下列物质分解为气态原子消耗能量即该物质的键能,设CO2的碳氧双键能为x,由 H=反应物的总键能-生成物的总键能=(2×632+2×1076)-(946+2×2x)= -742,解得x=803,故选:C。
3.C
A.由反应可知反应物的气体分子数多于生成物气体分子数,则,故A错误;
B.相同条件下,同种物质相对能量:气态>液态,则相对能量:,故B错误;
C.该反应的,故C正确;
D.相对能量:,生成液态水时放出的热量多于生成气态水时的热量,放热越多越小,则,故D错误;
故选:C。
4.B
A.已知 ,根据盖斯定律可得,即,故A正确;
B.已知为放热反应,根据盖斯定律可得,即,故B错误;
C.已知为吸热反应,,为放热反应,,即,故C正确;
D.已知氯元素的非金属性强于溴元素,因此氯气与氢气反应放出的热量多余溴与氢气,又因放热焓变为负值,放热越多焓变值越小,即,故D正确;
故答案选B选项。
5.C
据图像可知,反应物的总能量小于生成物的总能量,反应为吸热反应。
A.根据分析,反应吸热,焓变大于0,反应热=反应物能量总和-生成物能量总和= +(a-b) kJ/mol,属于吸热反应,A错误;
B.由图中信息可知,每生成2mol AB(g)吸收的热量应为(a-b)kJ,B错误;
C.由图像可知,反应吸热,反应物总能量小于生成物总能量,C正确;
D.断键应吸收能量,断裂1mol A-A和1mol B-B键,吸收akJ能量,D错误;
故选:C。
6.D
根据能量图中各步骤反应物的量和该步骤的能量变化关系来判断各反应的热化学方程式书写是否正确。
A.反应的,A错误;
B.反应的,B错误;
C.反应的,C错误;
D.反应的或,D正确;
故选D。
7.D
A.ΔH=生成物的总能量-反应物的总能量,由图可知,反应O3+O=2O2的ΔH= E3-E2,故A错误;
B.由图可知,O3+O的总能量大于2O2的总能量,则O3+O=2O2是放热反应,故B错误;
C.记①O3+Cl=ClO+O2 ΔH1,②ClO+O=Cl+O2 ΔH2,③O3+O=2O2 ΔH,根据盖斯定律有:①+②=③,则ΔH=ΔH1+ΔH2,故C错误;
D.O3+O=2O2是放热反应,且ΔH=生成物的总能量-反应物的总能量,则ΔH=E3-E2<0,故D正确;
故答案选D。
8.D
A.反应焓变等于生成物的能量和减去反应物的能量和;,则反应放出热量为286,A正确;
B.,B正确;
C.两个反应均为放热反应,焓变为负值,且反应放热更多,焓变更负,故,C正确;
D.根据盖斯定律,两个过程若均生成气态水则热效应是一样的,若反应后都恢复至室温,水蒸气液化释放热量,则两个过程的热效应是不一样的,D错误;
故选D。
9.D
反应焓变等于反应物键能和减去生成物键能和,则H2(g)+O2(g)=H2O(g) ΔH=(436 kJ·mol-1)+×(498.3 kJ·mol-1)-2×(463 kJ·mol-1)= 240.85kJ·mol-1;
A.由分析可知,反应放热,则反应物能量和大于生成物能量和,A正确;
B.1分子氢气中含有1个H-H键,断开1molH2中的化学键所吸收的能量是436kJ,B正确;
C.由分析可知,H2(g)+O2(g)=H2O(g) ΔH= 240.85kJ·mol-1,C正确;
D.1分子水中含有2个O-H键,生成1molH2O的化学键所放出热量是2×463kJ,D错误;
故选D。
10.C
反应物的键能之和-生成物的键能之和。
A.的,A正确;
B.的,B正确;
C.是 的逆反应,其,C错误;
D.是 的逆反应,其,D正确;
故选C。
11.C
A.卤化铵的分解为吸热反应,ΔH2对应的为HX化学键断裂过程,断裂化学键吸收热量,焓变也为正值,则ΔH1>0、ΔH2>0,故A错误;
B.氯原子半径小于碘原子,所以H-Cl的键能大于H-I的键能,断键吸收热量焓变大于0,所以相同条件下,NH4Cl的ΔH2比NH4I的大,故B错误;
C.ΔH3+ΔH4为原子变为离子需要的能量,Cl(g) Cl-(aq)比I(g) I-(aq)放出的热量多,所以相同条件下,NH4Cl的ΔH3+ΔH4比NH4I的小,故C正确;
D.途径5与途径1、2、3、4之和的起点和终点相同,结合盖斯定律可知ΔH1+ΔH2+ΔH3+ΔH4=ΔH5,故D错误;
答案选C。
12.D
A.断开化学键吸收能量,则拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子共吸收1368kJ能量,A错误;
B.根据题目信息可知,,B错误;
C.由图可知,2molH2(g)和1molO2(g)反应生成2molH2O(g)共放出484kJ能量,则反应生成2 mol H2O(l),放出能量大于484 kJ,C错误;
D.根据题目信息可知,,D正确;
故选D。
13.D
由,可知A和B的能量之和大于C的能量;由①,可知这步反应是吸热反应,故X的能量大于A和B的能量之和,反应②为放热反应,X的能量高于C,故D符合题意,故选D。
14.D
A.由图可知氢氢键的键能为,A正确;
B.断裂化学键吸热,形成化学键放热,B正确;
C.1mol和1mol反应生成2mol 共放出2×431-243-436kJ=183kJ能量,故的,C正确;
D.和反应生成的反应热只与反应物和生成物的能量有关,与反应路径无关,D错误。
故选D。
15.C
A.按盖斯定律,反应Ⅴ=反应Ⅰ+反应Ⅳ,ΔH5=ΔH1+ΔH4,则ΔH4<ΔH5,A正确;
B.由反应Ⅰ:C(金刚石,s)= C(石墨,s) ΔH1=+1.9 kJ mol-1知,等量的石墨能量比金刚石低,石墨比金刚石稳定,B正确;
C.由盖斯定律知,反应Ⅲ=反应Ⅰ+反应Ⅳ-反应Ⅱ,则ΔH4=ΔH3-ΔH1-ΔH2=[(-393.5)-(+1.9)-(-283.0) ]kJ mol-1=-112.4kJ mol-1,C错误;
D.结合选项A和选项C,ΔH5=ΔH1+ΔH4=(+1.9-112.4)kJ mol-1=-110.5 kJ mol-1,由盖斯定律,2×反应Ⅴ-反应Ⅲ得目标反应:C(石墨,s)+CO2(g)=2CO(g)ΔH=2ΔH5-ΔH3=+172.5 kJ mol-1,D正确;
故答案为:C。
16. N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-640kJ/mol 408 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol
(1)计算1mol液态肼与足量液态双氧水反应时放出的热量,可写出反应的热化学方程式。
(1)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ mol-1,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ mol-1;
(2)因①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ mol-1,②H2O(l)═H2O(g)△H=+44kJ mol-1,根据盖斯定律,①-②×4,得N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625 kJ mol-1,所以16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量为408.8kJ;
故答案为:408.8;
(3)①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
依据盖斯定律计算②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol。
17.(1)c
(2) CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJ/mol 797
(3) CH4+2H2O 4H2+CO2 C(s)+2H2O(g)=CO2(g)+2H2(g)或C(s)+CO2(g)=2CO(g)
(1)可燃冰是天然气和水在海底300~3000米的深度形成的固体,是低温高压条件下许多天然气被包进水分子中,在海底的低温(2~5℃)与压力下结晶,可燃冰形成的条件是低温、高压;故答案为:c;
(2)①条件下,1.6克甲烷完全燃烧生成二氧化碳和气态水放出能量,1mol甲烷反应燃烧反应的△H==-802kJ/mol;反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJ/mol。故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJ/mol;
②反应热△H=反应物总键能-生成物总键能=4×413kJ/mol+2×498kJ/mol-2EC=O-464kJ/mol×4=-802kJ/mol,EC=O=797kJ/mol,估算二氧化碳分子中的键能为797。故答案为:797;
(3)①反应物为CH4和H2O(g),生成物为H2和CO2,且物质的量之比为4∶1,据此结合质量守恒定律,CH4+2H2O 4H2+CO2,故答案为:CH4+2H2O 4H2+CO2;
②根据盖斯定律,ⅰ式+ⅱ式可得:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH1+ΔH2,则(ⅰ式+ⅱ式)-ⅲ式可得:C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH;ⅰ式-ⅱ式可得:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH1-ΔH2,则(ⅰ式-ⅱ式)-ⅲ式可得:C(s)+CO2(g)=2CO(g) ΔH。因此,要求反应ⅲ式的ΔH3,还必须利用反应C(s)+2H2O(g)=CO2(g)+2H2(g)或C(s)+CO2(g)=2CO(g)的ΔH。故答案为:C(s)+2H2O(g)=CO2(g)+2H2(g)或C(s)+CO2(g)=2CO(g)。
18. +172.5 kJ·mol-1 -74.8 kJ·mol-1
(1)已知:①C(s)+O2(g)=CO(g) ΔH1= -110.5 kJ·mol-1,②C(s)+O2(g)=CO2(g) ΔH2= -393.5 kJ·mol-1,根据盖斯定律,①×2-②可得C(s)+CO2(g)=2CO(g) ΔH=[(-110.5)×2-(-393.5)] kJ mol-1=+172.5 kJ·mol-1;
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1= -890.3 kJ·mol-1,②C(石墨)+O2(g)=CO2(g) ΔH2= -393.5 kJ·mol-1,③H2(g)+O2(g)=H2O(l) ΔH3= -285.8 kJ·mol-1,
根据盖斯定律,将②+③×2-①可得C(石墨)+2H2(g)=CH4(g) ΔH4=[(-393·5)+(-285.8)×2-(-890.3)] kJ·mol-1= -74.8 kJ·mol-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
