2.1.3 活化能 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册
文档属性
| 名称 | 2.1.3 活化能 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 914.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-27 16:06:39 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2.1.3 活化能 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
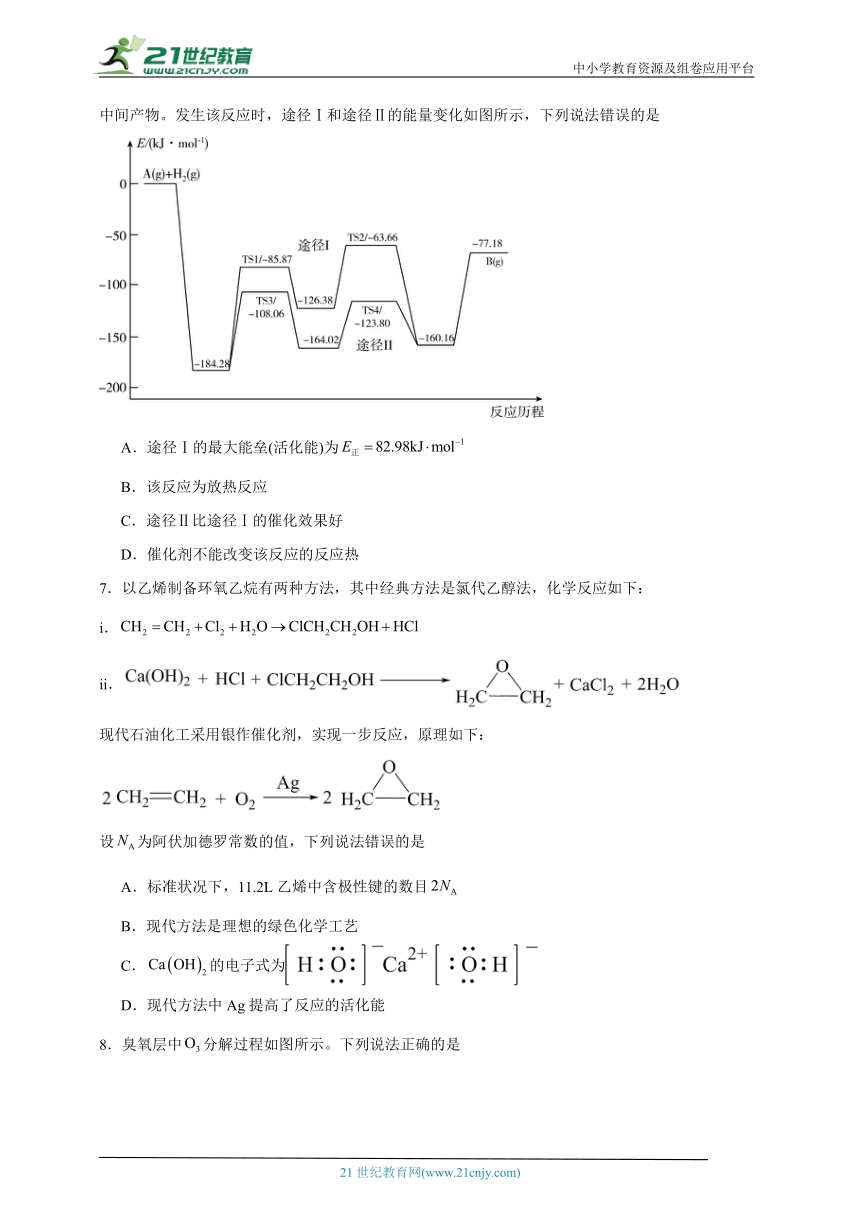
1.下列关于有效碰撞理论与影响速率因素之间关系正确的是
A.增大反应物浓度,可以提高活化分子百分数,从而提高反应速率
B.对于气体反应来说,通过压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率
C.温度升高,反应所需活化能减少,反应速率增大
D.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
2.一定条件下,反应的能量变化如图所示:
下列说法错误的是
A.该反应的焓变 B.该反应的速控步为
C.逆反应速控步的活化能为 D.反应物的键能之和小于生成物的键能之和
3.的光催化还原机理以及部分相对能量如图所示。下列说法正确的是
A.该机理总反应的化学方程式为
B.①~⑦过程中只有两个步骤中有生成
C.该历程存在9个基元反应
D.该过程有双键的形成与非极性键的断裂
4.工业上可采用的方法来制取高纯度的和。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇()脱氢反应的第一步历程,有如下两种可能方式(其中、为活化能):
方式①:
方式②:
图为计算机模拟的各步反应的能量变化示意图。
下列关于上述“第一步历程”的说法中,错误的是
A.主要历经方式②
B.第一步历程的焓变()大于0
C.最小能垒(活化能)为
D.焓变最小的基元反应为
5.关于有效碰撞理论,下列说法正确的是
A.能发生有效碰撞的分子不一定是活化分子
B.活化分子之间发生的碰撞一定是有效碰撞
C.增大压强使容器容积减小,单位体积内活化分子数目增多,化学反应速率加快
D.升高温度和使用催化剂,均降低反应的活化能,使得活化分子百分数增大,加快化学反应速率
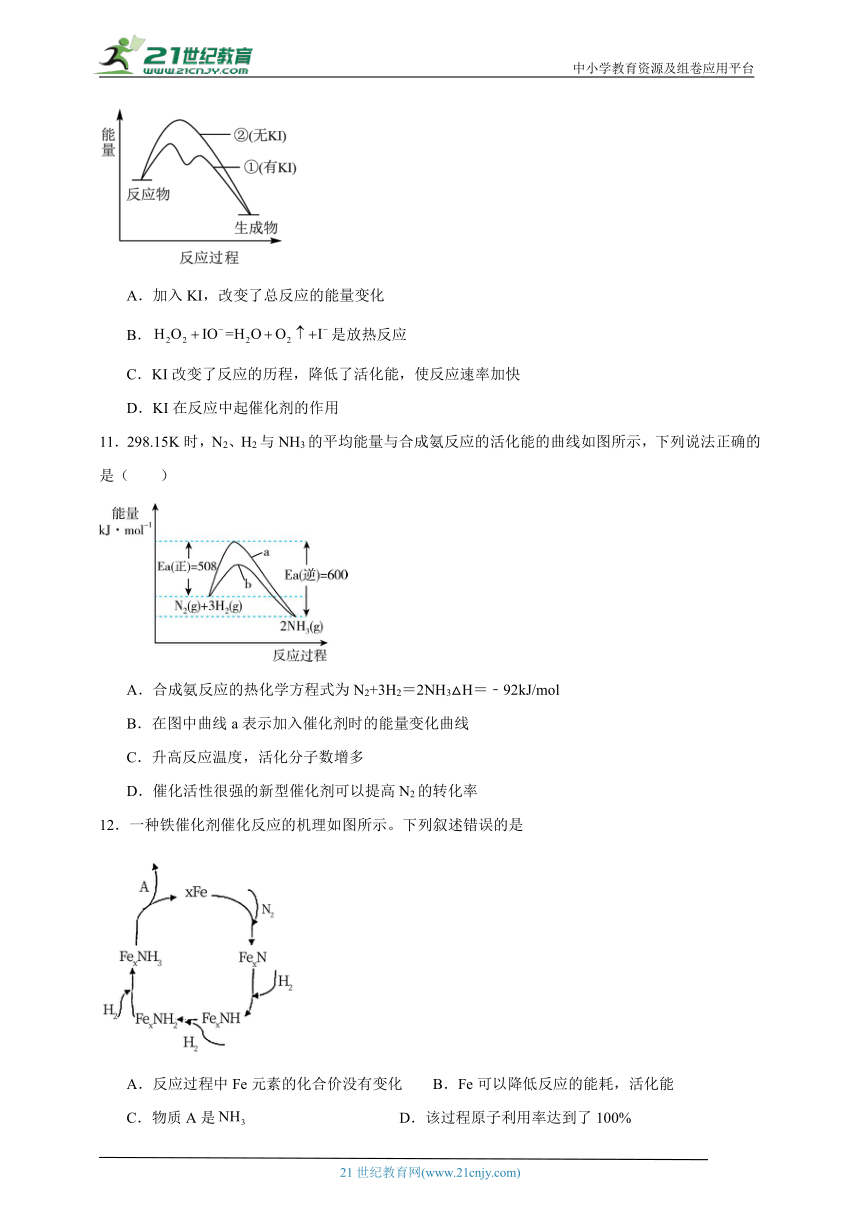
6.已知反应,在催化过程中,不同途径可能生成不同的过渡态(TS为过渡态)和中间产物。发生该反应时,途径Ⅰ和途径Ⅱ的能量变化如图所示,下列说法错误的是
A.途径Ⅰ的最大能垒(活化能)为
B.该反应为放热反应
C.途径Ⅱ比途径Ⅰ的催化效果好
D.催化剂不能改变该反应的反应热
7.以乙烯制备环氧乙烷有两种方法,其中经典方法是氯代乙醇法,化学反应如下:
i.
ii.
现代石油化工采用银作催化剂,实现一步反应,原理如下:
设为阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,11.2L乙烯中含极性键的数目
B.现代方法是理想的绿色化学工艺
C.的电子式为
D.现代方法中Ag提高了反应的活化能
8.臭氧层中分解过程如图所示。下列说法正确的是
A.催化剂能降低活化能,提高活化百分数
B.ClO是反应的催化剂,能提高反应物的反应率
C.原子是反应的催化剂,能提高反应物的转化率
D.该反应是放热反应,升高温度正反应速率降低
9.2021年我国首次实现以CO2为原料人工合成淀粉,该过程涉及CO2加氢(电解水得氢气)转化为甲醇(CH3OH)的过程,其能量变化如图所示。
下列叙述正确的是
A.CO2合成甲醇的反应中,寻找高效催化剂可以改变Q1和Q2的大小
B.CO2合成甲醇的反应中,破坏反应物化学键吸收的能量大于形成产物化学键释放的能量
C.CO2合成甲醇的反应中正反应活化能比逆反应的活化能大Q2kJ
D.CO2合成淀粉的过程有碳碳键形成
10.向双氧水中加入KI可观察到大量气泡产生,发生的反应为:,,反应过程中能量变化如下图所示。下列说法不正确的是
A.加入KI,改变了总反应的能量变化
B.是放热反应
C.KI改变了反应的历程,降低了活化能,使反应速率加快
D.KI在反应中起催化剂的作用
11.298.15K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线如图所示,下列说法正确的是( )
A.合成氨反应的热化学方程式为N2+3H2=2NH3△H=﹣92kJ/mol
B.在图中曲线a表示加入催化剂时的能量变化曲线
C.升高反应温度,活化分子数增多
D.催化活性很强的新型催化剂可以提高N2的转化率
12.一种铁催化剂催化反应的机理如图所示。下列叙述错误的是
A.反应过程中Fe元素的化合价没有变化 B.Fe可以降低反应的能耗,活化能
C.物质A是 D.该过程原子利用率达到了100%
13.某反应由两步反应ABC构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
A.AB的反应热ΔH=+(E2-E1)kJ/mol
B.三种化合物中A最稳定
C.CB 是放热反应
D.催化剂是要参与化学反应的,使用合适的催化剂可以 降低反应所需要的活化能
14.“疫去春来”,我们返校之日指日可待。同学们这道题要是做错了,小心开学挨板子噢。下列说法不正确的是
A.图甲中曲线II可以表示催化剂降低了反应的活化能
B.图乙中HI分子发生了有效碰撞
C.盐酸和氢氧化钠溶液的反应活化能很小
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
15.在催化剂作用下,某可逆反应的反应历程如图所示。下列说法正确的是
A.反应物的总能量小于生成物的总能量 B.活化能:反应ii→iii>反应i→ii
C.升高温度可提高反应物的平衡转化率 D.使用催化剂可提高活化分子百分数
二、填空题
16.科学家提出了以乙苯为原料制备苯乙烯的机理,如下图所示。(Ph-代表苯基,*代表吸附态)
虚线框内,化学反应速率最小的一步活化能的值为 。
参考答案
1.B
A.增大反应物浓度,单位体积内分子总数增多,活化分子数目增多,活化分子百分数不变,碰撞次数增多,反应速率增大,故A错误;
B.对于气体反应来说,通过压缩体积增大压强,单位体积内分子总数增多,活化分子数目增多,活化分子百分数不变,碰撞次数增多,反应速率增大,故B正确;
C.温度升高,反应的活化能不变,单位体积内分子总数不变,活化分子数目增多,活化分子百分数增多,碰撞次数增多,反应速率增大,故C错误;
D.选用适当的催化剂,降低反应所需的活化能,单位体积内分子总数不变,活化分子数目增多,活化分子百分数增多,碰撞次数增多,反应速率增大,故D错误;
综上所述,答案为B。
2.A
A.该反应的焓变为1mol氢气、1mol碘蒸气能量和与生成2molHI能量之间的差值,不是,A错误;
B.过渡态物质的总能量与反应物总能量的差值为活化能,活化能越小反应越快,活化能越大反应越慢,决定总反应速率的是慢反应;该反应的速控步为,B正确;
C.过渡态物质的总能量与反应物总能量的差值为活化能,由图可知,逆反应速控步的活化能为,C正确;
D.由图可知,反应为放热反应,则反应物的键能之和小于生成物的键能之和,D正确;
故选A。
3.B
A.题中所给该总反应的化学方程式为,其中反应前后电荷不守恒,故A错误;
B.①~⑦过程中只有两个步骤中有生成,分别是步骤②:COOH*+2H+→HCO*+H2O,步骤⑤:H3CO*+2H+→CH3*+H2O,故B正确;
C.该历程存在7个步骤,基元反应不可能有9个,故错误;
D.该过程中步骤②有碳氧双键的形成,但过程中无非极性键的断裂,故D错误;
故答案为:B。
4.AC
A.方式①的活化能低,说明其反应速率快,即甲醇裂解过程主要历经的方式应为①,故A错误;
B.由题中信息可知,CH3OH脱氢反应的第一步历程为分子中一个共价键的断裂过程,为吸热过程,大于0,故B正确;
C.由图可知,该历程中最小能垒(活化能)为(116.1-62.5)kJ·mol-1=53.6 kJ·mol-1,故C错误;
D.由图可知,焓变最小即放出热量最多的基元反应,为,反应物的能量高于生成物的能量,且差别最大,是放热最多的步骤,故D正确;
故选AC。
5.C
A.能发生有效碰撞的就一定是活化分子,因为根据碰撞理论,只有活化分子才能发生有效碰撞,A错误;
B.活化分子之间发生的碰撞不一定是有效碰撞,B错误;
C.增大压强使容器容积减小,单位体积内活化分子数目增多,有效碰撞增加,化学反应速率加快,C正确;
D.升高温度不能降低反应的活化能;使用催化剂可降低反应的活化能,使得活化分子百分数增大,加快化学反应速率,D错误;
故选C。
6.A
A.根据图中反应历程可知,途径I的最大能垒为-85.87kJmol-1-(-184.28 kJmol-1)=98.41 kJmol-1,A项错误;
B.根据图示可知,的反应热为-77.18 kJmol-1,为放热反应,B项正确;
C.整体活化能越低,催化效果越好,依图示可知,途径Ⅱ比途径Ⅰ的催化效果好,C项正确;
D.催化剂只能改变反应途径,不能改变反应的焓变,D项正确;
答案选A。
7.D
A.乙烯分子中四个碳氢键为极性键,故0.5mol乙烯含有极性键,A正确;
B.现代方法是理想的绿色化学工艺,原子利用率100%,B正确;
C.为离子化合物,电子式为,C正确;
D.Ag做催化剂,改变反应历程,降低活化能,D错误。
故选D。
8.A
A.催化剂改变反应历程,降低活化能,提高活化百分数,A正确;
B.由图可知,Cl是反应的催化剂,催化剂改变反应速率,但不能提高反应物的反应率,B错误;
C.催化剂改变反应速率,但不能提高反应物的转化率,C错误;
D.反应物总能量大于生成物的总能量,总反应是放热反应,升高温度正逆反应速率均会升高,D错误;
故选A。
9.D
A.CO2合成甲醇的反应中,寻找高效催化剂可以改变反应历程,降低反应的活化能,但是不改变焓变,故Q2的大小不变,A错误;
B.反应为放热反应,则破坏反应物化学键吸收的能量小于形成产物化学键释放的能量,B错误;
C.过渡态物质的总能量与反应物总能量的差值为活化能,即图中峰值越大则活化能越大,峰值越小则活化能越小,由图可知,CO2合成甲醇的反应中正反应活化能比逆反应的活化能小Q2kJ,C错误;
D.淀粉为高分子含碳化合物,则CO2合成淀粉的过程有碳碳键形成,D正确;
故选D。
10.A
A.KI是该反应的催化剂,能降低反应的活化能,但不能改变反应的始态和终态,即不能改变总反应的焓变,不改变总反应的能量变化,故A错误;
B.由图可知,图象①的后半段为,该反应的反应物的总能量大于生成物的总能量,则为放热反应,故B正确;
C.KI改变该反应的历程,能降低反应的活化能,增大活化分子数和百分数,有效碰撞几率增大,反应速率加快,故C正确;
D.KI是H2O2+I-=H2O+IO-的反应物,是H2O2+IO-=H2O+O2↑+I-的生成物,总反应为2H2O2=H2O+O2↑,所以KI在反应中起催化剂的作用,故D正确。
故选A。
11.C
A.在热化学反应方程式中,各物质的聚集状态应该标出,N2+3H2=2NH3△H=﹣92kJ/mol未标明物质聚集状态,故A错误;
B.加入催化剂,降低活化能,b为加入催化剂的曲线,故B错误;
C.升高温度,使分子的能量增大,活化分子的百分含量增大,数目增多,故C正确;
D.催化剂不影响化学平衡,不能改变转化率,故D错误。故选:C。
12.A
根据图示,Fe与N2反应生成FexN,再与H2反应生成FexNH,再与H2反应生成FexNH2,再与H2反应生成FexNH3,FexNH3分解生成Fe和NH3,铁作为催化剂进行循环。
A.根据分析,反应过程中Fe参加了反应,化合价发生了变化,故A错误;
B.Fe作为催化剂可以降低反应的能耗,活化能,故B正确;
C.根据分析,FexNH3分解生成Fe和NH3,所以物质A是NH3,故C正确;
D.该过程产物只有NH3,所以原子利用率达到了100%,故D正确;
答案选A。
13.D
A.B的总能量高于A的总能量, AB的反应为吸热反应,ΔH=+(E1-E2)kJ/mol,故A错误;
B.物质的能量越低越稳定,三种化合物中,C的能量最低,最稳定,故B错误;
C.B的总能量大于C的总能量,则CB 是吸热反应,故C错误;
D.加入合适的催化剂,能降低反应的活化能,反应速率加快,故D正确;
故答案选D。
14.B
A.催化剂可降低反应的活化能,由图可知,曲线II的活化能较低,可以表示催化剂降低了反应的活化能,故A正确;
B.只有发生化学反应的碰撞才是有效碰撞,由图乙可知碰撞后没有生成新分子,即没有发生化学反应,HI分子没有发生有效碰撞,故B错误;
C.酸和碱反应不需要外界做功的条件下就能发生,说明它们已经处于活跃状态,因此活化能很小,故C正确;
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加,故D正确;
答案选B。
15.D
A.由图中信息可知,反应物的总能量大于生成物的总能量,A错误;
B.反应ii→iii的活化能为0.85eV,反应i→ii的活化能为1.35eV,所以活化能:反应ii→iii<反应i→ii,B错误;
C.反应物的总能量大于生成物的总能量,该反应为放热反应,升高温度,平衡逆向移动,反应物的平衡转化率减小,C错误;
D.使用催化剂即可提高活化分子百分数,又可提高活化分子数目,D正确;
故选D。
16.63.5
由图可知,该反应为:i→ii→iii,共2步反应,活化能越大,反应速率越慢,则虚线框内化学反应速率最慢的一步为i变为过渡态1,活化能最大,值为(86.6-23.1)kJ/mol=63.5 kJ/mol。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2.1.3 活化能 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
1.下列关于有效碰撞理论与影响速率因素之间关系正确的是
A.增大反应物浓度,可以提高活化分子百分数,从而提高反应速率
B.对于气体反应来说,通过压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率
C.温度升高,反应所需活化能减少,反应速率增大
D.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
2.一定条件下,反应的能量变化如图所示:
下列说法错误的是
A.该反应的焓变 B.该反应的速控步为
C.逆反应速控步的活化能为 D.反应物的键能之和小于生成物的键能之和
3.的光催化还原机理以及部分相对能量如图所示。下列说法正确的是
A.该机理总反应的化学方程式为
B.①~⑦过程中只有两个步骤中有生成
C.该历程存在9个基元反应
D.该过程有双键的形成与非极性键的断裂
4.工业上可采用的方法来制取高纯度的和。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇()脱氢反应的第一步历程,有如下两种可能方式(其中、为活化能):
方式①:
方式②:
图为计算机模拟的各步反应的能量变化示意图。
下列关于上述“第一步历程”的说法中,错误的是
A.主要历经方式②
B.第一步历程的焓变()大于0
C.最小能垒(活化能)为
D.焓变最小的基元反应为
5.关于有效碰撞理论,下列说法正确的是
A.能发生有效碰撞的分子不一定是活化分子
B.活化分子之间发生的碰撞一定是有效碰撞
C.增大压强使容器容积减小,单位体积内活化分子数目增多,化学反应速率加快
D.升高温度和使用催化剂,均降低反应的活化能,使得活化分子百分数增大,加快化学反应速率
6.已知反应,在催化过程中,不同途径可能生成不同的过渡态(TS为过渡态)和中间产物。发生该反应时,途径Ⅰ和途径Ⅱ的能量变化如图所示,下列说法错误的是
A.途径Ⅰ的最大能垒(活化能)为
B.该反应为放热反应
C.途径Ⅱ比途径Ⅰ的催化效果好
D.催化剂不能改变该反应的反应热
7.以乙烯制备环氧乙烷有两种方法,其中经典方法是氯代乙醇法,化学反应如下:
i.
ii.
现代石油化工采用银作催化剂,实现一步反应,原理如下:
设为阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,11.2L乙烯中含极性键的数目
B.现代方法是理想的绿色化学工艺
C.的电子式为
D.现代方法中Ag提高了反应的活化能
8.臭氧层中分解过程如图所示。下列说法正确的是
A.催化剂能降低活化能,提高活化百分数
B.ClO是反应的催化剂,能提高反应物的反应率
C.原子是反应的催化剂,能提高反应物的转化率
D.该反应是放热反应,升高温度正反应速率降低
9.2021年我国首次实现以CO2为原料人工合成淀粉,该过程涉及CO2加氢(电解水得氢气)转化为甲醇(CH3OH)的过程,其能量变化如图所示。
下列叙述正确的是
A.CO2合成甲醇的反应中,寻找高效催化剂可以改变Q1和Q2的大小
B.CO2合成甲醇的反应中,破坏反应物化学键吸收的能量大于形成产物化学键释放的能量
C.CO2合成甲醇的反应中正反应活化能比逆反应的活化能大Q2kJ
D.CO2合成淀粉的过程有碳碳键形成
10.向双氧水中加入KI可观察到大量气泡产生,发生的反应为:,,反应过程中能量变化如下图所示。下列说法不正确的是
A.加入KI,改变了总反应的能量变化
B.是放热反应
C.KI改变了反应的历程,降低了活化能,使反应速率加快
D.KI在反应中起催化剂的作用
11.298.15K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线如图所示,下列说法正确的是( )
A.合成氨反应的热化学方程式为N2+3H2=2NH3△H=﹣92kJ/mol
B.在图中曲线a表示加入催化剂时的能量变化曲线
C.升高反应温度,活化分子数增多
D.催化活性很强的新型催化剂可以提高N2的转化率
12.一种铁催化剂催化反应的机理如图所示。下列叙述错误的是
A.反应过程中Fe元素的化合价没有变化 B.Fe可以降低反应的能耗,活化能
C.物质A是 D.该过程原子利用率达到了100%
13.某反应由两步反应ABC构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
A.AB的反应热ΔH=+(E2-E1)kJ/mol
B.三种化合物中A最稳定
C.CB 是放热反应
D.催化剂是要参与化学反应的,使用合适的催化剂可以 降低反应所需要的活化能
14.“疫去春来”,我们返校之日指日可待。同学们这道题要是做错了,小心开学挨板子噢。下列说法不正确的是
A.图甲中曲线II可以表示催化剂降低了反应的活化能
B.图乙中HI分子发生了有效碰撞
C.盐酸和氢氧化钠溶液的反应活化能很小
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
15.在催化剂作用下,某可逆反应的反应历程如图所示。下列说法正确的是
A.反应物的总能量小于生成物的总能量 B.活化能:反应ii→iii>反应i→ii
C.升高温度可提高反应物的平衡转化率 D.使用催化剂可提高活化分子百分数
二、填空题
16.科学家提出了以乙苯为原料制备苯乙烯的机理,如下图所示。(Ph-代表苯基,*代表吸附态)
虚线框内,化学反应速率最小的一步活化能的值为 。
参考答案
1.B
A.增大反应物浓度,单位体积内分子总数增多,活化分子数目增多,活化分子百分数不变,碰撞次数增多,反应速率增大,故A错误;
B.对于气体反应来说,通过压缩体积增大压强,单位体积内分子总数增多,活化分子数目增多,活化分子百分数不变,碰撞次数增多,反应速率增大,故B正确;
C.温度升高,反应的活化能不变,单位体积内分子总数不变,活化分子数目增多,活化分子百分数增多,碰撞次数增多,反应速率增大,故C错误;
D.选用适当的催化剂,降低反应所需的活化能,单位体积内分子总数不变,活化分子数目增多,活化分子百分数增多,碰撞次数增多,反应速率增大,故D错误;
综上所述,答案为B。
2.A
A.该反应的焓变为1mol氢气、1mol碘蒸气能量和与生成2molHI能量之间的差值,不是,A错误;
B.过渡态物质的总能量与反应物总能量的差值为活化能,活化能越小反应越快,活化能越大反应越慢,决定总反应速率的是慢反应;该反应的速控步为,B正确;
C.过渡态物质的总能量与反应物总能量的差值为活化能,由图可知,逆反应速控步的活化能为,C正确;
D.由图可知,反应为放热反应,则反应物的键能之和小于生成物的键能之和,D正确;
故选A。
3.B
A.题中所给该总反应的化学方程式为,其中反应前后电荷不守恒,故A错误;
B.①~⑦过程中只有两个步骤中有生成,分别是步骤②:COOH*+2H+→HCO*+H2O,步骤⑤:H3CO*+2H+→CH3*+H2O,故B正确;
C.该历程存在7个步骤,基元反应不可能有9个,故错误;
D.该过程中步骤②有碳氧双键的形成,但过程中无非极性键的断裂,故D错误;
故答案为:B。
4.AC
A.方式①的活化能低,说明其反应速率快,即甲醇裂解过程主要历经的方式应为①,故A错误;
B.由题中信息可知,CH3OH脱氢反应的第一步历程为分子中一个共价键的断裂过程,为吸热过程,大于0,故B正确;
C.由图可知,该历程中最小能垒(活化能)为(116.1-62.5)kJ·mol-1=53.6 kJ·mol-1,故C错误;
D.由图可知,焓变最小即放出热量最多的基元反应,为,反应物的能量高于生成物的能量,且差别最大,是放热最多的步骤,故D正确;
故选AC。
5.C
A.能发生有效碰撞的就一定是活化分子,因为根据碰撞理论,只有活化分子才能发生有效碰撞,A错误;
B.活化分子之间发生的碰撞不一定是有效碰撞,B错误;
C.增大压强使容器容积减小,单位体积内活化分子数目增多,有效碰撞增加,化学反应速率加快,C正确;
D.升高温度不能降低反应的活化能;使用催化剂可降低反应的活化能,使得活化分子百分数增大,加快化学反应速率,D错误;
故选C。
6.A
A.根据图中反应历程可知,途径I的最大能垒为-85.87kJmol-1-(-184.28 kJmol-1)=98.41 kJmol-1,A项错误;
B.根据图示可知,的反应热为-77.18 kJmol-1,为放热反应,B项正确;
C.整体活化能越低,催化效果越好,依图示可知,途径Ⅱ比途径Ⅰ的催化效果好,C项正确;
D.催化剂只能改变反应途径,不能改变反应的焓变,D项正确;
答案选A。
7.D
A.乙烯分子中四个碳氢键为极性键,故0.5mol乙烯含有极性键,A正确;
B.现代方法是理想的绿色化学工艺,原子利用率100%,B正确;
C.为离子化合物,电子式为,C正确;
D.Ag做催化剂,改变反应历程,降低活化能,D错误。
故选D。
8.A
A.催化剂改变反应历程,降低活化能,提高活化百分数,A正确;
B.由图可知,Cl是反应的催化剂,催化剂改变反应速率,但不能提高反应物的反应率,B错误;
C.催化剂改变反应速率,但不能提高反应物的转化率,C错误;
D.反应物总能量大于生成物的总能量,总反应是放热反应,升高温度正逆反应速率均会升高,D错误;
故选A。
9.D
A.CO2合成甲醇的反应中,寻找高效催化剂可以改变反应历程,降低反应的活化能,但是不改变焓变,故Q2的大小不变,A错误;
B.反应为放热反应,则破坏反应物化学键吸收的能量小于形成产物化学键释放的能量,B错误;
C.过渡态物质的总能量与反应物总能量的差值为活化能,即图中峰值越大则活化能越大,峰值越小则活化能越小,由图可知,CO2合成甲醇的反应中正反应活化能比逆反应的活化能小Q2kJ,C错误;
D.淀粉为高分子含碳化合物,则CO2合成淀粉的过程有碳碳键形成,D正确;
故选D。
10.A
A.KI是该反应的催化剂,能降低反应的活化能,但不能改变反应的始态和终态,即不能改变总反应的焓变,不改变总反应的能量变化,故A错误;
B.由图可知,图象①的后半段为,该反应的反应物的总能量大于生成物的总能量,则为放热反应,故B正确;
C.KI改变该反应的历程,能降低反应的活化能,增大活化分子数和百分数,有效碰撞几率增大,反应速率加快,故C正确;
D.KI是H2O2+I-=H2O+IO-的反应物,是H2O2+IO-=H2O+O2↑+I-的生成物,总反应为2H2O2=H2O+O2↑,所以KI在反应中起催化剂的作用,故D正确。
故选A。
11.C
A.在热化学反应方程式中,各物质的聚集状态应该标出,N2+3H2=2NH3△H=﹣92kJ/mol未标明物质聚集状态,故A错误;
B.加入催化剂,降低活化能,b为加入催化剂的曲线,故B错误;
C.升高温度,使分子的能量增大,活化分子的百分含量增大,数目增多,故C正确;
D.催化剂不影响化学平衡,不能改变转化率,故D错误。故选:C。
12.A
根据图示,Fe与N2反应生成FexN,再与H2反应生成FexNH,再与H2反应生成FexNH2,再与H2反应生成FexNH3,FexNH3分解生成Fe和NH3,铁作为催化剂进行循环。
A.根据分析,反应过程中Fe参加了反应,化合价发生了变化,故A错误;
B.Fe作为催化剂可以降低反应的能耗,活化能,故B正确;
C.根据分析,FexNH3分解生成Fe和NH3,所以物质A是NH3,故C正确;
D.该过程产物只有NH3,所以原子利用率达到了100%,故D正确;
答案选A。
13.D
A.B的总能量高于A的总能量, AB的反应为吸热反应,ΔH=+(E1-E2)kJ/mol,故A错误;
B.物质的能量越低越稳定,三种化合物中,C的能量最低,最稳定,故B错误;
C.B的总能量大于C的总能量,则CB 是吸热反应,故C错误;
D.加入合适的催化剂,能降低反应的活化能,反应速率加快,故D正确;
故答案选D。
14.B
A.催化剂可降低反应的活化能,由图可知,曲线II的活化能较低,可以表示催化剂降低了反应的活化能,故A正确;
B.只有发生化学反应的碰撞才是有效碰撞,由图乙可知碰撞后没有生成新分子,即没有发生化学反应,HI分子没有发生有效碰撞,故B错误;
C.酸和碱反应不需要外界做功的条件下就能发生,说明它们已经处于活跃状态,因此活化能很小,故C正确;
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加,故D正确;
答案选B。
15.D
A.由图中信息可知,反应物的总能量大于生成物的总能量,A错误;
B.反应ii→iii的活化能为0.85eV,反应i→ii的活化能为1.35eV,所以活化能:反应ii→iii<反应i→ii,B错误;
C.反应物的总能量大于生成物的总能量,该反应为放热反应,升高温度,平衡逆向移动,反应物的平衡转化率减小,C错误;
D.使用催化剂即可提高活化分子百分数,又可提高活化分子数目,D正确;
故选D。
16.63.5
由图可知,该反应为:i→ii→iii,共2步反应,活化能越大,反应速率越慢,则虚线框内化学反应速率最慢的一步为i变为过渡态1,活化能最大,值为(86.6-23.1)kJ/mol=63.5 kJ/mol。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
