3.3.3 盐类水解的应用 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册
文档属性
| 名称 | 3.3.3 盐类水解的应用 同步巩固练 2024-2025学年化学人教版(2019) 选择性必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 489.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-27 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
3.3.3 盐类水解的应用 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
1.下列有关化学用语表示正确的是
A.电离:
B.硫酸氢钠熔融状态下发生电离:
C.泡沫灭火器原理:
D.水解:
2.化学与生活密切相关,下列叙述错误的是
A.草木灰与铵态氮肥不能混合施用
B.硫酸铝可除去水体中的悬浮杂质并起到杀菌消毒的作用
C.用热的碳酸钠溶液除油污效果更好
D.SnO2可用作涂料和抛光剂等,在实验室中用SnCl4的水解反应制取
3.下列关于盐类水解的说法错误的是
A.在NH4Cl溶液中加入稀盐酸能抑制水解
B.常温下,醋酸分子不可能存在于pH>7的碱性溶液中
C.实验室配制FeCl3溶液时,常将FeCl3晶体溶于较浓的盐酸中,再加水稀释到所需浓度
D.滴有酚酞的CH3COONa溶液加热,溶液颜色会变深
4.下列说法正确的是
A.由溶液制备无水固体,可以将溶液直接蒸干
B.溶液和溶液加热、蒸干、灼烧,所得固体成分相同
C.配制氯化铁溶液时,可将氯化铁溶解在较浓的盐酸中再加水稀释
D.溶液可以存放在玻璃试剂瓶中
5.某火电厂的粉煤灰的主要成分为、、、、、等。研究小组对其进行综合处理的流程:,。已知:“酸浸”后钛主要以形式存在,强电解质在溶液中仅能电离和一种阳离子,该离子会水解,下列说法正确的是
A.滤渣1为
B.加入铁粉的主要目的是为了消耗过量硫酸
C.为使滤渣2沉淀完全,需“调”最小为4
D.溶液制备过程中需要通入的气流
6.下列关于盐类水解反应的应用说法,不正确的是
A.实验室盛放溶液的试剂瓶用磨口玻璃塞
B.实验室配制溶液时,常滴加少量的NaOH溶液
C.用小苏打溶液与溶液作泡沫灭火剂
D.常用可溶性的铝盐、铁盐作净水剂
7.盐在生产、生活中有广泛的应用。下列盐的性质与用途对应关系错误的是
A.Na2CO3能与油脂反应,可用于除去油污
B.TiCl4水解程度很大,可用于制备TiO2
C.NH4Cl溶液呈酸性,可用作焊接金属的除锈剂
D.明矾溶于水形成Al(OH)3胶体,可用于净水
8.下列四种肥料可以与草木灰(主要成分是K2CO3)混合施用的是
A.硫酸铵 B.氯化铵 C.硝酸钾 D.硝酸铵
9.化学与生活密切相关,下列说法错误的是
A.热碱液清洗厨房油污:油脂可碱性水解
B.柠檬酸去除水垢:柠檬酸酸性强于碳酸
C.苯甲酸钠作食品防腐剂:其容易被氧化
D.聚乙炔高分子制造航空材料:其具有一定的导电性能
10.工业原料氯化铵中含杂质氯化铁,可将含杂质的氯化铵溶解后,适量加入一种试剂,过滤除杂。这种试剂是
A. B. C. D.
11.下列生产生活中,没有运用相对应的化学反应原理的是
A.除去CuCl2溶液中少量的FeCl3,用CuO固体促进Fe3+水解生成氢氧化铁沉淀而除去
B.将未生锈的铁钉放入试管中,加入少量稀硫酸,可以验证铁发生了吸氧腐蚀
C.配制一定浓度的FeSO4溶液时,为了防止亚铁离子的水解需要将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度
D.氯化铵溶液水解显酸性,可以用氯化铵溶液清洗钢铁表面的锈迹
12.人们利用盐类水解的原理设计出了泡沫灭火器。泡沫灭火器中装有浓溶液和浓溶液,二者混合时会发生剧烈反应,产生气体和沉淀。下列说法错误的是
A.可利用如图所示装置来获得固体
B.溶液中:
C.二者混合时发生反应的离子方程式为
D.不能用浓溶液代替泡沫灭火器中的浓溶液
13.下列实验事实不能用勒夏特列原理来解释的是
A.用与稀硫酸制氢气时,为加快反应速率,将锌片换成锌粉
B.向溶液中加入铁粉,溶液颜色变浅
C.配制溶液时将晶体溶在浓盐酸中再加水稀释到所需浓度
D.用溶液清洗油污时,加热可以增强去污效果
14.下列说法不正确的是
A.向溶液中加入稀硫酸,溶液颜色由橙色变为黄色
B.中和滴定实验中,锥形瓶用水洗涤后,不能用待测液润洗
C.中和反应反应热测定实验中,一组完整实验数据需要测温度3次
D.配制溶液时,应将固体溶于较浓的盐酸中,再加水稀释到所需浓度
15.利用下列装置和试剂进行实验,所用仪器或相关操作合理的是
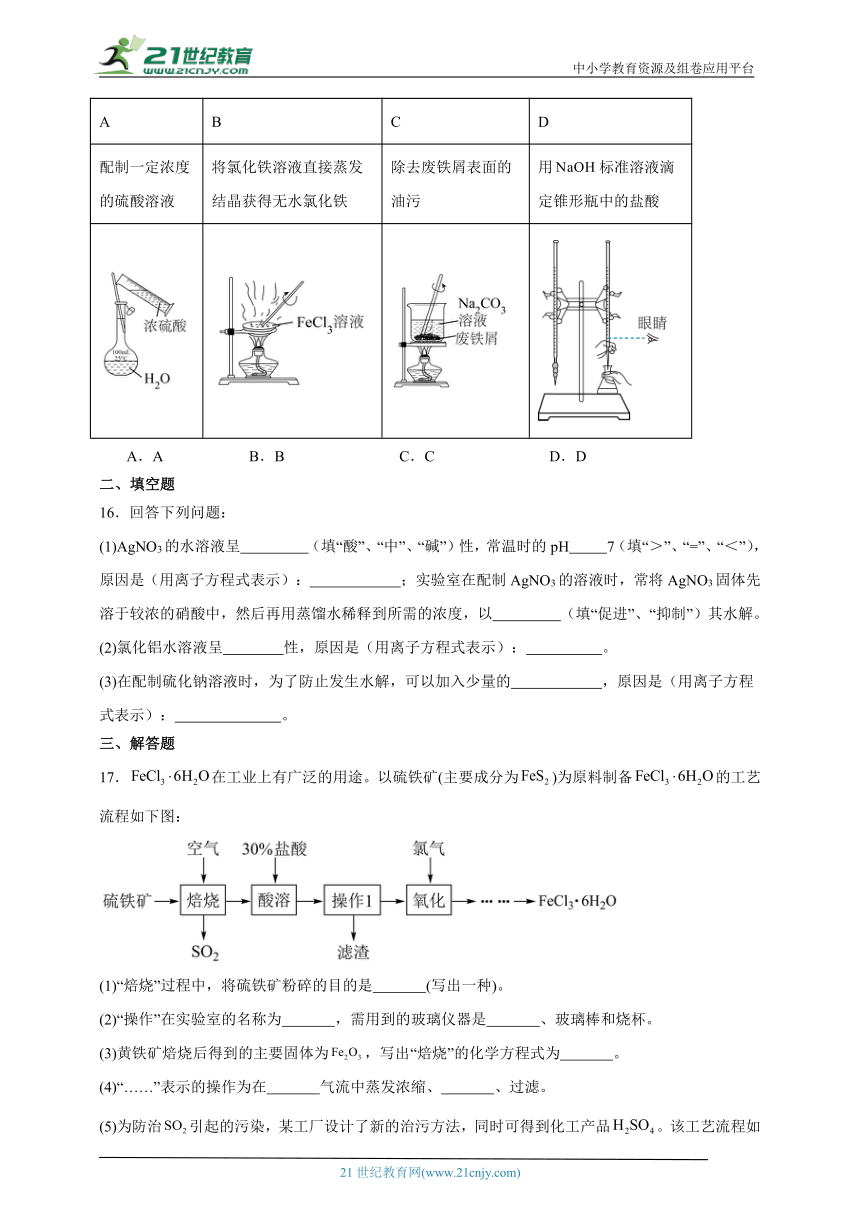
A B C D
配制一定浓度的硫酸溶液 将氯化铁溶液直接蒸发结晶获得无水氯化铁 除去废铁屑表面的油污 用标准溶液滴定锥形瓶中的盐酸
A.A B.B C.C D.D
二、填空题
16.回答下列问题:
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 ,原因是(用离子方程式表示): 。
三、解答题
17.在工业上有广泛的用途。以硫铁矿(主要成分为)为原料制备的工艺流程如下图:
(1)“焙烧”过程中,将硫铁矿粉碎的目的是 (写出一种)。
(2)“操作”在实验室的名称为 ,需用到的玻璃仪器是 、玻璃棒和烧杯。
(3)黄铁矿焙烧后得到的主要固体为,写出“焙烧”的化学方程式为 。
(4)“……”表示的操作为在 气流中蒸发浓缩、 、过滤。
(5)为防治引起的污染,某工厂设计了新的治污方法,同时可得到化工产品。该工艺流程如图所示,过程中起催化作用的物质是 ,生成化工产品的化学方程式为 。
(6)利用焙烧硫铁矿产生的生产硫酸。用含的硫铁矿,生产过程中硫损失,则可得的硫酸 。
参考答案
1.C
A.H2S电离:H2S H++HS ,A错误;
B.硫酸氢钠熔融状态下发生电离:NaHSO4=Na++ ,B错误;
C.泡沫灭火器使用时,其中铝离子和碳酸氢根发生双水解,生成二氧化碳,从而灭火,原理为:Al3++3=Al(OH)3↓+3CO2↑,C正确;
D.HS 水解:HS +H2O H2S+OH-,D错误;
故选C。
2.B
A.草木灰中的碳酸根与铵态氮肥中的铵根可以发生双促水解反应,降低了氮肥的利用率,与盐的水解有关,A正确;
B.硫酸铝电离的铝离子水解生成氢氧化铝胶体,吸附水中的悬浮物形成沉淀,达到净水目的,但硫酸铝没有强氧化性,不能杀菌消毒,B错误;
C.加热促进碳酸钠的水解,溶液碱性增强,有利于酯类的水解,C正确;
D.在实验室中用SnCl4的水解反应制取的SnO2可用作涂料和抛光剂等,D正确;
故选B。
3.B
A.水解生成一水合氨和氢离子,加入盐酸时溶液中氢离子浓度增大,能抑制水解,A正确;
B.醋酸根离子水解生成醋酸和氢氧根离子,导致CH3COONa溶液呈碱性,溶液中存在醋酸分子,即醋酸分子可能存在于pH>7的碱性溶液中,B错误;
C.FeCl3是强酸弱碱盐,易发生水解生成氢氧化铁胶体,配制FeCl3溶液时将FeCl3晶体溶于较浓的盐酸中,可防止其水解,再加水稀释到所需浓度,C正确;
D.水解反应吸热,升高温度能促进水解,则滴有酚酞的CH3COONa溶液加热时,溶液的碱性增强,溶液颜色会变深,D正确;
故答案为:B。
4.C
A.加热会促进镁离子的水解,蒸干氯化镁溶液只能得到氢氧化镁不能得到氯化镁,故A错误;
B.氯化铝溶液蒸干、灼烧得到氧化铝,硫酸铝溶液蒸干得到硫酸铝固体,所得固体成分不相同,故B错误;
C.用浓盐酸溶解氯化铁可以抑制铁离子的水解,稀释后可以得到所需浓度的氯化铁溶液,故C正确;
D.氟离子水解得到HF,能腐蚀玻璃,因此氟化铵溶液不能用玻璃瓶盛放,故D错误;
故答案为:C。
5.D
结合流程图及题目中信息可知,粉煤灰酸浸后、、、分别和酸反应生成对应的硫酸盐,和硫酸反应生成,不反应,滤渣1为,加入铁粉,将溶液中Fe3+还原为Fe2+,结晶得,滤液中还含有TiO2+、Fe2+、Al3+、Mg2+等,TiO2+水解得到TiO2·xH O,灼烧可得到TiO2,滤液2加入双氧水,可氧化 Fe2+生成Fe3+,调节pH,可生成Al(OH) 3、Fe(OH)3沉淀,滤液3含有Mg2+,经过一系列操作,最后结晶得到 MgCl2·6H2O,以此解答该题。
A.和硫酸不反应,滤渣1为,A错误;
B.加入铁粉,将溶液中Fe3+还原为Fe2+,结晶得,B错误;
C.滤渣2为Al(OH) 3,Fe(OH)3,由Ksp[Al(OH)3]=,Ksp[Fe(OH)3]= ,可知使铝离子完全沉淀需要调节的pH较大,当pH=4时,,mol/L,大于 mol/L,此时Al3+没有沉淀完全,故C错误;
D.溶液制备过程中需要在气流中蒸发浓缩,以避免氯化镁水解生成氢氧化镁,造成产品不纯,D正确;
故答案为D
6.A
A.溶液中发生反应,生成的与玻璃塞中二氧化硅反应生成具有粘性的硅酸钠,长期易打不开瓶塞,所以盛放溶液的试剂瓶不能用磨口玻璃塞,A错误;
B.硫化钠溶液呈碱性:,加入氢氧化钠溶液后,增大,水解平衡向逆反应方向移动,抑制的水解,B正确;
C.小苏打是,与两种溶液混合后发生双水解反应,生成氢氧化铝胶体和二氧化碳气体,能够灭火,可以用作泡沫灭火剂,C正确;
D.水解生成胶体、水解生成胶体可以使水中的悬浮颗粒聚集成较大的颗粒而沉降,从而达到净,D正确;
故选A。
7.A
A.水解显碱性,油脂在碱性条件下发生水解,不是直接与油脂反应,A错误;
B.水解可制备, ,B正确;
C.水解溶液显酸性,可用作焊接金属的除锈剂,C正确;
D.明矾溶于水形成 胶体,胶体具有吸附性,可用于净水,D正确;
故选A。
8.C
A.硫酸铵属于铵态氮肥,水解显酸性,不能和草木灰混合施用,故A错误;
B.氯化铵属于铵态氮肥,水解显酸性,不能和草木灰混合施用,故B错误;
C.硝酸钾不属于铵态氮肥,溶液呈中性,能和草木灰混合施用,故C正确;
D.硝酸铵属于铵态氮肥,水解显酸性,不能和草木灰混合施用,故D错误;
故选C。
9.C
A.碱性条件下油脂水解生成高级脂肪酸盐和甘油,所以用碱液清洗厨房油污,故A正确;
B.强酸能和弱酸盐反应生成弱酸,柠檬酸的酸性大于碳酸,柠檬酸和碳酸钙反应而除去水垢,故B正确;
C.苯甲酸钠作食品防腐剂,是因为它能够抑制霉菌、酵母菌、真菌和细菌的生长,苯甲酸钠不易被氧化,故C错误;
D.具有单双键交替的结构的有机物能导电,聚乙炔高分子材料能像金属一样具有导电性,故D正确;
10.A
A.加入一水合氨会生成Fe(OH)3沉淀使铁离子减少并生成氯化铵,不会引入新杂质,过滤得到氯化铵溶液,故A正确;
B.加入NaOH易生成氢氧化铁沉淀和一水合氨,且新的杂质NaCl,故B错误;
C.溶解于氯化铵和氯化铁水解生成的盐酸中,引入亚铁离子杂质,故C错误;
D.的加入不能除去氯化铁杂质且会引入硝酸铵等杂质,故D错误;
答案选A。
11.B
A.FeCl3中的铁离子易水解生成氢氧化铁而除去,加入氧化铜可调节溶液pH,促进铁离子的水解,A不合题意;
B.用稀硫酸浸没,发生析氢腐蚀,不能验证吸氧腐蚀,B符合题意;
C.硫酸亚铁水解显酸性,在溶液中加稀硫酸可以抑制亚铁离子的水解,所以配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度,C不合题意;
D.饱和氯化铵溶液中铵根离子水解显酸性,能溶解金属氧化物,所以用饱和氯化铵溶液可以清洗金属表面的锈迹,D不合题意;
故答案为:B。
12.B
A.可以用蒸发浓溶液获得固体,A正确;
B.溶液中,电荷守恒,溶液显碱性,,则,B错误;
C.二者混合时发生反应的离子方程式为,C正确;
D.与不能反应,故不能代替泡沫灭火器中的浓溶液,D正确;
故选B。
13.A
A.用与稀硫酸制氢气时,为加快反应速率,将锌片换成锌粉,增大接触面积使得反应更快速,不是可逆反应,不能用勒夏特列原理来解释,故A符合题意;
B.向溶液中加入铁粉,铁粉和三价铁离子反应生成亚铁离子,溶液中铁离子浓度减少,使得反应逆向进行,溶液颜色变浅,能用勒夏特列原理来解释,故B不符合题意;
C.配制溶液时将晶体溶在浓盐酸中,溶液中氢离子浓度增加,使得反应逆向进行,再加水稀释到所需浓度,能用勒夏特列原理来解释,故C不符合题意;
D.用溶液清洗油污时,加热可以促进碳酸根的水解,氢氧根浓度增大,碱性可以加快油污的水解,可以增强去污效果,能用勒夏特列原理来解释,故D不符合题意;
故选:A。
14.A
A.氢离子浓度增大,平衡Cr2(橙色)+H2O 2H++2Cr (黄色)向左移动,溶液颜色由黄色变为橙色,故A错误;
B.在酸碱中和滴定实验中,若锥形瓶用蒸馏水洗涤后再用待测液润洗,消耗更多的标准液,导致待测液的浓度测量结果偏大,因此锥形瓶不能用待测液润洗,故B正确;
C.中和反应反应热测定实验中,一组完整实验数据需要测温度三次:第一次测酸(或碱)溶液温度,第二次测碱(或酸)溶液的温度,第三次测混合溶液的温度以得到最高温度,故C正确;
D.Fe3+水解的离子方程式为Fe3++3H2O Fe(OH)3+3H+,配制溶液时,将FeCl3固体溶于较浓盐酸中抑制FeCl3水解,然后再用水稀释到所需的浓度,故D正确;
答案选A。
15.C
A.配制一定浓度硫酸溶液时不能将浓硫酸直接注入容量瓶中,应在烧杯中稀释,冷却后用玻璃棒引流转移至容量瓶,A错误;
B.氯化铁溶液直接蒸发会完全水解而转化为氢氧化铁,B错误;
C.碳酸钠因加热条件下水解使溶液显碱性,使油污在碱性条件下转化为易溶于水的物质,故可以用热的纯碱溶液除去废铁屑表面的油污,C正确;
D.用标准溶液滴定锥形瓶中的盐酸时,眼睛应注视锥形瓶内溶液颜色变化,且氢氧化钠溶液应用碱式滴定管,D错误;
故选C。
16.(1) 酸 < Ag++H2OAgOH+H+ 抑制
(2) 酸 Al3++3H2OAl(OH)3+3H+
(3) NaOH S2-+H2OHS-+OH-
(1)硝酸银为强酸弱碱盐,银离子水解,其溶液呈酸性,常温下硝酸银溶液pH<7,水解的离子方程式为Ag++H2OAgOH+H+,所以为了抑制其水解,配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度;
(2)氯化铝水溶液中铝离子水解溶液显酸性,其水解的离子方程式为Al3++3H2OAl(OH)3+3H+;
(3)硫化钠在溶液中硫离子水解生成NaOH,所以为了防止发生水解,可以加入少量的NaOH,硫离子主要是以第一步水解为主,水解的离子方程式为S2-+H2OHS-+OH-。
17.(1)增大接触面积,加快化学反应速率(或提高原料的利用率)
(2) 过滤 漏斗
(3)
(4) HCl 冷却结晶
(5)
(6)450
以硫铁矿(主要成分为FeS2)为原料在空气氛围下焙烧生成二氧化硫和氧化铁,加入盐酸生产氯化铁和氯化亚铁,根据有滤渣可知操作为过滤,通入氯气将二价铁离子氧化为三价,再通过系列操作制备FeCl3·6H2O,据此分析解题。
(1)“焙烧”过程中,将硫铁矿粉碎的目的是:增大接触面积,加快化学反应速率(或提高原料的利用率);
(2)由于有滤渣,“操作”在实验室的名称为过滤;需用到的玻璃仪器是漏斗、玻璃棒和烧杯;
(3)黄铁矿焙烧后得到的主要固体为,“焙烧”的化学方程式为:;
(4)“……”表示的操作为在氯化氢气流中蒸发浓缩抑制氯化铁水解,然后冷却结晶、过滤;
(5)硫酸铁与二氧化硫反应生成硫酸与硫酸亚铁,硫酸亚铁与氧气反应生成硫酸铁,过程中起催化作用的物质是Fe2(SO4)3,生成化工产品H2SO4的化学方程式为:;
(6)用1000kg含FeS260%的硫铁矿,生产过程中硫损失8%,S的质量为:(500kg×60%×)×90%=160kg,设可得98%的硫酸xkg,,x=450kg。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
3.3.3 盐类水解的应用 同步巩固练
2024-2025学年化学人教版(2019) 必修第一册
一、单选题
1.下列有关化学用语表示正确的是
A.电离:
B.硫酸氢钠熔融状态下发生电离:
C.泡沫灭火器原理:
D.水解:
2.化学与生活密切相关,下列叙述错误的是
A.草木灰与铵态氮肥不能混合施用
B.硫酸铝可除去水体中的悬浮杂质并起到杀菌消毒的作用
C.用热的碳酸钠溶液除油污效果更好
D.SnO2可用作涂料和抛光剂等,在实验室中用SnCl4的水解反应制取
3.下列关于盐类水解的说法错误的是
A.在NH4Cl溶液中加入稀盐酸能抑制水解
B.常温下,醋酸分子不可能存在于pH>7的碱性溶液中
C.实验室配制FeCl3溶液时,常将FeCl3晶体溶于较浓的盐酸中,再加水稀释到所需浓度
D.滴有酚酞的CH3COONa溶液加热,溶液颜色会变深
4.下列说法正确的是
A.由溶液制备无水固体,可以将溶液直接蒸干
B.溶液和溶液加热、蒸干、灼烧,所得固体成分相同
C.配制氯化铁溶液时,可将氯化铁溶解在较浓的盐酸中再加水稀释
D.溶液可以存放在玻璃试剂瓶中
5.某火电厂的粉煤灰的主要成分为、、、、、等。研究小组对其进行综合处理的流程:,。已知:“酸浸”后钛主要以形式存在,强电解质在溶液中仅能电离和一种阳离子,该离子会水解,下列说法正确的是
A.滤渣1为
B.加入铁粉的主要目的是为了消耗过量硫酸
C.为使滤渣2沉淀完全,需“调”最小为4
D.溶液制备过程中需要通入的气流
6.下列关于盐类水解反应的应用说法,不正确的是
A.实验室盛放溶液的试剂瓶用磨口玻璃塞
B.实验室配制溶液时,常滴加少量的NaOH溶液
C.用小苏打溶液与溶液作泡沫灭火剂
D.常用可溶性的铝盐、铁盐作净水剂
7.盐在生产、生活中有广泛的应用。下列盐的性质与用途对应关系错误的是
A.Na2CO3能与油脂反应,可用于除去油污
B.TiCl4水解程度很大,可用于制备TiO2
C.NH4Cl溶液呈酸性,可用作焊接金属的除锈剂
D.明矾溶于水形成Al(OH)3胶体,可用于净水
8.下列四种肥料可以与草木灰(主要成分是K2CO3)混合施用的是
A.硫酸铵 B.氯化铵 C.硝酸钾 D.硝酸铵
9.化学与生活密切相关,下列说法错误的是
A.热碱液清洗厨房油污:油脂可碱性水解
B.柠檬酸去除水垢:柠檬酸酸性强于碳酸
C.苯甲酸钠作食品防腐剂:其容易被氧化
D.聚乙炔高分子制造航空材料:其具有一定的导电性能
10.工业原料氯化铵中含杂质氯化铁,可将含杂质的氯化铵溶解后,适量加入一种试剂,过滤除杂。这种试剂是
A. B. C. D.
11.下列生产生活中,没有运用相对应的化学反应原理的是
A.除去CuCl2溶液中少量的FeCl3,用CuO固体促进Fe3+水解生成氢氧化铁沉淀而除去
B.将未生锈的铁钉放入试管中,加入少量稀硫酸,可以验证铁发生了吸氧腐蚀
C.配制一定浓度的FeSO4溶液时,为了防止亚铁离子的水解需要将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度
D.氯化铵溶液水解显酸性,可以用氯化铵溶液清洗钢铁表面的锈迹
12.人们利用盐类水解的原理设计出了泡沫灭火器。泡沫灭火器中装有浓溶液和浓溶液,二者混合时会发生剧烈反应,产生气体和沉淀。下列说法错误的是
A.可利用如图所示装置来获得固体
B.溶液中:
C.二者混合时发生反应的离子方程式为
D.不能用浓溶液代替泡沫灭火器中的浓溶液
13.下列实验事实不能用勒夏特列原理来解释的是
A.用与稀硫酸制氢气时,为加快反应速率,将锌片换成锌粉
B.向溶液中加入铁粉,溶液颜色变浅
C.配制溶液时将晶体溶在浓盐酸中再加水稀释到所需浓度
D.用溶液清洗油污时,加热可以增强去污效果
14.下列说法不正确的是
A.向溶液中加入稀硫酸,溶液颜色由橙色变为黄色
B.中和滴定实验中,锥形瓶用水洗涤后,不能用待测液润洗
C.中和反应反应热测定实验中,一组完整实验数据需要测温度3次
D.配制溶液时,应将固体溶于较浓的盐酸中,再加水稀释到所需浓度
15.利用下列装置和试剂进行实验,所用仪器或相关操作合理的是
A B C D
配制一定浓度的硫酸溶液 将氯化铁溶液直接蒸发结晶获得无水氯化铁 除去废铁屑表面的油污 用标准溶液滴定锥形瓶中的盐酸
A.A B.B C.C D.D
二、填空题
16.回答下列问题:
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 ,原因是(用离子方程式表示): 。
三、解答题
17.在工业上有广泛的用途。以硫铁矿(主要成分为)为原料制备的工艺流程如下图:
(1)“焙烧”过程中,将硫铁矿粉碎的目的是 (写出一种)。
(2)“操作”在实验室的名称为 ,需用到的玻璃仪器是 、玻璃棒和烧杯。
(3)黄铁矿焙烧后得到的主要固体为,写出“焙烧”的化学方程式为 。
(4)“……”表示的操作为在 气流中蒸发浓缩、 、过滤。
(5)为防治引起的污染,某工厂设计了新的治污方法,同时可得到化工产品。该工艺流程如图所示,过程中起催化作用的物质是 ,生成化工产品的化学方程式为 。
(6)利用焙烧硫铁矿产生的生产硫酸。用含的硫铁矿,生产过程中硫损失,则可得的硫酸 。
参考答案
1.C
A.H2S电离:H2S H++HS ,A错误;
B.硫酸氢钠熔融状态下发生电离:NaHSO4=Na++ ,B错误;
C.泡沫灭火器使用时,其中铝离子和碳酸氢根发生双水解,生成二氧化碳,从而灭火,原理为:Al3++3=Al(OH)3↓+3CO2↑,C正确;
D.HS 水解:HS +H2O H2S+OH-,D错误;
故选C。
2.B
A.草木灰中的碳酸根与铵态氮肥中的铵根可以发生双促水解反应,降低了氮肥的利用率,与盐的水解有关,A正确;
B.硫酸铝电离的铝离子水解生成氢氧化铝胶体,吸附水中的悬浮物形成沉淀,达到净水目的,但硫酸铝没有强氧化性,不能杀菌消毒,B错误;
C.加热促进碳酸钠的水解,溶液碱性增强,有利于酯类的水解,C正确;
D.在实验室中用SnCl4的水解反应制取的SnO2可用作涂料和抛光剂等,D正确;
故选B。
3.B
A.水解生成一水合氨和氢离子,加入盐酸时溶液中氢离子浓度增大,能抑制水解,A正确;
B.醋酸根离子水解生成醋酸和氢氧根离子,导致CH3COONa溶液呈碱性,溶液中存在醋酸分子,即醋酸分子可能存在于pH>7的碱性溶液中,B错误;
C.FeCl3是强酸弱碱盐,易发生水解生成氢氧化铁胶体,配制FeCl3溶液时将FeCl3晶体溶于较浓的盐酸中,可防止其水解,再加水稀释到所需浓度,C正确;
D.水解反应吸热,升高温度能促进水解,则滴有酚酞的CH3COONa溶液加热时,溶液的碱性增强,溶液颜色会变深,D正确;
故答案为:B。
4.C
A.加热会促进镁离子的水解,蒸干氯化镁溶液只能得到氢氧化镁不能得到氯化镁,故A错误;
B.氯化铝溶液蒸干、灼烧得到氧化铝,硫酸铝溶液蒸干得到硫酸铝固体,所得固体成分不相同,故B错误;
C.用浓盐酸溶解氯化铁可以抑制铁离子的水解,稀释后可以得到所需浓度的氯化铁溶液,故C正确;
D.氟离子水解得到HF,能腐蚀玻璃,因此氟化铵溶液不能用玻璃瓶盛放,故D错误;
故答案为:C。
5.D
结合流程图及题目中信息可知,粉煤灰酸浸后、、、分别和酸反应生成对应的硫酸盐,和硫酸反应生成,不反应,滤渣1为,加入铁粉,将溶液中Fe3+还原为Fe2+,结晶得,滤液中还含有TiO2+、Fe2+、Al3+、Mg2+等,TiO2+水解得到TiO2·xH O,灼烧可得到TiO2,滤液2加入双氧水,可氧化 Fe2+生成Fe3+,调节pH,可生成Al(OH) 3、Fe(OH)3沉淀,滤液3含有Mg2+,经过一系列操作,最后结晶得到 MgCl2·6H2O,以此解答该题。
A.和硫酸不反应,滤渣1为,A错误;
B.加入铁粉,将溶液中Fe3+还原为Fe2+,结晶得,B错误;
C.滤渣2为Al(OH) 3,Fe(OH)3,由Ksp[Al(OH)3]=,Ksp[Fe(OH)3]= ,可知使铝离子完全沉淀需要调节的pH较大,当pH=4时,,mol/L,大于 mol/L,此时Al3+没有沉淀完全,故C错误;
D.溶液制备过程中需要在气流中蒸发浓缩,以避免氯化镁水解生成氢氧化镁,造成产品不纯,D正确;
故答案为D
6.A
A.溶液中发生反应,生成的与玻璃塞中二氧化硅反应生成具有粘性的硅酸钠,长期易打不开瓶塞,所以盛放溶液的试剂瓶不能用磨口玻璃塞,A错误;
B.硫化钠溶液呈碱性:,加入氢氧化钠溶液后,增大,水解平衡向逆反应方向移动,抑制的水解,B正确;
C.小苏打是,与两种溶液混合后发生双水解反应,生成氢氧化铝胶体和二氧化碳气体,能够灭火,可以用作泡沫灭火剂,C正确;
D.水解生成胶体、水解生成胶体可以使水中的悬浮颗粒聚集成较大的颗粒而沉降,从而达到净,D正确;
故选A。
7.A
A.水解显碱性,油脂在碱性条件下发生水解,不是直接与油脂反应,A错误;
B.水解可制备, ,B正确;
C.水解溶液显酸性,可用作焊接金属的除锈剂,C正确;
D.明矾溶于水形成 胶体,胶体具有吸附性,可用于净水,D正确;
故选A。
8.C
A.硫酸铵属于铵态氮肥,水解显酸性,不能和草木灰混合施用,故A错误;
B.氯化铵属于铵态氮肥,水解显酸性,不能和草木灰混合施用,故B错误;
C.硝酸钾不属于铵态氮肥,溶液呈中性,能和草木灰混合施用,故C正确;
D.硝酸铵属于铵态氮肥,水解显酸性,不能和草木灰混合施用,故D错误;
故选C。
9.C
A.碱性条件下油脂水解生成高级脂肪酸盐和甘油,所以用碱液清洗厨房油污,故A正确;
B.强酸能和弱酸盐反应生成弱酸,柠檬酸的酸性大于碳酸,柠檬酸和碳酸钙反应而除去水垢,故B正确;
C.苯甲酸钠作食品防腐剂,是因为它能够抑制霉菌、酵母菌、真菌和细菌的生长,苯甲酸钠不易被氧化,故C错误;
D.具有单双键交替的结构的有机物能导电,聚乙炔高分子材料能像金属一样具有导电性,故D正确;
10.A
A.加入一水合氨会生成Fe(OH)3沉淀使铁离子减少并生成氯化铵,不会引入新杂质,过滤得到氯化铵溶液,故A正确;
B.加入NaOH易生成氢氧化铁沉淀和一水合氨,且新的杂质NaCl,故B错误;
C.溶解于氯化铵和氯化铁水解生成的盐酸中,引入亚铁离子杂质,故C错误;
D.的加入不能除去氯化铁杂质且会引入硝酸铵等杂质,故D错误;
答案选A。
11.B
A.FeCl3中的铁离子易水解生成氢氧化铁而除去,加入氧化铜可调节溶液pH,促进铁离子的水解,A不合题意;
B.用稀硫酸浸没,发生析氢腐蚀,不能验证吸氧腐蚀,B符合题意;
C.硫酸亚铁水解显酸性,在溶液中加稀硫酸可以抑制亚铁离子的水解,所以配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度,C不合题意;
D.饱和氯化铵溶液中铵根离子水解显酸性,能溶解金属氧化物,所以用饱和氯化铵溶液可以清洗金属表面的锈迹,D不合题意;
故答案为:B。
12.B
A.可以用蒸发浓溶液获得固体,A正确;
B.溶液中,电荷守恒,溶液显碱性,,则,B错误;
C.二者混合时发生反应的离子方程式为,C正确;
D.与不能反应,故不能代替泡沫灭火器中的浓溶液,D正确;
故选B。
13.A
A.用与稀硫酸制氢气时,为加快反应速率,将锌片换成锌粉,增大接触面积使得反应更快速,不是可逆反应,不能用勒夏特列原理来解释,故A符合题意;
B.向溶液中加入铁粉,铁粉和三价铁离子反应生成亚铁离子,溶液中铁离子浓度减少,使得反应逆向进行,溶液颜色变浅,能用勒夏特列原理来解释,故B不符合题意;
C.配制溶液时将晶体溶在浓盐酸中,溶液中氢离子浓度增加,使得反应逆向进行,再加水稀释到所需浓度,能用勒夏特列原理来解释,故C不符合题意;
D.用溶液清洗油污时,加热可以促进碳酸根的水解,氢氧根浓度增大,碱性可以加快油污的水解,可以增强去污效果,能用勒夏特列原理来解释,故D不符合题意;
故选:A。
14.A
A.氢离子浓度增大,平衡Cr2(橙色)+H2O 2H++2Cr (黄色)向左移动,溶液颜色由黄色变为橙色,故A错误;
B.在酸碱中和滴定实验中,若锥形瓶用蒸馏水洗涤后再用待测液润洗,消耗更多的标准液,导致待测液的浓度测量结果偏大,因此锥形瓶不能用待测液润洗,故B正确;
C.中和反应反应热测定实验中,一组完整实验数据需要测温度三次:第一次测酸(或碱)溶液温度,第二次测碱(或酸)溶液的温度,第三次测混合溶液的温度以得到最高温度,故C正确;
D.Fe3+水解的离子方程式为Fe3++3H2O Fe(OH)3+3H+,配制溶液时,将FeCl3固体溶于较浓盐酸中抑制FeCl3水解,然后再用水稀释到所需的浓度,故D正确;
答案选A。
15.C
A.配制一定浓度硫酸溶液时不能将浓硫酸直接注入容量瓶中,应在烧杯中稀释,冷却后用玻璃棒引流转移至容量瓶,A错误;
B.氯化铁溶液直接蒸发会完全水解而转化为氢氧化铁,B错误;
C.碳酸钠因加热条件下水解使溶液显碱性,使油污在碱性条件下转化为易溶于水的物质,故可以用热的纯碱溶液除去废铁屑表面的油污,C正确;
D.用标准溶液滴定锥形瓶中的盐酸时,眼睛应注视锥形瓶内溶液颜色变化,且氢氧化钠溶液应用碱式滴定管,D错误;
故选C。
16.(1) 酸 < Ag++H2OAgOH+H+ 抑制
(2) 酸 Al3++3H2OAl(OH)3+3H+
(3) NaOH S2-+H2OHS-+OH-
(1)硝酸银为强酸弱碱盐,银离子水解,其溶液呈酸性,常温下硝酸银溶液pH<7,水解的离子方程式为Ag++H2OAgOH+H+,所以为了抑制其水解,配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度;
(2)氯化铝水溶液中铝离子水解溶液显酸性,其水解的离子方程式为Al3++3H2OAl(OH)3+3H+;
(3)硫化钠在溶液中硫离子水解生成NaOH,所以为了防止发生水解,可以加入少量的NaOH,硫离子主要是以第一步水解为主,水解的离子方程式为S2-+H2OHS-+OH-。
17.(1)增大接触面积,加快化学反应速率(或提高原料的利用率)
(2) 过滤 漏斗
(3)
(4) HCl 冷却结晶
(5)
(6)450
以硫铁矿(主要成分为FeS2)为原料在空气氛围下焙烧生成二氧化硫和氧化铁,加入盐酸生产氯化铁和氯化亚铁,根据有滤渣可知操作为过滤,通入氯气将二价铁离子氧化为三价,再通过系列操作制备FeCl3·6H2O,据此分析解题。
(1)“焙烧”过程中,将硫铁矿粉碎的目的是:增大接触面积,加快化学反应速率(或提高原料的利用率);
(2)由于有滤渣,“操作”在实验室的名称为过滤;需用到的玻璃仪器是漏斗、玻璃棒和烧杯;
(3)黄铁矿焙烧后得到的主要固体为,“焙烧”的化学方程式为:;
(4)“……”表示的操作为在氯化氢气流中蒸发浓缩抑制氯化铁水解,然后冷却结晶、过滤;
(5)硫酸铁与二氧化硫反应生成硫酸与硫酸亚铁,硫酸亚铁与氧气反应生成硫酸铁,过程中起催化作用的物质是Fe2(SO4)3,生成化工产品H2SO4的化学方程式为:;
(6)用1000kg含FeS260%的硫铁矿,生产过程中硫损失8%,S的质量为:(500kg×60%×)×90%=160kg,设可得98%的硫酸xkg,,x=450kg。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
