2026全国版高考化学一轮基础知识练--第六章 化学键 分子和晶体的结构与性质(含解析)
文档属性
| 名称 | 2026全国版高考化学一轮基础知识练--第六章 化学键 分子和晶体的结构与性质(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-30 18:52:25 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2026全国版高考化学一轮
第六章 化学键 分子和晶体的结构与性质
第1节 化学键
五年高考
1.★(2024黑、吉、辽,2,3分)下列化学用语或表述正确的是( )
A.中子数为1的氦核素He
B.SiO2的晶体类型:分子晶体
C.F2的共价键类型:p-p σ键
D.PCl3的空间结构:平面三角形
2.★(2022天津,4,3分)利用反应2NH3+NaClO N2H4+NaCl+H2O可制备N2H4。下列叙述正确的是( )
A.NH3分子有孤电子对,可作配体
B.NaCl晶体可以导电
C.1个N2H4分子中有4个σ键
D.NaClO和NaCl均为离子化合物,它们所含的化学键类型相同
3.★(2024江苏,7,3分)下列有关反应描述正确的是 ( )
A.CH3CH2OH催化氧化为CH3CHO,CH3CH2OH断裂C—O键
B.氟氯烃破坏臭氧层,氟氯烃产生的氯自由基改变O3分解的历程
C.丁烷催化裂化为乙烷和乙烯,丁烷断裂σ键和π键
D.石墨转化为金刚石,碳原子轨道的杂化类型由sp3转变为sp2
4.★★(2024湖南,2,3分)下列化学用语表述错误的是 ( )
A.NaOH的电子式:
B.异丙基的结构简式:
C.NaCl溶液中的水合离子:
D.Cl2分子中σ键的形成:
三年模拟
5.★(2025届广西南宁二中摸底,2改编)实验室制备少量氮气的反应为NaNO2+NH4Cl NaCl+N2↑+2H2O。下列与该反应有关的化学用语表述错误的是( )
A.N中的σ键数目为4
B.N2的电子式为
C.NaCl的形成过程可表示为
D.H2O的VSEPR模型为
6.★★(2024贵州遵义三模,11改编)配合物种类繁多,新的配合物由于纷繁复杂的有机化合物而层出不穷。叶绿素、血红素和维生素B12都是配合物。其中一种叶绿素的结构如图所示。下列说法错误的是( )
A.叶绿素中Mg元素的化合价为+2
B.Mg的配位数为4
C.叶绿素中元素电负性:O>C>H>Mg
D.叶绿素分子中碳原子采取sp2杂化
第2节 分子结构与性质
五年高考
1.★(2024广西,2,3分)光照时,纳米TiO2能使水产生羟基自由基·OH,可用于处理废水。下列表述正确的是( )
A.基态Ti的价电子排布式:3d2
B.·OH的电子式:
C.H2O的VSEPR模型:
D.O的一种核素:8O
2.★(2024重庆,3,3分)下列各分子既含有sp2杂化的原子又能与H2O形成氢键的是( )
A.CH3CH3 B.CH2CHBr
C.CH3COOH D.CH3CH2NH2
3.★(2024湖北,5,3分)基本概念和理论是化学思维的基石。下列叙述错误的是( )
A.VSEPR理论认为VSEPR模型与分子的空间结构相同
B.元素性质随着原子序数递增而呈周期性变化的规律称为元素周期律
C.泡利原理认为一个原子轨道内最多只能容纳两个自旋相反的电子
D.sp3杂化轨道由1个s轨道和3个p轨道混杂而成
4.★(2024湖北,8,3分)结构决定性质,性质决定用途。下列事实解释错误的是( )
事实 解释
A 甘油是黏稠液体 甘油分子间的氢键较强
B 王水溶解铂 浓盐酸增强了浓硝酸的氧化性
C 冰的密度小于干冰 冰晶体中水分子的空间利用率相对较低
D 石墨能导电 未杂化的p轨道重叠使电子可在整个碳原子平面内运动
5.★★(2024湖南,4,3分)下列有关化学概念或性质的判断错误的是( )
A.CH4分子是正四面体结构,则CH2Cl2没有同分异构体
B.环己烷与苯分子中C—H键的键能相等
C.甲苯的质谱图中,质荷比为92的峰归属于
D.由R4N+与P组成的离子液体常温下呈液态,与其离子的体积较大有关
6.★★(2023湖南,4,3分)下列有关物质结构和性质的说法错误的是 ( )
A.含有手性碳原子的分子叫做手性分子
B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
C.酰胺在酸或碱存在并加热的条件下可发生水解反应
D.冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子
7.★★(2024安徽,8,3分)某催化剂结构简式如图所示。下列说法错误的是( )
A.该物质中Ni为+2价
B.基态原子的第一电离能:Cl>P
C.该物质中C和P均采取sp2杂化
D.基态Ni原子价电子排布式为3d84s2
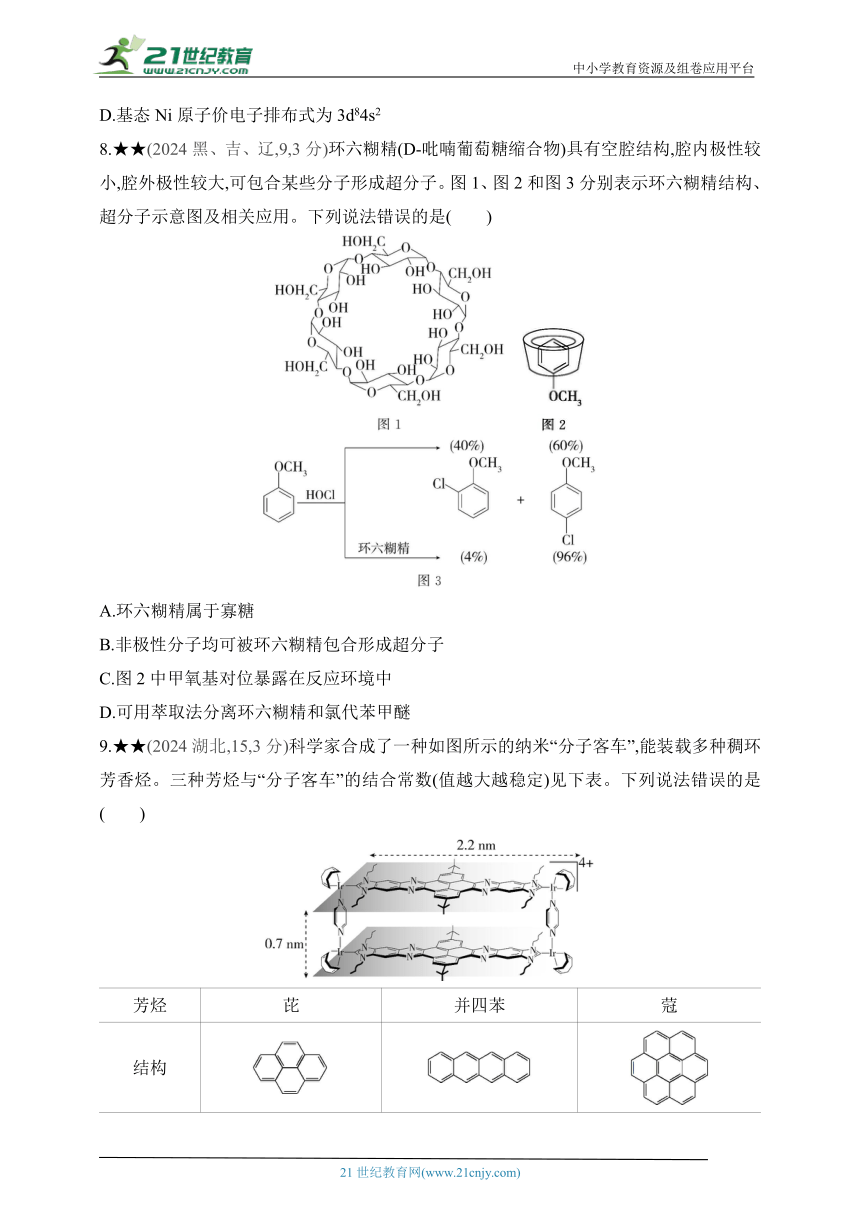
8.★★(2024黑、吉、辽,9,3分)环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。下列说法错误的是( )
A.环六糊精属于寡糖
B.非极性分子均可被环六糊精包合形成超分子
C.图2中甲氧基对位暴露在反应环境中
D.可用萃取法分离环六糊精和氯代苯甲醚
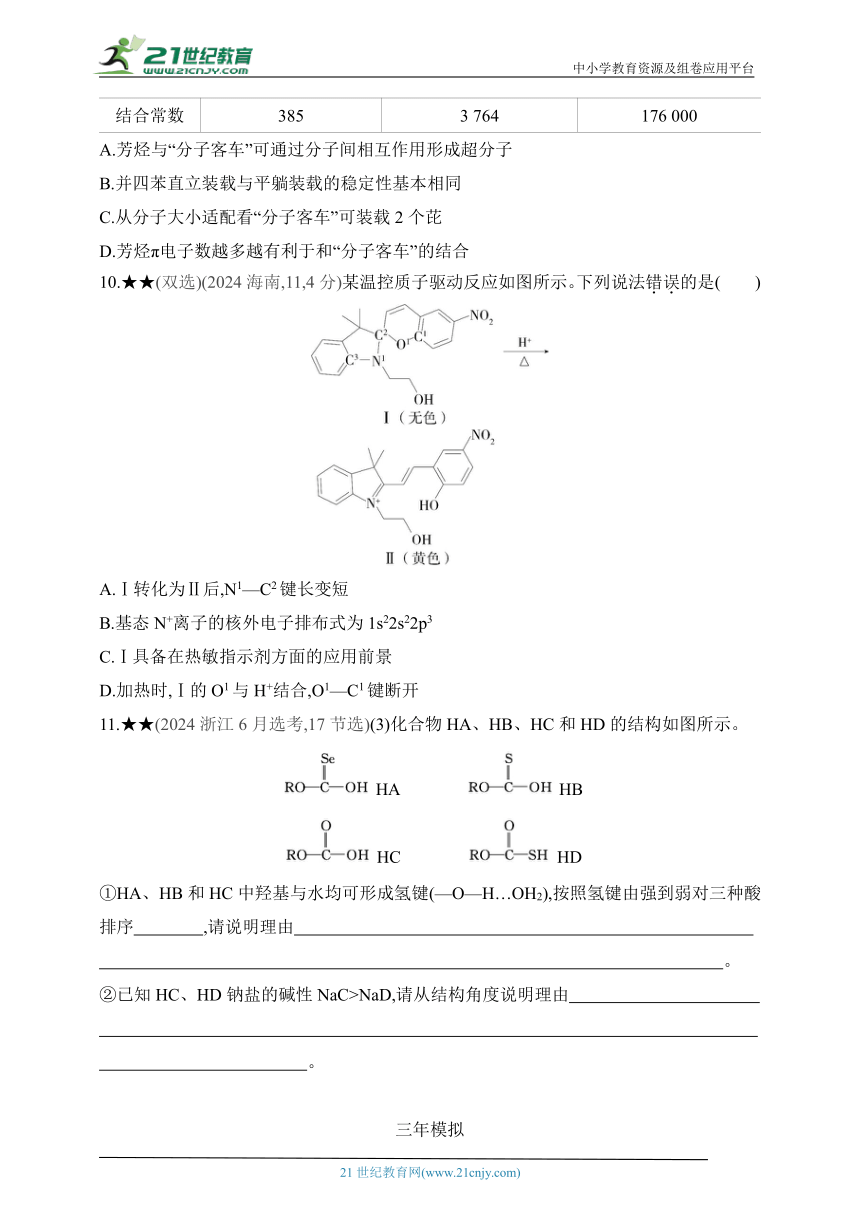
9.★★(2024湖北,15,3分)科学家合成了一种如图所示的纳米“分子客车”,能装载多种稠环芳香烃。三种芳烃与“分子客车”的结合常数(值越大越稳定)见下表。下列说法错误的是( )
芳烃 芘 并四苯 蒄
结构
结合常数 385 3 764 176 000
A.芳烃与“分子客车”可通过分子间相互作用形成超分子
B.并四苯直立装载与平躺装载的稳定性基本相同
C.从分子大小适配看“分子客车”可装载2个芘
D.芳烃π电子数越多越有利于和“分子客车”的结合
10.★★(双选)(2024海南,11,4分)某温控质子驱动反应如图所示。下列说法错误的是( )
A.Ⅰ转化为Ⅱ后,N1—C2键长变短
B.基态N+离子的核外电子排布式为1s22s22p3
C.Ⅰ具备在热敏指示剂方面的应用前景
D.加热时,Ⅰ的O1与H+结合,O1—C1键断开
11.★★(2024浙江6月选考,17节选)(3)化合物HA、HB、HC和HD的结构如图所示。
HA HB
HC HD
①HA、HB和HC中羟基与水均可形成氢键(—O—H…OH2),按照氢键由强到弱对三种酸排序 ,请说明理由
。
②已知HC、HD钠盐的碱性NaC>NaD,请从结构角度说明理由
。
三年模拟
12.★★(2024山东潍坊二模,4)下列分子的空间结构相同的是( )
A.XeO3和NH3 B.COCl2和SOCl2
C.ClF3和BF3 D.CO2和SCl2
13.★★(2024广东湛江二模,8)下列有关物质结构与性质的表述正确的是( )
A.N—H键的极性大于C—H键的极性,NH3分子的极性小于CH4
B.I2易溶于CCl4,可从I2和CCl4都是非极性分子的角度解释
C.HNO3中的氢键数量比H3PO4少,可推断HNO3的稳定性比H3PO4差
D.超分子是两种或两种以上的分子(包括离子)通过化学键形成的分子聚集体
14.★★(2025届江西红色十校第一次联考,2)氮的循环是生态循环系统的重要组成部分,如图所示。
下列叙述错误的是( )
A.反应①产物中N原子杂化类型相同
B.反应②产物分子的VSEPR模型都是平面三角形
C.氮气分子中π键和σ键数目之比为1∶2
D.键角:N>NH3
15.★★(2025届湖南长郡中学调研一,7)超分子化学的研究日益深入。分离C60和C70就借助了超分子的“分子识别”特性,分离流程如图所示。下列有关说法错误的是( )
A.超分子是通过分子间相互作用形成的高分子
B.氯仿的作用是溶解“杯酚”
C.“杯酚”是极性分子
D.C60和C70互为同素异形体
16.★★(2025届云南昆明一中第二次月考,6)物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
选项 性质差异 结构因素
A 熔点:石英 干冰 晶体类型差异
B Ka:CCl3COOHC 分解温度:H2O>H2S 氢键与范德华力差异
D 键角:PF317.★★(2025届重庆涪陵五中开学考,17节选)金属铂(Pt)及其化合物在催化剂和电镀等领域有着重要的应用。回答下列问题:
(1)PtCl2(NH3)2是铂的重要配位化合物,它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙水解产物的化学式均为Pt(OH)2(NH3)2。
①在CCl4中的溶解度:甲 乙(填“>”“<”或“=”)。
②PtCl2(NH3)2发生水解反应的化学方程式为 。
③依据文中信息,推断PtCl2(NH3)2的空间结构为 (填“四面体结构”或“平面四边形”)。
④PtCl2(NH3)2和Pt(C2O4)(NH3)2中Pt2+的配体数不同,但配位数均为4,原因是 。
考法突破9 杂化轨道类型及分子极性的判断
五年高考
1.★(2023海南,4,2分)下列有关元素单质或化合物的叙述正确的是( )
A.P4分子呈正四面体,键角为109°28'
B.NaCl焰色为黄色,与Cl电子跃迁有关
C.基态Cu原子核外电子排布符合构造原理
D.OF2是由极性键构成的极性分子
2.★★(2023湖北,9,3分)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是 ( )
A.CH4和H2O的VSEPR模型均为四面体
B.S和C的空间构型均为平面三角形
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
3.★★(2024湖南,9,3分)通过理论计算方法优化了P和Q的分子结构,P和Q呈平面六元并环结构,原子的连接方式如图所示,下列说法错误的是( )
A.P为非极性分子,Q为极性分子
B.第一电离能:BC.1 mol P和1 mol Q所含电子数目相等
D.P和Q分子中C、B和N均为sp2杂化
4.★★(2024北京,9,3分)氘代氨(ND3)可用于反应机理研究。下列两种方法均可得到ND3:①Mg3N2与D2O的水解反应;②NH3与D2O反应。下列说法不正确的是( )
A.NH3和ND3可用质谱法区分
B.NH3和ND3均为极性分子
C.方法①的化学方程式是Mg3N2+6D2O 3Mg(OD)2+2ND3↑
D.方法②得到的产品纯度比方法①的高
5.★★(2024河北,9,3分)NH4ClO4是火箭固体燃料重要的氧载体,与某些易燃物作用可全部生成气态产物,如:NH4ClO4+2C NH3↑+2CO2↑+HCl↑。下列有关化学用语或表述正确的是( )
A.HCl的形成过程可表示为
B.NH4ClO4中的阴、阳离子有相同的VSEPR模型和空间结构
C.在C60、石墨、金刚石中,碳原子有sp、sp2和sp3三种杂化方式
D.NH3和CO2都能作制冷剂是因为它们有相同类型的分子间作用力
6.★★(2023重庆,10,3分)NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:
下列说法正确的是( )
A.NCl3和SiCl4均为极性分子
B.NCl3和NH3中的N均为sp2杂化
C.NCl3和SiCl4的水解反应机理相同
D.NHCl2和NH3均能与H2O形成氢键
7.★★(2024浙江1月选考,17节选)(3)①H2N—NH2+H+H2N—N,其中—NH2的N原子杂化方式为 ;比较键角∠HNH:H2N—NH2中的—NH2 H2N—N中的—N(填“>”“<”或“=”),请说明理由
。
三年模拟
8.★★(2025届上海闵行中学学情调研,3)气态氯化铝通常以二聚体Al2Cl6的形式存在,其结构如下图所示,更高温度下,二聚体会离解成AlCl3,其分子构型与BF3相似。下列有关AlCl3的说法错误的是( )
A.二聚体Al2Cl6中存在离子键、极性键和非极性键
B.AlCl3分子的空间结构是平面三角形
C.二聚体Al2Cl6中Al原子是sp3杂化
D.BF3中B原子是sp2杂化
9.★★(2025届山西大学附中二诊,13)下列叙述正确的是( )
A.S2与S的中心原子均采用sp3杂化
B.NCl3分子和BCl3分子均为平面三角形结构
C.H2S和CS2分子都是含极性键的极性分子
D.HClO2、HClO3、HClO4三种酸中心原子杂化方式相同,且酸性依次递减
10.★★(2025届湖南长郡中学调研一,5)德国化学家维勒通过蒸发氰酸铵(NH4CNO)水溶液得到了尿素[CO(NH2)2],揭开了人工合成有机化合物的序幕。下列说法正确的是( )
A.组成元素的电负性:N>O>C>H
B.NH4CNO、CO(NH2)2中碳原子均采用sp2杂化
C.N的空间结构为三角锥形
D.NH4CNO的熔点高于CO(NH2)2的熔点
11.★★(2024湖北黄冈中学二模,4)科学研究发现新型含碳化合物COS和C3O2,它们的结构类似CO2,均为直线形分子。下列结论中错误的是( )
A.COS和CO2分子中碳原子的杂化方式均为sp
B.CO2是非极性分子,COS和C3O2也是非极性分子
C.COS、C3O2分子全部由双键构成
D.COS、C3O2分子中所有原子最外层均满足8电子稳定结构
12.★★(2024河南开封三模,9改编)DNA的部分结构如下图所示,其中A为腺嘌呤、G为鸟嘌呤,嘌呤()为平面结构。下列说法正确的是( )
A.第一电离能:HB.基态原子的价层空轨道数:CC.嘌呤中N原子的杂化轨道类型只有一种
D.图中碱基互补配对时存在N…H—O氢键
13.★★(2024山西临汾二模,9)在室温或接近室温时呈液态的自由离子构成的物质称为室温离子液体。某离子液体的制备原理如下:
已知X具有类似于苯的芳香性。下列说法正确的是( )
A.基态原子未成对电子数:HB.X中N原子均为sp2杂化,其中3号N原子孤电子对占据sp2杂化轨道
C.Z的阴离子中所有原子均满足8电子稳定结构
D.熔点:Y考法突破10 键参数大小的比较 大π键分析
五年高考
1.★★(2024江西,2,3分)科学家发现宇宙中存在100多种星际分子。下列关于星际分子说法正确的是( )
A.分子的极性:SiH4>NH3
B.键的极性:H—Cl>H—H
C.键角:H2O>CH4
D.分子中三键的键长:>
2.★★(2024安徽,7,3分)常温常压下羟胺(NH2OH)的水溶液呈碱性,与盐酸反应生成盐酸羟胺[NH3OH]Cl。Kb(NH3·H2O)>Kb(NH2OH)。下列有关物质结构或性质的比较中,正确的是( )
A.键角:NH3>N
B.熔点:NH2OH>[NH3OH]Cl
C.25 ℃同浓度水溶液的pH:[NH3OH]Cl>NH4Cl
D.羟胺分子间氢键的强弱:O—H…O>N—H…N
3.★★(2024山东,9,2分)由O、F、I组成化学式为IO2F的化合物,能体现其成键结构的片段如图所示。下列说法正确的是( )
A.图中代表F原子
B.该化合物中存在过氧键
C.该化合物中I原子存在孤对电子
D.该化合物中所有碘氧键键长相等
4.★★(2024河北,8,3分)从微观视角探析物质结构及性质是学习化学的有效方法。下列实例与解释不符的是( )
选项 实例 解释
A 原子光谱是不连续的线状谱线 原子的能级是量子化的
B CO2、CH2O、CCl4键角依次减小 孤电子对与成键电子对的斥力大于成键电子对之间的斥力
C CsCl晶体中Cs+与8个Cl-配位,而NaCl晶体中Na+与6个Cl-配位 Cs+比Na+的半径大
D 逐个断开CH4中的C—H键,每步所需能量不同 各步中的C—H键所处化学环境不同
5.★★(2022北京,9,3分)由键能数据大小,不能解释下列事实的是( )
化学键 C—H Si—H C O C—O
键能/kJ·mol-1 411 318 799 358
化学键 Si—O C—C Si—Si
键能/kJ·mol-1 452 346 222
A.稳定性:CH4>SiH4
B.键长:C.熔点:CO2D.硬度:金刚石>晶体硅
6.★★(2023山东,16节选)卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)-40 ℃时,F2与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为 ,HOF水解反应的产物为 (填化学式)。
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键()。ClO2中Cl原子的轨道杂化方式为 ;O—Cl—O键角 Cl—O—Cl键角(填“>”“<”或“=”)。比较ClO2与Cl2O中Cl—O键的键长并说明原因
。
三年模拟
7.★★(2025届安徽江淮十校第一次联考,7改编)下列有关物质结构或性质的比较中,错误的是( )
A.键角:NH3>H2O
B.中心原子杂化方式:SCN-与CO2的相同
C.键能:F—F>Cl—Cl
D.羟基的极性:苯酚>乙醇
8.★★(2024湖北武汉4月调研,9)键角是重要的键参数之一。下列键角的大小比较正确的是( )
选项 键角 键角的大小比较
A ∠H—N—H [Cu(NH3)4]2+>NH3
B ∠C—C—C 金刚石>石墨
C ∠O—S—O SO3D ∠H—C—H C9.★★(2024辽宁凌源三模,11)物质的结构决定其性质。下列实例与解释不相符的是( )
选项 实例 解释
A 键角:NCl3>PCl3 原子半径:NB 熔点:石英>干冰 石英是共价晶体,干冰是分子晶体;共价键比分子间作用力强
C 利用“杯酚”可分离C60和C70 超分子具有自组装的特性
D 沸点:乙醇>二甲醚 乙醇和二甲醚互为同分异构体,但乙醇中存在分子间氢键,而二甲醚中不存在,导致乙醇的沸点高于二甲醚
10.★★(教考衔接:人教版选择性必修2第三章第三节科学·技术·社会)(2025届山东济南开学考,16节选)Ⅱ.离子液体指在室温或室温附近温度下呈液态的盐,广泛应用于电化学研究。1-丁基-3-甲基咪唑六氟磷酸盐是一种离子液体,结构简式如图所示。
(3)阳离子中咪唑环存在大π键,其中提供2个电子形成大π键的N的编号是 ,阴离子的空间结构是 。
(4)结合1-丁基-3-甲基咪唑六氟磷酸盐的结构分析离子液体的熔点一般较低的原因是 。
11.★★(2025届福建厦门一中9月月考,10节选)(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示。下列说法正确的是 (填字母)。
A.含有手性碳原子
B.2号氧提供孤电子对与钛离子形成配位键
C.1~4号原子不在同一平面上
D.∠α大于∠β
(4)钛酸四异丙酯可与EMIM+形成一种易燃物质,EMIM+结构如图,其环上所有原子共平面。大π键可用符号表示,其中m表示参与形成大π键的原子数,n表示形成大π键的电子数。EMIM+中的大π键应表示为 。为使EMIM+以单个形式存在从而获得良好的溶解性,应避免与N原子相连的—CH3、—CH2CH3被H原子替代,其原因是
。
第3节 晶体结构与性质
五年高考
1.★(2021天津,2,3分)下列各组物质的晶体类型相同的是( )
A.SiO2和SO3 B.I2和NaCl
C.Cu和Ag D.SiC和MgO
2.★(2024天津,4,3分)我国学者在碳化硅(SiC)表面制备出超高迁移率半导体外延石墨烯。下列说法正确的是( )
A.SiC是离子化合物
B.SiC晶体的熔点高、硬度大
C.核素14C的质子数为8
D.石墨烯属于烯烃
3.★★(2024湖北,11,3分)黄金按质量分数分级,纯金为24K。Au-Cu合金的三种晶胞结构如图,Ⅱ和Ⅲ是立方晶胞。下列说法错误的是( )
A.Ⅰ为18K金
B.Ⅱ中Au的配位数是12
C.Ⅲ中最小核间距Au-CuD.Ⅰ、Ⅱ、Ⅲ中,Au与Cu原子个数比依次为1∶1、1∶3、3∶1
4.★★(2024湖南,12,3分)Li2CN2是一种高活性的人工固氮产物,其合成反应为2LiH+C+N2 Li2CN2+H2,晶胞如图所示,下列说法错误的是( )
A.合成反应中,还原剂是LiH和C
B.晶胞中含有的Li+个数为4
C.每个C周围与它最近且距离相等的Li+有8个
D.C为V形结构
5.★★(2024黑、吉、辽,14,3分)某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是( )
A.结构1钴硫化物的化学式为Co9S8
B.晶胞2中S与S的最短距离为a
C.晶胞2中距Li最近的S有4个
D.晶胞2和晶胞3表示同一晶体
6.★★(2024安徽,14,3分)研究人员制备了一种具有锂离子通道的导电氧化物(LixLayTiO3),其立方晶胞和导电时Li+迁移过程如下图所示。已知该氧化物中Ti为+4价,La为+3价。下列说法错误的是( )
A.导电时,Ti和La的价态不变
B.若x=,Li+与空位的数目相等
C.与体心最邻近的O原子数为12
D.导电时,空位移动方向与电流方向相反
三年模拟
7.★(教考衔接:人教版选择性必修2第三章第三节·研究与实践)(2024浙江义乌三模,6)明矾常用作净水剂,下列关于明矾大晶体制备实验的说法不正确的是( )
A.配制明矾饱和溶液的温度要控制在比室温高10~15 ℃
B.明矾小晶核要悬挂在饱和溶液中央,可避免形成形状不规整的晶体
C.形成大晶体的过程中,需要敞开玻璃杯静置较长时间
D.本实验中所用仪器都要用蒸馏水洗净
8.★★(2025届四川绵阳一诊,14)AlxCoOy晶体的一种立方晶胞如图所示。已知:Al与O最小间距大于Co与O最小间距,x、y为整数,两个“”之间的最短距离为b nm(设NA为阿伏加德罗常数的值)。下列说法错误的是( )
A.x=1,y=3
B.Al周围最近的O原子数目为12
C.图中体心位置“”一定代表Co
D.晶体的密度为 g/cm3
9.★★(2024吉林三模,13)由Li、Al、Si构成的某三元化合物固态晶胞结构如图所示:
下列说法错误的是( )
A.晶体中Li、Al、Si三种微粒的比例为1∶1∶1
B.图中所指Si原子的坐标为()
C.晶体中与每个Al紧邻的Li为6个,与每个Si紧邻的Si为12个
D.晶体中Al和Li构成CsCl型晶体结构,晶体中Al和Si构成金刚石型晶体结构
10.★★(2024湖南岳阳二模,9)一种超导材料(仅由Cs、Ag、F三种元素组成)的长方体晶胞结构如图所示(已知MP=QR),下列说法错误的是( )
A.基态47Ag位于元素周期表的ds区
B.若N点原子分数坐标为(,0),则P点原子分数坐标为(0,0,)
C.M、N之间的距离为a pm
D.该晶体的化学式为CsAgF4
11.★★(2025届黑龙江哈尔滨三中8月月考,16节选)(6)TiO2有三种类型晶体结构,其中一种晶胞结构如图所示。
①Ti的价电子排布式为 。
②晶胞中白球代表 (填“Ti”或“O”),该晶体的密度为 g·cm-3(用含a、b、NA的代数式表示,NA为阿伏加德罗常数的值)。
考法突破11 物质熔、沸点高低的比较
五年高考
1.★(2024山东,4,2分)下列物质均为共价晶体且成键结构相似,其中熔点最低的是( )
A.金刚石(C)
B.单晶硅(Si)
C.金刚砂(SiC)
D.氮化硼(BN,立方相)
2.★★(2021海南,11,4分)关于NH3性质的解释合理的是( )
选项 性质 解释
A 比PH3容易液化 NH3分子间的范德华力更大
B 熔点高于PH3 N—H键的键能比P—H大
C 能与Ag+以配位键结合 NH3中氮原子有孤电子对
D 氨水中存在N NH3·H2O是离子化合物
3.★★(2022山东,5,2分)AlN、GaN属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在N—Al键、N—Ga键。下列说法错误的是( )
A.GaN的熔点高于AlN
B.晶体中所有化学键均为极性键
C.晶体中所有原子均采取sp3杂化
D.晶体中所有原子的配位数均相同
4.★★(2024浙江6月选考,14,3分)Si5Cl10中的Si原子均通过sp3杂化轨道成键,与NaOH溶液反应Si元素均转化成Na2SiO3。下列说法不正确的是( )
A.Si5Cl10分子结构可能是
B.Si5Cl10与水反应可生成一种强酸
C.Si5Cl10与NaOH溶液反应会产生H2
D.Si5Cl10沸点低于相同结构的Si5Br10
三年模拟
5.★★(2024山东淄博二模,9)二维磁性材料卤化铬CrXn混合晶体结构如图所示,在纯氧中发生光氧化反应生成长链状CrOm和X2。下列说法错误的是( )
A.化学键中离子键成分百分数:CrCln>CrBrn>CrIn
B.n=m=3
C.生成1 mol X—X键转移3 mol电子
D.熔点:CrCln>CrBrn>CrIn
6.★★(2024湖北宜荆荆随恩二模联考,7)下列不符合陈述Ⅰ、陈述Ⅱ均正确,且存在因果关系的选项是( )
选项 陈述Ⅰ 陈述Ⅱ
A 第一电离能:Na>K Na与K位于同一主族,原子半径:NaK
B 碳正离子稳定性:> Br电负性比F小,电子云更加偏向碳正离子
C 熔点:金刚石>石墨 金刚石属于共价晶体只含共价键,石墨属于混合型晶体,既存在共价键又存在范德华力
D 熔点:AlF3(1 040 ℃)>AlCl3(178 ℃) AlF3属于离子晶体,AlCl3属于分子晶体
7.★★(2025届四川绵阳南山中学9月月考,15节选)(3)②锡的卤化物熔点数据如下表,结合变化规律说明原因: 。
物质 SnF4 SnCl4 SnBr4 SnI4
熔点/℃ 442 -34 29 143
微专题2 晶胞结构分析与计算
五年高考
1.★★(2024江西,12,3分)NbO的立方晶胞如图,晶胞参数为a nm,P的分数坐标为(0,0,0),阿伏加德罗常数的值为NA,下列说法正确的是 ( )
A.Nb的配位数是6
B.Nb和O最短距离为a nm
C.晶体密度ρ= g/cm3
D.M的分数坐标为
2.★★(2024河北,12,3分)金属铋及其化合物广泛应用于电子设备、医药等领域。如图是铋的一种氟化物的立方晶胞及晶胞中M、N、P、Q点的截面图,晶胞的边长为a pm,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.该铋氟化物的化学式为BiF3
B.粒子S、T之间的距离为a pm
C.该晶体的密度为 g·cm-3
D.晶体中与铋离子最近且等距的氟离子有6个
3.★★(2023辽宁,14,3分)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为 g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
4.★★(2023北京,15节选)硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根(S2)可看作是S中的一个O原子被S原子取代的产物。
(4)同位素示踪实验可证实S2中两个S原子的化学环境不同,实验过程为S S2 Ag2S+S。过程ⅱ中,S2断裂的只有硫硫键,若过程ⅰ所用试剂是NSO3和35S,过程ⅱ含硫产物是 。
(5)MgS2O3·6H2O的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
晶胞中的[Mg(H2O)6]2+个数为 。
已知MgS2O3·6H2O的摩尔质量是M g·mol-1,阿伏加德罗常数的值为NA,该晶体的密度为
g·cm-3。(1 nm=10-7 cm)
(6)浸金时,S2作为配体可提供孤电子对与Au+形成[Au(S2O3)2]3-。分别判断S2中的中心S原子和端基S原子能否做配位原子并说明理由:
。
5.★★(2024北京,15节选)(3)白锡和灰锡是单质Sn的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn原子周围与它最近且距离相等的Sn原子有 个。
②若白锡和灰锡的晶胞体积分别为v1 nm3和v2 nm3,则白锡和灰锡晶体的密度之比是 。
6.★★(2023山东,16节选)(3)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
7.★★(2024福建,11节选)(5)LiOH的晶胞结构如图所示。
①晶体中与一个O紧邻的Li有 个。
②一个Li与所有紧邻O形成的空间结构为 。
③晶体中微粒间作用力有 (填标号)。
a.氢键 b.离子键 c.金属键 d.范德华力 e.极性共价键 f.非极性共价键
8.★★(2022全国乙,35,15分)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有 ,其中能量较高的是 。(填标号)
a.1s22s22p43s1 b.1s22s22p43d2
c.1s22s12p5 d.1s22s22p33p2
(2)①一氯乙烯(C2H3Cl)分子中,C的一个 杂化轨道与Cl的3px轨道形成C—Cl
键,并且Cl的3pz轨道与C的2pz轨道形成3中心4电子的大π键()。
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长的顺序是 ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C—Cl键越强;(ⅱ) 。
(3)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为
。解释X的熔点比Y高的原因 。
(4)α-AgI晶体中I-作体心立方堆积(如图所示),Ag+主要分布在由I-构成的四面体、八面体等空隙中。在电场作用下,Ag+不需要克服太大的阻力即可发生迁移。因此,α-AgI晶体在电池中可作为 。
已知阿伏加德罗常数为NA,则α-AgI晶体的摩尔体积Vm= m3·mol-1(列出算式)。
三年模拟
9.★★(2025届湖北“宜荆荆恩”起点考,12)在不同的压强和温度区间,可以获得不同结构的氮分子结晶。部分固态氮分子相的存在范围及晶胞结构如下表所示,其中α相晶胞是立方晶胞,晶胞边长为a pm,下列说法错误的是( )
分子相 α相 γ相
温度和压强 <35.6 K, <0.35 GPa <40~0 K, 0.35~1.96 GPa
结构
A.继续增大压强,可能形成共价晶体结构的氮同素异形体
B.α相、γ相晶胞中,分子配位数均为12
C.α相、γ相晶胞中,原子个数之比为2∶1
D.α相晶体密度为 g·cm-3
10.★★(2025届黑龙江大庆第一次质检,14)黄铁矿晶体的晶胞如图所示,晶胞参数为a nm,晶胞中Fe2+位于所形成的正八面体的体心,M点分数坐标为(0,,0),NA为阿伏加德罗常数的值,下列说法错误的是( )
A.N点的分数坐标为(1,,1)
B.晶胞中与Fe2+等距且最近的Fe2+数目为8
C.该晶体密度为×1023 g·cm-3
D.若八面体边长为d,则d=a nm
11.★★(2025届海南农垦中学第一次月考,19节选)(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7围成)和正八面体空隙(3、6、7、8、9、12围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为 。
(6)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为 pm(列出计算式即可)。
12.★★(2025届山西长治9月月考,17节选)(6)某化合物的晶胞结构如图甲所示,沿x轴方向的投影为图乙,晶胞底面显示为图丙,晶胞参数a≠c;图丙中Ca与N的距离为 pm;化合物的化学式是 ,其摩尔质量为M g·mol-1,阿伏加德罗常数的值是NA,则晶体的密度为 g·cm-3(列出计算表达式)。
第六章 化学键 分子和晶体的结构与性质
第1节 化学键
五年高考
1.★(2024黑、吉、辽,2,3分)下列化学用语或表述正确的是( )
A.中子数为1的氦核素He
B.SiO2的晶体类型:分子晶体
C.F2的共价键类型:p-p σ键
D.PCl3的空间结构:平面三角形
答案 C
2.★(2022天津,4,3分)利用反应2NH3+NaClO N2H4+NaCl+H2O可制备N2H4。下列叙述正确的是( )
A.NH3分子有孤电子对,可作配体
B.NaCl晶体可以导电
C.1个N2H4分子中有4个σ键
D.NaClO和NaCl均为离子化合物,它们所含的化学键类型相同
答案 A
3.★(2024江苏,7,3分)下列有关反应描述正确的是 ( )
A.CH3CH2OH催化氧化为CH3CHO,CH3CH2OH断裂C—O键
B.氟氯烃破坏臭氧层,氟氯烃产生的氯自由基改变O3分解的历程
C.丁烷催化裂化为乙烷和乙烯,丁烷断裂σ键和π键
D.石墨转化为金刚石,碳原子轨道的杂化类型由sp3转变为sp2
答案 B
4.★★(2024湖南,2,3分)下列化学用语表述错误的是 ( )
A.NaOH的电子式:
B.异丙基的结构简式:
C.NaCl溶液中的水合离子:
D.Cl2分子中σ键的形成:
答案 C
三年模拟
5.★(2025届广西南宁二中摸底,2改编)实验室制备少量氮气的反应为NaNO2+NH4Cl NaCl+N2↑+2H2O。下列与该反应有关的化学用语表述错误的是( )
A.N中的σ键数目为4
B.N2的电子式为
C.NaCl的形成过程可表示为
D.H2O的VSEPR模型为
答案 B
6.★★(2024贵州遵义三模,11改编)配合物种类繁多,新的配合物由于纷繁复杂的有机化合物而层出不穷。叶绿素、血红素和维生素B12都是配合物。其中一种叶绿素的结构如图所示。下列说法错误的是( )
A.叶绿素中Mg元素的化合价为+2
B.Mg的配位数为4
C.叶绿素中元素电负性:O>C>H>Mg
D.叶绿素分子中碳原子采取sp2杂化
答案 D
第2节 分子结构与性质
五年高考
1.★(2024广西,2,3分)光照时,纳米TiO2能使水产生羟基自由基·OH,可用于处理废水。下列表述正确的是( )
A.基态Ti的价电子排布式:3d2
B.·OH的电子式:
C.H2O的VSEPR模型:
D.O的一种核素:8O
答案 B
2.★(2024重庆,3,3分)下列各分子既含有sp2杂化的原子又能与H2O形成氢键的是( )
A.CH3CH3 B.CH2CHBr
C.CH3COOH D.CH3CH2NH2
答案 C
3.★(2024湖北,5,3分)基本概念和理论是化学思维的基石。下列叙述错误的是( )
A.VSEPR理论认为VSEPR模型与分子的空间结构相同
B.元素性质随着原子序数递增而呈周期性变化的规律称为元素周期律
C.泡利原理认为一个原子轨道内最多只能容纳两个自旋相反的电子
D.sp3杂化轨道由1个s轨道和3个p轨道混杂而成
答案 A
4.★(2024湖北,8,3分)结构决定性质,性质决定用途。下列事实解释错误的是( )
事实 解释
A 甘油是黏稠液体 甘油分子间的氢键较强
B 王水溶解铂 浓盐酸增强了浓硝酸的氧化性
C 冰的密度小于干冰 冰晶体中水分子的空间利用率相对较低
D 石墨能导电 未杂化的p轨道重叠使电子可在整个碳原子平面内运动
答案 B
5.★★(2024湖南,4,3分)下列有关化学概念或性质的判断错误的是( )
A.CH4分子是正四面体结构,则CH2Cl2没有同分异构体
B.环己烷与苯分子中C—H键的键能相等
C.甲苯的质谱图中,质荷比为92的峰归属于
D.由R4N+与P组成的离子液体常温下呈液态,与其离子的体积较大有关
答案 B
6.★★(2023湖南,4,3分)下列有关物质结构和性质的说法错误的是 ( )
A.含有手性碳原子的分子叫做手性分子
B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
C.酰胺在酸或碱存在并加热的条件下可发生水解反应
D.冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子
答案 A
7.★★(2024安徽,8,3分)某催化剂结构简式如图所示。下列说法错误的是( )
A.该物质中Ni为+2价
B.基态原子的第一电离能:Cl>P
C.该物质中C和P均采取sp2杂化
D.基态Ni原子价电子排布式为3d84s2
答案 C
8.★★(2024黑、吉、辽,9,3分)环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。下列说法错误的是( )
A.环六糊精属于寡糖
B.非极性分子均可被环六糊精包合形成超分子
C.图2中甲氧基对位暴露在反应环境中
D.可用萃取法分离环六糊精和氯代苯甲醚
答案 B
9.★★(2024湖北,15,3分)科学家合成了一种如图所示的纳米“分子客车”,能装载多种稠环芳香烃。三种芳烃与“分子客车”的结合常数(值越大越稳定)见下表。下列说法错误的是( )
芳烃 芘 并四苯 蒄
结构
结合常数 385 3 764 176 000
A.芳烃与“分子客车”可通过分子间相互作用形成超分子
B.并四苯直立装载与平躺装载的稳定性基本相同
C.从分子大小适配看“分子客车”可装载2个芘
D.芳烃π电子数越多越有利于和“分子客车”的结合
答案 B
10.★★(双选)(2024海南,11,4分)某温控质子驱动反应如图所示。下列说法错误的是( )
A.Ⅰ转化为Ⅱ后,N1—C2键长变短
B.基态N+离子的核外电子排布式为1s22s22p3
C.Ⅰ具备在热敏指示剂方面的应用前景
D.加热时,Ⅰ的O1与H+结合,O1—C1键断开
答案 BD
11.★★(2024浙江6月选考,17节选)(3)化合物HA、HB、HC和HD的结构如图所示。
HA HB
HC HD
①HA、HB和HC中羟基与水均可形成氢键(—O—H…OH2),按照氢键由强到弱对三种酸排序 ,请说明理由
。
②已知HC、HD钠盐的碱性NaC>NaD,请从结构角度说明理由
。
答案 (3)①HC>HB>HA 电负性:O>S>Se,电负性越大,O—H键电子云就越偏向中心C原子,O—H键的极性就越强,与H2O分子形成氢键的强度就越大
②原子半径S>O,键长S—H>O—H,S—H键更易断键电离,因此HD的酸性更强,酸根更不易水解,碱性NaC>NaD
三年模拟
12.★★(2024山东潍坊二模,4)下列分子的空间结构相同的是( )
A.XeO3和NH3 B.COCl2和SOCl2
C.ClF3和BF3 D.CO2和SCl2
答案 A
13.★★(2024广东湛江二模,8)下列有关物质结构与性质的表述正确的是( )
A.N—H键的极性大于C—H键的极性,NH3分子的极性小于CH4
B.I2易溶于CCl4,可从I2和CCl4都是非极性分子的角度解释
C.HNO3中的氢键数量比H3PO4少,可推断HNO3的稳定性比H3PO4差
D.超分子是两种或两种以上的分子(包括离子)通过化学键形成的分子聚集体
答案 B
14.★★(2025届江西红色十校第一次联考,2)氮的循环是生态循环系统的重要组成部分,如图所示。
下列叙述错误的是( )
A.反应①产物中N原子杂化类型相同
B.反应②产物分子的VSEPR模型都是平面三角形
C.氮气分子中π键和σ键数目之比为1∶2
D.键角:N>NH3
答案 C
15.★★(2025届湖南长郡中学调研一,7)超分子化学的研究日益深入。分离C60和C70就借助了超分子的“分子识别”特性,分离流程如图所示。下列有关说法错误的是( )
A.超分子是通过分子间相互作用形成的高分子
B.氯仿的作用是溶解“杯酚”
C.“杯酚”是极性分子
D.C60和C70互为同素异形体
答案 A
16.★★(2025届云南昆明一中第二次月考,6)物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
选项 性质差异 结构因素
A 熔点:石英 干冰 晶体类型差异
B Ka:CCl3COOHC 分解温度:H2O>H2S 氢键与范德华力差异
D 键角:PF3答案 C
17.★★(2025届重庆涪陵五中开学考,17节选)金属铂(Pt)及其化合物在催化剂和电镀等领域有着重要的应用。回答下列问题:
(1)PtCl2(NH3)2是铂的重要配位化合物,它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙水解产物的化学式均为Pt(OH)2(NH3)2。
①在CCl4中的溶解度:甲 乙(填“>”“<”或“=”)。
②PtCl2(NH3)2发生水解反应的化学方程式为 。
③依据文中信息,推断PtCl2(NH3)2的空间结构为 (填“四面体结构”或“平面四边形”)。
④PtCl2(NH3)2和Pt(C2O4)(NH3)2中Pt2+的配体数不同,但配位数均为4,原因是 。
答案 (1)①< ②PtCl2(NH3)2+2H2O Pt(OH)2(NH3)2+2HCl ③平面四边形 ④每个C2中有2个原子与Pt2+配位
考法突破9 杂化轨道类型及分子极性的判断
五年高考
1.★(2023海南,4,2分)下列有关元素单质或化合物的叙述正确的是( )
A.P4分子呈正四面体,键角为109°28'
B.NaCl焰色为黄色,与Cl电子跃迁有关
C.基态Cu原子核外电子排布符合构造原理
D.OF2是由极性键构成的极性分子
答案 D
2.★★(2023湖北,9,3分)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是 ( )
A.CH4和H2O的VSEPR模型均为四面体
B.S和C的空间构型均为平面三角形
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
答案 A
3.★★(2024湖南,9,3分)通过理论计算方法优化了P和Q的分子结构,P和Q呈平面六元并环结构,原子的连接方式如图所示,下列说法错误的是( )
A.P为非极性分子,Q为极性分子
B.第一电离能:BC.1 mol P和1 mol Q所含电子数目相等
D.P和Q分子中C、B和N均为sp2杂化
答案 A
4.★★(2024北京,9,3分)氘代氨(ND3)可用于反应机理研究。下列两种方法均可得到ND3:①Mg3N2与D2O的水解反应;②NH3与D2O反应。下列说法不正确的是( )
A.NH3和ND3可用质谱法区分
B.NH3和ND3均为极性分子
C.方法①的化学方程式是Mg3N2+6D2O 3Mg(OD)2+2ND3↑
D.方法②得到的产品纯度比方法①的高
答案 D
5.★★(2024河北,9,3分)NH4ClO4是火箭固体燃料重要的氧载体,与某些易燃物作用可全部生成气态产物,如:NH4ClO4+2C NH3↑+2CO2↑+HCl↑。下列有关化学用语或表述正确的是( )
A.HCl的形成过程可表示为
B.NH4ClO4中的阴、阳离子有相同的VSEPR模型和空间结构
C.在C60、石墨、金刚石中,碳原子有sp、sp2和sp3三种杂化方式
D.NH3和CO2都能作制冷剂是因为它们有相同类型的分子间作用力
答案 B
6.★★(2023重庆,10,3分)NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:
下列说法正确的是( )
A.NCl3和SiCl4均为极性分子
B.NCl3和NH3中的N均为sp2杂化
C.NCl3和SiCl4的水解反应机理相同
D.NHCl2和NH3均能与H2O形成氢键
答案 D
7.★★(2024浙江1月选考,17节选)(3)①H2N—NH2+H+H2N—N,其中—NH2的N原子杂化方式为 ;比较键角∠HNH:H2N—NH2中的—NH2 H2N—N中的—N(填“>”“<”或“=”),请说明理由
。
答案 (3)①sp3 < —NH2和—中N原子均采取sp3杂化,—NH2中N原子上有1个孤电子对,而—N中N原子上没有孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力
三年模拟
8.★★(2025届上海闵行中学学情调研,3)气态氯化铝通常以二聚体Al2Cl6的形式存在,其结构如下图所示,更高温度下,二聚体会离解成AlCl3,其分子构型与BF3相似。下列有关AlCl3的说法错误的是( )
A.二聚体Al2Cl6中存在离子键、极性键和非极性键
B.AlCl3分子的空间结构是平面三角形
C.二聚体Al2Cl6中Al原子是sp3杂化
D.BF3中B原子是sp2杂化
答案 A
9.★★(2025届山西大学附中二诊,13)下列叙述正确的是( )
A.S2与S的中心原子均采用sp3杂化
B.NCl3分子和BCl3分子均为平面三角形结构
C.H2S和CS2分子都是含极性键的极性分子
D.HClO2、HClO3、HClO4三种酸中心原子杂化方式相同,且酸性依次递减
答案 A
10.★★(2025届湖南长郡中学调研一,5)德国化学家维勒通过蒸发氰酸铵(NH4CNO)水溶液得到了尿素[CO(NH2)2],揭开了人工合成有机化合物的序幕。下列说法正确的是( )
A.组成元素的电负性:N>O>C>H
B.NH4CNO、CO(NH2)2中碳原子均采用sp2杂化
C.N的空间结构为三角锥形
D.NH4CNO的熔点高于CO(NH2)2的熔点
答案 D
11.★★(2024湖北黄冈中学二模,4)科学研究发现新型含碳化合物COS和C3O2,它们的结构类似CO2,均为直线形分子。下列结论中错误的是( )
A.COS和CO2分子中碳原子的杂化方式均为sp
B.CO2是非极性分子,COS和C3O2也是非极性分子
C.COS、C3O2分子全部由双键构成
D.COS、C3O2分子中所有原子最外层均满足8电子稳定结构
答案 B
12.★★(2024河南开封三模,9改编)DNA的部分结构如下图所示,其中A为腺嘌呤、G为鸟嘌呤,嘌呤()为平面结构。下列说法正确的是( )
A.第一电离能:HB.基态原子的价层空轨道数:CC.嘌呤中N原子的杂化轨道类型只有一种
D.图中碱基互补配对时存在N…H—O氢键
答案 C
13.★★(2024山西临汾二模,9)在室温或接近室温时呈液态的自由离子构成的物质称为室温离子液体。某离子液体的制备原理如下:
已知X具有类似于苯的芳香性。下列说法正确的是( )
A.基态原子未成对电子数:HB.X中N原子均为sp2杂化,其中3号N原子孤电子对占据sp2杂化轨道
C.Z的阴离子中所有原子均满足8电子稳定结构
D.熔点:Y答案 B
考法突破10 键参数大小的比较 大π键分析
五年高考
1.★★(2024江西,2,3分)科学家发现宇宙中存在100多种星际分子。下列关于星际分子说法正确的是( )
A.分子的极性:SiH4>NH3
B.键的极性:H—Cl>H—H
C.键角:H2O>CH4
D.分子中三键的键长:>
答案 B
2.★★(2024安徽,7,3分)常温常压下羟胺(NH2OH)的水溶液呈碱性,与盐酸反应生成盐酸羟胺[NH3OH]Cl。Kb(NH3·H2O)>Kb(NH2OH)。下列有关物质结构或性质的比较中,正确的是( )
A.键角:NH3>N
B.熔点:NH2OH>[NH3OH]Cl
C.25 ℃同浓度水溶液的pH:[NH3OH]Cl>NH4Cl
D.羟胺分子间氢键的强弱:O—H…O>N—H…N
答案 D
3.★★(2024山东,9,2分)由O、F、I组成化学式为IO2F的化合物,能体现其成键结构的片段如图所示。下列说法正确的是( )
A.图中代表F原子
B.该化合物中存在过氧键
C.该化合物中I原子存在孤对电子
D.该化合物中所有碘氧键键长相等
答案 C
4.★★(2024河北,8,3分)从微观视角探析物质结构及性质是学习化学的有效方法。下列实例与解释不符的是( )
选项 实例 解释
A 原子光谱是不连续的线状谱线 原子的能级是量子化的
B CO2、CH2O、CCl4键角依次减小 孤电子对与成键电子对的斥力大于成键电子对之间的斥力
C CsCl晶体中Cs+与8个Cl-配位,而NaCl晶体中Na+与6个Cl-配位 Cs+比Na+的半径大
D 逐个断开CH4中的C—H键,每步所需能量不同 各步中的C—H键所处化学环境不同
答案 B
5.★★(2022北京,9,3分)由键能数据大小,不能解释下列事实的是( )
化学键 C—H Si—H C O C—O
键能/kJ·mol-1 411 318 799 358
化学键 Si—O C—C Si—Si
键能/kJ·mol-1 452 346 222
A.稳定性:CH4>SiH4
B.键长:C.熔点:CO2D.硬度:金刚石>晶体硅
答案 C
6.★★(2023山东,16节选)卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)-40 ℃时,F2与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为 ,HOF水解反应的产物为 (填化学式)。
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键()。ClO2中Cl原子的轨道杂化方式为 ;O—Cl—O键角 Cl—O—Cl键角(填“>”“<”或“=”)。比较ClO2与Cl2O中Cl—O键的键长并说明原因
。
答案 (1)分子晶体 HF和H2O2 (2)sp2 > ClO2中存在大π键,Cl2O中仅存在Cl—O σ键,所以ClO2中Cl—O键的键长更短
三年模拟
7.★★(2025届安徽江淮十校第一次联考,7改编)下列有关物质结构或性质的比较中,错误的是( )
A.键角:NH3>H2O
B.中心原子杂化方式:SCN-与CO2的相同
C.键能:F—F>Cl—Cl
D.羟基的极性:苯酚>乙醇
答案 C
8.★★(2024湖北武汉4月调研,9)键角是重要的键参数之一。下列键角的大小比较正确的是( )
选项 键角 键角的大小比较
A ∠H—N—H [Cu(NH3)4]2+>NH3
B ∠C—C—C 金刚石>石墨
C ∠O—S—O SO3D ∠H—C—H C答案 A
9.★★(2024辽宁凌源三模,11)物质的结构决定其性质。下列实例与解释不相符的是( )
选项 实例 解释
A 键角:NCl3>PCl3 原子半径:NB 熔点:石英>干冰 石英是共价晶体,干冰是分子晶体;共价键比分子间作用力强
C 利用“杯酚”可分离C60和C70 超分子具有自组装的特性
D 沸点:乙醇>二甲醚 乙醇和二甲醚互为同分异构体,但乙醇中存在分子间氢键,而二甲醚中不存在,导致乙醇的沸点高于二甲醚
答案 C
10.★★(教考衔接:人教版选择性必修2第三章第三节科学·技术·社会)(2025届山东济南开学考,16节选)Ⅱ.离子液体指在室温或室温附近温度下呈液态的盐,广泛应用于电化学研究。1-丁基-3-甲基咪唑六氟磷酸盐是一种离子液体,结构简式如图所示。
(3)阳离子中咪唑环存在大π键,其中提供2个电子形成大π键的N的编号是 ,阴离子的空间结构是 。
(4)结合1-丁基-3-甲基咪唑六氟磷酸盐的结构分析离子液体的熔点一般较低的原因是 。
答案 (3)① 正八面体
(4)离子液体中阴、阳离子体积很大,结构松散,导致阴、阳离子之间的作用力较小,熔点较低
11.★★(2025届福建厦门一中9月月考,10节选)(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示。下列说法正确的是 (填字母)。
A.含有手性碳原子
B.2号氧提供孤电子对与钛离子形成配位键
C.1~4号原子不在同一平面上
D.∠α大于∠β
(4)钛酸四异丙酯可与EMIM+形成一种易燃物质,EMIM+结构如图,其环上所有原子共平面。大π键可用符号表示,其中m表示参与形成大π键的原子数,n表示形成大π键的电子数。EMIM+中的大π键应表示为 。为使EMIM+以单个形式存在从而获得良好的溶解性,应避免与N原子相连的—CH3、—CH2CH3被H原子替代,其原因是
。
答案 (3)BD
(4) 由于氮原子上连有氢原子,易形成氢键,使该离子不易以单个形式存在,无法获得良好的溶解性
第3节 晶体结构与性质
五年高考
1.★(2021天津,2,3分)下列各组物质的晶体类型相同的是( )
A.SiO2和SO3 B.I2和NaCl
C.Cu和Ag D.SiC和MgO
答案 C
2.★(2024天津,4,3分)我国学者在碳化硅(SiC)表面制备出超高迁移率半导体外延石墨烯。下列说法正确的是( )
A.SiC是离子化合物
B.SiC晶体的熔点高、硬度大
C.核素14C的质子数为8
D.石墨烯属于烯烃
答案 B
3.★★(2024湖北,11,3分)黄金按质量分数分级,纯金为24K。Au-Cu合金的三种晶胞结构如图,Ⅱ和Ⅲ是立方晶胞。下列说法错误的是( )
A.Ⅰ为18K金
B.Ⅱ中Au的配位数是12
C.Ⅲ中最小核间距Au-CuD.Ⅰ、Ⅱ、Ⅲ中,Au与Cu原子个数比依次为1∶1、1∶3、3∶1
答案 C
4.★★(2024湖南,12,3分)Li2CN2是一种高活性的人工固氮产物,其合成反应为2LiH+C+N2 Li2CN2+H2,晶胞如图所示,下列说法错误的是( )
A.合成反应中,还原剂是LiH和C
B.晶胞中含有的Li+个数为4
C.每个C周围与它最近且距离相等的Li+有8个
D.C为V形结构
答案 D
5.★★(2024黑、吉、辽,14,3分)某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是( )
A.结构1钴硫化物的化学式为Co9S8
B.晶胞2中S与S的最短距离为a
C.晶胞2中距Li最近的S有4个
D.晶胞2和晶胞3表示同一晶体
答案 B
6.★★(2024安徽,14,3分)研究人员制备了一种具有锂离子通道的导电氧化物(LixLayTiO3),其立方晶胞和导电时Li+迁移过程如下图所示。已知该氧化物中Ti为+4价,La为+3价。下列说法错误的是( )
A.导电时,Ti和La的价态不变
B.若x=,Li+与空位的数目相等
C.与体心最邻近的O原子数为12
D.导电时,空位移动方向与电流方向相反
答案 B
三年模拟
7.★(教考衔接:人教版选择性必修2第三章第三节·研究与实践)(2024浙江义乌三模,6)明矾常用作净水剂,下列关于明矾大晶体制备实验的说法不正确的是( )
A.配制明矾饱和溶液的温度要控制在比室温高10~15 ℃
B.明矾小晶核要悬挂在饱和溶液中央,可避免形成形状不规整的晶体
C.形成大晶体的过程中,需要敞开玻璃杯静置较长时间
D.本实验中所用仪器都要用蒸馏水洗净
答案 C
8.★★(2025届四川绵阳一诊,14)AlxCoOy晶体的一种立方晶胞如图所示。已知:Al与O最小间距大于Co与O最小间距,x、y为整数,两个“”之间的最短距离为b nm(设NA为阿伏加德罗常数的值)。下列说法错误的是( )
A.x=1,y=3
B.Al周围最近的O原子数目为12
C.图中体心位置“”一定代表Co
D.晶体的密度为 g/cm3
答案 D
9.★★(2024吉林三模,13)由Li、Al、Si构成的某三元化合物固态晶胞结构如图所示:
下列说法错误的是( )
A.晶体中Li、Al、Si三种微粒的比例为1∶1∶1
B.图中所指Si原子的坐标为()
C.晶体中与每个Al紧邻的Li为6个,与每个Si紧邻的Si为12个
D.晶体中Al和Li构成CsCl型晶体结构,晶体中Al和Si构成金刚石型晶体结构
答案 D
10.★★(2024湖南岳阳二模,9)一种超导材料(仅由Cs、Ag、F三种元素组成)的长方体晶胞结构如图所示(已知MP=QR),下列说法错误的是( )
A.基态47Ag位于元素周期表的ds区
B.若N点原子分数坐标为(,0),则P点原子分数坐标为(0,0,)
C.M、N之间的距离为a pm
D.该晶体的化学式为CsAgF4
答案 D
11.★★(2025届黑龙江哈尔滨三中8月月考,16节选)(6)TiO2有三种类型晶体结构,其中一种晶胞结构如图所示。
①Ti的价电子排布式为 。
②晶胞中白球代表 (填“Ti”或“O”),该晶体的密度为 g·cm-3(用含a、b、NA的代数式表示,NA为阿伏加德罗常数的值)。
答案 (6)①3d24s2 ②O
考法突破11 物质熔、沸点高低的比较
五年高考
1.★(2024山东,4,2分)下列物质均为共价晶体且成键结构相似,其中熔点最低的是( )
A.金刚石(C)
B.单晶硅(Si)
C.金刚砂(SiC)
D.氮化硼(BN,立方相)
答案 B
2.★★(2021海南,11,4分)关于NH3性质的解释合理的是( )
选项 性质 解释
A 比PH3容易液化 NH3分子间的范德华力更大
B 熔点高于PH3 N—H键的键能比P—H大
C 能与Ag+以配位键结合 NH3中氮原子有孤电子对
D 氨水中存在N NH3·H2O是离子化合物
答案 C
3.★★(2022山东,5,2分)AlN、GaN属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在N—Al键、N—Ga键。下列说法错误的是( )
A.GaN的熔点高于AlN
B.晶体中所有化学键均为极性键
C.晶体中所有原子均采取sp3杂化
D.晶体中所有原子的配位数均相同
答案 A
4.★★(2024浙江6月选考,14,3分)Si5Cl10中的Si原子均通过sp3杂化轨道成键,与NaOH溶液反应Si元素均转化成Na2SiO3。下列说法不正确的是( )
A.Si5Cl10分子结构可能是
B.Si5Cl10与水反应可生成一种强酸
C.Si5Cl10与NaOH溶液反应会产生H2
D.Si5Cl10沸点低于相同结构的Si5Br10
答案 A
三年模拟
5.★★(2024山东淄博二模,9)二维磁性材料卤化铬CrXn混合晶体结构如图所示,在纯氧中发生光氧化反应生成长链状CrOm和X2。下列说法错误的是( )
A.化学键中离子键成分百分数:CrCln>CrBrn>CrIn
B.n=m=3
C.生成1 mol X—X键转移3 mol电子
D.熔点:CrCln>CrBrn>CrIn
答案 C
6.★★(2024湖北宜荆荆随恩二模联考,7)下列不符合陈述Ⅰ、陈述Ⅱ均正确,且存在因果关系的选项是( )
选项 陈述Ⅰ 陈述Ⅱ
A 第一电离能:Na>K Na与K位于同一主族,原子半径:NaK
B 碳正离子稳定性:> Br电负性比F小,电子云更加偏向碳正离子
C 熔点:金刚石>石墨 金刚石属于共价晶体只含共价键,石墨属于混合型晶体,既存在共价键又存在范德华力
D 熔点:AlF3(1 040 ℃)>AlCl3(178 ℃) AlF3属于离子晶体,AlCl3属于分子晶体
答案 C
7.★★(2025届四川绵阳南山中学9月月考,15节选)(3)②锡的卤化物熔点数据如下表,结合变化规律说明原因: 。
物质 SnF4 SnCl4 SnBr4 SnI4
熔点/℃ 442 -34 29 143
答案 (3)②SnF4属于离子晶体,SnCl4、SnBr4、SnI4属于分子晶体,离子晶体的熔点比分子晶体高,分子晶体的相对分子质量越大,范德华力越强,熔点越高
微专题2 晶胞结构分析与计算
五年高考
1.★★(2024江西,12,3分)NbO的立方晶胞如图,晶胞参数为a nm,P的分数坐标为(0,0,0),阿伏加德罗常数的值为NA,下列说法正确的是 ( )
A.Nb的配位数是6
B.Nb和O最短距离为a nm
C.晶体密度ρ= g/cm3
D.M的分数坐标为
答案 D
2.★★(2024河北,12,3分)金属铋及其化合物广泛应用于电子设备、医药等领域。如图是铋的一种氟化物的立方晶胞及晶胞中M、N、P、Q点的截面图,晶胞的边长为a pm,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.该铋氟化物的化学式为BiF3
B.粒子S、T之间的距离为a pm
C.该晶体的密度为 g·cm-3
D.晶体中与铋离子最近且等距的氟离子有6个
答案 D
3.★★(2023辽宁,14,3分)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为 g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
答案 C
4.★★(2023北京,15节选)硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根(S2)可看作是S中的一个O原子被S原子取代的产物。
(4)同位素示踪实验可证实S2中两个S原子的化学环境不同,实验过程为S S2 Ag2S+S。过程ⅱ中,S2断裂的只有硫硫键,若过程ⅰ所用试剂是NSO3和35S,过程ⅱ含硫产物是 。
(5)MgS2O3·6H2O的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
晶胞中的[Mg(H2O)6]2+个数为 。
已知MgS2O3·6H2O的摩尔质量是M g·mol-1,阿伏加德罗常数的值为NA,该晶体的密度为
g·cm-3。(1 nm=10-7 cm)
(6)浸金时,S2作为配体可提供孤电子对与Au+形成[Au(S2O3)2]3-。分别判断S2中的中心S原子和端基S原子能否做配位原子并说明理由:
。
答案 (4)AS、32S
(5)4 ×1021
(6)S2中中心S原子不能做配位原子,端基S原子能做配位原子;因为S2中中心S原子无孤电子对,端基S原子有孤电子对
5.★★(2024北京,15节选)(3)白锡和灰锡是单质Sn的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn原子周围与它最近且距离相等的Sn原子有 个。
②若白锡和灰锡的晶胞体积分别为v1 nm3和v2 nm3,则白锡和灰锡晶体的密度之比是 。
答案 (3)①4 ②
6.★★(2023山东,16节选)(3)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
答案 (3)CuCl2+4K+2F2 2KCl+K2CuF4
7.★★(2024福建,11节选)(5)LiOH的晶胞结构如图所示。
①晶体中与一个O紧邻的Li有 个。
②一个Li与所有紧邻O形成的空间结构为 。
③晶体中微粒间作用力有 (填标号)。
a.氢键 b.离子键 c.金属键 d.范德华力 e.极性共价键 f.非极性共价键
答案 (5)①4 ②四面体形 ③bde
8.★★(2022全国乙,35,15分)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有 ,其中能量较高的是 。(填标号)
a.1s22s22p43s1 b.1s22s22p43d2
c.1s22s12p5 d.1s22s22p33p2
(2)①一氯乙烯(C2H3Cl)分子中,C的一个 杂化轨道与Cl的3px轨道形成C—Cl
键,并且Cl的3pz轨道与C的2pz轨道形成3中心4电子的大π键()。
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长的顺序是 ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C—Cl键越强;(ⅱ) 。
(3)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为
。解释X的熔点比Y高的原因 。
(4)α-AgI晶体中I-作体心立方堆积(如图所示),Ag+主要分布在由I-构成的四面体、八面体等空隙中。在电场作用下,Ag+不需要克服太大的阻力即可发生迁移。因此,α-AgI晶体在电池中可作为 。
已知阿伏加德罗常数为NA,则α-AgI晶体的摩尔体积Vm= m3·mol-1(列出算式)。
答案 (1)ad d (2)①sp2 σ ②C2H5Cl>C2H3Cl>C2HCl Cl参与形成的大π键越多,形成的C—Cl键越短 (3)CsCl CsCl是离子晶体,熔化时需要克服Cs+和Cl-之间的离子键,而ICl是分子晶体,熔化时只需要克服范德华力 (4)固体电解质 (5.04×10-10)3NA
三年模拟
9.★★(2025届湖北“宜荆荆恩”起点考,12)在不同的压强和温度区间,可以获得不同结构的氮分子结晶。部分固态氮分子相的存在范围及晶胞结构如下表所示,其中α相晶胞是立方晶胞,晶胞边长为a pm,下列说法错误的是( )
分子相 α相 γ相
温度和压强 <35.6 K, <0.35 GPa <40~0 K, 0.35~1.96 GPa
结构
A.继续增大压强,可能形成共价晶体结构的氮同素异形体
B.α相、γ相晶胞中,分子配位数均为12
C.α相、γ相晶胞中,原子个数之比为2∶1
D.α相晶体密度为 g·cm-3
答案 B
10.★★(2025届黑龙江大庆第一次质检,14)黄铁矿晶体的晶胞如图所示,晶胞参数为a nm,晶胞中Fe2+位于所形成的正八面体的体心,M点分数坐标为(0,,0),NA为阿伏加德罗常数的值,下列说法错误的是( )
A.N点的分数坐标为(1,,1)
B.晶胞中与Fe2+等距且最近的Fe2+数目为8
C.该晶体密度为×1023 g·cm-3
D.若八面体边长为d,则d=a nm
答案 B
11.★★(2025届海南农垦中学第一次月考,19节选)(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7围成)和正八面体空隙(3、6、7、8、9、12围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为 。
(6)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为 pm(列出计算式即可)。
答案 (5)7∶2 (6)×1010
12.★★(2025届山西长治9月月考,17节选)(6)某化合物的晶胞结构如图甲所示,沿x轴方向的投影为图乙,晶胞底面显示为图丙,晶胞参数a≠c;图丙中Ca与N的距离为 pm;化合物的化学式是 ,其摩尔质量为M g·mol-1,阿伏加德罗常数的值是NA,则晶体的密度为 g·cm-3(列出计算表达式)。
答案 (6)×1030
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2026全国版高考化学一轮
第六章 化学键 分子和晶体的结构与性质
第1节 化学键
五年高考
1.★(2024黑、吉、辽,2,3分)下列化学用语或表述正确的是( )
A.中子数为1的氦核素He
B.SiO2的晶体类型:分子晶体
C.F2的共价键类型:p-p σ键
D.PCl3的空间结构:平面三角形
2.★(2022天津,4,3分)利用反应2NH3+NaClO N2H4+NaCl+H2O可制备N2H4。下列叙述正确的是( )
A.NH3分子有孤电子对,可作配体
B.NaCl晶体可以导电
C.1个N2H4分子中有4个σ键
D.NaClO和NaCl均为离子化合物,它们所含的化学键类型相同
3.★(2024江苏,7,3分)下列有关反应描述正确的是 ( )
A.CH3CH2OH催化氧化为CH3CHO,CH3CH2OH断裂C—O键
B.氟氯烃破坏臭氧层,氟氯烃产生的氯自由基改变O3分解的历程
C.丁烷催化裂化为乙烷和乙烯,丁烷断裂σ键和π键
D.石墨转化为金刚石,碳原子轨道的杂化类型由sp3转变为sp2
4.★★(2024湖南,2,3分)下列化学用语表述错误的是 ( )
A.NaOH的电子式:
B.异丙基的结构简式:
C.NaCl溶液中的水合离子:
D.Cl2分子中σ键的形成:
三年模拟
5.★(2025届广西南宁二中摸底,2改编)实验室制备少量氮气的反应为NaNO2+NH4Cl NaCl+N2↑+2H2O。下列与该反应有关的化学用语表述错误的是( )
A.N中的σ键数目为4
B.N2的电子式为
C.NaCl的形成过程可表示为
D.H2O的VSEPR模型为
6.★★(2024贵州遵义三模,11改编)配合物种类繁多,新的配合物由于纷繁复杂的有机化合物而层出不穷。叶绿素、血红素和维生素B12都是配合物。其中一种叶绿素的结构如图所示。下列说法错误的是( )
A.叶绿素中Mg元素的化合价为+2
B.Mg的配位数为4
C.叶绿素中元素电负性:O>C>H>Mg
D.叶绿素分子中碳原子采取sp2杂化
第2节 分子结构与性质
五年高考
1.★(2024广西,2,3分)光照时,纳米TiO2能使水产生羟基自由基·OH,可用于处理废水。下列表述正确的是( )
A.基态Ti的价电子排布式:3d2
B.·OH的电子式:
C.H2O的VSEPR模型:
D.O的一种核素:8O
2.★(2024重庆,3,3分)下列各分子既含有sp2杂化的原子又能与H2O形成氢键的是( )
A.CH3CH3 B.CH2CHBr
C.CH3COOH D.CH3CH2NH2
3.★(2024湖北,5,3分)基本概念和理论是化学思维的基石。下列叙述错误的是( )
A.VSEPR理论认为VSEPR模型与分子的空间结构相同
B.元素性质随着原子序数递增而呈周期性变化的规律称为元素周期律
C.泡利原理认为一个原子轨道内最多只能容纳两个自旋相反的电子
D.sp3杂化轨道由1个s轨道和3个p轨道混杂而成
4.★(2024湖北,8,3分)结构决定性质,性质决定用途。下列事实解释错误的是( )
事实 解释
A 甘油是黏稠液体 甘油分子间的氢键较强
B 王水溶解铂 浓盐酸增强了浓硝酸的氧化性
C 冰的密度小于干冰 冰晶体中水分子的空间利用率相对较低
D 石墨能导电 未杂化的p轨道重叠使电子可在整个碳原子平面内运动
5.★★(2024湖南,4,3分)下列有关化学概念或性质的判断错误的是( )
A.CH4分子是正四面体结构,则CH2Cl2没有同分异构体
B.环己烷与苯分子中C—H键的键能相等
C.甲苯的质谱图中,质荷比为92的峰归属于
D.由R4N+与P组成的离子液体常温下呈液态,与其离子的体积较大有关
6.★★(2023湖南,4,3分)下列有关物质结构和性质的说法错误的是 ( )
A.含有手性碳原子的分子叫做手性分子
B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
C.酰胺在酸或碱存在并加热的条件下可发生水解反应
D.冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子
7.★★(2024安徽,8,3分)某催化剂结构简式如图所示。下列说法错误的是( )
A.该物质中Ni为+2价
B.基态原子的第一电离能:Cl>P
C.该物质中C和P均采取sp2杂化
D.基态Ni原子价电子排布式为3d84s2
8.★★(2024黑、吉、辽,9,3分)环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。下列说法错误的是( )
A.环六糊精属于寡糖
B.非极性分子均可被环六糊精包合形成超分子
C.图2中甲氧基对位暴露在反应环境中
D.可用萃取法分离环六糊精和氯代苯甲醚
9.★★(2024湖北,15,3分)科学家合成了一种如图所示的纳米“分子客车”,能装载多种稠环芳香烃。三种芳烃与“分子客车”的结合常数(值越大越稳定)见下表。下列说法错误的是( )
芳烃 芘 并四苯 蒄
结构
结合常数 385 3 764 176 000
A.芳烃与“分子客车”可通过分子间相互作用形成超分子
B.并四苯直立装载与平躺装载的稳定性基本相同
C.从分子大小适配看“分子客车”可装载2个芘
D.芳烃π电子数越多越有利于和“分子客车”的结合
10.★★(双选)(2024海南,11,4分)某温控质子驱动反应如图所示。下列说法错误的是( )
A.Ⅰ转化为Ⅱ后,N1—C2键长变短
B.基态N+离子的核外电子排布式为1s22s22p3
C.Ⅰ具备在热敏指示剂方面的应用前景
D.加热时,Ⅰ的O1与H+结合,O1—C1键断开
11.★★(2024浙江6月选考,17节选)(3)化合物HA、HB、HC和HD的结构如图所示。
HA HB
HC HD
①HA、HB和HC中羟基与水均可形成氢键(—O—H…OH2),按照氢键由强到弱对三种酸排序 ,请说明理由
。
②已知HC、HD钠盐的碱性NaC>NaD,请从结构角度说明理由
。
三年模拟
12.★★(2024山东潍坊二模,4)下列分子的空间结构相同的是( )
A.XeO3和NH3 B.COCl2和SOCl2
C.ClF3和BF3 D.CO2和SCl2
13.★★(2024广东湛江二模,8)下列有关物质结构与性质的表述正确的是( )
A.N—H键的极性大于C—H键的极性,NH3分子的极性小于CH4
B.I2易溶于CCl4,可从I2和CCl4都是非极性分子的角度解释
C.HNO3中的氢键数量比H3PO4少,可推断HNO3的稳定性比H3PO4差
D.超分子是两种或两种以上的分子(包括离子)通过化学键形成的分子聚集体
14.★★(2025届江西红色十校第一次联考,2)氮的循环是生态循环系统的重要组成部分,如图所示。
下列叙述错误的是( )
A.反应①产物中N原子杂化类型相同
B.反应②产物分子的VSEPR模型都是平面三角形
C.氮气分子中π键和σ键数目之比为1∶2
D.键角:N>NH3
15.★★(2025届湖南长郡中学调研一,7)超分子化学的研究日益深入。分离C60和C70就借助了超分子的“分子识别”特性,分离流程如图所示。下列有关说法错误的是( )
A.超分子是通过分子间相互作用形成的高分子
B.氯仿的作用是溶解“杯酚”
C.“杯酚”是极性分子
D.C60和C70互为同素异形体
16.★★(2025届云南昆明一中第二次月考,6)物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
选项 性质差异 结构因素
A 熔点:石英 干冰 晶体类型差异
B Ka:CCl3COOH
D 键角:PF3
(1)PtCl2(NH3)2是铂的重要配位化合物,它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙水解产物的化学式均为Pt(OH)2(NH3)2。
①在CCl4中的溶解度:甲 乙(填“>”“<”或“=”)。
②PtCl2(NH3)2发生水解反应的化学方程式为 。
③依据文中信息,推断PtCl2(NH3)2的空间结构为 (填“四面体结构”或“平面四边形”)。
④PtCl2(NH3)2和Pt(C2O4)(NH3)2中Pt2+的配体数不同,但配位数均为4,原因是 。
考法突破9 杂化轨道类型及分子极性的判断
五年高考
1.★(2023海南,4,2分)下列有关元素单质或化合物的叙述正确的是( )
A.P4分子呈正四面体,键角为109°28'
B.NaCl焰色为黄色,与Cl电子跃迁有关
C.基态Cu原子核外电子排布符合构造原理
D.OF2是由极性键构成的极性分子
2.★★(2023湖北,9,3分)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是 ( )
A.CH4和H2O的VSEPR模型均为四面体
B.S和C的空间构型均为平面三角形
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
3.★★(2024湖南,9,3分)通过理论计算方法优化了P和Q的分子结构,P和Q呈平面六元并环结构,原子的连接方式如图所示,下列说法错误的是( )
A.P为非极性分子,Q为极性分子
B.第一电离能:B
D.P和Q分子中C、B和N均为sp2杂化
4.★★(2024北京,9,3分)氘代氨(ND3)可用于反应机理研究。下列两种方法均可得到ND3:①Mg3N2与D2O的水解反应;②NH3与D2O反应。下列说法不正确的是( )
A.NH3和ND3可用质谱法区分
B.NH3和ND3均为极性分子
C.方法①的化学方程式是Mg3N2+6D2O 3Mg(OD)2+2ND3↑
D.方法②得到的产品纯度比方法①的高
5.★★(2024河北,9,3分)NH4ClO4是火箭固体燃料重要的氧载体,与某些易燃物作用可全部生成气态产物,如:NH4ClO4+2C NH3↑+2CO2↑+HCl↑。下列有关化学用语或表述正确的是( )
A.HCl的形成过程可表示为
B.NH4ClO4中的阴、阳离子有相同的VSEPR模型和空间结构
C.在C60、石墨、金刚石中,碳原子有sp、sp2和sp3三种杂化方式
D.NH3和CO2都能作制冷剂是因为它们有相同类型的分子间作用力
6.★★(2023重庆,10,3分)NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:
下列说法正确的是( )
A.NCl3和SiCl4均为极性分子
B.NCl3和NH3中的N均为sp2杂化
C.NCl3和SiCl4的水解反应机理相同
D.NHCl2和NH3均能与H2O形成氢键
7.★★(2024浙江1月选考,17节选)(3)①H2N—NH2+H+H2N—N,其中—NH2的N原子杂化方式为 ;比较键角∠HNH:H2N—NH2中的—NH2 H2N—N中的—N(填“>”“<”或“=”),请说明理由
。
三年模拟
8.★★(2025届上海闵行中学学情调研,3)气态氯化铝通常以二聚体Al2Cl6的形式存在,其结构如下图所示,更高温度下,二聚体会离解成AlCl3,其分子构型与BF3相似。下列有关AlCl3的说法错误的是( )
A.二聚体Al2Cl6中存在离子键、极性键和非极性键
B.AlCl3分子的空间结构是平面三角形
C.二聚体Al2Cl6中Al原子是sp3杂化
D.BF3中B原子是sp2杂化
9.★★(2025届山西大学附中二诊,13)下列叙述正确的是( )
A.S2与S的中心原子均采用sp3杂化
B.NCl3分子和BCl3分子均为平面三角形结构
C.H2S和CS2分子都是含极性键的极性分子
D.HClO2、HClO3、HClO4三种酸中心原子杂化方式相同,且酸性依次递减
10.★★(2025届湖南长郡中学调研一,5)德国化学家维勒通过蒸发氰酸铵(NH4CNO)水溶液得到了尿素[CO(NH2)2],揭开了人工合成有机化合物的序幕。下列说法正确的是( )
A.组成元素的电负性:N>O>C>H
B.NH4CNO、CO(NH2)2中碳原子均采用sp2杂化
C.N的空间结构为三角锥形
D.NH4CNO的熔点高于CO(NH2)2的熔点
11.★★(2024湖北黄冈中学二模,4)科学研究发现新型含碳化合物COS和C3O2,它们的结构类似CO2,均为直线形分子。下列结论中错误的是( )
A.COS和CO2分子中碳原子的杂化方式均为sp
B.CO2是非极性分子,COS和C3O2也是非极性分子
C.COS、C3O2分子全部由双键构成
D.COS、C3O2分子中所有原子最外层均满足8电子稳定结构
12.★★(2024河南开封三模,9改编)DNA的部分结构如下图所示,其中A为腺嘌呤、G为鸟嘌呤,嘌呤()为平面结构。下列说法正确的是( )
A.第一电离能:H
D.图中碱基互补配对时存在N…H—O氢键
13.★★(2024山西临汾二模,9)在室温或接近室温时呈液态的自由离子构成的物质称为室温离子液体。某离子液体的制备原理如下:
已知X具有类似于苯的芳香性。下列说法正确的是( )
A.基态原子未成对电子数:H
C.Z的阴离子中所有原子均满足8电子稳定结构
D.熔点:Y
五年高考
1.★★(2024江西,2,3分)科学家发现宇宙中存在100多种星际分子。下列关于星际分子说法正确的是( )
A.分子的极性:SiH4>NH3
B.键的极性:H—Cl>H—H
C.键角:H2O>CH4
D.分子中三键的键长:>
2.★★(2024安徽,7,3分)常温常压下羟胺(NH2OH)的水溶液呈碱性,与盐酸反应生成盐酸羟胺[NH3OH]Cl。Kb(NH3·H2O)>Kb(NH2OH)。下列有关物质结构或性质的比较中,正确的是( )
A.键角:NH3>N
B.熔点:NH2OH>[NH3OH]Cl
C.25 ℃同浓度水溶液的pH:[NH3OH]Cl>NH4Cl
D.羟胺分子间氢键的强弱:O—H…O>N—H…N
3.★★(2024山东,9,2分)由O、F、I组成化学式为IO2F的化合物,能体现其成键结构的片段如图所示。下列说法正确的是( )
A.图中代表F原子
B.该化合物中存在过氧键
C.该化合物中I原子存在孤对电子
D.该化合物中所有碘氧键键长相等
4.★★(2024河北,8,3分)从微观视角探析物质结构及性质是学习化学的有效方法。下列实例与解释不符的是( )
选项 实例 解释
A 原子光谱是不连续的线状谱线 原子的能级是量子化的
B CO2、CH2O、CCl4键角依次减小 孤电子对与成键电子对的斥力大于成键电子对之间的斥力
C CsCl晶体中Cs+与8个Cl-配位,而NaCl晶体中Na+与6个Cl-配位 Cs+比Na+的半径大
D 逐个断开CH4中的C—H键,每步所需能量不同 各步中的C—H键所处化学环境不同
5.★★(2022北京,9,3分)由键能数据大小,不能解释下列事实的是( )
化学键 C—H Si—H C O C—O
键能/kJ·mol-1 411 318 799 358
化学键 Si—O C—C Si—Si
键能/kJ·mol-1 452 346 222
A.稳定性:CH4>SiH4
B.键长:
6.★★(2023山东,16节选)卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)-40 ℃时,F2与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为 ,HOF水解反应的产物为 (填化学式)。
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键()。ClO2中Cl原子的轨道杂化方式为 ;O—Cl—O键角 Cl—O—Cl键角(填“>”“<”或“=”)。比较ClO2与Cl2O中Cl—O键的键长并说明原因
。
三年模拟
7.★★(2025届安徽江淮十校第一次联考,7改编)下列有关物质结构或性质的比较中,错误的是( )
A.键角:NH3>H2O
B.中心原子杂化方式:SCN-与CO2的相同
C.键能:F—F>Cl—Cl
D.羟基的极性:苯酚>乙醇
8.★★(2024湖北武汉4月调研,9)键角是重要的键参数之一。下列键角的大小比较正确的是( )
选项 键角 键角的大小比较
A ∠H—N—H [Cu(NH3)4]2+>NH3
B ∠C—C—C 金刚石>石墨
C ∠O—S—O SO3
选项 实例 解释
A 键角:NCl3>PCl3 原子半径:N
C 利用“杯酚”可分离C60和C70 超分子具有自组装的特性
D 沸点:乙醇>二甲醚 乙醇和二甲醚互为同分异构体,但乙醇中存在分子间氢键,而二甲醚中不存在,导致乙醇的沸点高于二甲醚
10.★★(教考衔接:人教版选择性必修2第三章第三节科学·技术·社会)(2025届山东济南开学考,16节选)Ⅱ.离子液体指在室温或室温附近温度下呈液态的盐,广泛应用于电化学研究。1-丁基-3-甲基咪唑六氟磷酸盐是一种离子液体,结构简式如图所示。
(3)阳离子中咪唑环存在大π键,其中提供2个电子形成大π键的N的编号是 ,阴离子的空间结构是 。
(4)结合1-丁基-3-甲基咪唑六氟磷酸盐的结构分析离子液体的熔点一般较低的原因是 。
11.★★(2025届福建厦门一中9月月考,10节选)(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示。下列说法正确的是 (填字母)。
A.含有手性碳原子
B.2号氧提供孤电子对与钛离子形成配位键
C.1~4号原子不在同一平面上
D.∠α大于∠β
(4)钛酸四异丙酯可与EMIM+形成一种易燃物质,EMIM+结构如图,其环上所有原子共平面。大π键可用符号表示,其中m表示参与形成大π键的原子数,n表示形成大π键的电子数。EMIM+中的大π键应表示为 。为使EMIM+以单个形式存在从而获得良好的溶解性,应避免与N原子相连的—CH3、—CH2CH3被H原子替代,其原因是
。
第3节 晶体结构与性质
五年高考
1.★(2021天津,2,3分)下列各组物质的晶体类型相同的是( )
A.SiO2和SO3 B.I2和NaCl
C.Cu和Ag D.SiC和MgO
2.★(2024天津,4,3分)我国学者在碳化硅(SiC)表面制备出超高迁移率半导体外延石墨烯。下列说法正确的是( )
A.SiC是离子化合物
B.SiC晶体的熔点高、硬度大
C.核素14C的质子数为8
D.石墨烯属于烯烃
3.★★(2024湖北,11,3分)黄金按质量分数分级,纯金为24K。Au-Cu合金的三种晶胞结构如图,Ⅱ和Ⅲ是立方晶胞。下列说法错误的是( )
A.Ⅰ为18K金
B.Ⅱ中Au的配位数是12
C.Ⅲ中最小核间距Au-Cu
4.★★(2024湖南,12,3分)Li2CN2是一种高活性的人工固氮产物,其合成反应为2LiH+C+N2 Li2CN2+H2,晶胞如图所示,下列说法错误的是( )
A.合成反应中,还原剂是LiH和C
B.晶胞中含有的Li+个数为4
C.每个C周围与它最近且距离相等的Li+有8个
D.C为V形结构
5.★★(2024黑、吉、辽,14,3分)某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是( )
A.结构1钴硫化物的化学式为Co9S8
B.晶胞2中S与S的最短距离为a
C.晶胞2中距Li最近的S有4个
D.晶胞2和晶胞3表示同一晶体
6.★★(2024安徽,14,3分)研究人员制备了一种具有锂离子通道的导电氧化物(LixLayTiO3),其立方晶胞和导电时Li+迁移过程如下图所示。已知该氧化物中Ti为+4价,La为+3价。下列说法错误的是( )
A.导电时,Ti和La的价态不变
B.若x=,Li+与空位的数目相等
C.与体心最邻近的O原子数为12
D.导电时,空位移动方向与电流方向相反
三年模拟
7.★(教考衔接:人教版选择性必修2第三章第三节·研究与实践)(2024浙江义乌三模,6)明矾常用作净水剂,下列关于明矾大晶体制备实验的说法不正确的是( )
A.配制明矾饱和溶液的温度要控制在比室温高10~15 ℃
B.明矾小晶核要悬挂在饱和溶液中央,可避免形成形状不规整的晶体
C.形成大晶体的过程中,需要敞开玻璃杯静置较长时间
D.本实验中所用仪器都要用蒸馏水洗净
8.★★(2025届四川绵阳一诊,14)AlxCoOy晶体的一种立方晶胞如图所示。已知:Al与O最小间距大于Co与O最小间距,x、y为整数,两个“”之间的最短距离为b nm(设NA为阿伏加德罗常数的值)。下列说法错误的是( )
A.x=1,y=3
B.Al周围最近的O原子数目为12
C.图中体心位置“”一定代表Co
D.晶体的密度为 g/cm3
9.★★(2024吉林三模,13)由Li、Al、Si构成的某三元化合物固态晶胞结构如图所示:
下列说法错误的是( )
A.晶体中Li、Al、Si三种微粒的比例为1∶1∶1
B.图中所指Si原子的坐标为()
C.晶体中与每个Al紧邻的Li为6个,与每个Si紧邻的Si为12个
D.晶体中Al和Li构成CsCl型晶体结构,晶体中Al和Si构成金刚石型晶体结构
10.★★(2024湖南岳阳二模,9)一种超导材料(仅由Cs、Ag、F三种元素组成)的长方体晶胞结构如图所示(已知MP=QR),下列说法错误的是( )
A.基态47Ag位于元素周期表的ds区
B.若N点原子分数坐标为(,0),则P点原子分数坐标为(0,0,)
C.M、N之间的距离为a pm
D.该晶体的化学式为CsAgF4
11.★★(2025届黑龙江哈尔滨三中8月月考,16节选)(6)TiO2有三种类型晶体结构,其中一种晶胞结构如图所示。
①Ti的价电子排布式为 。
②晶胞中白球代表 (填“Ti”或“O”),该晶体的密度为 g·cm-3(用含a、b、NA的代数式表示,NA为阿伏加德罗常数的值)。
考法突破11 物质熔、沸点高低的比较
五年高考
1.★(2024山东,4,2分)下列物质均为共价晶体且成键结构相似,其中熔点最低的是( )
A.金刚石(C)
B.单晶硅(Si)
C.金刚砂(SiC)
D.氮化硼(BN,立方相)
2.★★(2021海南,11,4分)关于NH3性质的解释合理的是( )
选项 性质 解释
A 比PH3容易液化 NH3分子间的范德华力更大
B 熔点高于PH3 N—H键的键能比P—H大
C 能与Ag+以配位键结合 NH3中氮原子有孤电子对
D 氨水中存在N NH3·H2O是离子化合物
3.★★(2022山东,5,2分)AlN、GaN属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在N—Al键、N—Ga键。下列说法错误的是( )
A.GaN的熔点高于AlN
B.晶体中所有化学键均为极性键
C.晶体中所有原子均采取sp3杂化
D.晶体中所有原子的配位数均相同
4.★★(2024浙江6月选考,14,3分)Si5Cl10中的Si原子均通过sp3杂化轨道成键,与NaOH溶液反应Si元素均转化成Na2SiO3。下列说法不正确的是( )
A.Si5Cl10分子结构可能是
B.Si5Cl10与水反应可生成一种强酸
C.Si5Cl10与NaOH溶液反应会产生H2
D.Si5Cl10沸点低于相同结构的Si5Br10
三年模拟
5.★★(2024山东淄博二模,9)二维磁性材料卤化铬CrXn混合晶体结构如图所示,在纯氧中发生光氧化反应生成长链状CrOm和X2。下列说法错误的是( )
A.化学键中离子键成分百分数:CrCln>CrBrn>CrIn
B.n=m=3
C.生成1 mol X—X键转移3 mol电子
D.熔点:CrCln>CrBrn>CrIn
6.★★(2024湖北宜荆荆随恩二模联考,7)下列不符合陈述Ⅰ、陈述Ⅱ均正确,且存在因果关系的选项是( )
选项 陈述Ⅰ 陈述Ⅱ
A 第一电离能:Na>K Na与K位于同一主族,原子半径:Na
B 碳正离子稳定性:> Br电负性比F小,电子云更加偏向碳正离子
C 熔点:金刚石>石墨 金刚石属于共价晶体只含共价键,石墨属于混合型晶体,既存在共价键又存在范德华力
D 熔点:AlF3(1 040 ℃)>AlCl3(178 ℃) AlF3属于离子晶体,AlCl3属于分子晶体
7.★★(2025届四川绵阳南山中学9月月考,15节选)(3)②锡的卤化物熔点数据如下表,结合变化规律说明原因: 。
物质 SnF4 SnCl4 SnBr4 SnI4
熔点/℃ 442 -34 29 143
微专题2 晶胞结构分析与计算
五年高考
1.★★(2024江西,12,3分)NbO的立方晶胞如图,晶胞参数为a nm,P的分数坐标为(0,0,0),阿伏加德罗常数的值为NA,下列说法正确的是 ( )
A.Nb的配位数是6
B.Nb和O最短距离为a nm
C.晶体密度ρ= g/cm3
D.M的分数坐标为
2.★★(2024河北,12,3分)金属铋及其化合物广泛应用于电子设备、医药等领域。如图是铋的一种氟化物的立方晶胞及晶胞中M、N、P、Q点的截面图,晶胞的边长为a pm,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.该铋氟化物的化学式为BiF3
B.粒子S、T之间的距离为a pm
C.该晶体的密度为 g·cm-3
D.晶体中与铋离子最近且等距的氟离子有6个
3.★★(2023辽宁,14,3分)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为 g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
4.★★(2023北京,15节选)硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根(S2)可看作是S中的一个O原子被S原子取代的产物。
(4)同位素示踪实验可证实S2中两个S原子的化学环境不同,实验过程为S S2 Ag2S+S。过程ⅱ中,S2断裂的只有硫硫键,若过程ⅰ所用试剂是NSO3和35S,过程ⅱ含硫产物是 。
(5)MgS2O3·6H2O的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
晶胞中的[Mg(H2O)6]2+个数为 。
已知MgS2O3·6H2O的摩尔质量是M g·mol-1,阿伏加德罗常数的值为NA,该晶体的密度为
g·cm-3。(1 nm=10-7 cm)
(6)浸金时,S2作为配体可提供孤电子对与Au+形成[Au(S2O3)2]3-。分别判断S2中的中心S原子和端基S原子能否做配位原子并说明理由:
。
5.★★(2024北京,15节选)(3)白锡和灰锡是单质Sn的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn原子周围与它最近且距离相等的Sn原子有 个。
②若白锡和灰锡的晶胞体积分别为v1 nm3和v2 nm3,则白锡和灰锡晶体的密度之比是 。
6.★★(2023山东,16节选)(3)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
7.★★(2024福建,11节选)(5)LiOH的晶胞结构如图所示。
①晶体中与一个O紧邻的Li有 个。
②一个Li与所有紧邻O形成的空间结构为 。
③晶体中微粒间作用力有 (填标号)。
a.氢键 b.离子键 c.金属键 d.范德华力 e.极性共价键 f.非极性共价键
8.★★(2022全国乙,35,15分)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有 ,其中能量较高的是 。(填标号)
a.1s22s22p43s1 b.1s22s22p43d2
c.1s22s12p5 d.1s22s22p33p2
(2)①一氯乙烯(C2H3Cl)分子中,C的一个 杂化轨道与Cl的3px轨道形成C—Cl
键,并且Cl的3pz轨道与C的2pz轨道形成3中心4电子的大π键()。
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长的顺序是 ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C—Cl键越强;(ⅱ) 。
(3)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为
。解释X的熔点比Y高的原因 。
(4)α-AgI晶体中I-作体心立方堆积(如图所示),Ag+主要分布在由I-构成的四面体、八面体等空隙中。在电场作用下,Ag+不需要克服太大的阻力即可发生迁移。因此,α-AgI晶体在电池中可作为 。
已知阿伏加德罗常数为NA,则α-AgI晶体的摩尔体积Vm= m3·mol-1(列出算式)。
三年模拟
9.★★(2025届湖北“宜荆荆恩”起点考,12)在不同的压强和温度区间,可以获得不同结构的氮分子结晶。部分固态氮分子相的存在范围及晶胞结构如下表所示,其中α相晶胞是立方晶胞,晶胞边长为a pm,下列说法错误的是( )
分子相 α相 γ相
温度和压强 <35.6 K, <0.35 GPa <40~0 K, 0.35~1.96 GPa
结构
A.继续增大压强,可能形成共价晶体结构的氮同素异形体
B.α相、γ相晶胞中,分子配位数均为12
C.α相、γ相晶胞中,原子个数之比为2∶1
D.α相晶体密度为 g·cm-3
10.★★(2025届黑龙江大庆第一次质检,14)黄铁矿晶体的晶胞如图所示,晶胞参数为a nm,晶胞中Fe2+位于所形成的正八面体的体心,M点分数坐标为(0,,0),NA为阿伏加德罗常数的值,下列说法错误的是( )
A.N点的分数坐标为(1,,1)
B.晶胞中与Fe2+等距且最近的Fe2+数目为8
C.该晶体密度为×1023 g·cm-3
D.若八面体边长为d,则d=a nm
11.★★(2025届海南农垦中学第一次月考,19节选)(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7围成)和正八面体空隙(3、6、7、8、9、12围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为 。
(6)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为 pm(列出计算式即可)。
12.★★(2025届山西长治9月月考,17节选)(6)某化合物的晶胞结构如图甲所示,沿x轴方向的投影为图乙,晶胞底面显示为图丙,晶胞参数a≠c;图丙中Ca与N的距离为 pm;化合物的化学式是 ,其摩尔质量为M g·mol-1,阿伏加德罗常数的值是NA,则晶体的密度为 g·cm-3(列出计算表达式)。
第六章 化学键 分子和晶体的结构与性质
第1节 化学键
五年高考
1.★(2024黑、吉、辽,2,3分)下列化学用语或表述正确的是( )
A.中子数为1的氦核素He
B.SiO2的晶体类型:分子晶体
C.F2的共价键类型:p-p σ键
D.PCl3的空间结构:平面三角形
答案 C
2.★(2022天津,4,3分)利用反应2NH3+NaClO N2H4+NaCl+H2O可制备N2H4。下列叙述正确的是( )
A.NH3分子有孤电子对,可作配体
B.NaCl晶体可以导电
C.1个N2H4分子中有4个σ键
D.NaClO和NaCl均为离子化合物,它们所含的化学键类型相同
答案 A
3.★(2024江苏,7,3分)下列有关反应描述正确的是 ( )
A.CH3CH2OH催化氧化为CH3CHO,CH3CH2OH断裂C—O键
B.氟氯烃破坏臭氧层,氟氯烃产生的氯自由基改变O3分解的历程
C.丁烷催化裂化为乙烷和乙烯,丁烷断裂σ键和π键
D.石墨转化为金刚石,碳原子轨道的杂化类型由sp3转变为sp2
答案 B
4.★★(2024湖南,2,3分)下列化学用语表述错误的是 ( )
A.NaOH的电子式:
B.异丙基的结构简式:
C.NaCl溶液中的水合离子:
D.Cl2分子中σ键的形成:
答案 C
三年模拟
5.★(2025届广西南宁二中摸底,2改编)实验室制备少量氮气的反应为NaNO2+NH4Cl NaCl+N2↑+2H2O。下列与该反应有关的化学用语表述错误的是( )
A.N中的σ键数目为4
B.N2的电子式为
C.NaCl的形成过程可表示为
D.H2O的VSEPR模型为
答案 B
6.★★(2024贵州遵义三模,11改编)配合物种类繁多,新的配合物由于纷繁复杂的有机化合物而层出不穷。叶绿素、血红素和维生素B12都是配合物。其中一种叶绿素的结构如图所示。下列说法错误的是( )
A.叶绿素中Mg元素的化合价为+2
B.Mg的配位数为4
C.叶绿素中元素电负性:O>C>H>Mg
D.叶绿素分子中碳原子采取sp2杂化
答案 D
第2节 分子结构与性质
五年高考
1.★(2024广西,2,3分)光照时,纳米TiO2能使水产生羟基自由基·OH,可用于处理废水。下列表述正确的是( )
A.基态Ti的价电子排布式:3d2
B.·OH的电子式:
C.H2O的VSEPR模型:
D.O的一种核素:8O
答案 B
2.★(2024重庆,3,3分)下列各分子既含有sp2杂化的原子又能与H2O形成氢键的是( )
A.CH3CH3 B.CH2CHBr
C.CH3COOH D.CH3CH2NH2
答案 C
3.★(2024湖北,5,3分)基本概念和理论是化学思维的基石。下列叙述错误的是( )
A.VSEPR理论认为VSEPR模型与分子的空间结构相同
B.元素性质随着原子序数递增而呈周期性变化的规律称为元素周期律
C.泡利原理认为一个原子轨道内最多只能容纳两个自旋相反的电子
D.sp3杂化轨道由1个s轨道和3个p轨道混杂而成
答案 A
4.★(2024湖北,8,3分)结构决定性质,性质决定用途。下列事实解释错误的是( )
事实 解释
A 甘油是黏稠液体 甘油分子间的氢键较强
B 王水溶解铂 浓盐酸增强了浓硝酸的氧化性
C 冰的密度小于干冰 冰晶体中水分子的空间利用率相对较低
D 石墨能导电 未杂化的p轨道重叠使电子可在整个碳原子平面内运动
答案 B
5.★★(2024湖南,4,3分)下列有关化学概念或性质的判断错误的是( )
A.CH4分子是正四面体结构,则CH2Cl2没有同分异构体
B.环己烷与苯分子中C—H键的键能相等
C.甲苯的质谱图中,质荷比为92的峰归属于
D.由R4N+与P组成的离子液体常温下呈液态,与其离子的体积较大有关
答案 B
6.★★(2023湖南,4,3分)下列有关物质结构和性质的说法错误的是 ( )
A.含有手性碳原子的分子叫做手性分子
B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
C.酰胺在酸或碱存在并加热的条件下可发生水解反应
D.冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子
答案 A
7.★★(2024安徽,8,3分)某催化剂结构简式如图所示。下列说法错误的是( )
A.该物质中Ni为+2价
B.基态原子的第一电离能:Cl>P
C.该物质中C和P均采取sp2杂化
D.基态Ni原子价电子排布式为3d84s2
答案 C
8.★★(2024黑、吉、辽,9,3分)环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。下列说法错误的是( )
A.环六糊精属于寡糖
B.非极性分子均可被环六糊精包合形成超分子
C.图2中甲氧基对位暴露在反应环境中
D.可用萃取法分离环六糊精和氯代苯甲醚
答案 B
9.★★(2024湖北,15,3分)科学家合成了一种如图所示的纳米“分子客车”,能装载多种稠环芳香烃。三种芳烃与“分子客车”的结合常数(值越大越稳定)见下表。下列说法错误的是( )
芳烃 芘 并四苯 蒄
结构
结合常数 385 3 764 176 000
A.芳烃与“分子客车”可通过分子间相互作用形成超分子
B.并四苯直立装载与平躺装载的稳定性基本相同
C.从分子大小适配看“分子客车”可装载2个芘
D.芳烃π电子数越多越有利于和“分子客车”的结合
答案 B
10.★★(双选)(2024海南,11,4分)某温控质子驱动反应如图所示。下列说法错误的是( )
A.Ⅰ转化为Ⅱ后,N1—C2键长变短
B.基态N+离子的核外电子排布式为1s22s22p3
C.Ⅰ具备在热敏指示剂方面的应用前景
D.加热时,Ⅰ的O1与H+结合,O1—C1键断开
答案 BD
11.★★(2024浙江6月选考,17节选)(3)化合物HA、HB、HC和HD的结构如图所示。
HA HB
HC HD
①HA、HB和HC中羟基与水均可形成氢键(—O—H…OH2),按照氢键由强到弱对三种酸排序 ,请说明理由
。
②已知HC、HD钠盐的碱性NaC>NaD,请从结构角度说明理由
。
答案 (3)①HC>HB>HA 电负性:O>S>Se,电负性越大,O—H键电子云就越偏向中心C原子,O—H键的极性就越强,与H2O分子形成氢键的强度就越大
②原子半径S>O,键长S—H>O—H,S—H键更易断键电离,因此HD的酸性更强,酸根更不易水解,碱性NaC>NaD
三年模拟
12.★★(2024山东潍坊二模,4)下列分子的空间结构相同的是( )
A.XeO3和NH3 B.COCl2和SOCl2
C.ClF3和BF3 D.CO2和SCl2
答案 A
13.★★(2024广东湛江二模,8)下列有关物质结构与性质的表述正确的是( )
A.N—H键的极性大于C—H键的极性,NH3分子的极性小于CH4
B.I2易溶于CCl4,可从I2和CCl4都是非极性分子的角度解释
C.HNO3中的氢键数量比H3PO4少,可推断HNO3的稳定性比H3PO4差
D.超分子是两种或两种以上的分子(包括离子)通过化学键形成的分子聚集体
答案 B
14.★★(2025届江西红色十校第一次联考,2)氮的循环是生态循环系统的重要组成部分,如图所示。
下列叙述错误的是( )
A.反应①产物中N原子杂化类型相同
B.反应②产物分子的VSEPR模型都是平面三角形
C.氮气分子中π键和σ键数目之比为1∶2
D.键角:N>NH3
答案 C
15.★★(2025届湖南长郡中学调研一,7)超分子化学的研究日益深入。分离C60和C70就借助了超分子的“分子识别”特性,分离流程如图所示。下列有关说法错误的是( )
A.超分子是通过分子间相互作用形成的高分子
B.氯仿的作用是溶解“杯酚”
C.“杯酚”是极性分子
D.C60和C70互为同素异形体
答案 A
16.★★(2025届云南昆明一中第二次月考,6)物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
选项 性质差异 结构因素
A 熔点:石英 干冰 晶体类型差异
B Ka:CCl3COOH
D 键角:PF3
17.★★(2025届重庆涪陵五中开学考,17节选)金属铂(Pt)及其化合物在催化剂和电镀等领域有着重要的应用。回答下列问题:
(1)PtCl2(NH3)2是铂的重要配位化合物,它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙水解产物的化学式均为Pt(OH)2(NH3)2。
①在CCl4中的溶解度:甲 乙(填“>”“<”或“=”)。
②PtCl2(NH3)2发生水解反应的化学方程式为 。
③依据文中信息,推断PtCl2(NH3)2的空间结构为 (填“四面体结构”或“平面四边形”)。
④PtCl2(NH3)2和Pt(C2O4)(NH3)2中Pt2+的配体数不同,但配位数均为4,原因是 。
答案 (1)①< ②PtCl2(NH3)2+2H2O Pt(OH)2(NH3)2+2HCl ③平面四边形 ④每个C2中有2个原子与Pt2+配位
考法突破9 杂化轨道类型及分子极性的判断
五年高考
1.★(2023海南,4,2分)下列有关元素单质或化合物的叙述正确的是( )
A.P4分子呈正四面体,键角为109°28'
B.NaCl焰色为黄色,与Cl电子跃迁有关
C.基态Cu原子核外电子排布符合构造原理
D.OF2是由极性键构成的极性分子
答案 D
2.★★(2023湖北,9,3分)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是 ( )
A.CH4和H2O的VSEPR模型均为四面体
B.S和C的空间构型均为平面三角形
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
答案 A
3.★★(2024湖南,9,3分)通过理论计算方法优化了P和Q的分子结构,P和Q呈平面六元并环结构,原子的连接方式如图所示,下列说法错误的是( )
A.P为非极性分子,Q为极性分子
B.第一电离能:B
D.P和Q分子中C、B和N均为sp2杂化
答案 A
4.★★(2024北京,9,3分)氘代氨(ND3)可用于反应机理研究。下列两种方法均可得到ND3:①Mg3N2与D2O的水解反应;②NH3与D2O反应。下列说法不正确的是( )
A.NH3和ND3可用质谱法区分
B.NH3和ND3均为极性分子
C.方法①的化学方程式是Mg3N2+6D2O 3Mg(OD)2+2ND3↑
D.方法②得到的产品纯度比方法①的高
答案 D
5.★★(2024河北,9,3分)NH4ClO4是火箭固体燃料重要的氧载体,与某些易燃物作用可全部生成气态产物,如:NH4ClO4+2C NH3↑+2CO2↑+HCl↑。下列有关化学用语或表述正确的是( )
A.HCl的形成过程可表示为
B.NH4ClO4中的阴、阳离子有相同的VSEPR模型和空间结构
C.在C60、石墨、金刚石中,碳原子有sp、sp2和sp3三种杂化方式
D.NH3和CO2都能作制冷剂是因为它们有相同类型的分子间作用力
答案 B
6.★★(2023重庆,10,3分)NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:
下列说法正确的是( )
A.NCl3和SiCl4均为极性分子
B.NCl3和NH3中的N均为sp2杂化
C.NCl3和SiCl4的水解反应机理相同
D.NHCl2和NH3均能与H2O形成氢键
答案 D
7.★★(2024浙江1月选考,17节选)(3)①H2N—NH2+H+H2N—N,其中—NH2的N原子杂化方式为 ;比较键角∠HNH:H2N—NH2中的—NH2 H2N—N中的—N(填“>”“<”或“=”),请说明理由
。
答案 (3)①sp3 < —NH2和—中N原子均采取sp3杂化,—NH2中N原子上有1个孤电子对,而—N中N原子上没有孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力
三年模拟
8.★★(2025届上海闵行中学学情调研,3)气态氯化铝通常以二聚体Al2Cl6的形式存在,其结构如下图所示,更高温度下,二聚体会离解成AlCl3,其分子构型与BF3相似。下列有关AlCl3的说法错误的是( )
A.二聚体Al2Cl6中存在离子键、极性键和非极性键
B.AlCl3分子的空间结构是平面三角形
C.二聚体Al2Cl6中Al原子是sp3杂化
D.BF3中B原子是sp2杂化
答案 A
9.★★(2025届山西大学附中二诊,13)下列叙述正确的是( )
A.S2与S的中心原子均采用sp3杂化
B.NCl3分子和BCl3分子均为平面三角形结构
C.H2S和CS2分子都是含极性键的极性分子
D.HClO2、HClO3、HClO4三种酸中心原子杂化方式相同,且酸性依次递减
答案 A
10.★★(2025届湖南长郡中学调研一,5)德国化学家维勒通过蒸发氰酸铵(NH4CNO)水溶液得到了尿素[CO(NH2)2],揭开了人工合成有机化合物的序幕。下列说法正确的是( )
A.组成元素的电负性:N>O>C>H
B.NH4CNO、CO(NH2)2中碳原子均采用sp2杂化
C.N的空间结构为三角锥形
D.NH4CNO的熔点高于CO(NH2)2的熔点
答案 D
11.★★(2024湖北黄冈中学二模,4)科学研究发现新型含碳化合物COS和C3O2,它们的结构类似CO2,均为直线形分子。下列结论中错误的是( )
A.COS和CO2分子中碳原子的杂化方式均为sp
B.CO2是非极性分子,COS和C3O2也是非极性分子
C.COS、C3O2分子全部由双键构成
D.COS、C3O2分子中所有原子最外层均满足8电子稳定结构
答案 B
12.★★(2024河南开封三模,9改编)DNA的部分结构如下图所示,其中A为腺嘌呤、G为鸟嘌呤,嘌呤()为平面结构。下列说法正确的是( )
A.第一电离能:H
D.图中碱基互补配对时存在N…H—O氢键
答案 C
13.★★(2024山西临汾二模,9)在室温或接近室温时呈液态的自由离子构成的物质称为室温离子液体。某离子液体的制备原理如下:
已知X具有类似于苯的芳香性。下列说法正确的是( )
A.基态原子未成对电子数:H
C.Z的阴离子中所有原子均满足8电子稳定结构
D.熔点:Y
考法突破10 键参数大小的比较 大π键分析
五年高考
1.★★(2024江西,2,3分)科学家发现宇宙中存在100多种星际分子。下列关于星际分子说法正确的是( )
A.分子的极性:SiH4>NH3
B.键的极性:H—Cl>H—H
C.键角:H2O>CH4
D.分子中三键的键长:>
答案 B
2.★★(2024安徽,7,3分)常温常压下羟胺(NH2OH)的水溶液呈碱性,与盐酸反应生成盐酸羟胺[NH3OH]Cl。Kb(NH3·H2O)>Kb(NH2OH)。下列有关物质结构或性质的比较中,正确的是( )
A.键角:NH3>N
B.熔点:NH2OH>[NH3OH]Cl
C.25 ℃同浓度水溶液的pH:[NH3OH]Cl>NH4Cl
D.羟胺分子间氢键的强弱:O—H…O>N—H…N
答案 D
3.★★(2024山东,9,2分)由O、F、I组成化学式为IO2F的化合物,能体现其成键结构的片段如图所示。下列说法正确的是( )
A.图中代表F原子
B.该化合物中存在过氧键
C.该化合物中I原子存在孤对电子
D.该化合物中所有碘氧键键长相等
答案 C
4.★★(2024河北,8,3分)从微观视角探析物质结构及性质是学习化学的有效方法。下列实例与解释不符的是( )
选项 实例 解释
A 原子光谱是不连续的线状谱线 原子的能级是量子化的
B CO2、CH2O、CCl4键角依次减小 孤电子对与成键电子对的斥力大于成键电子对之间的斥力
C CsCl晶体中Cs+与8个Cl-配位,而NaCl晶体中Na+与6个Cl-配位 Cs+比Na+的半径大
D 逐个断开CH4中的C—H键,每步所需能量不同 各步中的C—H键所处化学环境不同
答案 B
5.★★(2022北京,9,3分)由键能数据大小,不能解释下列事实的是( )
化学键 C—H Si—H C O C—O
键能/kJ·mol-1 411 318 799 358
化学键 Si—O C—C Si—Si
键能/kJ·mol-1 452 346 222
A.稳定性:CH4>SiH4
B.键长:
答案 C
6.★★(2023山东,16节选)卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)-40 ℃时,F2与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为 ,HOF水解反应的产物为 (填化学式)。
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键()。ClO2中Cl原子的轨道杂化方式为 ;O—Cl—O键角 Cl—O—Cl键角(填“>”“<”或“=”)。比较ClO2与Cl2O中Cl—O键的键长并说明原因
。
答案 (1)分子晶体 HF和H2O2 (2)sp2 > ClO2中存在大π键,Cl2O中仅存在Cl—O σ键,所以ClO2中Cl—O键的键长更短
三年模拟
7.★★(2025届安徽江淮十校第一次联考,7改编)下列有关物质结构或性质的比较中,错误的是( )
A.键角:NH3>H2O
B.中心原子杂化方式:SCN-与CO2的相同
C.键能:F—F>Cl—Cl
D.羟基的极性:苯酚>乙醇
答案 C
8.★★(2024湖北武汉4月调研,9)键角是重要的键参数之一。下列键角的大小比较正确的是( )
选项 键角 键角的大小比较
A ∠H—N—H [Cu(NH3)4]2+>NH3
B ∠C—C—C 金刚石>石墨
C ∠O—S—O SO3
9.★★(2024辽宁凌源三模,11)物质的结构决定其性质。下列实例与解释不相符的是( )
选项 实例 解释
A 键角:NCl3>PCl3 原子半径:N
C 利用“杯酚”可分离C60和C70 超分子具有自组装的特性
D 沸点:乙醇>二甲醚 乙醇和二甲醚互为同分异构体,但乙醇中存在分子间氢键,而二甲醚中不存在,导致乙醇的沸点高于二甲醚
答案 C
10.★★(教考衔接:人教版选择性必修2第三章第三节科学·技术·社会)(2025届山东济南开学考,16节选)Ⅱ.离子液体指在室温或室温附近温度下呈液态的盐,广泛应用于电化学研究。1-丁基-3-甲基咪唑六氟磷酸盐是一种离子液体,结构简式如图所示。
(3)阳离子中咪唑环存在大π键,其中提供2个电子形成大π键的N的编号是 ,阴离子的空间结构是 。
(4)结合1-丁基-3-甲基咪唑六氟磷酸盐的结构分析离子液体的熔点一般较低的原因是 。
答案 (3)① 正八面体
(4)离子液体中阴、阳离子体积很大,结构松散,导致阴、阳离子之间的作用力较小,熔点较低
11.★★(2025届福建厦门一中9月月考,10节选)(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示。下列说法正确的是 (填字母)。
A.含有手性碳原子
B.2号氧提供孤电子对与钛离子形成配位键
C.1~4号原子不在同一平面上
D.∠α大于∠β
(4)钛酸四异丙酯可与EMIM+形成一种易燃物质,EMIM+结构如图,其环上所有原子共平面。大π键可用符号表示,其中m表示参与形成大π键的原子数,n表示形成大π键的电子数。EMIM+中的大π键应表示为 。为使EMIM+以单个形式存在从而获得良好的溶解性,应避免与N原子相连的—CH3、—CH2CH3被H原子替代,其原因是
。
答案 (3)BD
(4) 由于氮原子上连有氢原子,易形成氢键,使该离子不易以单个形式存在,无法获得良好的溶解性
第3节 晶体结构与性质
五年高考
1.★(2021天津,2,3分)下列各组物质的晶体类型相同的是( )
A.SiO2和SO3 B.I2和NaCl
C.Cu和Ag D.SiC和MgO
答案 C
2.★(2024天津,4,3分)我国学者在碳化硅(SiC)表面制备出超高迁移率半导体外延石墨烯。下列说法正确的是( )
A.SiC是离子化合物
B.SiC晶体的熔点高、硬度大
C.核素14C的质子数为8
D.石墨烯属于烯烃
答案 B
3.★★(2024湖北,11,3分)黄金按质量分数分级,纯金为24K。Au-Cu合金的三种晶胞结构如图,Ⅱ和Ⅲ是立方晶胞。下列说法错误的是( )
A.Ⅰ为18K金
B.Ⅱ中Au的配位数是12
C.Ⅲ中最小核间距Au-Cu
答案 C
4.★★(2024湖南,12,3分)Li2CN2是一种高活性的人工固氮产物,其合成反应为2LiH+C+N2 Li2CN2+H2,晶胞如图所示,下列说法错误的是( )
A.合成反应中,还原剂是LiH和C
B.晶胞中含有的Li+个数为4
C.每个C周围与它最近且距离相等的Li+有8个
D.C为V形结构
答案 D
5.★★(2024黑、吉、辽,14,3分)某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是( )
A.结构1钴硫化物的化学式为Co9S8
B.晶胞2中S与S的最短距离为a
C.晶胞2中距Li最近的S有4个
D.晶胞2和晶胞3表示同一晶体
答案 B
6.★★(2024安徽,14,3分)研究人员制备了一种具有锂离子通道的导电氧化物(LixLayTiO3),其立方晶胞和导电时Li+迁移过程如下图所示。已知该氧化物中Ti为+4价,La为+3价。下列说法错误的是( )
A.导电时,Ti和La的价态不变
B.若x=,Li+与空位的数目相等
C.与体心最邻近的O原子数为12
D.导电时,空位移动方向与电流方向相反
答案 B
三年模拟
7.★(教考衔接:人教版选择性必修2第三章第三节·研究与实践)(2024浙江义乌三模,6)明矾常用作净水剂,下列关于明矾大晶体制备实验的说法不正确的是( )
A.配制明矾饱和溶液的温度要控制在比室温高10~15 ℃
B.明矾小晶核要悬挂在饱和溶液中央,可避免形成形状不规整的晶体
C.形成大晶体的过程中,需要敞开玻璃杯静置较长时间
D.本实验中所用仪器都要用蒸馏水洗净
答案 C
8.★★(2025届四川绵阳一诊,14)AlxCoOy晶体的一种立方晶胞如图所示。已知:Al与O最小间距大于Co与O最小间距,x、y为整数,两个“”之间的最短距离为b nm(设NA为阿伏加德罗常数的值)。下列说法错误的是( )
A.x=1,y=3
B.Al周围最近的O原子数目为12
C.图中体心位置“”一定代表Co
D.晶体的密度为 g/cm3
答案 D
9.★★(2024吉林三模,13)由Li、Al、Si构成的某三元化合物固态晶胞结构如图所示:
下列说法错误的是( )
A.晶体中Li、Al、Si三种微粒的比例为1∶1∶1
B.图中所指Si原子的坐标为()
C.晶体中与每个Al紧邻的Li为6个,与每个Si紧邻的Si为12个
D.晶体中Al和Li构成CsCl型晶体结构,晶体中Al和Si构成金刚石型晶体结构
答案 D
10.★★(2024湖南岳阳二模,9)一种超导材料(仅由Cs、Ag、F三种元素组成)的长方体晶胞结构如图所示(已知MP=QR),下列说法错误的是( )
A.基态47Ag位于元素周期表的ds区
B.若N点原子分数坐标为(,0),则P点原子分数坐标为(0,0,)
C.M、N之间的距离为a pm
D.该晶体的化学式为CsAgF4
答案 D
11.★★(2025届黑龙江哈尔滨三中8月月考,16节选)(6)TiO2有三种类型晶体结构,其中一种晶胞结构如图所示。
①Ti的价电子排布式为 。
②晶胞中白球代表 (填“Ti”或“O”),该晶体的密度为 g·cm-3(用含a、b、NA的代数式表示,NA为阿伏加德罗常数的值)。
答案 (6)①3d24s2 ②O
考法突破11 物质熔、沸点高低的比较
五年高考
1.★(2024山东,4,2分)下列物质均为共价晶体且成键结构相似,其中熔点最低的是( )
A.金刚石(C)
B.单晶硅(Si)
C.金刚砂(SiC)
D.氮化硼(BN,立方相)
答案 B
2.★★(2021海南,11,4分)关于NH3性质的解释合理的是( )
选项 性质 解释
A 比PH3容易液化 NH3分子间的范德华力更大
B 熔点高于PH3 N—H键的键能比P—H大
C 能与Ag+以配位键结合 NH3中氮原子有孤电子对
D 氨水中存在N NH3·H2O是离子化合物
答案 C
3.★★(2022山东,5,2分)AlN、GaN属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在N—Al键、N—Ga键。下列说法错误的是( )
A.GaN的熔点高于AlN
B.晶体中所有化学键均为极性键
C.晶体中所有原子均采取sp3杂化
D.晶体中所有原子的配位数均相同
答案 A
4.★★(2024浙江6月选考,14,3分)Si5Cl10中的Si原子均通过sp3杂化轨道成键,与NaOH溶液反应Si元素均转化成Na2SiO3。下列说法不正确的是( )
A.Si5Cl10分子结构可能是
B.Si5Cl10与水反应可生成一种强酸
C.Si5Cl10与NaOH溶液反应会产生H2
D.Si5Cl10沸点低于相同结构的Si5Br10
答案 A
三年模拟
5.★★(2024山东淄博二模,9)二维磁性材料卤化铬CrXn混合晶体结构如图所示,在纯氧中发生光氧化反应生成长链状CrOm和X2。下列说法错误的是( )
A.化学键中离子键成分百分数:CrCln>CrBrn>CrIn
B.n=m=3
C.生成1 mol X—X键转移3 mol电子
D.熔点:CrCln>CrBrn>CrIn
答案 C
6.★★(2024湖北宜荆荆随恩二模联考,7)下列不符合陈述Ⅰ、陈述Ⅱ均正确,且存在因果关系的选项是( )
选项 陈述Ⅰ 陈述Ⅱ
A 第一电离能:Na>K Na与K位于同一主族,原子半径:Na
B 碳正离子稳定性:> Br电负性比F小,电子云更加偏向碳正离子
C 熔点:金刚石>石墨 金刚石属于共价晶体只含共价键,石墨属于混合型晶体,既存在共价键又存在范德华力
D 熔点:AlF3(1 040 ℃)>AlCl3(178 ℃) AlF3属于离子晶体,AlCl3属于分子晶体
答案 C
7.★★(2025届四川绵阳南山中学9月月考,15节选)(3)②锡的卤化物熔点数据如下表,结合变化规律说明原因: 。
物质 SnF4 SnCl4 SnBr4 SnI4
熔点/℃ 442 -34 29 143
答案 (3)②SnF4属于离子晶体,SnCl4、SnBr4、SnI4属于分子晶体,离子晶体的熔点比分子晶体高,分子晶体的相对分子质量越大,范德华力越强,熔点越高
微专题2 晶胞结构分析与计算
五年高考
1.★★(2024江西,12,3分)NbO的立方晶胞如图,晶胞参数为a nm,P的分数坐标为(0,0,0),阿伏加德罗常数的值为NA,下列说法正确的是 ( )
A.Nb的配位数是6
B.Nb和O最短距离为a nm
C.晶体密度ρ= g/cm3
D.M的分数坐标为
答案 D
2.★★(2024河北,12,3分)金属铋及其化合物广泛应用于电子设备、医药等领域。如图是铋的一种氟化物的立方晶胞及晶胞中M、N、P、Q点的截面图,晶胞的边长为a pm,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.该铋氟化物的化学式为BiF3
B.粒子S、T之间的距离为a pm
C.该晶体的密度为 g·cm-3
D.晶体中与铋离子最近且等距的氟离子有6个
答案 D
3.★★(2023辽宁,14,3分)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为 g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
答案 C
4.★★(2023北京,15节选)硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根(S2)可看作是S中的一个O原子被S原子取代的产物。
(4)同位素示踪实验可证实S2中两个S原子的化学环境不同,实验过程为S S2 Ag2S+S。过程ⅱ中,S2断裂的只有硫硫键,若过程ⅰ所用试剂是NSO3和35S,过程ⅱ含硫产物是 。
(5)MgS2O3·6H2O的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
晶胞中的[Mg(H2O)6]2+个数为 。
已知MgS2O3·6H2O的摩尔质量是M g·mol-1,阿伏加德罗常数的值为NA,该晶体的密度为
g·cm-3。(1 nm=10-7 cm)
(6)浸金时,S2作为配体可提供孤电子对与Au+形成[Au(S2O3)2]3-。分别判断S2中的中心S原子和端基S原子能否做配位原子并说明理由:
。
答案 (4)AS、32S
(5)4 ×1021
(6)S2中中心S原子不能做配位原子,端基S原子能做配位原子;因为S2中中心S原子无孤电子对,端基S原子有孤电子对
5.★★(2024北京,15节选)(3)白锡和灰锡是单质Sn的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn原子周围与它最近且距离相等的Sn原子有 个。
②若白锡和灰锡的晶胞体积分别为v1 nm3和v2 nm3,则白锡和灰锡晶体的密度之比是 。
答案 (3)①4 ②
6.★★(2023山东,16节选)(3)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
答案 (3)CuCl2+4K+2F2 2KCl+K2CuF4
7.★★(2024福建,11节选)(5)LiOH的晶胞结构如图所示。
①晶体中与一个O紧邻的Li有 个。
②一个Li与所有紧邻O形成的空间结构为 。
③晶体中微粒间作用力有 (填标号)。
a.氢键 b.离子键 c.金属键 d.范德华力 e.极性共价键 f.非极性共价键
答案 (5)①4 ②四面体形 ③bde
8.★★(2022全国乙,35,15分)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有 ,其中能量较高的是 。(填标号)
a.1s22s22p43s1 b.1s22s22p43d2
c.1s22s12p5 d.1s22s22p33p2
(2)①一氯乙烯(C2H3Cl)分子中,C的一个 杂化轨道与Cl的3px轨道形成C—Cl
键,并且Cl的3pz轨道与C的2pz轨道形成3中心4电子的大π键()。
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长的顺序是 ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C—Cl键越强;(ⅱ) 。
(3)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为
。解释X的熔点比Y高的原因 。
(4)α-AgI晶体中I-作体心立方堆积(如图所示),Ag+主要分布在由I-构成的四面体、八面体等空隙中。在电场作用下,Ag+不需要克服太大的阻力即可发生迁移。因此,α-AgI晶体在电池中可作为 。
已知阿伏加德罗常数为NA,则α-AgI晶体的摩尔体积Vm= m3·mol-1(列出算式)。
答案 (1)ad d (2)①sp2 σ ②C2H5Cl>C2H3Cl>C2HCl Cl参与形成的大π键越多,形成的C—Cl键越短 (3)CsCl CsCl是离子晶体,熔化时需要克服Cs+和Cl-之间的离子键,而ICl是分子晶体,熔化时只需要克服范德华力 (4)固体电解质 (5.04×10-10)3NA
三年模拟
9.★★(2025届湖北“宜荆荆恩”起点考,12)在不同的压强和温度区间,可以获得不同结构的氮分子结晶。部分固态氮分子相的存在范围及晶胞结构如下表所示,其中α相晶胞是立方晶胞,晶胞边长为a pm,下列说法错误的是( )
分子相 α相 γ相
温度和压强 <35.6 K, <0.35 GPa <40~0 K, 0.35~1.96 GPa
结构
A.继续增大压强,可能形成共价晶体结构的氮同素异形体
B.α相、γ相晶胞中,分子配位数均为12
C.α相、γ相晶胞中,原子个数之比为2∶1
D.α相晶体密度为 g·cm-3
答案 B
10.★★(2025届黑龙江大庆第一次质检,14)黄铁矿晶体的晶胞如图所示,晶胞参数为a nm,晶胞中Fe2+位于所形成的正八面体的体心,M点分数坐标为(0,,0),NA为阿伏加德罗常数的值,下列说法错误的是( )
A.N点的分数坐标为(1,,1)
B.晶胞中与Fe2+等距且最近的Fe2+数目为8
C.该晶体密度为×1023 g·cm-3
D.若八面体边长为d,则d=a nm
答案 B
11.★★(2025届海南农垦中学第一次月考,19节选)(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7围成)和正八面体空隙(3、6、7、8、9、12围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为 。
(6)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为 pm(列出计算式即可)。
答案 (5)7∶2 (6)×1010
12.★★(2025届山西长治9月月考,17节选)(6)某化合物的晶胞结构如图甲所示,沿x轴方向的投影为图乙,晶胞底面显示为图丙,晶胞参数a≠c;图丙中Ca与N的距离为 pm;化合物的化学式是 ,其摩尔质量为M g·mol-1,阿伏加德罗常数的值是NA,则晶体的密度为 g·cm-3(列出计算表达式)。
答案 (6)×1030
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
