四川省泸州市泸州老窖天府中学2024-2025学年高一下学期3月检测化学试卷(含答案)
文档属性
| 名称 | 四川省泸州市泸州老窖天府中学2024-2025学年高一下学期3月检测化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 522.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-28 00:00:00 | ||
图片预览


文档简介
月考试卷
可能用到的相对原子质量:H-1 N-14 O-16 S-32 Fe-56 Cu-64 Ba-137
一、单选题
1.化学已经渗透到人类生活的各个方面,下列说法不正确的是
A.在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量
B.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关
C.低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
D.二氧化碳含量属于空气质量日报中空气污染指数指标
2.下列变化过程中,既有离子键被破坏又有共价键被破坏的是
A.将通入水 B.溶于水 C.将HCl通入水中 D.分解
3.下列物质中,能用两种单质直接化合而成的是
A. B. C. D.
4.下列说法不正确的是
A.遇空气变为红棕色的气体是NO
B.SO2能使湿润的红色石蕊试纸褪色
C.NH4HCO3不稳定,受热易分解
D.浓硫酸能使蔗糖变黑并有刺激性气味的气体生成
5.下列化学用语或图示表达正确的是
A.用电子式表示的形成过程:
B.的结构示意图:
C.的电子式为
D.质量数为31的磷原子:
6.我国科研人员发现使用氟磺酰叠氮(化学式:FSO2N3),可以更安全、高效地实现1200种叠氮化合物的制备。下列关于FSO2N3中各元素的说法错误的是
A.非金属性:S>O B.热稳定性:H2O>NH3
C.原子半径:N>F D.沸点:H2O>H2S
7.关于阿伏伽德罗常数,下列说法正确的是
A.可与反应转移的电子数为
B.标况下的体积为
C.的与足量稀硝酸反应转移电子数为
D.的溶于水生成的的数目为
8.将和X气体分别通入溶液中,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是
A. B. C. D.
9.下列实验装置不能达到实验目的的是
A.用做喷泉实验 B.验证Cu与浓硝酸反应的热量变化 C.验证易溶于水 D.浓氨水与浓硫酸反应
10.下列离子方程式书写正确的是
A.向碳酸氢铵溶液中加入过量的溶液:
B.过量铁粉加入稀硝酸中:
C.用过量氨水吸收工业尾气中的:
D.氢氧化亚铁溶于过量稀硝酸:
11.下列描述正确的是
A.氯化铵和氯化钠的固体混合物可用升华法分离
B.将少量硫酸铵和熟石灰混合在研钵中进行研磨,可以闻到刺激性气味
C.检验某白色固体是铵盐的方法是:加氢氧化钠溶液,加热,用湿润蓝色石蕊试纸在试管口检验,观察试纸是否变红
D.所有铵盐都易溶于水,铵盐中的氮元素均为-3价
12.X、Y、Z、R、W是五种短周期主族元素,原子序数依次增大;Z的原子半径是同周期主族元素中最大的;X、Y原子的最外层电子数之比为,其化合物常用于灭火,R是地壳中含量最高的金属元素,W与Y同主族。下列说法错误的是
A.的电子式为
B.比Y周期数大2的同主族元素Q的原子序数为34
C.最高价氧化物对应水化物的碱性:
D.简单氢化物的稳定性Y大于W是因为Y分子间形成了氢键
13.“价—类”二维图是研究物质性质的一种方法,图中a~f表示的均是含硫物质。下列说法正确的是
A.a可用硫化亚铁与稀硝酸反应制取
B.可发生反应:(未配平)
C.c能使溴水褪色,证明c有漂白性
D.f既有氧化性又有还原性
14.某溶液可能含有中的几种。取该溶液进行实验,如图所示。则下列说法正确的是
A.标况下的无色气体为二氧化碳
B.原溶液中可能含有和
C.原溶液中至少含有上述离子中的五种离子
D.向溶液中加入酸化的溶液,产生白色沉淀,证明原溶液中一定含有
二、解答题
15.下表为元素周期表的一部分,用化学用语回答下列问题。
族周期 IA IIA IIIA IVA VA VIA VIIA
二 ① ②
三 ③ ④ ⑤ ⑥ ⑦
(1)元素④在周期表中所处位置为第 周期第 族。
(2)①元素的氢化物与其最高价氧化物的水化物在空中相遇会产生白烟,相关的化学反应方程式为 。
(3)⑥元素的最高价氧化物的水化物中的浓溶液与铜共热的化学反应方程式为 。
(4)①、③、⑥三种元素的简单离子的半径由小到大的顺序为 。(填离子符号)
(5)①、④、⑤三种元素的最高价氧化物的水化物中酸性最强的是 。(填化学式)
(6)⑥元素正四价的氧化物能使⑦元素的单质的水溶液褪色,写出该离子反应方程式 。
(7)②与③在加热条件下形成的化合物的电子式 。
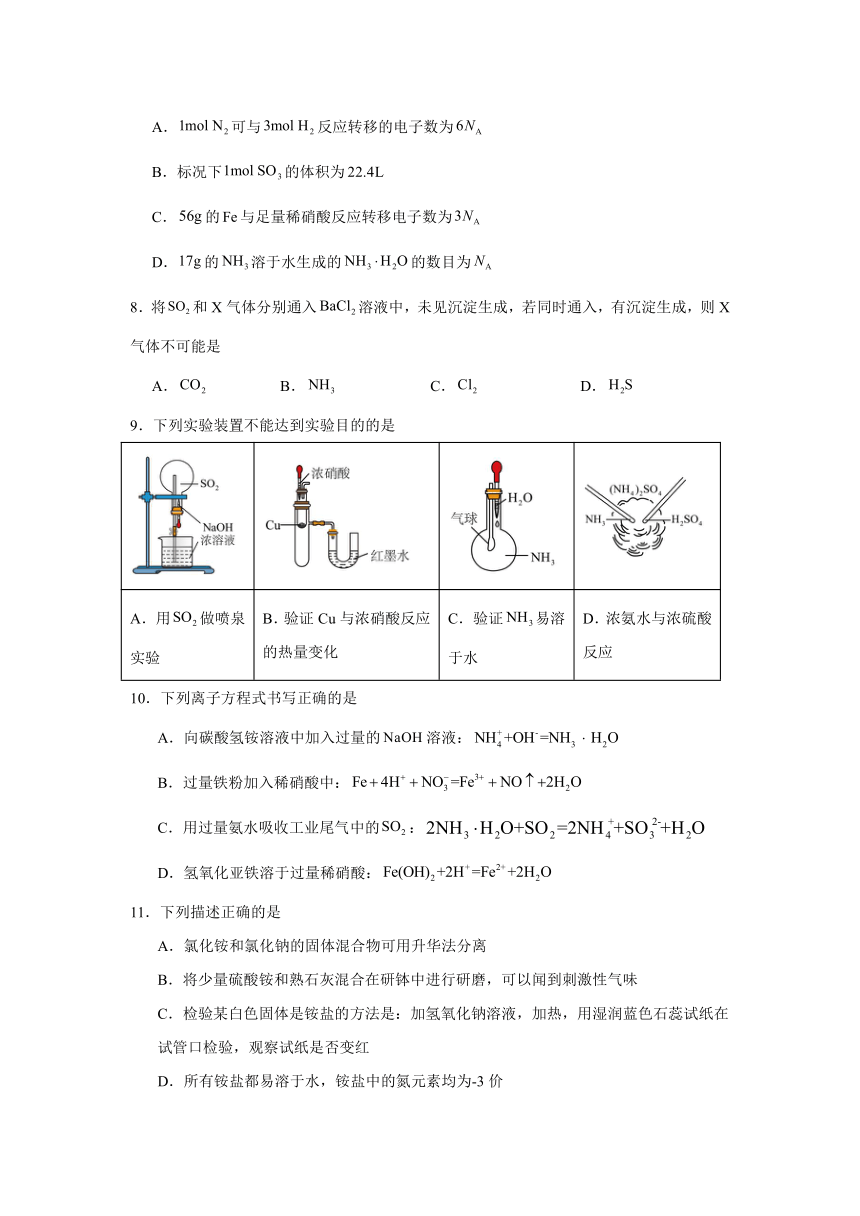
16.SO2是硫元素中一种重要物质,在生产生活中有着重要用途。
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
①通入足量SO2时C中观察到的现象为 。
②根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
a.写出SO2与FeCl3溶液反应的离子方程式: 。
b.请设计实验方案检验溶液中是否还有Fe3+: 。
c.该小组同学向C中反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了S。该做法 (填“合理”或“不合理”),理由是 。
③为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有 (填字母)。
A.浓硫酸 B.酸性KMnO4溶液
C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究SO2的性质(熔点:SO2 -72 ℃,SO3 16.8 ℃,沸点:SO2 -10 ℃,SO3 44.8 ℃)。
①装置 Ⅰ 模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②该同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50 mL 2.5 mol·L-1NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
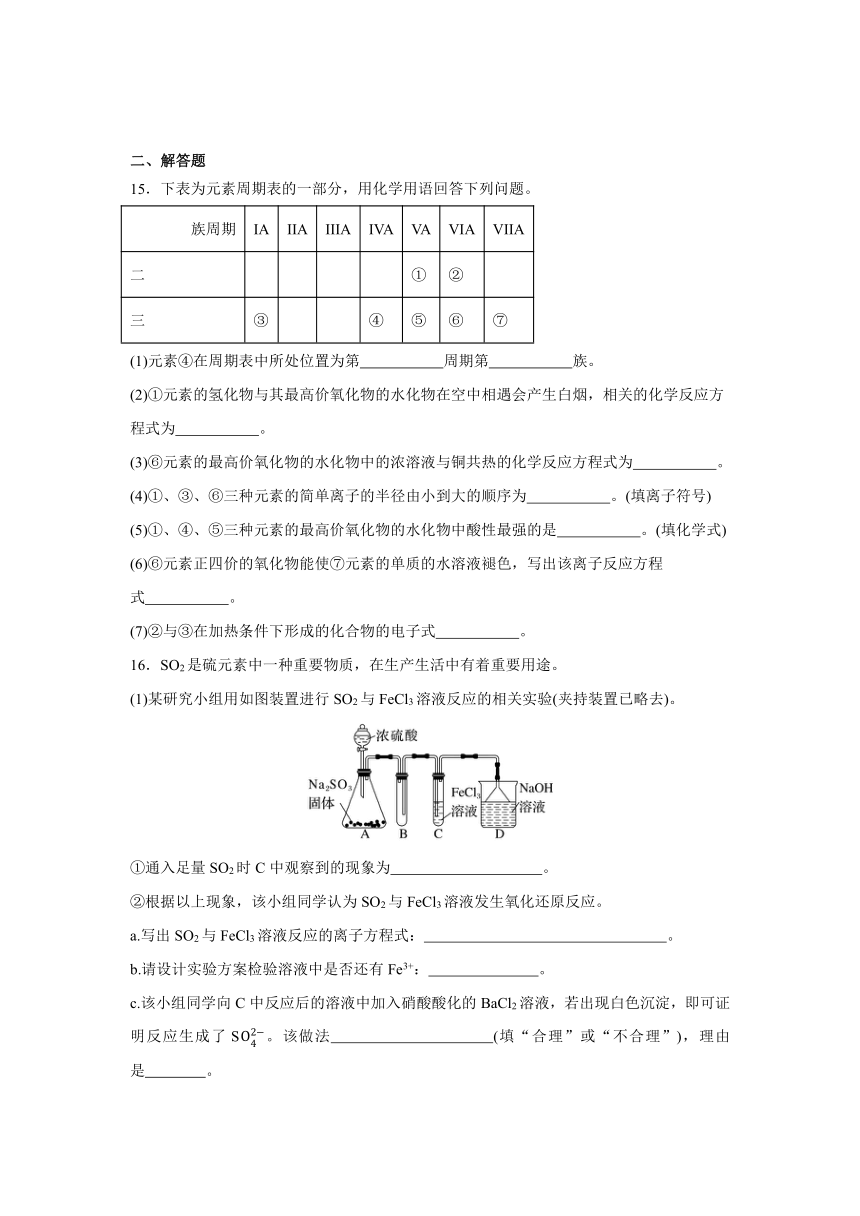
17.氨气是一种重要的化工原料。某实验小组同学设计如图装置制取氨气,并模拟氨气催化氧化制取硝酸。
Ⅰ.氨气的制备
(1)仪器X的名称为 ;氨气的发生装置若选用上图中的A,反应的化学方程式为 。若选用图B,固体试剂可以为 (填序号)。
a.过氧化钠固体 b.氢氧化钠固体 c.生石灰
(2)欲收集一瓶干燥的氨气,选用上图中的装置,其连接顺序为:发生装置→ (按气流方向,用小写字母表示)。
Ⅱ.下图是氨气催化氧化制备少量硝酸的装置图
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是 (填“吸热”或“放热”)反应,反应的化学方程式是 。
(4)B中试剂为 。
(5)欲使氨气尽可能完全转化为硝酸,理论上的最佳比例为 。
18.胆矾(CuSO4 5H2O)是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2]制备胆矾并测定其纯度。
I.制备胆矾
已知:Na2CO3溶液呈碱性,铜屑可用Na2CO3溶液去除油污
(1)步骤②中,在H2O2存在下Cu溶于稀H2SO4,反应的离子方程式为 。
(2)欲从溶液C得到胆矾晶体需要进行系列操作,步骤③需要进行的操作有 、冷却结晶。步骤④用到的玻璃仪器有 、烧杯、 。
(3)溶液D呈蓝色,具有氧化性,加入KI溶液后生成CuI沉淀。可判断该反应的氧化产物是 ,写出反应的离子方程式为 。
II.沉淀法测定胆矾晶体中CuSO4 5H2O的含量
实验原理:CuSO4+BaCl2=BaSO4↓+CuCl2
实验步骤:称取胆矾晶体25.0g配成100mL溶液,取出25mL进行如图实验:
(4)过滤前需要检验是否沉淀完全,检验方法是 。
(5)固体质量为wg,则胆矾晶体中CuSO4 5H2O的质量分数为 (用含w的代数式表示)。若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得CuSO4 5H2O的质量分数 (填“偏高”“偏低”或“无影响”)。
《月考试卷》参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D D A B D A C A D C
题号 11 12 13 14
答案 B D D C
15.(14分)(1) 三 IVA
(2)NH3+HNO3=NH4NO3
(3)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(4)Na+(5)HNO3
(6)SO2+Cl2+2H2O=4H++SO42-+2Cl-
(7)
16.(15分)(1)①溶液由棕黄色变成浅绿色 ②a.2Fe3++SO2+2H2O===S+4H++2Fe2+ b.取少量C中反应后的溶液于试管中,向其中滴入KSCN溶液,若显红色说明有Fe3+,反之无Fe3+ c.不合理 HNO3具有强氧化性,可以将溶解的SO2氧化成S,干扰实验 ③BC
(2)①2SO2+O22SO3 ②3SO2+5NaOH===2Na2SO3+NaHSO3+2H2O
17.(14分)(1) 圆底烧瓶 bc
(2) dcfei
(3) 放热
(4) 水
(5)
18.(15分)(1)
(2) 蒸发浓缩 漏斗 玻璃棒
(3) I2
(4) 静置,往上层清液中继续滴加氯化钡溶液,若无白色沉淀生成,则沉淀完全,反之,则未沉淀完全
(5) 偏低
可能用到的相对原子质量:H-1 N-14 O-16 S-32 Fe-56 Cu-64 Ba-137
一、单选题
1.化学已经渗透到人类生活的各个方面,下列说法不正确的是
A.在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量
B.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关
C.低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
D.二氧化碳含量属于空气质量日报中空气污染指数指标
2.下列变化过程中,既有离子键被破坏又有共价键被破坏的是
A.将通入水 B.溶于水 C.将HCl通入水中 D.分解
3.下列物质中,能用两种单质直接化合而成的是
A. B. C. D.
4.下列说法不正确的是
A.遇空气变为红棕色的气体是NO
B.SO2能使湿润的红色石蕊试纸褪色
C.NH4HCO3不稳定,受热易分解
D.浓硫酸能使蔗糖变黑并有刺激性气味的气体生成
5.下列化学用语或图示表达正确的是
A.用电子式表示的形成过程:
B.的结构示意图:
C.的电子式为
D.质量数为31的磷原子:
6.我国科研人员发现使用氟磺酰叠氮(化学式:FSO2N3),可以更安全、高效地实现1200种叠氮化合物的制备。下列关于FSO2N3中各元素的说法错误的是
A.非金属性:S>O B.热稳定性:H2O>NH3
C.原子半径:N>F D.沸点:H2O>H2S
7.关于阿伏伽德罗常数,下列说法正确的是
A.可与反应转移的电子数为
B.标况下的体积为
C.的与足量稀硝酸反应转移电子数为
D.的溶于水生成的的数目为
8.将和X气体分别通入溶液中,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是
A. B. C. D.
9.下列实验装置不能达到实验目的的是
A.用做喷泉实验 B.验证Cu与浓硝酸反应的热量变化 C.验证易溶于水 D.浓氨水与浓硫酸反应
10.下列离子方程式书写正确的是
A.向碳酸氢铵溶液中加入过量的溶液:
B.过量铁粉加入稀硝酸中:
C.用过量氨水吸收工业尾气中的:
D.氢氧化亚铁溶于过量稀硝酸:
11.下列描述正确的是
A.氯化铵和氯化钠的固体混合物可用升华法分离
B.将少量硫酸铵和熟石灰混合在研钵中进行研磨,可以闻到刺激性气味
C.检验某白色固体是铵盐的方法是:加氢氧化钠溶液,加热,用湿润蓝色石蕊试纸在试管口检验,观察试纸是否变红
D.所有铵盐都易溶于水,铵盐中的氮元素均为-3价
12.X、Y、Z、R、W是五种短周期主族元素,原子序数依次增大;Z的原子半径是同周期主族元素中最大的;X、Y原子的最外层电子数之比为,其化合物常用于灭火,R是地壳中含量最高的金属元素,W与Y同主族。下列说法错误的是
A.的电子式为
B.比Y周期数大2的同主族元素Q的原子序数为34
C.最高价氧化物对应水化物的碱性:
D.简单氢化物的稳定性Y大于W是因为Y分子间形成了氢键
13.“价—类”二维图是研究物质性质的一种方法,图中a~f表示的均是含硫物质。下列说法正确的是
A.a可用硫化亚铁与稀硝酸反应制取
B.可发生反应:(未配平)
C.c能使溴水褪色,证明c有漂白性
D.f既有氧化性又有还原性
14.某溶液可能含有中的几种。取该溶液进行实验,如图所示。则下列说法正确的是
A.标况下的无色气体为二氧化碳
B.原溶液中可能含有和
C.原溶液中至少含有上述离子中的五种离子
D.向溶液中加入酸化的溶液,产生白色沉淀,证明原溶液中一定含有
二、解答题
15.下表为元素周期表的一部分,用化学用语回答下列问题。
族周期 IA IIA IIIA IVA VA VIA VIIA
二 ① ②
三 ③ ④ ⑤ ⑥ ⑦
(1)元素④在周期表中所处位置为第 周期第 族。
(2)①元素的氢化物与其最高价氧化物的水化物在空中相遇会产生白烟,相关的化学反应方程式为 。
(3)⑥元素的最高价氧化物的水化物中的浓溶液与铜共热的化学反应方程式为 。
(4)①、③、⑥三种元素的简单离子的半径由小到大的顺序为 。(填离子符号)
(5)①、④、⑤三种元素的最高价氧化物的水化物中酸性最强的是 。(填化学式)
(6)⑥元素正四价的氧化物能使⑦元素的单质的水溶液褪色,写出该离子反应方程式 。
(7)②与③在加热条件下形成的化合物的电子式 。
16.SO2是硫元素中一种重要物质,在生产生活中有着重要用途。
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
①通入足量SO2时C中观察到的现象为 。
②根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
a.写出SO2与FeCl3溶液反应的离子方程式: 。
b.请设计实验方案检验溶液中是否还有Fe3+: 。
c.该小组同学向C中反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了S。该做法 (填“合理”或“不合理”),理由是 。
③为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有 (填字母)。
A.浓硫酸 B.酸性KMnO4溶液
C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究SO2的性质(熔点:SO2 -72 ℃,SO3 16.8 ℃,沸点:SO2 -10 ℃,SO3 44.8 ℃)。
①装置 Ⅰ 模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②该同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50 mL 2.5 mol·L-1NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
17.氨气是一种重要的化工原料。某实验小组同学设计如图装置制取氨气,并模拟氨气催化氧化制取硝酸。
Ⅰ.氨气的制备
(1)仪器X的名称为 ;氨气的发生装置若选用上图中的A,反应的化学方程式为 。若选用图B,固体试剂可以为 (填序号)。
a.过氧化钠固体 b.氢氧化钠固体 c.生石灰
(2)欲收集一瓶干燥的氨气,选用上图中的装置,其连接顺序为:发生装置→ (按气流方向,用小写字母表示)。
Ⅱ.下图是氨气催化氧化制备少量硝酸的装置图
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是 (填“吸热”或“放热”)反应,反应的化学方程式是 。
(4)B中试剂为 。
(5)欲使氨气尽可能完全转化为硝酸,理论上的最佳比例为 。
18.胆矾(CuSO4 5H2O)是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2]制备胆矾并测定其纯度。
I.制备胆矾
已知:Na2CO3溶液呈碱性,铜屑可用Na2CO3溶液去除油污
(1)步骤②中,在H2O2存在下Cu溶于稀H2SO4,反应的离子方程式为 。
(2)欲从溶液C得到胆矾晶体需要进行系列操作,步骤③需要进行的操作有 、冷却结晶。步骤④用到的玻璃仪器有 、烧杯、 。
(3)溶液D呈蓝色,具有氧化性,加入KI溶液后生成CuI沉淀。可判断该反应的氧化产物是 ,写出反应的离子方程式为 。
II.沉淀法测定胆矾晶体中CuSO4 5H2O的含量
实验原理:CuSO4+BaCl2=BaSO4↓+CuCl2
实验步骤:称取胆矾晶体25.0g配成100mL溶液,取出25mL进行如图实验:
(4)过滤前需要检验是否沉淀完全,检验方法是 。
(5)固体质量为wg,则胆矾晶体中CuSO4 5H2O的质量分数为 (用含w的代数式表示)。若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得CuSO4 5H2O的质量分数 (填“偏高”“偏低”或“无影响”)。
《月考试卷》参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D D A B D A C A D C
题号 11 12 13 14
答案 B D D C
15.(14分)(1) 三 IVA
(2)NH3+HNO3=NH4NO3
(3)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(4)Na+
(6)SO2+Cl2+2H2O=4H++SO42-+2Cl-
(7)
16.(15分)(1)①溶液由棕黄色变成浅绿色 ②a.2Fe3++SO2+2H2O===S+4H++2Fe2+ b.取少量C中反应后的溶液于试管中,向其中滴入KSCN溶液,若显红色说明有Fe3+,反之无Fe3+ c.不合理 HNO3具有强氧化性,可以将溶解的SO2氧化成S,干扰实验 ③BC
(2)①2SO2+O22SO3 ②3SO2+5NaOH===2Na2SO3+NaHSO3+2H2O
17.(14分)(1) 圆底烧瓶 bc
(2) dcfei
(3) 放热
(4) 水
(5)
18.(15分)(1)
(2) 蒸发浓缩 漏斗 玻璃棒
(3) I2
(4) 静置,往上层清液中继续滴加氯化钡溶液,若无白色沉淀生成,则沉淀完全,反之,则未沉淀完全
(5) 偏低
同课章节目录
