江苏省扬州中学2024-2025学年高二下学期3月月考 化学试题(含答案)
文档属性
| 名称 | 江苏省扬州中学2024-2025学年高二下学期3月月考 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 867.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-28 16:54:57 | ||
图片预览


文档简介
江苏省扬州中学2024-2025学年第二学期阶段检测
高二化学 2025.03
试卷满分:100分 考试时间:75分钟
可能用到的相对原子质量:H-1 C-12 O-16 Ti-48 Ba-137
Ⅰ卷(选择题,共39分)
选择题:共13题,每题3分,共39分。每小题只有一个选项最符合题意。
1.“新质生产力”的概念中,“新”的核心在于科技创新,下列有关说法正确的是
A.我国研发的核反应堆“华龙一号”以为核燃料,与化学性质不相同
B.奥运“中国制造”的足球植入了芯片,制备芯片的原料属于无机非金属材料
C.“祝融号”火星车采用我国研发的“正十一烷相变保温系统”,正十一烷属于脂环烃
D.“歼-35”战斗机使用的碳纤维与金刚石互为同分异构体
2.下列有关化学用语表示正确的是
A.苯的最简式是C6H6
B.与都表示羟基
C.乙醛的结构简式是
D.空间填充模型既可以表示甲烷分子,又可以表示四氯化碳分子
3. 已知反应:2[Co(H2O)6]2++10NH3+2N+H2O2===2[Co(NH3)6]3++14H2O。下列说法不正确的是
A. 1 mol [Co(H2O)6]2+配离子中,含有的σ键数目约为6×6.02×1023
B. 反应中H2O2作氧化剂,发生还原反应
C. NH3和H2O与Co3+的配位能力:NH3>H2O
D. NH3和H2O的中心原子的杂化类型相同
4.下列说法正确的是
A.甲烷、乙烯都不能使溴水褪色
B.N95口罩所使用的熔喷布为聚丙烯,聚丙烯能使酸性高锰酸钾褪色
C.有机物的名称,2,2-二甲基丁烷
D.的一溴代物有4种
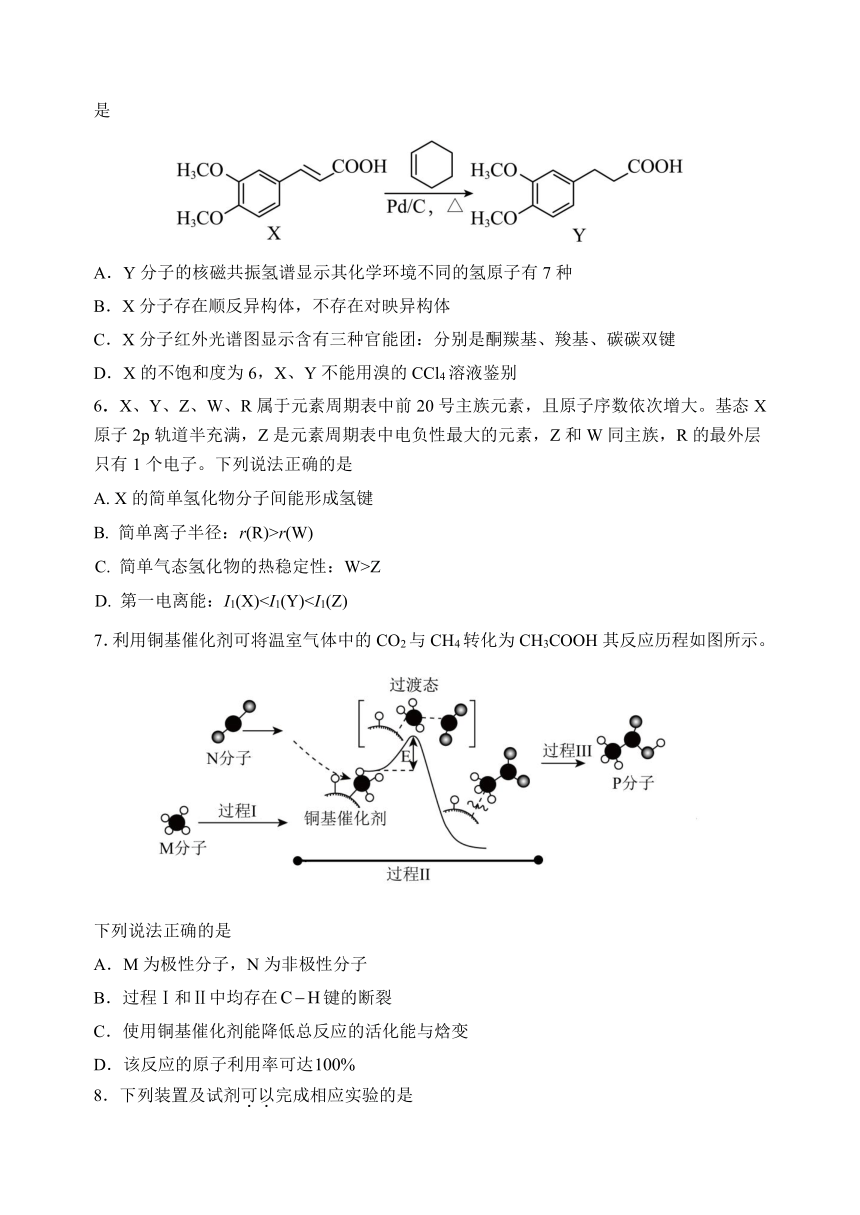
5.多奈哌齐是一种抗阿尔茨海默病药物,合成路线中的一步反应如下。下列说法正确的是
A.Y分子的核磁共振氢谱显示其化学环境不同的氢原子有7种
B.X分子存在顺反异构体,不存在对映异构体
C.X分子红外光谱图显示含有三种官能团:分别是酮羰基、羧基、碳碳双键
D.X的不饱和度为6,X、Y不能用溴的CCl4溶液鉴别
6.X、Y、Z、W、R属于元素周期表中前20号主族元素,且原子序数依次增大。基态X原子2p轨道半充满,Z是元素周期表中电负性最大的元素,Z和W同主族,R的最外层只有1个电子。下列说法正确的是
A. X的简单氢化物分子间能形成氢键
B. 简单离子半径:r(R)>r(W)
C. 简单气态氢化物的热稳定性:W>Z
D. 第一电离能:I1(X)7.利用铜基催化剂可将温室气体中的CO2与CH4转化为CH3COOH其反应历程如图所示。
下列说法正确的是
A.M为极性分子,N为非极性分子
B.过程Ⅰ和Ⅱ中均存在键的断裂
C.使用铜基催化剂能降低总反应的活化能与焓变
D.该反应的原子利用率可达
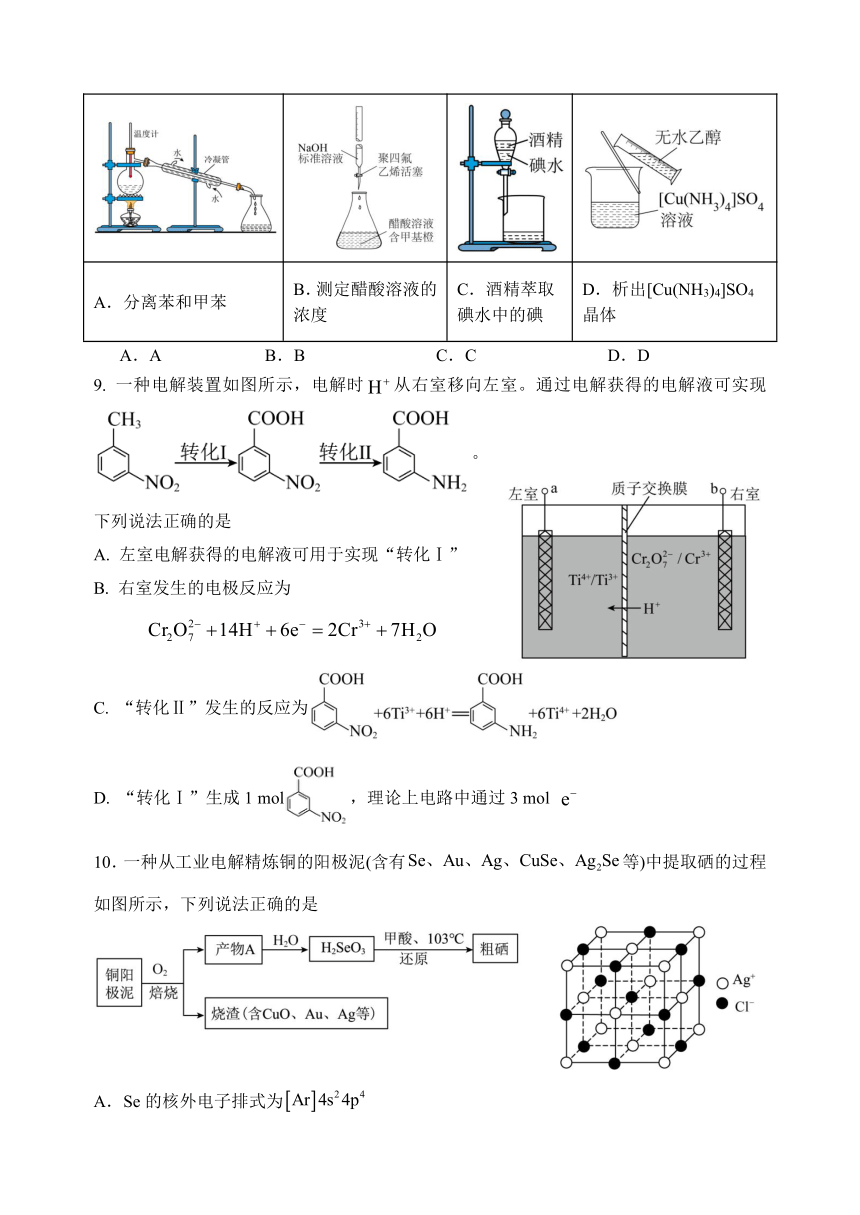
8.下列装置及试剂可以完成相应实验的是
A.分离苯和甲苯 B.测定醋酸溶液的浓度 C.酒精萃取碘水中的碘 D.析出[Cu(NH3)4]SO4晶体
A.A B.B C.C D.D
9. 一种电解装置如图所示,电解时从右室移向左室。通过电解获得的电解液可实现。
下列说法正确的是
A. 左室电解获得的电解液可用于实现“转化Ⅰ”
B. 右室发生的电极反应为
C. “转化Ⅱ”发生的反应为
D. “转化Ⅰ”生成1 mol,理论上电路中通过3 mol
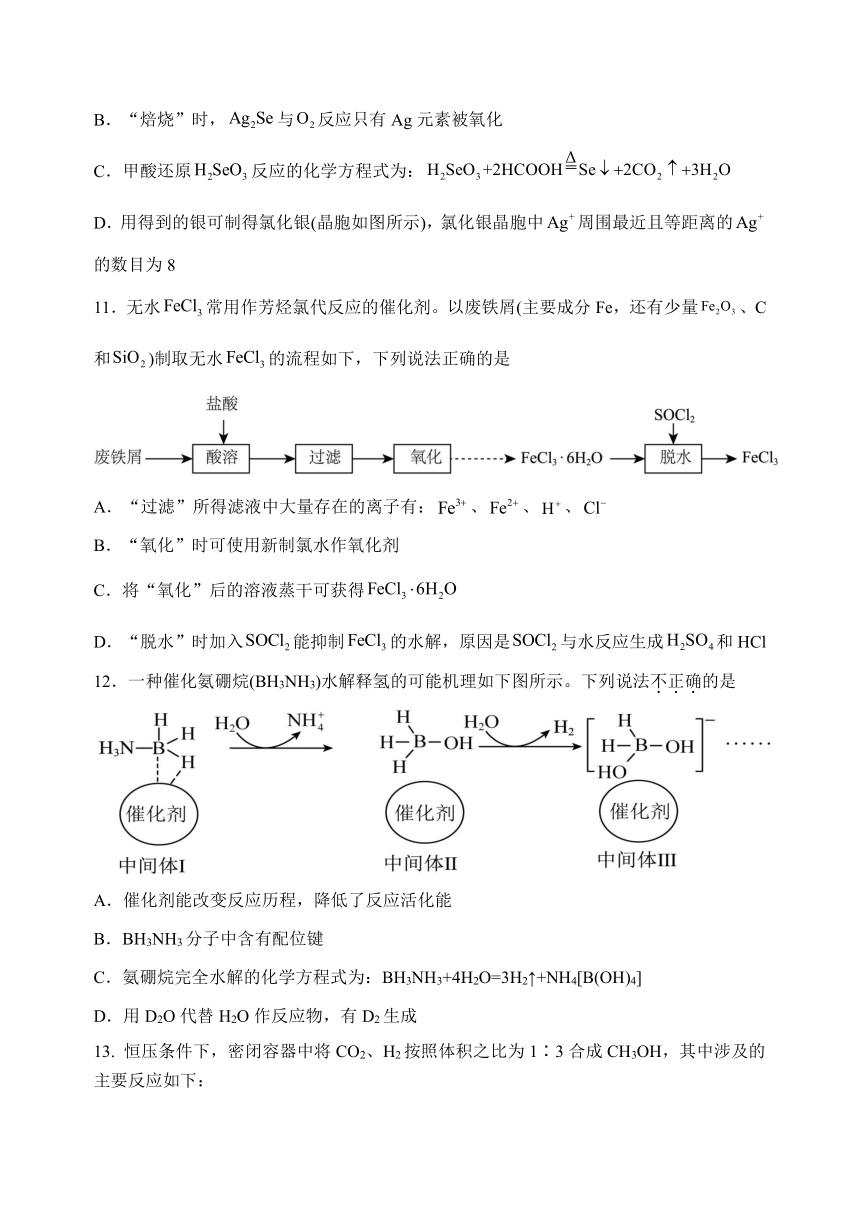
10.一种从工业电解精炼铜的阳极泥(含有等)中提取硒的过程如图所示,下列说法正确的是
A.Se的核外电子排式为
B.“焙烧”时,与反应只有Ag元素被氧化
C.甲酸还原反应的化学方程式为:
D.用得到的银可制得氯化银(晶胞如图所示),氯化银晶胞中周围最近且等距离的的数目为8
11.无水常用作芳烃氯代反应的催化剂。以废铁屑(主要成分Fe,还有少量、C和)制取无水的流程如下,下列说法正确的是
A.“过滤”所得滤液中大量存在的离子有:、、、
B.“氧化”时可使用新制氯水作氧化剂
C.将“氧化”后的溶液蒸干可获得
D.“脱水”时加入能抑制的水解,原因是与水反应生成和HCl
12.一种催化氨硼烷(BH3NH3)水解释氢的可能机理如下图所示。下列说法不正确的是
A.催化剂能改变反应历程,降低了反应活化能
B.BH3NH3分子中含有配位键
C.氨硼烷完全水解的化学方程式为:BH3NH3+4H2O=3H2↑+NH4[B(OH)4]
D.用D2O代替H2O作反应物,有D2生成
13. 恒压条件下,密闭容器中将CO2、H2按照体积之比为1∶3合成CH3OH,其中涉及的主要反应如下:
Ⅰ. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49 kJ/mol
Ⅱ. CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41 kJ/mol
在不同催化剂作用下发生反应Ⅰ、Ⅱ,在相同的时间段内CH3OH选择性和产率随温度的变化如图。
已知:CH3OH的选择性=×100%。下列说法正确的是
A. 反应 CO(g)+2H2(g) CH3OH(g) ΔH=+90 kJ/mol
B. 合成甲醇的适宜工业条件是290 ℃,催化剂选择CZ(Zr-1)T
C. 230 ℃以上,升高温度CO2转化率增大,但甲醇的产率降低,原因是230 ℃以上,升温对反应Ⅱ的影响更大
D. 恒压恒温下充入氦气,不影响CO2转化率
Ⅱ卷(非选择题,共61分)
14.铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1)Cu在周期表中位于 ▲ 区,Cu2+价电子排布式为 ▲ 。
(2)邻氨基吡啶()的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为 ▲ ;1mol中σ键的数目为 ▲ mol。邻氨基吡啶的铜配合物结构简式如右图所示,C原子轨道杂化类型为 ▲ 。
(3)蓝色晶体[Cu(NH3)4]SO4 H2O为铜的配位化合物。
①NH3分子中H-N-H键角 ▲ (选填“大于”、“等于”、“小于”)[Cu(NH3)4]2+中H-N-H键角。
②NF3与NH3均为三角锥形分子,NF3分子中的氮原子不易与Cu2+形成配离子,请从电负性角度分析其原因是 ▲ 。
15.A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略)。其中,A是一种气态烃,在标准状况下的密度是,其产量是衡量一个国家石油化工发展水平的标志;C的分子式为;B和C在浓硫酸和加热的条件下发生反应,生成的有机物D有特殊的香味。试回答下列问题:
(1)A的结构简式为 ▲ ,丙烯酸分子结构中所含的含氧官能团名称是 ▲ ,丙烯分子中最多有 ▲ 个原子共平面。
(2)丙烯酸乙酯可能发生的反应类型有 ▲ 。
①加成反应 ②氧化反应 ③加聚反应 ④取代反应
A.①③ B.①②③ C.①③④ D.①②③④
(3)写出丙烯酸生成聚丙烯酸的化学方程式 ▲ 。
(4)有机物D的质谱图和红外光谱分别如图所示,则该有机物的结构简式为 ▲ 。
(5)下列有关说法正确的是 ▲ (填编号)。
A.D与丙烯酸乙酯互为同系物 B.B→C的转化是氧化反应
C.可以用酸性溶液鉴别A和丙烯酸 D.A→B的转化是加成反应
(6)丙烯酸乙酯有很多同分异构体,其中含有—COOH的同分异构体有 ▲ 种(不考虑立体异构)。
16. Ⅰ . 月桂烯()是重要的化工原料,广泛用于香料行业。
(1) 月桂烯与足量氢气完全加成后生成A,A的名称是 ▲ 。
(2) 以月桂烯为原料制取乙酸香叶酯的流程如图:
① B中含有的官能团的名称为 ▲ ;
② 乙酸香叶酯的化学式为 ▲ ;
③ 反应Ⅰ的反应类型为 ▲ ;
④ 反应Ⅱ的化学方程式为 ▲ 。
Ⅱ. 双烯合成即Diels-Alder反应,由共轭双烯与烯烃或炔烃反应生成六元环的反应,是有机化学合成反应中非常重要的碳碳键形成的手段之一。
例如:
(3) 物质M()是月桂烯的同分异构体,可由烃N(C5H8)通过Diels-Alder反应合成,则烃N的系统命名是 ▲ 。
(4) 烯烃能在臭氧作用下发生臭氧化及分解反应,可表示如下:
(R1、R2、R3、R4为烃基或氢原子)。
① 写出M()发生上述反应的产物中相对分子质量较大的物质的结构简式: ▲ (以键线式表示)。
② 加热条件下,用碱性新制Cu(OH)2检验另一种产物分子中的官能团的化学方程式为
▲ (产物中有Na2CO3、Cu2O)。
17.钛酸钡(BaTiO3)是制备电子陶瓷材料的基础原料。
(1) 实验室模拟制备钛酸钡的过程如下:
已知:TiCl4能水解生成TiO2+,TiO2+能进一步水解生成TiO2;BaTiO3能与浓硫酸反应生成TiO2+。草酸氧钛钡晶体的化学式为BaTiO(C2O4)2·4H2O。
① Ti(Ⅳ)的存在形式(相对含量分数)与溶液pH的关系如图1所示。“沉钛”时,需加入氨水调节溶液的pH在2~3之间,理由是 ▲ 。
图1 图2 图3
② 由草酸氧钛钡晶体(相对分子质量为449)煅烧制得钛酸钡分为三个阶段。现称取44.9 g草酸氧钛钡晶体进行热重分析,测得残留固体质量与温度的变化关系如图2所示。C点残留固体中含有碳酸钡和钛氧化物,则阶段Ⅱ发生反应的化学方程式为 ▲ 。
③ 钛酸钡晶胞的结构示意图如图3所示,其中与Ti4+紧邻的O2-构成的几何构型是 ▲ 。
(2) 利用Fe3+将浅紫色Ti3+氧化为无色Ti(Ⅳ)的反应可用于测定钛酸钡的纯度。
① 请补充完整实验方案:称量2.33 g钛酸钡样品完全溶于浓硫酸后,加入过量铝粉,充分振荡,使其完全反应(Al将TiO2+转化为Ti3+); ▲ ;向待测钛液中加入稀硫酸酸化后,将其转移到100 mL容量瓶中后定容,取20.00 mL待测钛液于锥形瓶中, ▲ ;记录消耗标准液的体积,重复滴定实验操作3次,平均消耗标准液19.50 mL(实验时须使用的试剂:0.100 0 mol/L FeCl3溶液、KSCN溶液)。
② 计算钛酸钡样品的纯度(写出计算过程)。
江苏省扬州中学2024-2025学年第二学期阶段检测
高二化学参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13
B B A C B A D D C C B D C
填空题除标注外,每空2分
14(14分)(1) ds 3d9 (2) N>O>C 13 sp2、sp3
(3) ① 小于
② F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子对其孤电子对的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子
15(17分)(1) CH2 =CH2 羧基 7 (2)D
(3)(3分)
(4)CH3COOCH2CH3
(5)BD
(6)12
(16分)(1) 2,6-二甲基辛烷
(2) ① 碳碳双键、碳氯键 ;
② C12H20O2 ;
③ 加成反应 ;
④ +CH3COONaNaCl+ 。
(3)2-甲基-1,3-丁二烯
(4)①
②HCHO+4Cu(OH)2+2NaOHNa2CO3+2Cu2O↓+6H2O
17(14分)(1)①pH在2~3之间时,Ti(Ⅳ)主要以TiO(C2O4)的形式存在,可直接与Ba2+反应,有利于草酸氧钛钡晶体的生成。
②(3分)BaTiO(C2O4)2BaCO3+TiO2+2CO↑+CO2↑
③正八面体形
(2)①过滤,洗涤滤渣2~3次,将洗涤液与原滤液合并,
向锥形瓶中滴加2~3滴KSCN溶液,用0.100 0 mol/L FeCl3溶液滴定,当滴入最后半滴标准液时,溶液由浅紫色变成红色,且半分钟内红色不褪去
②(3分)
根据反应:Ti3++Fe3+―→Ti(Ⅳ)+Fe2+可知,
20 mL待测钛液中,
n(Ti3+)=n(Fe3+)=0.019 5 L×0.100 0 mol/L=0.001 95 mol
钛酸钡样品的纯度=×100%=97.5%
高二化学 2025.03
试卷满分:100分 考试时间:75分钟
可能用到的相对原子质量:H-1 C-12 O-16 Ti-48 Ba-137
Ⅰ卷(选择题,共39分)
选择题:共13题,每题3分,共39分。每小题只有一个选项最符合题意。
1.“新质生产力”的概念中,“新”的核心在于科技创新,下列有关说法正确的是
A.我国研发的核反应堆“华龙一号”以为核燃料,与化学性质不相同
B.奥运“中国制造”的足球植入了芯片,制备芯片的原料属于无机非金属材料
C.“祝融号”火星车采用我国研发的“正十一烷相变保温系统”,正十一烷属于脂环烃
D.“歼-35”战斗机使用的碳纤维与金刚石互为同分异构体
2.下列有关化学用语表示正确的是
A.苯的最简式是C6H6
B.与都表示羟基
C.乙醛的结构简式是
D.空间填充模型既可以表示甲烷分子,又可以表示四氯化碳分子
3. 已知反应:2[Co(H2O)6]2++10NH3+2N+H2O2===2[Co(NH3)6]3++14H2O。下列说法不正确的是
A. 1 mol [Co(H2O)6]2+配离子中,含有的σ键数目约为6×6.02×1023
B. 反应中H2O2作氧化剂,发生还原反应
C. NH3和H2O与Co3+的配位能力:NH3>H2O
D. NH3和H2O的中心原子的杂化类型相同
4.下列说法正确的是
A.甲烷、乙烯都不能使溴水褪色
B.N95口罩所使用的熔喷布为聚丙烯,聚丙烯能使酸性高锰酸钾褪色
C.有机物的名称,2,2-二甲基丁烷
D.的一溴代物有4种
5.多奈哌齐是一种抗阿尔茨海默病药物,合成路线中的一步反应如下。下列说法正确的是
A.Y分子的核磁共振氢谱显示其化学环境不同的氢原子有7种
B.X分子存在顺反异构体,不存在对映异构体
C.X分子红外光谱图显示含有三种官能团:分别是酮羰基、羧基、碳碳双键
D.X的不饱和度为6,X、Y不能用溴的CCl4溶液鉴别
6.X、Y、Z、W、R属于元素周期表中前20号主族元素,且原子序数依次增大。基态X原子2p轨道半充满,Z是元素周期表中电负性最大的元素,Z和W同主族,R的最外层只有1个电子。下列说法正确的是
A. X的简单氢化物分子间能形成氢键
B. 简单离子半径:r(R)>r(W)
C. 简单气态氢化物的热稳定性:W>Z
D. 第一电离能:I1(X)
下列说法正确的是
A.M为极性分子,N为非极性分子
B.过程Ⅰ和Ⅱ中均存在键的断裂
C.使用铜基催化剂能降低总反应的活化能与焓变
D.该反应的原子利用率可达
8.下列装置及试剂可以完成相应实验的是
A.分离苯和甲苯 B.测定醋酸溶液的浓度 C.酒精萃取碘水中的碘 D.析出[Cu(NH3)4]SO4晶体
A.A B.B C.C D.D
9. 一种电解装置如图所示,电解时从右室移向左室。通过电解获得的电解液可实现。
下列说法正确的是
A. 左室电解获得的电解液可用于实现“转化Ⅰ”
B. 右室发生的电极反应为
C. “转化Ⅱ”发生的反应为
D. “转化Ⅰ”生成1 mol,理论上电路中通过3 mol
10.一种从工业电解精炼铜的阳极泥(含有等)中提取硒的过程如图所示,下列说法正确的是
A.Se的核外电子排式为
B.“焙烧”时,与反应只有Ag元素被氧化
C.甲酸还原反应的化学方程式为:
D.用得到的银可制得氯化银(晶胞如图所示),氯化银晶胞中周围最近且等距离的的数目为8
11.无水常用作芳烃氯代反应的催化剂。以废铁屑(主要成分Fe,还有少量、C和)制取无水的流程如下,下列说法正确的是
A.“过滤”所得滤液中大量存在的离子有:、、、
B.“氧化”时可使用新制氯水作氧化剂
C.将“氧化”后的溶液蒸干可获得
D.“脱水”时加入能抑制的水解,原因是与水反应生成和HCl
12.一种催化氨硼烷(BH3NH3)水解释氢的可能机理如下图所示。下列说法不正确的是
A.催化剂能改变反应历程,降低了反应活化能
B.BH3NH3分子中含有配位键
C.氨硼烷完全水解的化学方程式为:BH3NH3+4H2O=3H2↑+NH4[B(OH)4]
D.用D2O代替H2O作反应物,有D2生成
13. 恒压条件下,密闭容器中将CO2、H2按照体积之比为1∶3合成CH3OH,其中涉及的主要反应如下:
Ⅰ. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49 kJ/mol
Ⅱ. CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41 kJ/mol
在不同催化剂作用下发生反应Ⅰ、Ⅱ,在相同的时间段内CH3OH选择性和产率随温度的变化如图。
已知:CH3OH的选择性=×100%。下列说法正确的是
A. 反应 CO(g)+2H2(g) CH3OH(g) ΔH=+90 kJ/mol
B. 合成甲醇的适宜工业条件是290 ℃,催化剂选择CZ(Zr-1)T
C. 230 ℃以上,升高温度CO2转化率增大,但甲醇的产率降低,原因是230 ℃以上,升温对反应Ⅱ的影响更大
D. 恒压恒温下充入氦气,不影响CO2转化率
Ⅱ卷(非选择题,共61分)
14.铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1)Cu在周期表中位于 ▲ 区,Cu2+价电子排布式为 ▲ 。
(2)邻氨基吡啶()的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为 ▲ ;1mol中σ键的数目为 ▲ mol。邻氨基吡啶的铜配合物结构简式如右图所示,C原子轨道杂化类型为 ▲ 。
(3)蓝色晶体[Cu(NH3)4]SO4 H2O为铜的配位化合物。
①NH3分子中H-N-H键角 ▲ (选填“大于”、“等于”、“小于”)[Cu(NH3)4]2+中H-N-H键角。
②NF3与NH3均为三角锥形分子,NF3分子中的氮原子不易与Cu2+形成配离子,请从电负性角度分析其原因是 ▲ 。
15.A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略)。其中,A是一种气态烃,在标准状况下的密度是,其产量是衡量一个国家石油化工发展水平的标志;C的分子式为;B和C在浓硫酸和加热的条件下发生反应,生成的有机物D有特殊的香味。试回答下列问题:
(1)A的结构简式为 ▲ ,丙烯酸分子结构中所含的含氧官能团名称是 ▲ ,丙烯分子中最多有 ▲ 个原子共平面。
(2)丙烯酸乙酯可能发生的反应类型有 ▲ 。
①加成反应 ②氧化反应 ③加聚反应 ④取代反应
A.①③ B.①②③ C.①③④ D.①②③④
(3)写出丙烯酸生成聚丙烯酸的化学方程式 ▲ 。
(4)有机物D的质谱图和红外光谱分别如图所示,则该有机物的结构简式为 ▲ 。
(5)下列有关说法正确的是 ▲ (填编号)。
A.D与丙烯酸乙酯互为同系物 B.B→C的转化是氧化反应
C.可以用酸性溶液鉴别A和丙烯酸 D.A→B的转化是加成反应
(6)丙烯酸乙酯有很多同分异构体,其中含有—COOH的同分异构体有 ▲ 种(不考虑立体异构)。
16. Ⅰ . 月桂烯()是重要的化工原料,广泛用于香料行业。
(1) 月桂烯与足量氢气完全加成后生成A,A的名称是 ▲ 。
(2) 以月桂烯为原料制取乙酸香叶酯的流程如图:
① B中含有的官能团的名称为 ▲ ;
② 乙酸香叶酯的化学式为 ▲ ;
③ 反应Ⅰ的反应类型为 ▲ ;
④ 反应Ⅱ的化学方程式为 ▲ 。
Ⅱ. 双烯合成即Diels-Alder反应,由共轭双烯与烯烃或炔烃反应生成六元环的反应,是有机化学合成反应中非常重要的碳碳键形成的手段之一。
例如:
(3) 物质M()是月桂烯的同分异构体,可由烃N(C5H8)通过Diels-Alder反应合成,则烃N的系统命名是 ▲ 。
(4) 烯烃能在臭氧作用下发生臭氧化及分解反应,可表示如下:
(R1、R2、R3、R4为烃基或氢原子)。
① 写出M()发生上述反应的产物中相对分子质量较大的物质的结构简式: ▲ (以键线式表示)。
② 加热条件下,用碱性新制Cu(OH)2检验另一种产物分子中的官能团的化学方程式为
▲ (产物中有Na2CO3、Cu2O)。
17.钛酸钡(BaTiO3)是制备电子陶瓷材料的基础原料。
(1) 实验室模拟制备钛酸钡的过程如下:
已知:TiCl4能水解生成TiO2+,TiO2+能进一步水解生成TiO2;BaTiO3能与浓硫酸反应生成TiO2+。草酸氧钛钡晶体的化学式为BaTiO(C2O4)2·4H2O。
① Ti(Ⅳ)的存在形式(相对含量分数)与溶液pH的关系如图1所示。“沉钛”时,需加入氨水调节溶液的pH在2~3之间,理由是 ▲ 。
图1 图2 图3
② 由草酸氧钛钡晶体(相对分子质量为449)煅烧制得钛酸钡分为三个阶段。现称取44.9 g草酸氧钛钡晶体进行热重分析,测得残留固体质量与温度的变化关系如图2所示。C点残留固体中含有碳酸钡和钛氧化物,则阶段Ⅱ发生反应的化学方程式为 ▲ 。
③ 钛酸钡晶胞的结构示意图如图3所示,其中与Ti4+紧邻的O2-构成的几何构型是 ▲ 。
(2) 利用Fe3+将浅紫色Ti3+氧化为无色Ti(Ⅳ)的反应可用于测定钛酸钡的纯度。
① 请补充完整实验方案:称量2.33 g钛酸钡样品完全溶于浓硫酸后,加入过量铝粉,充分振荡,使其完全反应(Al将TiO2+转化为Ti3+); ▲ ;向待测钛液中加入稀硫酸酸化后,将其转移到100 mL容量瓶中后定容,取20.00 mL待测钛液于锥形瓶中, ▲ ;记录消耗标准液的体积,重复滴定实验操作3次,平均消耗标准液19.50 mL(实验时须使用的试剂:0.100 0 mol/L FeCl3溶液、KSCN溶液)。
② 计算钛酸钡样品的纯度(写出计算过程)。
江苏省扬州中学2024-2025学年第二学期阶段检测
高二化学参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13
B B A C B A D D C C B D C
填空题除标注外,每空2分
14(14分)(1) ds 3d9 (2) N>O>C 13 sp2、sp3
(3) ① 小于
② F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子对其孤电子对的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子
15(17分)(1) CH2 =CH2 羧基 7 (2)D
(3)(3分)
(4)CH3COOCH2CH3
(5)BD
(6)12
(16分)(1) 2,6-二甲基辛烷
(2) ① 碳碳双键、碳氯键 ;
② C12H20O2 ;
③ 加成反应 ;
④ +CH3COONaNaCl+ 。
(3)2-甲基-1,3-丁二烯
(4)①
②HCHO+4Cu(OH)2+2NaOHNa2CO3+2Cu2O↓+6H2O
17(14分)(1)①pH在2~3之间时,Ti(Ⅳ)主要以TiO(C2O4)的形式存在,可直接与Ba2+反应,有利于草酸氧钛钡晶体的生成。
②(3分)BaTiO(C2O4)2BaCO3+TiO2+2CO↑+CO2↑
③正八面体形
(2)①过滤,洗涤滤渣2~3次,将洗涤液与原滤液合并,
向锥形瓶中滴加2~3滴KSCN溶液,用0.100 0 mol/L FeCl3溶液滴定,当滴入最后半滴标准液时,溶液由浅紫色变成红色,且半分钟内红色不褪去
②(3分)
根据反应:Ti3++Fe3+―→Ti(Ⅳ)+Fe2+可知,
20 mL待测钛液中,
n(Ti3+)=n(Fe3+)=0.019 5 L×0.100 0 mol/L=0.001 95 mol
钛酸钡样品的纯度=×100%=97.5%
同课章节目录
