6.1 第2课时 化学反应与电能 学案 (含答案)2024-2025学年高一化学人教版(2019)必修2
文档属性
| 名称 | 6.1 第2课时 化学反应与电能 学案 (含答案)2024-2025学年高一化学人教版(2019)必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 544.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-28 20:53:03 | ||
图片预览


文档简介
第2课时 化学反应与电能
【课程目标】 1.设计实验认识构成原电池的条件。
2.理解原电池的概念及工作原理,能正确判断原电池的正、负极。
3.了解原电池工作原理的应用。
夯基提能·一遍过
知识点一 火力发电——化学能间接转化为电能
1.电能来源
目前我国使用的电能主要来自火力发电,其次来自水力发电。
2.火力发电的原理
通过化石燃料燃烧时发生的氧化还原反应,使化学能转化为________,加热水使之汽化为蒸汽以推动蒸汽轮机,带动发电机发电。
3.能量转换过程
化学能________________电能。
4.能量转化的关键及特点
关键 燃烧(氧化还原反应)
特点 能量利用率低,污染严重
即学即练
1.下列说法不正确的是( )
A.火力发电用的煤是不可再生能源
B.煤经过气化和液化两个化学变化,可变为清洁能源
C.电能是一种清洁、高效、便捷的一次能源
D.科学规划开发水电,可助力实现碳达峰、碳中和的“双碳”目标
2.试从资源、能效、对环境的影响等方面,阐述火力发电的弊端有哪些?
知识点二 原电池
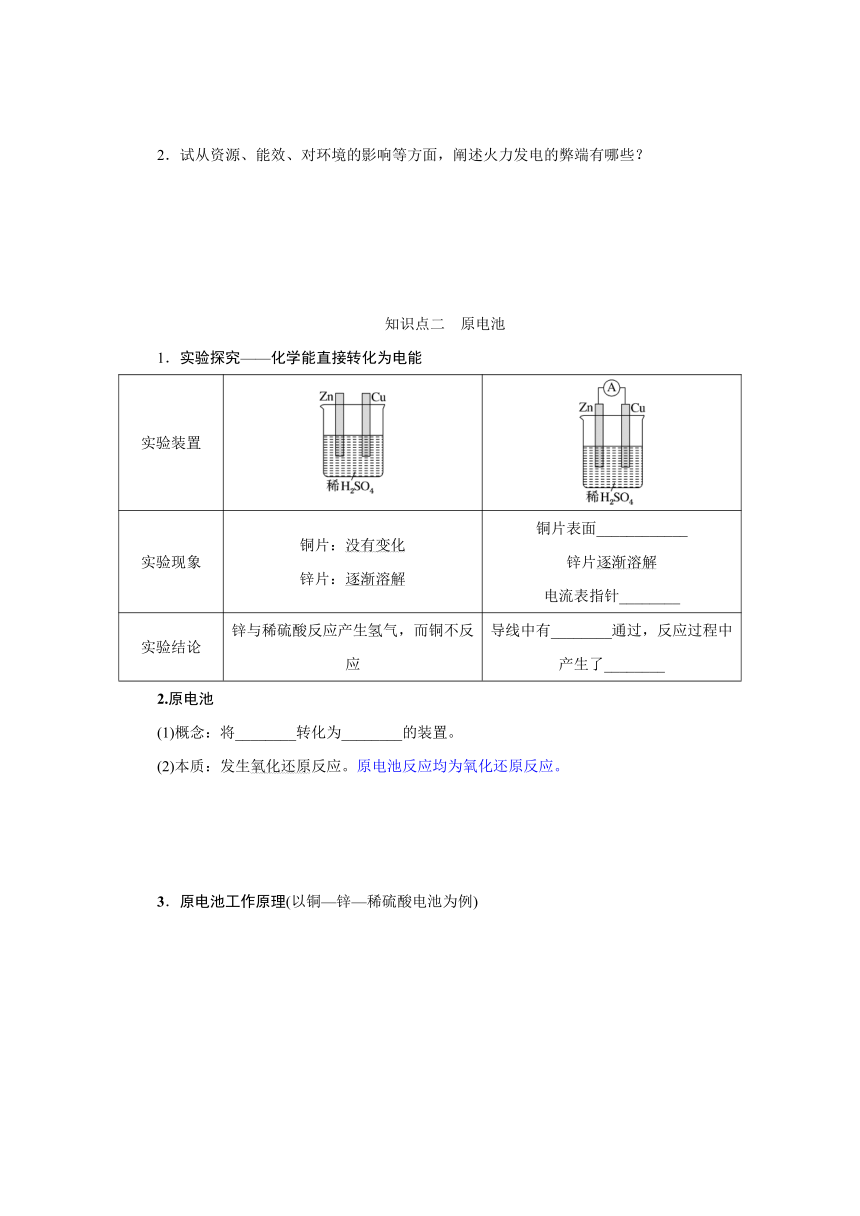
1.实验探究——化学能直接转化为电能
实验装置
实验现象 铜片:没有变化 锌片:逐渐溶解 铜片表面____________ 锌片逐渐溶解 电流表指针________
实验结论 锌与稀硫酸反应产生氢气,而铜不反应 导线中有________通过,反应过程中产生了________
2.原电池
(1)概念:将________转化为________的装置。
(2)本质:发生氧化还原反应。原电池反应均为氧化还原反应。
3.原电池工作原理(以铜—锌—稀硫酸电池为例)
【师说·提醒】 电极(锌片、铜片)和导线中的导电微粒是电子;电解质溶液中的导电微粒是阴、阳离子。
4.原电池的构成条件
即学即练
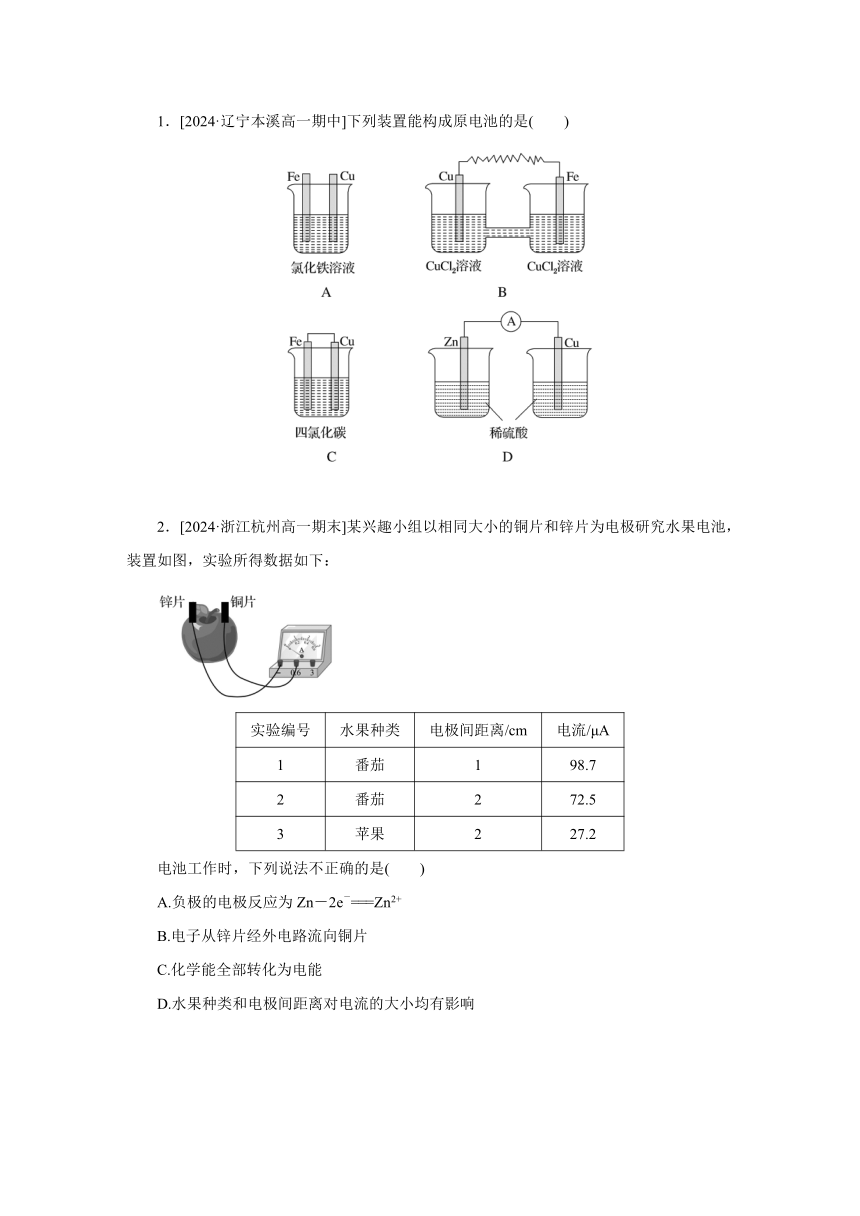
1.[2024·辽宁本溪高一期中]下列装置能构成原电池的是( )
2.[2024·浙江杭州高一期末]某兴趣小组以相同大小的铜片和锌片为电极研究水果电池,装置如图,实验所得数据如下:
实验编号 水果种类 电极间距离/cm 电流/μA
1 番茄 1 98.7
2 番茄 2 72.5
3 苹果 2 27.2
电池工作时,下列说法不正确的是( )
A.负极的电极反应为Zn-2e-===Zn2+
B.电子从锌片经外电路流向铜片
C.化学能全部转化为电能
D.水果种类和电极间距离对电流的大小均有影响
知识点三 原电池工作原理的应用
1.加快氧化还原反应的进行
在原电池中,氧化反应和还原反应分别在两极进行,使溶液中粒子运动相互间的干扰减小,使反应加快。
2.比较金属的活动性
一般地,两种金属A、B与电解质溶液构成原电池,若A作负极,则金属活动性:________。
3.设计原电池
一般给定氧化还原反应的还原剂作负极,氧化剂作电解质溶液,比负极活动性弱的金属或石墨等能导电的非金属作正极。
【师说·助学】 利用Cu+2AgNO3===Cu(NO3)2+2Ag设计原电池。
即学即练
1.[2024·黑龙江佳木斯高一期中]少量的Zn与过量的稀硫酸反应制取氢气,一定温度下能加快反应速率又不影响氢气的量,可向其中加入少量的( )
A.CuSO4晶体 B.CH3COONa固体
C.NaHSO4晶体 D.Na2SO4溶液
2.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为________,判断依据为________________。
素养落实·重拓展
题型 判断原电池电极名称的方法
例 根据原电池原理,结合装置图,按要求解答问题:
(1)若X为Zn,Y为硫酸铜溶液,则X为________(填电极名称);铜电极的名称是________,溶液中的Cu2+移向________(填“Cu”或“X”)电极。
(2)若X为银,Y为硝酸银溶液,则X为________(填电极名称);铜电极的名称是________,溶液中的Ag+移向________(填“Cu”或“X”)电极。X电极上的电极反应式为________________。
练后归纳
电极名称的判断方法
【变式演练】
1.一种锂水电池以锂和钢板为电极,LiOH为电解质,使用时加入水即可放电,总反应为2Li+2H2O===2LiOH+H2↑。下列有关该电池的说法错误的是( )
A.锂极为负极
B.OH-移向正极
C.H2为正极产物
D.电子由锂经导线流向钢板
2.[2024·陕西宝鸡高一期中]锌锰干电池是应用最普遍的电池之一,其基本反应为
X极:Zn-2e-===Zn2+。
Y极:2MnO2++2e-===Mn2O3+2NH3+H2O。
(1)该反应中MnO2是________(填“还原剂”或“氧化剂”)。
(2)X是电池的________(填“正”或“负”,下同)极,Zn2+向________极移动。
(3)若反应消耗16.25 g Zn,则电池中转移电子的物质的量为________。
第2课时 化学反应与电能
夯基提能·一遍过
知识点一
2.热能
3.热能 机械能
即学即练
1.解析:火力发电用的煤是化石能源,煤是不可再生能源,故A正确;煤经过气化和液化两个化学变化,可变为清洁能源,故B正确;电能是一种清洁、高效、便捷的二次能源,故C错误;科学规划开发水电,能降低化石燃料的消耗,可助力实现碳达峰、碳中和的“双碳”目标,故D正确。
答案:C
2.答案:①化石燃料属于不可再生能源,用化石燃料发电会造成资源的浪费;②火力发电的过程中,能量经过多次转化,利用率低,能量损失大;③化石燃料燃烧会产生大量的有害物质(如SO2、CO、NOx、粉尘等),污染环境。
知识点二
1.有气泡产生 发生偏转 电流 电能
2.(1)化学能 电能
3.锌片 铜片 Zn-2e-===Zn2+ 2H++2e-===H2↑ 氧化 还原 Zn Cu Cu 正极 负极 Zn+2H+===Zn2++H2↑
4.活泼性不同 电解质 闭合回路 氧化还原
即学即练
1.解析:未形成闭合回路,不能构成原电池,故A错误;装置中有两个活泼性不同的电极、有电解质溶液、形成了闭合回路,同时有自发进行的氧化还原反应:Fe+CuCl2===FeCl2+Cu,即符合原电池的构成原理和条件,故B正确;四氯化碳为非电解质,不能构成原电池,故C错误;未形成闭合回路,不能构成原电池,故D错误。
答案:B
2.解析:水果中的电解质溶液与锌片、铜片构成原电池,锌为负极,失去电子发生氧化反应,铜片为正极,发生得到电子的还原反应,电子从负极经导线流向正极。溶液中的离子移动方向是阳正阴负。负极的电极反应为Zn-2e-===Zn2+,A正确;Zn为负极,电子从负极到正极,即电子从锌片经外电路流向铜片,B正确;化学能不可能全部转化为电能,一部分转化为热能,C错误;水果中的电解质溶液的酸性越强,电解质溶液导电能力就越强,两个电极之间的距离越大,水果电池的电流越小,可见水果的种类和电极间距离对电流的大小均有影响,D正确。
答案:C
知识点三
2.A>B
[师说·助学] 提示:
即学即练
1.解析:CuSO4晶体溶于水后与Zn反应,生成ZnSO4和Cu,Zn、Cu、稀硫酸形成原电池,反应速率加快,但由于与硫酸反应的Zn量减少,生成H2的体积减少,A不符合题意;CH3COONa固体溶于水后,与稀硫酸反应,使溶液中c(H+)减小,反应速率减慢,B不符合题意;NaHSO4晶体溶于水后,增大了溶液中的c(H+),加快反应速率,但对产生H2的体积不产生影响,C符合题意;加入Na2SO4溶液,相当于加入水,使c(H+)减小,反应速率减慢,D不符合题意。
答案:C
2.答案:Y>X>Z 根据原电池原理,负极的金属比正极活泼,可知Y>X,根据金属活动性顺序表和置换反应原理,可知X>Z,故有Y>X>Z
素养落实·重拓展
例 答案:(1)负极 正极 Cu (2)正极 负极 X ===Ag
变式演练
1.解析:由方程式可知,Li失去电子,发生氧化反应,作负极,则钢板作正极,A项正确;负极上的电极方程式为Li-e-+OH-===LiOH,可知OH-移向负极,B项错误;正极上的电极方程式为2H2O+2e-===2OH-+H2↑,可知氢气为正极产物,C项正确;电子会从负极经外电路流向正极,即电子由锂经导线流向钢板,D项正确。
答案:B
2.解析:(1)MnO2中Mn元素化合价降低,得电子,作氧化剂。(2)X极Zn失电子,X作负极,阳离子Zn2+移向正极。
(3)因为1 mol Zn失2 mol电子,反应消耗16.25 g,即0.25 mol Zn,所以电池中转移电子的物质的量为0.25 mol×2=0.5 mol。
答案:(1)氧化剂 (2)负 正 (3)0.5 mol
【课程目标】 1.设计实验认识构成原电池的条件。
2.理解原电池的概念及工作原理,能正确判断原电池的正、负极。
3.了解原电池工作原理的应用。
夯基提能·一遍过
知识点一 火力发电——化学能间接转化为电能
1.电能来源
目前我国使用的电能主要来自火力发电,其次来自水力发电。
2.火力发电的原理
通过化石燃料燃烧时发生的氧化还原反应,使化学能转化为________,加热水使之汽化为蒸汽以推动蒸汽轮机,带动发电机发电。
3.能量转换过程
化学能________________电能。
4.能量转化的关键及特点
关键 燃烧(氧化还原反应)
特点 能量利用率低,污染严重
即学即练
1.下列说法不正确的是( )
A.火力发电用的煤是不可再生能源
B.煤经过气化和液化两个化学变化,可变为清洁能源
C.电能是一种清洁、高效、便捷的一次能源
D.科学规划开发水电,可助力实现碳达峰、碳中和的“双碳”目标
2.试从资源、能效、对环境的影响等方面,阐述火力发电的弊端有哪些?
知识点二 原电池
1.实验探究——化学能直接转化为电能
实验装置
实验现象 铜片:没有变化 锌片:逐渐溶解 铜片表面____________ 锌片逐渐溶解 电流表指针________
实验结论 锌与稀硫酸反应产生氢气,而铜不反应 导线中有________通过,反应过程中产生了________
2.原电池
(1)概念:将________转化为________的装置。
(2)本质:发生氧化还原反应。原电池反应均为氧化还原反应。
3.原电池工作原理(以铜—锌—稀硫酸电池为例)
【师说·提醒】 电极(锌片、铜片)和导线中的导电微粒是电子;电解质溶液中的导电微粒是阴、阳离子。
4.原电池的构成条件
即学即练
1.[2024·辽宁本溪高一期中]下列装置能构成原电池的是( )
2.[2024·浙江杭州高一期末]某兴趣小组以相同大小的铜片和锌片为电极研究水果电池,装置如图,实验所得数据如下:
实验编号 水果种类 电极间距离/cm 电流/μA
1 番茄 1 98.7
2 番茄 2 72.5
3 苹果 2 27.2
电池工作时,下列说法不正确的是( )
A.负极的电极反应为Zn-2e-===Zn2+
B.电子从锌片经外电路流向铜片
C.化学能全部转化为电能
D.水果种类和电极间距离对电流的大小均有影响
知识点三 原电池工作原理的应用
1.加快氧化还原反应的进行
在原电池中,氧化反应和还原反应分别在两极进行,使溶液中粒子运动相互间的干扰减小,使反应加快。
2.比较金属的活动性
一般地,两种金属A、B与电解质溶液构成原电池,若A作负极,则金属活动性:________。
3.设计原电池
一般给定氧化还原反应的还原剂作负极,氧化剂作电解质溶液,比负极活动性弱的金属或石墨等能导电的非金属作正极。
【师说·助学】 利用Cu+2AgNO3===Cu(NO3)2+2Ag设计原电池。
即学即练
1.[2024·黑龙江佳木斯高一期中]少量的Zn与过量的稀硫酸反应制取氢气,一定温度下能加快反应速率又不影响氢气的量,可向其中加入少量的( )
A.CuSO4晶体 B.CH3COONa固体
C.NaHSO4晶体 D.Na2SO4溶液
2.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为________,判断依据为________________。
素养落实·重拓展
题型 判断原电池电极名称的方法
例 根据原电池原理,结合装置图,按要求解答问题:
(1)若X为Zn,Y为硫酸铜溶液,则X为________(填电极名称);铜电极的名称是________,溶液中的Cu2+移向________(填“Cu”或“X”)电极。
(2)若X为银,Y为硝酸银溶液,则X为________(填电极名称);铜电极的名称是________,溶液中的Ag+移向________(填“Cu”或“X”)电极。X电极上的电极反应式为________________。
练后归纳
电极名称的判断方法
【变式演练】
1.一种锂水电池以锂和钢板为电极,LiOH为电解质,使用时加入水即可放电,总反应为2Li+2H2O===2LiOH+H2↑。下列有关该电池的说法错误的是( )
A.锂极为负极
B.OH-移向正极
C.H2为正极产物
D.电子由锂经导线流向钢板
2.[2024·陕西宝鸡高一期中]锌锰干电池是应用最普遍的电池之一,其基本反应为
X极:Zn-2e-===Zn2+。
Y极:2MnO2++2e-===Mn2O3+2NH3+H2O。
(1)该反应中MnO2是________(填“还原剂”或“氧化剂”)。
(2)X是电池的________(填“正”或“负”,下同)极,Zn2+向________极移动。
(3)若反应消耗16.25 g Zn,则电池中转移电子的物质的量为________。
第2课时 化学反应与电能
夯基提能·一遍过
知识点一
2.热能
3.热能 机械能
即学即练
1.解析:火力发电用的煤是化石能源,煤是不可再生能源,故A正确;煤经过气化和液化两个化学变化,可变为清洁能源,故B正确;电能是一种清洁、高效、便捷的二次能源,故C错误;科学规划开发水电,能降低化石燃料的消耗,可助力实现碳达峰、碳中和的“双碳”目标,故D正确。
答案:C
2.答案:①化石燃料属于不可再生能源,用化石燃料发电会造成资源的浪费;②火力发电的过程中,能量经过多次转化,利用率低,能量损失大;③化石燃料燃烧会产生大量的有害物质(如SO2、CO、NOx、粉尘等),污染环境。
知识点二
1.有气泡产生 发生偏转 电流 电能
2.(1)化学能 电能
3.锌片 铜片 Zn-2e-===Zn2+ 2H++2e-===H2↑ 氧化 还原 Zn Cu Cu 正极 负极 Zn+2H+===Zn2++H2↑
4.活泼性不同 电解质 闭合回路 氧化还原
即学即练
1.解析:未形成闭合回路,不能构成原电池,故A错误;装置中有两个活泼性不同的电极、有电解质溶液、形成了闭合回路,同时有自发进行的氧化还原反应:Fe+CuCl2===FeCl2+Cu,即符合原电池的构成原理和条件,故B正确;四氯化碳为非电解质,不能构成原电池,故C错误;未形成闭合回路,不能构成原电池,故D错误。
答案:B
2.解析:水果中的电解质溶液与锌片、铜片构成原电池,锌为负极,失去电子发生氧化反应,铜片为正极,发生得到电子的还原反应,电子从负极经导线流向正极。溶液中的离子移动方向是阳正阴负。负极的电极反应为Zn-2e-===Zn2+,A正确;Zn为负极,电子从负极到正极,即电子从锌片经外电路流向铜片,B正确;化学能不可能全部转化为电能,一部分转化为热能,C错误;水果中的电解质溶液的酸性越强,电解质溶液导电能力就越强,两个电极之间的距离越大,水果电池的电流越小,可见水果的种类和电极间距离对电流的大小均有影响,D正确。
答案:C
知识点三
2.A>B
[师说·助学] 提示:
即学即练
1.解析:CuSO4晶体溶于水后与Zn反应,生成ZnSO4和Cu,Zn、Cu、稀硫酸形成原电池,反应速率加快,但由于与硫酸反应的Zn量减少,生成H2的体积减少,A不符合题意;CH3COONa固体溶于水后,与稀硫酸反应,使溶液中c(H+)减小,反应速率减慢,B不符合题意;NaHSO4晶体溶于水后,增大了溶液中的c(H+),加快反应速率,但对产生H2的体积不产生影响,C符合题意;加入Na2SO4溶液,相当于加入水,使c(H+)减小,反应速率减慢,D不符合题意。
答案:C
2.答案:Y>X>Z 根据原电池原理,负极的金属比正极活泼,可知Y>X,根据金属活动性顺序表和置换反应原理,可知X>Z,故有Y>X>Z
素养落实·重拓展
例 答案:(1)负极 正极 Cu (2)正极 负极 X ===Ag
变式演练
1.解析:由方程式可知,Li失去电子,发生氧化反应,作负极,则钢板作正极,A项正确;负极上的电极方程式为Li-e-+OH-===LiOH,可知OH-移向负极,B项错误;正极上的电极方程式为2H2O+2e-===2OH-+H2↑,可知氢气为正极产物,C项正确;电子会从负极经外电路流向正极,即电子由锂经导线流向钢板,D项正确。
答案:B
2.解析:(1)MnO2中Mn元素化合价降低,得电子,作氧化剂。(2)X极Zn失电子,X作负极,阳离子Zn2+移向正极。
(3)因为1 mol Zn失2 mol电子,反应消耗16.25 g,即0.25 mol Zn,所以电池中转移电子的物质的量为0.25 mol×2=0.5 mol。
答案:(1)氧化剂 (2)负 正 (3)0.5 mol
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
