7.1 第1课时 碳原子的成键特点 烷烃的结构 学案 (含答案) 2024-2025学年高一化学人教版(2019)必修2
文档属性
| 名称 | 7.1 第1课时 碳原子的成键特点 烷烃的结构 学案 (含答案) 2024-2025学年高一化学人教版(2019)必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 560.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-28 20:59:49 | ||
图片预览


文档简介
第1课时 碳原子的成键特点 烷烃的结构
【课程目标】
1.知道有机化合物分子具有的空间结构,以甲烷为例认识有机物中碳原子的成键特点。
2.认识烷烃的组成及结构,了解有机物的多种表示方法。
知识点一 有机化合物中碳原子的成键特点
1.甲烷中碳原子的成键特点
碳原子的结构示意图为____________,其最外层的4个电子分别与4个氢原子的电子形成了________个C—H共价键。
甲烷的电子式:__________,结构式:__________。
2.有机化合物中碳原子的成键特点
【师说·助学1】 有机化合物中每个碳原子能与其他原子形成4个共价键。下图中碳原子的其余共价键均与氢原子相连。写出各物质的分子式。
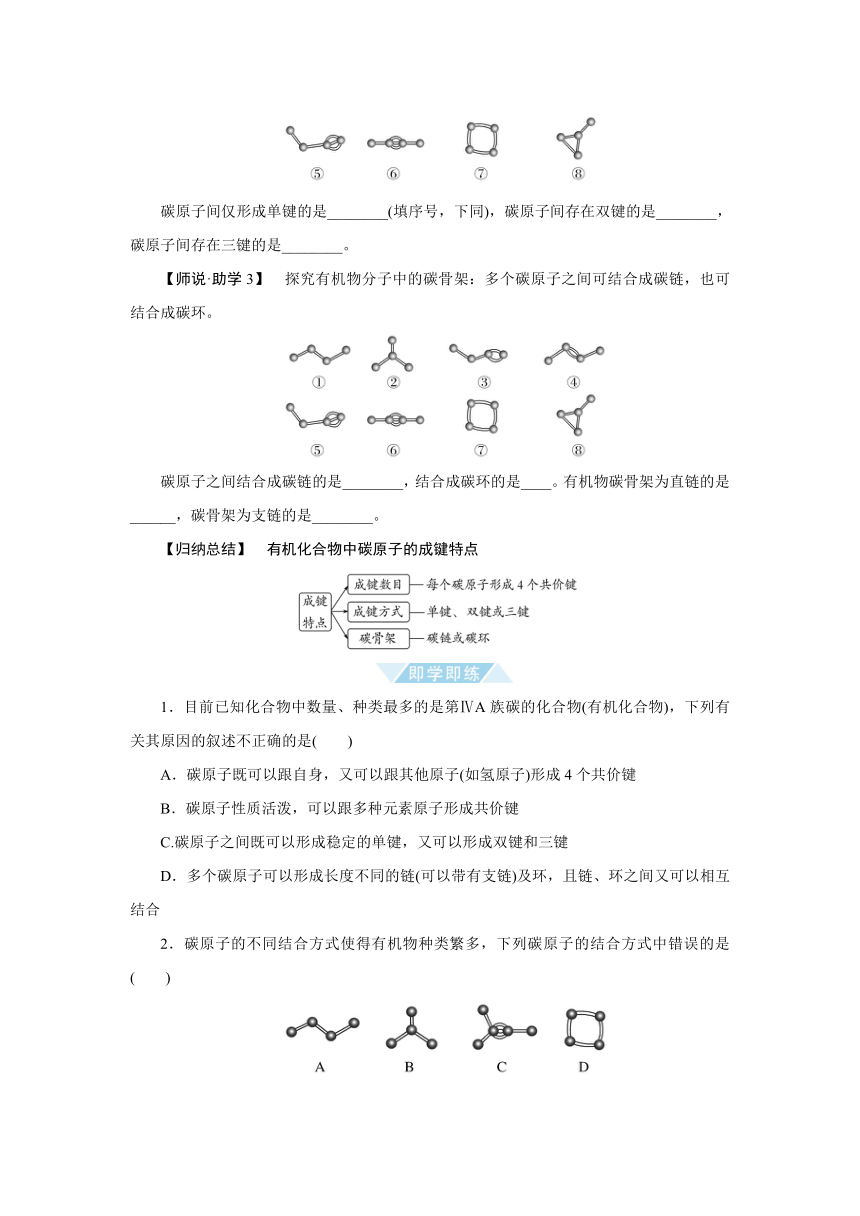
【师说·助学2】 探究有机物分子中碳原子之间的成键方式。
碳原子间仅形成单键的是________(填序号,下同),碳原子间存在双键的是________,碳原子间存在三键的是________。
【师说·助学3】 探究有机物分子中的碳骨架:多个碳原子之间可结合成碳链,也可结合成碳环。
碳原子之间结合成碳链的是________,结合成碳环的是____。有机物碳骨架为直链的是______,碳骨架为支链的是________。
【归纳总结】 有机化合物中碳原子的成键特点
1.目前已知化合物中数量、种类最多的是第ⅣA族碳的化合物(有机化合物),下列有关其原因的叙述不正确的是( )
A.碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键
B.碳原子性质活泼,可以跟多种元素原子形成共价键
C.碳原子之间既可以形成稳定的单键,又可以形成双键和三键
D.多个碳原子可以形成长度不同的链(可以带有支链)及环,且链、环之间又可以相互结合
2.碳原子的不同结合方式使得有机物种类繁多,下列碳原子的结合方式中错误的是( )
知识点二 烷烃的结构
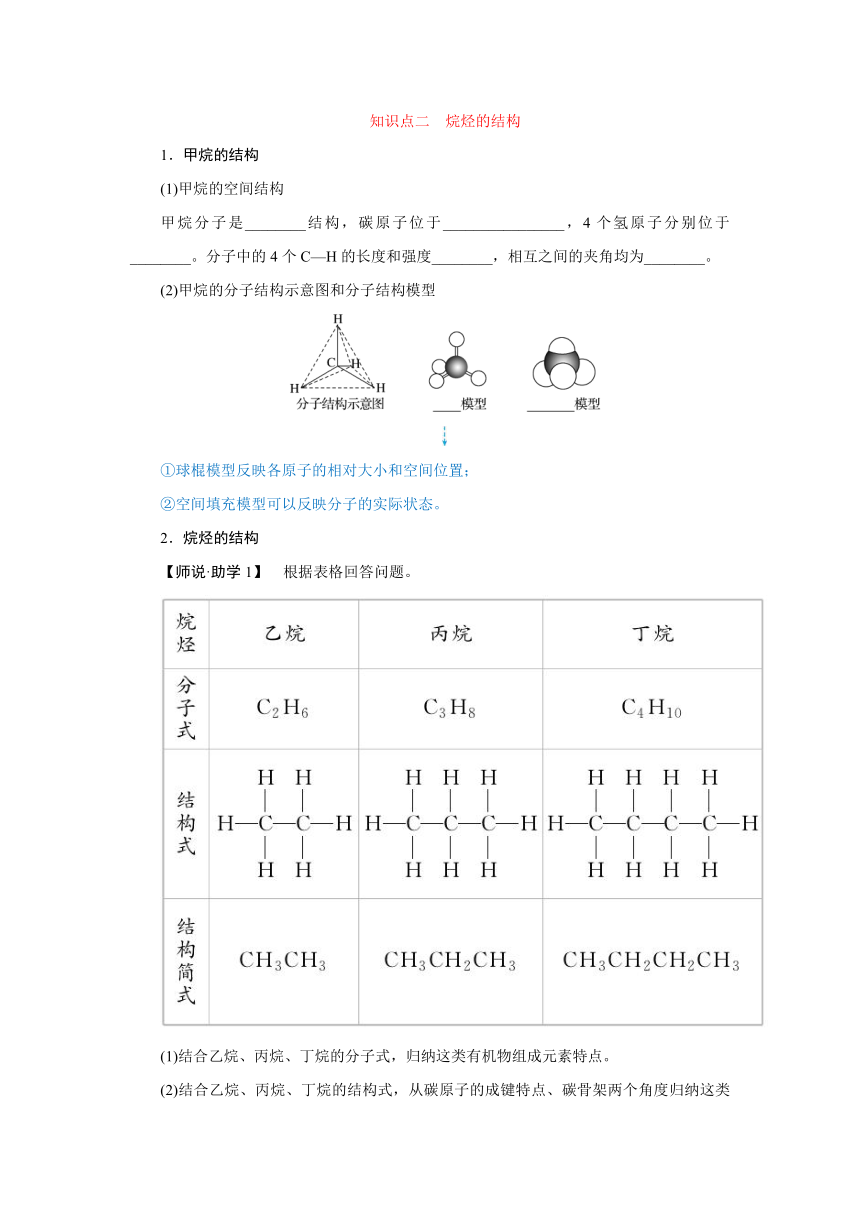
1.甲烷的结构
(1)甲烷的空间结构
甲烷分子是________结构,碳原子位于________________,4个氢原子分别位于________。分子中的4个C—H的长度和强度________,相互之间的夹角均为________。
(2)甲烷的分子结构示意图和分子结构模型
①球棍模型反映各原子的相对大小和空间位置;
②空间填充模型可以反映分子的实际状态。
2.烷烃的结构
【师说·助学1】 根据表格回答问题。
(1)结合乙烷、丙烷、丁烷的分子式,归纳这类有机物组成元素特点。
(2)结合乙烷、丙烷、丁烷的结构式,从碳原子的成键特点、碳骨架两个角度归纳这类有机物的分子结构特点。
(3)设n代表有机化合物分子中碳原子个数。结合乙烷、丙烷、丁烷的分子式,归纳这类有机物分子式的通式。
【归纳总结】 烷烃
(1)烷烃的定义
只含有碳和氢两种元素,分子中的碳原子之间都以单键结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”。这样的一类有机化合物称为饱和烃,也称为烷烃。
(2)链状烷烃
碳骨架呈链状结构的烷烃称为链状烷烃。
(3)链状烷烃的习惯命名(n为碳原子个数)
(4)链状烷烃的通式:CnH2n+2(n≥1)。
【师说·助学2】 下列表示的物质中,属于链状烷烃的是________(填序号)。
1.以下结构表示的有机物属于链状烷烃的是( )
2.下面是4个碳原子相互结合的6种方式(氢原子没有画出),其中符合通式CnH2n+2的是( )
A.②③ B.①⑤
C.②③④ D.①⑤⑥
题型 有机物的表示方法
例. 图Ⅰ、Ⅱ、Ⅲ、Ⅳ均能表示甲烷的分子结构,下列说法错误的是( )
A.Ⅰ将各原子看成了质点,为空间结构示意图
B.Ⅱ为电子式,表示甲烷分子中有8个电子
C.Ⅲ为球棍模型,棍代表甲烷分子内含有的共价键
D.Ⅳ为空间填充模型,能表示甲烷的空间结构及各原子的相对大小
练后归纳
有机物的表示方法
种类 实例 含义
分子式 CH4 用元素符号表示物质分子组成的式子,可反映一个分子中原子的种类和数目
最简式 (实验式) 乙烷(C2H6)的最简式为CH3 ①表示物质组成的各元素原子最简整数比的式子; ②由最简式可求最简式量
电子式 用小黑点等记号代替电子,表示原子最外层电子成键情况的式子
结构式 ①能反映物质的结构; ②表示分子中原子的结合或排列顺序的式子,但不表示空间结构
结构简式 CH3CH3 将结构式中碳碳单键、碳氢键等短线省略后得到的式子即为结构简式,它比结构式书写简单,比较常用,是结构式的简便写法,着重突出结构特点(官能团)
键线式 省略碳、氢元素符号,用线段或折线表示分子中键的连接情况的式子
球棍模型 小球表示原子,小棍表示价键,用于表示分子的空间结构(立体形状)
空间填充模型 ①用不同体积的小球表示不同大小的原子; ②用于表示分子中各原子的相对大小和结合顺序
【变式演练】———————————你学会了吗?
已知正戊烷的分子式为C5H12,结构式为。完成下列问题:
(1)正戊烷的结构简式为________________。
(2)正戊烷的键线式为________________。
第1课时 碳原子的成键特点 烷烃的结构
夯基提能·一遍过
知识点一
1. 4
[师说·助学1] 提示:①C4H10 ②C4H8 ③C4H6
[师说·助学2] 提示:①②⑦⑧ ③④ ⑤⑥
[师说·助学3] 提示:①②③④⑤⑥ ⑦⑧ ①③④⑤⑥ ②
即学即练
1.解析:碳原子性质稳定,不易得电子也不易失电子,故B项错误。
答案:B
2.解析:碳原子之间可以相互结合形成碳链(可带支链),也可形成碳环,但每个碳原子形成4个共价键。故C项错误。
答案:C
知识点二
1.(1)正四面体 正四面体的中心 4个顶点 相同 109°28′ (2)球棍 空间填充
[师说·助学1] 提示:(1)仅由C、H两种元素组成。
(2)碳原子之间都以单键相连,形成链状结构。
(3)CnH2n+2(n≥1)。
[师说·助学2] 提示:②④
即学即练
1.解析:烷烃不含O元素,故A不属于链状烷烃;链状烷烃不含碳碳双键,故B不属于链状烷烃;C项符合链状烷烃的结构特征;链状烷烃不含环状结构,故D不属于链状烷烃。
答案:C
2.解析:符合通式CnH2n+2的是链状烷烃,链状烷烃不含不饱和碳原子和碳环。①⑤不含不饱和碳原子和碳环,属于链状烷烃,②③④含有不饱和碳原子,⑥含有碳环。
答案:B
素养落实·重拓展
例 解析:Ⅱ表示电子式,但略去了碳原子的内层电子,甲烷分子中应含有10个电子。
答案:B
变式演练
答案:(1)CH3CH2CH2CH2CH3或CH3(CH2)3CH3
(2)
【课程目标】
1.知道有机化合物分子具有的空间结构,以甲烷为例认识有机物中碳原子的成键特点。
2.认识烷烃的组成及结构,了解有机物的多种表示方法。
知识点一 有机化合物中碳原子的成键特点
1.甲烷中碳原子的成键特点
碳原子的结构示意图为____________,其最外层的4个电子分别与4个氢原子的电子形成了________个C—H共价键。
甲烷的电子式:__________,结构式:__________。
2.有机化合物中碳原子的成键特点
【师说·助学1】 有机化合物中每个碳原子能与其他原子形成4个共价键。下图中碳原子的其余共价键均与氢原子相连。写出各物质的分子式。
【师说·助学2】 探究有机物分子中碳原子之间的成键方式。
碳原子间仅形成单键的是________(填序号,下同),碳原子间存在双键的是________,碳原子间存在三键的是________。
【师说·助学3】 探究有机物分子中的碳骨架:多个碳原子之间可结合成碳链,也可结合成碳环。
碳原子之间结合成碳链的是________,结合成碳环的是____。有机物碳骨架为直链的是______,碳骨架为支链的是________。
【归纳总结】 有机化合物中碳原子的成键特点
1.目前已知化合物中数量、种类最多的是第ⅣA族碳的化合物(有机化合物),下列有关其原因的叙述不正确的是( )
A.碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键
B.碳原子性质活泼,可以跟多种元素原子形成共价键
C.碳原子之间既可以形成稳定的单键,又可以形成双键和三键
D.多个碳原子可以形成长度不同的链(可以带有支链)及环,且链、环之间又可以相互结合
2.碳原子的不同结合方式使得有机物种类繁多,下列碳原子的结合方式中错误的是( )
知识点二 烷烃的结构
1.甲烷的结构
(1)甲烷的空间结构
甲烷分子是________结构,碳原子位于________________,4个氢原子分别位于________。分子中的4个C—H的长度和强度________,相互之间的夹角均为________。
(2)甲烷的分子结构示意图和分子结构模型
①球棍模型反映各原子的相对大小和空间位置;
②空间填充模型可以反映分子的实际状态。
2.烷烃的结构
【师说·助学1】 根据表格回答问题。
(1)结合乙烷、丙烷、丁烷的分子式,归纳这类有机物组成元素特点。
(2)结合乙烷、丙烷、丁烷的结构式,从碳原子的成键特点、碳骨架两个角度归纳这类有机物的分子结构特点。
(3)设n代表有机化合物分子中碳原子个数。结合乙烷、丙烷、丁烷的分子式,归纳这类有机物分子式的通式。
【归纳总结】 烷烃
(1)烷烃的定义
只含有碳和氢两种元素,分子中的碳原子之间都以单键结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”。这样的一类有机化合物称为饱和烃,也称为烷烃。
(2)链状烷烃
碳骨架呈链状结构的烷烃称为链状烷烃。
(3)链状烷烃的习惯命名(n为碳原子个数)
(4)链状烷烃的通式:CnH2n+2(n≥1)。
【师说·助学2】 下列表示的物质中,属于链状烷烃的是________(填序号)。
1.以下结构表示的有机物属于链状烷烃的是( )
2.下面是4个碳原子相互结合的6种方式(氢原子没有画出),其中符合通式CnH2n+2的是( )
A.②③ B.①⑤
C.②③④ D.①⑤⑥
题型 有机物的表示方法
例. 图Ⅰ、Ⅱ、Ⅲ、Ⅳ均能表示甲烷的分子结构,下列说法错误的是( )
A.Ⅰ将各原子看成了质点,为空间结构示意图
B.Ⅱ为电子式,表示甲烷分子中有8个电子
C.Ⅲ为球棍模型,棍代表甲烷分子内含有的共价键
D.Ⅳ为空间填充模型,能表示甲烷的空间结构及各原子的相对大小
练后归纳
有机物的表示方法
种类 实例 含义
分子式 CH4 用元素符号表示物质分子组成的式子,可反映一个分子中原子的种类和数目
最简式 (实验式) 乙烷(C2H6)的最简式为CH3 ①表示物质组成的各元素原子最简整数比的式子; ②由最简式可求最简式量
电子式 用小黑点等记号代替电子,表示原子最外层电子成键情况的式子
结构式 ①能反映物质的结构; ②表示分子中原子的结合或排列顺序的式子,但不表示空间结构
结构简式 CH3CH3 将结构式中碳碳单键、碳氢键等短线省略后得到的式子即为结构简式,它比结构式书写简单,比较常用,是结构式的简便写法,着重突出结构特点(官能团)
键线式 省略碳、氢元素符号,用线段或折线表示分子中键的连接情况的式子
球棍模型 小球表示原子,小棍表示价键,用于表示分子的空间结构(立体形状)
空间填充模型 ①用不同体积的小球表示不同大小的原子; ②用于表示分子中各原子的相对大小和结合顺序
【变式演练】———————————你学会了吗?
已知正戊烷的分子式为C5H12,结构式为。完成下列问题:
(1)正戊烷的结构简式为________________。
(2)正戊烷的键线式为________________。
第1课时 碳原子的成键特点 烷烃的结构
夯基提能·一遍过
知识点一
1. 4
[师说·助学1] 提示:①C4H10 ②C4H8 ③C4H6
[师说·助学2] 提示:①②⑦⑧ ③④ ⑤⑥
[师说·助学3] 提示:①②③④⑤⑥ ⑦⑧ ①③④⑤⑥ ②
即学即练
1.解析:碳原子性质稳定,不易得电子也不易失电子,故B项错误。
答案:B
2.解析:碳原子之间可以相互结合形成碳链(可带支链),也可形成碳环,但每个碳原子形成4个共价键。故C项错误。
答案:C
知识点二
1.(1)正四面体 正四面体的中心 4个顶点 相同 109°28′ (2)球棍 空间填充
[师说·助学1] 提示:(1)仅由C、H两种元素组成。
(2)碳原子之间都以单键相连,形成链状结构。
(3)CnH2n+2(n≥1)。
[师说·助学2] 提示:②④
即学即练
1.解析:烷烃不含O元素,故A不属于链状烷烃;链状烷烃不含碳碳双键,故B不属于链状烷烃;C项符合链状烷烃的结构特征;链状烷烃不含环状结构,故D不属于链状烷烃。
答案:C
2.解析:符合通式CnH2n+2的是链状烷烃,链状烷烃不含不饱和碳原子和碳环。①⑤不含不饱和碳原子和碳环,属于链状烷烃,②③④含有不饱和碳原子,⑥含有碳环。
答案:B
素养落实·重拓展
例 解析:Ⅱ表示电子式,但略去了碳原子的内层电子,甲烷分子中应含有10个电子。
答案:B
变式演练
答案:(1)CH3CH2CH2CH2CH3或CH3(CH2)3CH3
(2)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
