第六章 化学反应与能量 实验活动 7 化学反应速率的影响因素 学案(含答案)2024-2025学年高一化学人教版(2019)必修2
文档属性
| 名称 | 第六章 化学反应与能量 实验活动 7 化学反应速率的影响因素 学案(含答案)2024-2025学年高一化学人教版(2019)必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 82.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-28 21:16:18 | ||
图片预览


文档简介
实验活动7 化学反应速率的影响因素
【实验目的】
1.体验浓度、温度和催化剂对化学反应速率的影响。
2.理解改变反应条件可以调控化学反应的速率。
【实验原理】
1.硫代硫酸钠与硫酸的反应
硫代硫酸钠与硫酸反应会生成不溶于水的硫:
Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
反应生成的硫使溶液出现乳白色浑浊,比较浑浊现象出现所需时间的长短,可以判断该反应进行的快慢。在不同浓度和温度条件下分别进行上述反应,并比较其反应快慢,可以看出反应物浓度和温度对该反应速率的影响。
2.过氧化氢分解会产生氧气,在有或无催化剂存在下进行对比实验,通过观察氧气产生的快慢可以看出催化剂对该反应速率的影响。
【实验用品】
烧杯、试管、量筒、试管架、胶头滴管、温度计、药匙、秒表。
0.1 mol·L-1 Na2S2O3溶液、0.1 mol·L-1 H2SO4溶液、10% H2O2溶液、1 mol·L-1 FeCl3溶液、MnO2粉末、蒸馏水。
【方法指导】
为了比较实验中溶液出现浑浊的快慢,可以先在一张白纸上用黑色记号笔在合适的位置画上粗细、深浅一致的“十”字,衬在反应容器(锥形瓶)的底部。实验以Na2S2O3和H2SO4两溶液相混合时开始计时,到溶液出现的浑浊将锥形瓶底部的“十”字完全遮盖时结束(如图)。通过比较记录反应所需时间,可以判断反应速率的大小。
【实验步骤】
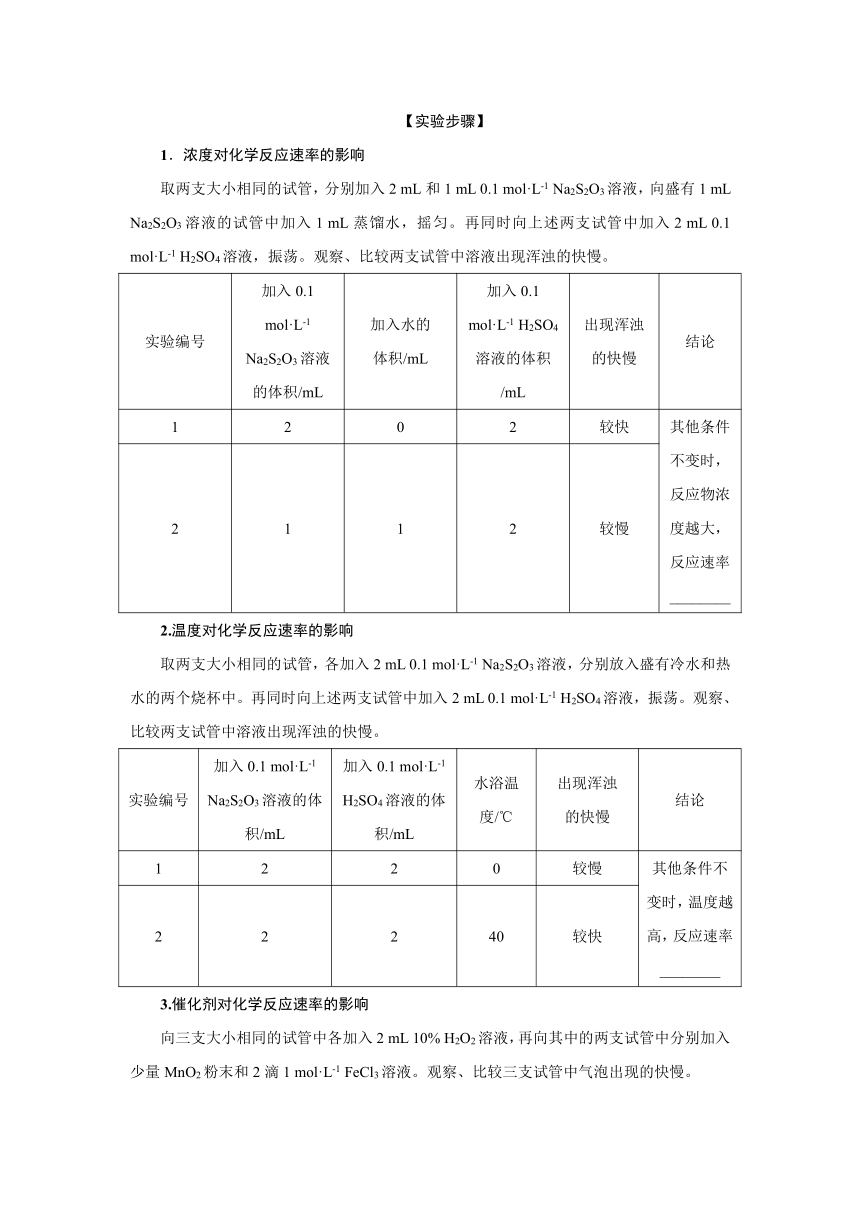
1.浓度对化学反应速率的影响
取两支大小相同的试管,分别加入2 mL和1 mL 0.1 mol·L-1 Na2S2O3溶液,向盛有1 mL Na2S2O3溶液的试管中加入1 mL蒸馏水,摇匀。再同时向上述两支试管中加入2 mL 0.1 mol·L-1 H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1 mol·L-1 Na2S2O3溶液的体积/mL 加入水的 体积/mL 加入0.1 mol·L-1 H2SO4溶液的体积/mL 出现浑浊 的快慢 结论
1 2 0 2 较快 其他条件不变时,反应物浓度越大,反应速率________
2 1 1 2 较慢
2.温度对化学反应速率的影响
取两支大小相同的试管,各加入2 mL 0.1 mol·L-1 Na2S2O3溶液,分别放入盛有冷水和热水的两个烧杯中。再同时向上述两支试管中加入2 mL 0.1 mol·L-1 H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1 mol·L-1 Na2S2O3溶液的体积/mL 加入0.1 mol·L-1 H2SO4溶液的体积/mL 水浴温 度/℃ 出现浑浊 的快慢 结论
1 2 2 0 较慢 其他条件不变时,温度越高,反应速率________
2 2 2 40 较快
3.催化剂对化学反应速率的影响
向三支大小相同的试管中各加入2 mL 10% H2O2溶液,再向其中的两支试管中分别加入少量MnO2粉末和2滴1 mol·L-1 FeCl3溶液。观察、比较三支试管中气泡出现的快慢。
实验编号 加入10% H2O2溶液的体积/mL 加入的催化剂 气泡出现 的快慢 结论
1 2 无 较慢 其他条件不变时,加入催化剂,反应速率______
2 2 少量MnO2粉末 很快
3 2 2滴1 mol·L-1 FeCl3溶液 较快
【问题探究】
1.写出硫代硫酸钠溶液与稀硫酸反应的离子方程式,可以从哪些方面来测定硫代硫酸钠与酸反应速率的大小?
2.浓度对化学反应速率的影响实验中,实验2加入1 mL水的原因是什么?
3.在通常情况下,铁与冷水或热水都不发生反应,但红热的铁与水蒸气则可发生反应,生成Fe3O4和H2。试从反应条件的角度思考并解释这一事实。
即学即练
1.如图所示实验操作能实现的实验目的是( )
A.探究浓度对化学反应速率的影响
B.探究温度对化学反应速率的影响
C.探究压强对化学反应速率的影响
D.探究接触面积对化学反应速率的影响
2.下列各组反应(表中物质均为反应物)在反应刚开始时,放出H2的速率最大的是( )
金属(粉末状)及 其物质的量/mol 酸的浓度及体积 反应温 度/℃
A Mg 0.1 3 mol·L-1硫酸 10 mL 30
B Mg 0.1 3 mol·L-1盐酸 10 mL 30
C Fe 0.1 18 mol·L-1硫酸 10 mL 30
D Mg 0.1 6 mol·L-1硝酸 10 mL 30
3.为了研究外界条件对H2O2分解反应速率的影响,某同学在相应条件下进行实验,实验记录如表。
实验 序号 反应物 温度 催化剂 收集V mL 气体所用时间
① 5 mL 5%H2O2溶液 25 ℃ 2滴1 mol·L-1 FeCl3 t1
② 5 mL 5% H2O2溶液 45 ℃ 2滴1 mol·L-1 FeCl3 t2
③ 5 mL 10%H2O2溶液 25 ℃ 2滴1 mol·L-1 FeCl3 t3
④ 5 mL 5%H2O2溶液 25 ℃ 不使用 t4
下列说法中,不正确的是( )
A.通过实验①、②,可研究温度对反应速率的影响
B.所用时间t1>t3
C.通过实验①、④,可研究催化剂对反应速率的影响
D.反应速率③<④
4.变量控制法是我们化学重要的学科思想,某化学小组欲探究某反应过程中浓度、温度对化学反应速率的影响,进行如表实验(忽略溶液体积变化)。
已知:2KMnO4+5H2C2O4+3H2SO4===2MnSO4+K2SO4+10CO2↑+8H2O。
编 号 0.01 mol·L-1酸性KMnO4溶液体积/mL 0.1 mol L-1 H2C2O4溶液体积/mL 水的体 积/mL 反应温 度/℃ 反应时 间/min
Ⅰ 2 2 0 20 2.1
Ⅱ 2 V1 1 20 5.5
Ⅲ 2 V2 0 50 0.5
下列说法错误的是( )
A.V1=1,V2=2
B.实验Ⅰ和实验Ⅲ的目的是探究温度对化学反应速率的影响
C.实验计时是从溶液混合开始,溶液呈紫红色时结束
D.若改用1 mol·L-1酸性KMnO4溶液,将不能达到实验目的
实验活动7 化学反应速率的影响因素
[实验步骤]
1.越快
2.越快
3.加快
[问题探究]
1.提示:+2H+===SO2↑+S↓+H2O;溶液浑浊出现的快慢或溶液中氢离子浓度的变化(pH的变化)快慢。
2.提示:为了使混合后溶液总体积相同,从而使混合后只有硫代硫酸钠溶液浓度不同,其余因素均相同。
3.提示:红热的铁与水蒸气可发生反应生成Fe3O4和H2,是因为反应温度高,反应速率大,且反应物H2O为气态,铁与水蒸气的接触面积大,反应速率大,说明反应条件及反应物状态对化学反应速率有重要影响。
即学即练
1.解析:该实验中硫酸的浓度、体积均相同,硫代硫酸钠溶液的体积也相同,只有硫代硫酸钠溶液的浓度不同,所以该实验目的是探究硫代硫酸钠的浓度对化学反应速率的影响。故选A。
答案:A
2.解析:H2SO4为二元酸,3 mol·L-1的硫酸中H+浓度为6 mol·L-1;HCl为一元酸,3 mol·L-1的盐酸中H+浓度为3 mol·L-1;18 mol·L-1硫酸是浓硫酸,常温下铁与浓硫酸发生钝化反应,反应的速率较慢;Mg与硝酸反应不生成氢气;则A项反应物浓度最大,反应速率最快,故选A。
答案:A
3.解析:实验①、②中除温度外其他条件均相同,可研究温度对反应速率的影响,A正确;实验①、③中除过氧化氢浓度不同外其他条件均相同,浓度大的反应速率快,故收集相同体积的气体实验③用的时间短,故t1>t3,B正确;实验①、④中,①采用了催化剂,其他条件均相同,可研究催化剂对反应速率的影响,C正确;对比实验③④可知,③中浓度大且使用催化剂,则③中反应速率快,反应速率③>④,D错误。
答案:D
4.解析:根据变量不变原则可知,实验Ⅰ是对照实验,溶液总体积为4 mL,则V1=4-2-1=1,V2=4-2=2,A正确;实验Ⅰ和Ⅲ的温度不同,其他条件相同,则设计实验Ⅰ和实验Ⅲ的目的是探究温度对反应速率的影响,B正确;高锰酸钾不足,结束时溶液紫色褪去,则实验计时是从溶液混合开始,溶液紫红色褪去时结束,C错误;该定性实验是根据酸性KMnO4溶液褪色时间来判断反应快慢的,若改用1 mol·L-1酸性KMnO4溶液,溶液浓度太大,KMnO4过量,溶液不褪色,不能达到实验目的,D正确。
答案:C
【实验目的】
1.体验浓度、温度和催化剂对化学反应速率的影响。
2.理解改变反应条件可以调控化学反应的速率。
【实验原理】
1.硫代硫酸钠与硫酸的反应
硫代硫酸钠与硫酸反应会生成不溶于水的硫:
Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
反应生成的硫使溶液出现乳白色浑浊,比较浑浊现象出现所需时间的长短,可以判断该反应进行的快慢。在不同浓度和温度条件下分别进行上述反应,并比较其反应快慢,可以看出反应物浓度和温度对该反应速率的影响。
2.过氧化氢分解会产生氧气,在有或无催化剂存在下进行对比实验,通过观察氧气产生的快慢可以看出催化剂对该反应速率的影响。
【实验用品】
烧杯、试管、量筒、试管架、胶头滴管、温度计、药匙、秒表。
0.1 mol·L-1 Na2S2O3溶液、0.1 mol·L-1 H2SO4溶液、10% H2O2溶液、1 mol·L-1 FeCl3溶液、MnO2粉末、蒸馏水。
【方法指导】
为了比较实验中溶液出现浑浊的快慢,可以先在一张白纸上用黑色记号笔在合适的位置画上粗细、深浅一致的“十”字,衬在反应容器(锥形瓶)的底部。实验以Na2S2O3和H2SO4两溶液相混合时开始计时,到溶液出现的浑浊将锥形瓶底部的“十”字完全遮盖时结束(如图)。通过比较记录反应所需时间,可以判断反应速率的大小。
【实验步骤】
1.浓度对化学反应速率的影响
取两支大小相同的试管,分别加入2 mL和1 mL 0.1 mol·L-1 Na2S2O3溶液,向盛有1 mL Na2S2O3溶液的试管中加入1 mL蒸馏水,摇匀。再同时向上述两支试管中加入2 mL 0.1 mol·L-1 H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1 mol·L-1 Na2S2O3溶液的体积/mL 加入水的 体积/mL 加入0.1 mol·L-1 H2SO4溶液的体积/mL 出现浑浊 的快慢 结论
1 2 0 2 较快 其他条件不变时,反应物浓度越大,反应速率________
2 1 1 2 较慢
2.温度对化学反应速率的影响
取两支大小相同的试管,各加入2 mL 0.1 mol·L-1 Na2S2O3溶液,分别放入盛有冷水和热水的两个烧杯中。再同时向上述两支试管中加入2 mL 0.1 mol·L-1 H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1 mol·L-1 Na2S2O3溶液的体积/mL 加入0.1 mol·L-1 H2SO4溶液的体积/mL 水浴温 度/℃ 出现浑浊 的快慢 结论
1 2 2 0 较慢 其他条件不变时,温度越高,反应速率________
2 2 2 40 较快
3.催化剂对化学反应速率的影响
向三支大小相同的试管中各加入2 mL 10% H2O2溶液,再向其中的两支试管中分别加入少量MnO2粉末和2滴1 mol·L-1 FeCl3溶液。观察、比较三支试管中气泡出现的快慢。
实验编号 加入10% H2O2溶液的体积/mL 加入的催化剂 气泡出现 的快慢 结论
1 2 无 较慢 其他条件不变时,加入催化剂,反应速率______
2 2 少量MnO2粉末 很快
3 2 2滴1 mol·L-1 FeCl3溶液 较快
【问题探究】
1.写出硫代硫酸钠溶液与稀硫酸反应的离子方程式,可以从哪些方面来测定硫代硫酸钠与酸反应速率的大小?
2.浓度对化学反应速率的影响实验中,实验2加入1 mL水的原因是什么?
3.在通常情况下,铁与冷水或热水都不发生反应,但红热的铁与水蒸气则可发生反应,生成Fe3O4和H2。试从反应条件的角度思考并解释这一事实。
即学即练
1.如图所示实验操作能实现的实验目的是( )
A.探究浓度对化学反应速率的影响
B.探究温度对化学反应速率的影响
C.探究压强对化学反应速率的影响
D.探究接触面积对化学反应速率的影响
2.下列各组反应(表中物质均为反应物)在反应刚开始时,放出H2的速率最大的是( )
金属(粉末状)及 其物质的量/mol 酸的浓度及体积 反应温 度/℃
A Mg 0.1 3 mol·L-1硫酸 10 mL 30
B Mg 0.1 3 mol·L-1盐酸 10 mL 30
C Fe 0.1 18 mol·L-1硫酸 10 mL 30
D Mg 0.1 6 mol·L-1硝酸 10 mL 30
3.为了研究外界条件对H2O2分解反应速率的影响,某同学在相应条件下进行实验,实验记录如表。
实验 序号 反应物 温度 催化剂 收集V mL 气体所用时间
① 5 mL 5%H2O2溶液 25 ℃ 2滴1 mol·L-1 FeCl3 t1
② 5 mL 5% H2O2溶液 45 ℃ 2滴1 mol·L-1 FeCl3 t2
③ 5 mL 10%H2O2溶液 25 ℃ 2滴1 mol·L-1 FeCl3 t3
④ 5 mL 5%H2O2溶液 25 ℃ 不使用 t4
下列说法中,不正确的是( )
A.通过实验①、②,可研究温度对反应速率的影响
B.所用时间t1>t3
C.通过实验①、④,可研究催化剂对反应速率的影响
D.反应速率③<④
4.变量控制法是我们化学重要的学科思想,某化学小组欲探究某反应过程中浓度、温度对化学反应速率的影响,进行如表实验(忽略溶液体积变化)。
已知:2KMnO4+5H2C2O4+3H2SO4===2MnSO4+K2SO4+10CO2↑+8H2O。
编 号 0.01 mol·L-1酸性KMnO4溶液体积/mL 0.1 mol L-1 H2C2O4溶液体积/mL 水的体 积/mL 反应温 度/℃ 反应时 间/min
Ⅰ 2 2 0 20 2.1
Ⅱ 2 V1 1 20 5.5
Ⅲ 2 V2 0 50 0.5
下列说法错误的是( )
A.V1=1,V2=2
B.实验Ⅰ和实验Ⅲ的目的是探究温度对化学反应速率的影响
C.实验计时是从溶液混合开始,溶液呈紫红色时结束
D.若改用1 mol·L-1酸性KMnO4溶液,将不能达到实验目的
实验活动7 化学反应速率的影响因素
[实验步骤]
1.越快
2.越快
3.加快
[问题探究]
1.提示:+2H+===SO2↑+S↓+H2O;溶液浑浊出现的快慢或溶液中氢离子浓度的变化(pH的变化)快慢。
2.提示:为了使混合后溶液总体积相同,从而使混合后只有硫代硫酸钠溶液浓度不同,其余因素均相同。
3.提示:红热的铁与水蒸气可发生反应生成Fe3O4和H2,是因为反应温度高,反应速率大,且反应物H2O为气态,铁与水蒸气的接触面积大,反应速率大,说明反应条件及反应物状态对化学反应速率有重要影响。
即学即练
1.解析:该实验中硫酸的浓度、体积均相同,硫代硫酸钠溶液的体积也相同,只有硫代硫酸钠溶液的浓度不同,所以该实验目的是探究硫代硫酸钠的浓度对化学反应速率的影响。故选A。
答案:A
2.解析:H2SO4为二元酸,3 mol·L-1的硫酸中H+浓度为6 mol·L-1;HCl为一元酸,3 mol·L-1的盐酸中H+浓度为3 mol·L-1;18 mol·L-1硫酸是浓硫酸,常温下铁与浓硫酸发生钝化反应,反应的速率较慢;Mg与硝酸反应不生成氢气;则A项反应物浓度最大,反应速率最快,故选A。
答案:A
3.解析:实验①、②中除温度外其他条件均相同,可研究温度对反应速率的影响,A正确;实验①、③中除过氧化氢浓度不同外其他条件均相同,浓度大的反应速率快,故收集相同体积的气体实验③用的时间短,故t1>t3,B正确;实验①、④中,①采用了催化剂,其他条件均相同,可研究催化剂对反应速率的影响,C正确;对比实验③④可知,③中浓度大且使用催化剂,则③中反应速率快,反应速率③>④,D错误。
答案:D
4.解析:根据变量不变原则可知,实验Ⅰ是对照实验,溶液总体积为4 mL,则V1=4-2-1=1,V2=4-2=2,A正确;实验Ⅰ和Ⅲ的温度不同,其他条件相同,则设计实验Ⅰ和实验Ⅲ的目的是探究温度对反应速率的影响,B正确;高锰酸钾不足,结束时溶液紫色褪去,则实验计时是从溶液混合开始,溶液紫红色褪去时结束,C错误;该定性实验是根据酸性KMnO4溶液褪色时间来判断反应快慢的,若改用1 mol·L-1酸性KMnO4溶液,溶液浓度太大,KMnO4过量,溶液不褪色,不能达到实验目的,D正确。
答案:C
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
