北京工大附中2024-2025学年高一下学期3月月考化学试卷(PDF版,含答案)
文档属性
| 名称 | 北京工大附中2024-2025学年高一下学期3月月考化学试卷(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 834.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-29 19:13:40 | ||
图片预览


文档简介
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
2024-2025 学年第二学期月考
高一年级 化学学科试卷
(考试时间 90 分钟,总分 100 分)
一、选择题(每小题只有一个正确选项,每小题 3 分,共 42 分)
1.下列电池工作时能量转化形式与其它三个不.同.的是
A. 锌锰碱性电池 B. 硅太阳能电池 C. 氢氧燃料电池 D. 铅蓄电池
2.下列做法的目的与改变化学反应速率无.关.的是
A.牛奶在冰箱里保存 B.向玻璃中加入氧化铅
C.高炉炼铁前先将铁矿石粉碎 D.在糕点包装内放置小包除氧剂
3.下列反应中,属于吸热反应的是
A.Mg与盐酸的反应 B.H2与Cl2的反应
C.Na 与 H2O 的反应 D.Ba(OH)2·8H2O 与 NH4Cl 的反应
4.下列气体中,既可用浓硫酸干燥,又可用 NaOH 固体干燥的是
A.O2 B.SO2 C.NH3 D.Cl2
5.下列关于氮及其化合物的说法不.正.确.的是
A.氮原子的结构示意图:
B.氨水呈碱性的原因:NH ·H O NH + -3 2 4 + OH
C.常温下可以用铁制或铝制的容器来盛装稀硝酸
D.液氨汽化时要吸收大量的热,因此液氨可用作制冷剂
6.在某一化学反应中,生成物 X 的浓度在 10 s 内从 1.5 mol / L 变成 2.0 mol / L,则这 10 s
内用 X 表示的反应速率为
A.0.05 mol / L B.0.05 mol / (L·s) C.0.20 mol / L D.0.20 mol / (L·s)
化学试卷(第 1 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
7.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,
原理如下图所示。下列说法不.正.确.的是
A.通过该催化反应,实现了太阳能向化学能的转化
B.反应 I 中涉及到非极性键的断裂和极性键的形成
C.反应 II 为:2H2O2 2H2O + O2↑
D.总反应为:2H2O 2H2↑+ O2↑
8.某原电池的离子方程式是 Zn + Cu2+ = Zn2+ + Cu,能组成原电池正确是
正极 负极 电解质溶液
A Cu Zn H2SO4
B Zn Cu CuSO4
C 石墨 Zn CuSO4
D Cu Zn ZnCl2
9.探究亚硫酸(溶液中存在大量 H2SO3 分子)的性质,进行如下实验。
实验 装置 试剂 a 现象
① 亚硫酸 氯水 氯水褪色
② Ca(OH)2溶液(含酚酞) 溶液褪色,产生白色沉淀
③ 酸性KMnO4 溶液 紫色溶液褪色
④ 试剂a H2S 溶液
溶液出现乳白色浑浊
由上述实验所得亚硫酸性质及对应的解释不.正.确.的是
A.H2SO3溶液使氯水褪色:Cl2 + H2SO3 + H2O = H2SO4 + 2HCl
B.H2SO3有酸性:Ca(OH)2 + H2SO3 = CaSO3↓+ 2H2O
C.H SO - + 2- 2+2 3有还原性: 2MnO4 + 6H + 5SO3 = 2Mn + 5SO 2-4 + 3H2O
D.H2SO3有氧化性:H2SO3 + 2H2S = 3S↓+ 3H O 2
化学试卷(第 2 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
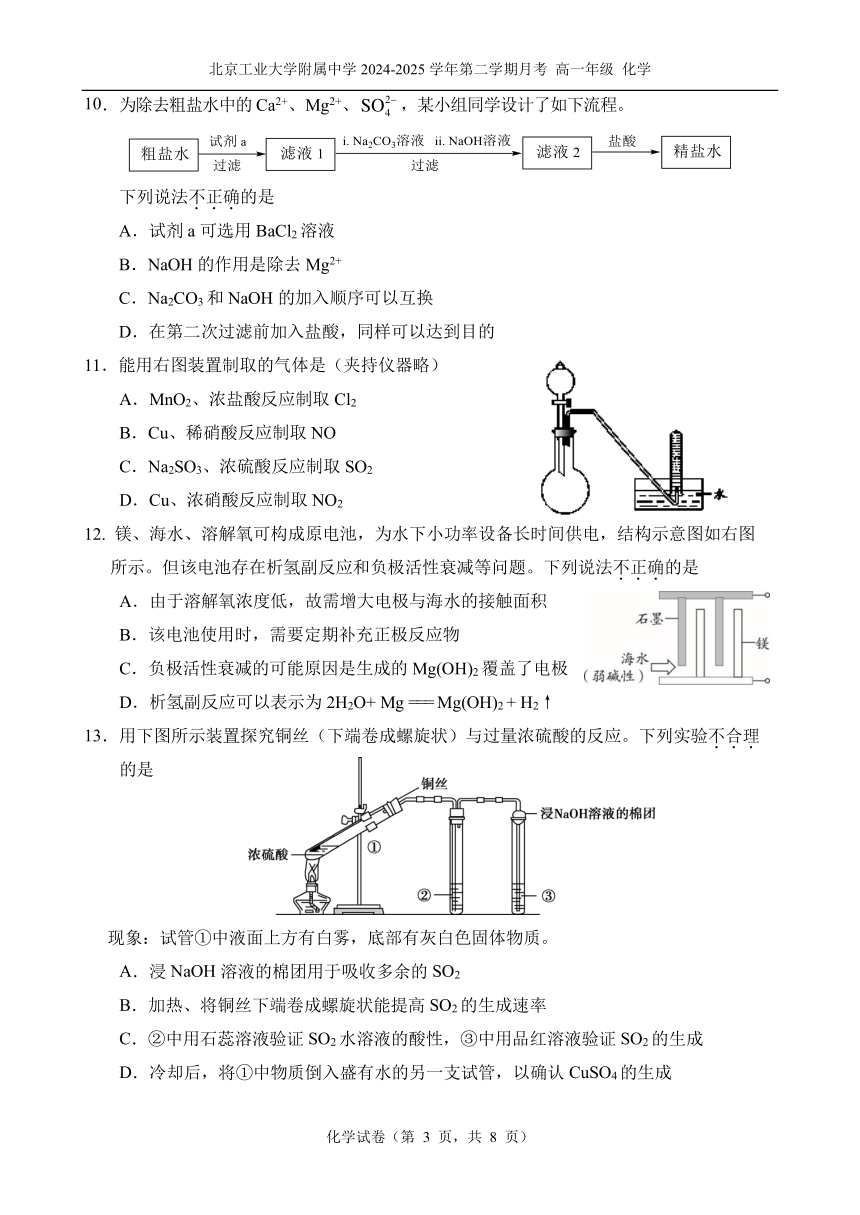
10.为除去粗盐水中的 Ca2+、Mg2+、SO2 ,某小组同学设计了如下流程。 4
下列说法不.正.确.的是
A.试剂 a 可选用 BaCl2 溶液
B.NaOH 的作用是除去 Mg2+
C.Na2CO3 和 NaOH 的加入顺序可以互换
D.在第二次过滤前加入盐酸,同样可以达到目的
11.能用右图装置制取的气体是(夹持仪器略)
A.MnO2、浓盐酸反应制取 Cl2
B.Cu、稀硝酸反应制取 NO
C.Na2SO3、浓硫酸反应制取 SO2
D.Cu、浓硝酸反应制取 NO2
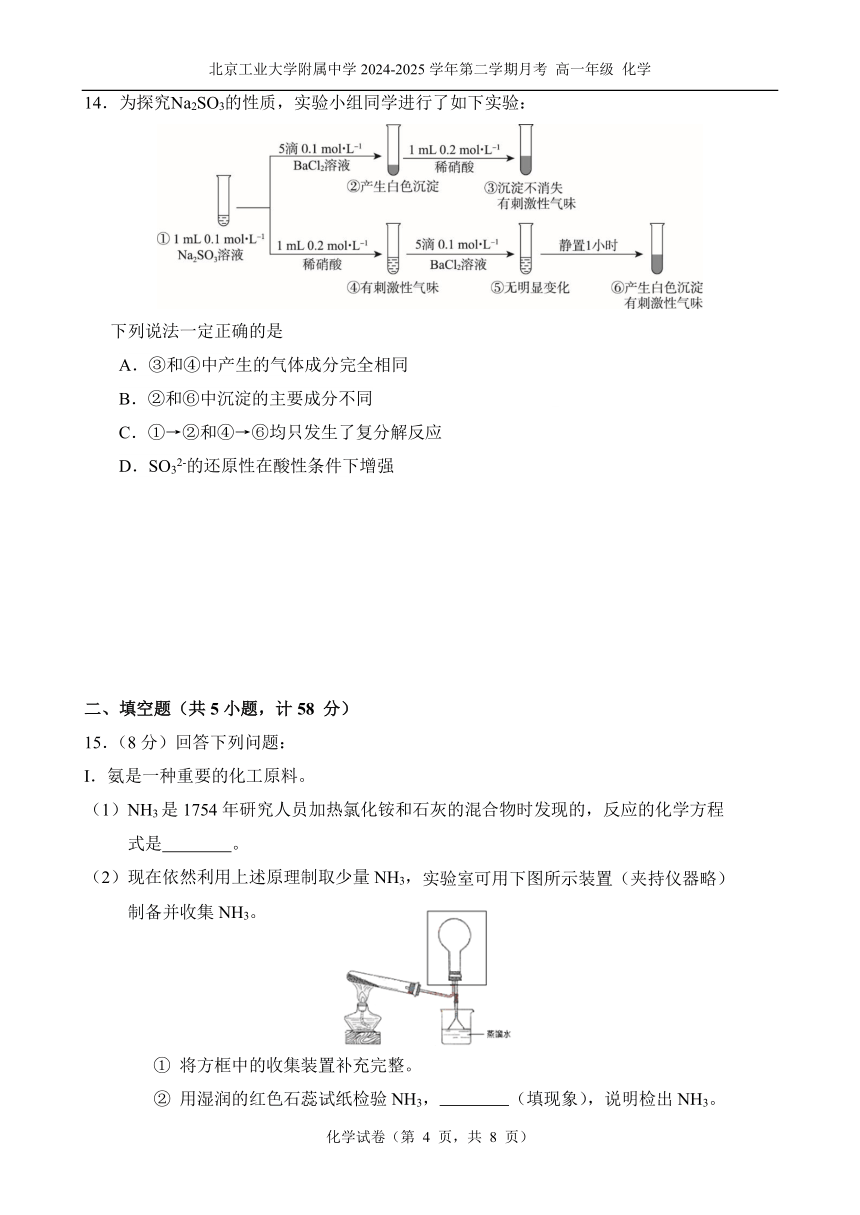
12. 镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,结构示意图如右图
所示。但该电池存在析氢副反应和负极活性衰减等问题。下列说法不.正.确.的是
A.由于溶解氧浓度低,故需增大电极与海水的接触面积
B.该电池使用时,需要定期补充正极反应物
C.负极活性衰减的可能原因是生成的 Mg(OH)2 覆盖了电极
D.析氢副反应可以表示为 2H2O+ Mg === Mg(OH) 2 + H2↑
13.用下图所示装置探究铜丝(下端卷成螺旋状)与过量浓硫酸的反应。下列实验不.合.理.
的是
现象:试管①中液面上方有白雾,底部有灰白色固体物质。
A.浸 NaOH 溶液的棉团用于吸收多余的 SO2
B.加热、将铜丝下端卷成螺旋状能提高 SO2的生成速率
C.②中用石蕊溶液验证 SO2水溶液的酸性,③中用品红溶液验证 SO2的生成
D.冷却后,将①中物质倒入盛有水的另一支试管,以确认 CuSO4的生成
化学试卷(第 3 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
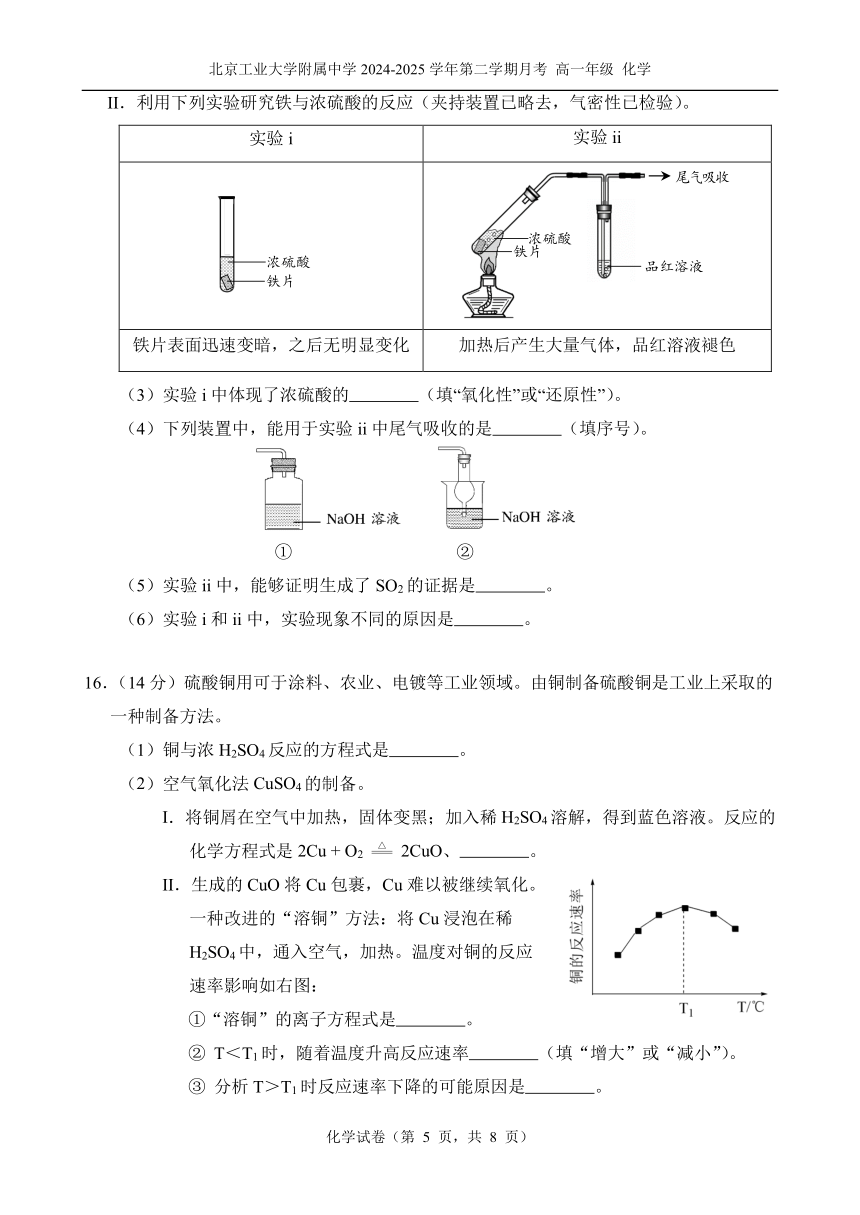
14.为探究Na2SO3的性质,实验小组同学进行了如下实验:
下列说法一定正确的是
A.③和④中产生的气体成分完全相同
B.②和⑥中沉淀的主要成分不同
C.①→②和④→⑥均只发生了复分解反应
D.SO 2-3 的还原性在酸性条件下增强
二、填空题(共 5 小题,计 58 分)
15.(8 分)回答下列问题:
I.氨是一种重要的化工原料。
(1)NH3是 1754 年研究人员加热氯化铵和石灰的混合物时发现的,反应的化学方程
式是 。
(2)现在依然利用上述原理制取少量 NH3,实验室可用下图所示装置(夹持仪器略)
制备并收集 NH3。
① 将方框中的收集装置补充完整。
② 用湿润的红色石蕊试纸检验 NH3, (填现象),说明检出 NH3。
化学试卷(第 4 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
II.利用下列实验研究铁与浓硫酸的反应(夹持装置已略去,气密性已检验)。
实验 i 实验 ii
尾气吸收
浓硫酸
铁片
浓硫酸 品红溶液
铁片
铁片表面迅速变暗,之后无明显变化 加热后产生大量气体,品红溶液褪色
(3)实验 i 中体现了浓硫酸的 (填“氧化性”或“还原性”)。
(4)下列装置中,能用于实验 ii 中尾气吸收的是 (填序号)。
① ②
(5)实验 ii 中,能够证明生成了 SO2 的证据是 。
(6)实验 i 和 ii 中,实验现象不同的原因是 。
16.(14 分)硫酸铜用可于涂料、农业、电镀等工业领域。由铜制备硫酸铜是工业上采取的
一种制备方法。
(1)铜与浓 H2SO4 反应的方程式是 。
(2)空气氧化法 CuSO4的制备。
I.将铜屑在空气中加热,固体变黑;加入稀 H2SO4溶解,得到蓝色溶液。反应的
化学方程式是 △2Cu + O 2 2CuO、 。
II.生成的 CuO 将 Cu 包裹,Cu 难以被继续氧化。
一种改进的“溶铜”方法:将 Cu 浸泡在稀
H2SO4中,通入空气,加热。温度对铜的反应
速率影响如右图:
①“溶铜”的离子方程式是 。
② T<T1 时,随着温度升高反应速率 (填“增大”或“减小”)。
③ 分析 T>T1 时反应速率下降的可能原因是 。
化学试卷(第 5 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
(3)硫酸-硝酸氧化法制备硫酸铜。
反应原理: 3Cu + 2HNO3 + 3H
△
2SO4 3CuSO4 + 2NO↑ + 4H2O
I.将 Cu 浸于 3 mol/L H2SO4中,再缓缓加入 HNO3,加热。
II.经过滤、蒸发、结晶制得 CuSO4·5H2O 固体。
① HNO3的作用是 (填“氧化剂”或“还原剂”)。
② 制备过程中,产物中往往混有 Cu(NO3)2,其产生的原因是 。
(4)由 CuSO4·5H2O 制备 CuSO4固体,一种方法是控制温度,加热 CuSO4·5H2O 使之
脱水;另一种方法是使 CuSO4·5H2O 与 SOCl2 混合,得到无水硫酸铜。
17.(12 分)探究浓度对化学反应速率的影响。
【实验原理】反应 a:Na2S2O3 + H2SO 4 Na2SO4 + SO2↑ + S↓ + H2O,反应中溶液出
现乳白色浑浊,比较浑浊现象出现的时间长短,判断反应进行的快慢。
【实验用品】0.1 mol/L Na2S2O3 溶液、0.1 mol/L H2SO4溶液、蒸馏水。
试管、烧杯、量筒、胶头滴管、秒表等。
(1)乳白色浑浊的主要成分是 。
(2)已知:Na2S O + 2-2 3 = 2Na + S2O3 。反应 a 的离子方程式是 。
【实验步骤】各组实验数据如下表。
加入 0.1 mol/L 加入水 加入 0.1 mol/L H2SO4
实验 溶液出现浑
Na2S2O3溶液的体积 的体积 溶液的体积(mL)
编号 浊的时间(s)
(mL) (mL)
1 2 0 2 t1
2 1 V1 2 t2
3 t3
(3)实验 1、2 探究 Na2S2O3 溶液的浓度对化学反应速率的影响。
① V1= 。
②“实验 2”中加入 V1 mL 水的主要目的是 。
③“实验 2”中,向试管中加入 Na2S2O3溶液后,再依次加入水、H2SO4溶液。水
与 H2SO4溶液的加入顺序不能颠倒,理由是 。
(4)实验 1、3 探究 H2SO4溶液的浓度对化学反应速率的影响,请将实验 3 的有关数据
填.入.上.表.。
(5)该实验能说明增大反应物的浓度,化学反应速率变快。实验依据是 。
化学试卷(第 6 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
18.(12 分)为消除燃煤烟气中含有的 SO2、NOx,研究者提出了若干烟气“脱硫”、“脱硝”的
方法。
(1)向燃煤中加入适量石灰石,高温时将 SO2 转化为 CaSO4 的化学方程式是 。
(2)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的 NO
进行无害化处理。NH3 还原 NO 的化学方程式是 。
(3)以 NaClO 溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的 pH=5.5,将
烟气中的 SO2、NO 转化为 SO 2 4 、NO 3 ,均为放热反应。
①放热反应:反应物的总能量 生成物的总能量(填“大于、等于、小于”)
②NaClO 溶液吸收烟气中 SO2的离子方程式是 。
③一定时间内,温度对硫、硝脱除率的影响曲线如图 1,SO2 的脱除率高于 NO,可
能的原因是 (写出 1 种即可)。
图 1
④烟气中 SO2和 NO 的体积比为 4∶1,50℃时的脱除率见图 1,则此吸收液中烟气
转化生成的 NO 3 和 Cl 的物质的量之比为 。
19.(12 分)化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀 HNO3的试管中,开始无明显现象,渐有小气泡生
成,该气体是 。液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙: 铜与浓 HNO3 反应,装置、现象如下:
实验装置 实验现象
A 中:最初反应较慢,随后加快,反应剧烈;产生
红棕色气体;溶液呈绿色。
B 中:溶液呈淡蓝色。
化学试卷(第 7 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
① A 中铜与浓 HNO3 产生红棕色气体的化学方程式是 。
② 实验现象“最初反应较慢,随后加快”的原因可能是 。
(3)有文献记载:铜与浓 HNO3 反应一旦发生就变快,是因为开始生成的 NO2溶于水
形成 HNO2(弱酸,不稳定),它再和 Cu 反应,反应就加快。实验探究如下:
Ⅰ:向 1 mL 浓硝酸中加入几滴 30% H2O2溶液、铜片,反应较慢,溶液呈蓝色。
Ⅱ:向 1 mL 浓硝酸中加入几滴 30% H2O2溶液,无明显变化。
① Ⅰ中反应变慢的原因是 。
② NO2 与 H2O 反应生成 HNO2 和 。
③ 对生成 HNO2后反应变快的原因进行实验探究。
序号 实验操作 实验现象
取 B 中溶液,加入一定量 立即产生无色气体;液面上方呈
Ⅲ
固体,再加入铜片 红棕色
取 B 中溶液,放置一段时间,溶液 产生无色气体,较Ⅲ慢;液面上
Ⅳ
变为无色后,再加入铜片 方呈浅红棕色
a.Ⅲ中加入的固体为 。
b.Ⅳ中“放置一段时间”的目的是 。
实验Ⅲ、可以说明,HNO2 氧化 Cu 的反应速率比 HNO3氧化 Cu 的反应快。
(4)化学小组同学结合实验甲、乙中 HNO3被还原后的气体产物以及实验Ⅲ的产物,
综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中
温度较低外,另一个重要原因是 。
化学试卷(第 8 页,共 8 页)
高一化学月考答案
题号 1 2 3 4 5 6 7 8 9 10 11
答案 B B D A C B B C C D B
题号 12 13 14
答案 B C B
15.(8 分)
(1) (2 分,不写加热或者没配平扣 1 分)
(2)
① (1 分)
② 试纸变蓝(1 分)
(3)氧化性(1 分)
(4)②(1 分)
(5)品红溶液褪色(1 分)
(6)温度不同(1 分)
16.(14 分)
(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2 分,不写加热或者没配平扣 1 分)
(2)Ⅰ.CuO + H2SO4 = CuSO4 + H2O (2 分)
Ⅱ.① 2Cu + 4H+ + O = 2Cu2+2 + 2H2O (2 分,没配平扣 1 分)
② 增大(2 分)
③ 温度升高,氧气在水溶液中的溶解度下降,溶液中的氧气浓度降低,反应速
率下降。(2 分)
(3)① 氧化剂(2 分)
② 硝酸过量(硝酸浓度大),或硫酸不足量。(2 分)
17.(12 分)
(1)S(硫)(1 分)
(2)S O 2- 2 3 + 2H+ = SO2↑+ S↓+ H2O(2 分)
(3)① V1=1(1 分)
② 变量控制,使实验 1、2 中混合溶液总体积相同(1 分),从而控制混合溶液中
硫酸溶液的浓度相同(1 分)。
③ 若先加入 H2SO4 溶液,则反应开始时,实验 2 混合溶液中 H2SO4溶液的浓度与
实验 1 不同。(2 分)
(4)2,1 ,1(2 分)
(5)t1 < t2(1 分),t118.(12 分,每空 2 分)
高温
(1)2CaCO3+2SO2+O2 ===== 2CaSO4+2CO2(2 分,不写条件或者没配平扣 1 分)
催化剂
(2)4NH3+6NO===== 5N2+6H2O (2 分,不写催化剂或者没配平扣 1 分)
(3)①大于(2 分)
②SO +ClO +H O == SO 2 2 2 4 +Cl +2H+ (2 分,没配平扣 1 分)
③SO2 在水中的溶解度大于 NO;SO2在溶液中的还原性强于 NO;SO2 与 NaClO 溶液
的反应速率大于 NO (2 分,写出 1 条即可)
④2∶13(2 分)
19.(12 分)
(1)NO(1 分)
(2)① Cu + 4HNO3 (浓)=== Cu(NO3)2 + 2NO2↑+ 2H2O(2 分,没配平扣 1 分)
② 反应放热,随着反应的进行,体系温度升高(1 分)
(3)① H2O2 与 HNO2 发生反应使 HNO2 浓度降低(1 分)
② HNO3(1 分)
③ a. NaNO2(2 分)
b. 使 HNO2完全分解(2 分)
(4)稀硝酸不能将 NO 氧化为 NO2,体系中不能发生 NO2与 H2O 生成 HNO2 的反应(2
分)
2024-2025 学年第二学期月考
高一年级 化学学科试卷
(考试时间 90 分钟,总分 100 分)
一、选择题(每小题只有一个正确选项,每小题 3 分,共 42 分)
1.下列电池工作时能量转化形式与其它三个不.同.的是
A. 锌锰碱性电池 B. 硅太阳能电池 C. 氢氧燃料电池 D. 铅蓄电池
2.下列做法的目的与改变化学反应速率无.关.的是
A.牛奶在冰箱里保存 B.向玻璃中加入氧化铅
C.高炉炼铁前先将铁矿石粉碎 D.在糕点包装内放置小包除氧剂
3.下列反应中,属于吸热反应的是
A.Mg与盐酸的反应 B.H2与Cl2的反应
C.Na 与 H2O 的反应 D.Ba(OH)2·8H2O 与 NH4Cl 的反应
4.下列气体中,既可用浓硫酸干燥,又可用 NaOH 固体干燥的是
A.O2 B.SO2 C.NH3 D.Cl2
5.下列关于氮及其化合物的说法不.正.确.的是
A.氮原子的结构示意图:
B.氨水呈碱性的原因:NH ·H O NH + -3 2 4 + OH
C.常温下可以用铁制或铝制的容器来盛装稀硝酸
D.液氨汽化时要吸收大量的热,因此液氨可用作制冷剂
6.在某一化学反应中,生成物 X 的浓度在 10 s 内从 1.5 mol / L 变成 2.0 mol / L,则这 10 s
内用 X 表示的反应速率为
A.0.05 mol / L B.0.05 mol / (L·s) C.0.20 mol / L D.0.20 mol / (L·s)
化学试卷(第 1 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
7.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,
原理如下图所示。下列说法不.正.确.的是
A.通过该催化反应,实现了太阳能向化学能的转化
B.反应 I 中涉及到非极性键的断裂和极性键的形成
C.反应 II 为:2H2O2 2H2O + O2↑
D.总反应为:2H2O 2H2↑+ O2↑
8.某原电池的离子方程式是 Zn + Cu2+ = Zn2+ + Cu,能组成原电池正确是
正极 负极 电解质溶液
A Cu Zn H2SO4
B Zn Cu CuSO4
C 石墨 Zn CuSO4
D Cu Zn ZnCl2
9.探究亚硫酸(溶液中存在大量 H2SO3 分子)的性质,进行如下实验。
实验 装置 试剂 a 现象
① 亚硫酸 氯水 氯水褪色
② Ca(OH)2溶液(含酚酞) 溶液褪色,产生白色沉淀
③ 酸性KMnO4 溶液 紫色溶液褪色
④ 试剂a H2S 溶液
溶液出现乳白色浑浊
由上述实验所得亚硫酸性质及对应的解释不.正.确.的是
A.H2SO3溶液使氯水褪色:Cl2 + H2SO3 + H2O = H2SO4 + 2HCl
B.H2SO3有酸性:Ca(OH)2 + H2SO3 = CaSO3↓+ 2H2O
C.H SO - + 2- 2+2 3有还原性: 2MnO4 + 6H + 5SO3 = 2Mn + 5SO 2-4 + 3H2O
D.H2SO3有氧化性:H2SO3 + 2H2S = 3S↓+ 3H O 2
化学试卷(第 2 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
10.为除去粗盐水中的 Ca2+、Mg2+、SO2 ,某小组同学设计了如下流程。 4
下列说法不.正.确.的是
A.试剂 a 可选用 BaCl2 溶液
B.NaOH 的作用是除去 Mg2+
C.Na2CO3 和 NaOH 的加入顺序可以互换
D.在第二次过滤前加入盐酸,同样可以达到目的
11.能用右图装置制取的气体是(夹持仪器略)
A.MnO2、浓盐酸反应制取 Cl2
B.Cu、稀硝酸反应制取 NO
C.Na2SO3、浓硫酸反应制取 SO2
D.Cu、浓硝酸反应制取 NO2
12. 镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,结构示意图如右图
所示。但该电池存在析氢副反应和负极活性衰减等问题。下列说法不.正.确.的是
A.由于溶解氧浓度低,故需增大电极与海水的接触面积
B.该电池使用时,需要定期补充正极反应物
C.负极活性衰减的可能原因是生成的 Mg(OH)2 覆盖了电极
D.析氢副反应可以表示为 2H2O+ Mg === Mg(OH) 2 + H2↑
13.用下图所示装置探究铜丝(下端卷成螺旋状)与过量浓硫酸的反应。下列实验不.合.理.
的是
现象:试管①中液面上方有白雾,底部有灰白色固体物质。
A.浸 NaOH 溶液的棉团用于吸收多余的 SO2
B.加热、将铜丝下端卷成螺旋状能提高 SO2的生成速率
C.②中用石蕊溶液验证 SO2水溶液的酸性,③中用品红溶液验证 SO2的生成
D.冷却后,将①中物质倒入盛有水的另一支试管,以确认 CuSO4的生成
化学试卷(第 3 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
14.为探究Na2SO3的性质,实验小组同学进行了如下实验:
下列说法一定正确的是
A.③和④中产生的气体成分完全相同
B.②和⑥中沉淀的主要成分不同
C.①→②和④→⑥均只发生了复分解反应
D.SO 2-3 的还原性在酸性条件下增强
二、填空题(共 5 小题,计 58 分)
15.(8 分)回答下列问题:
I.氨是一种重要的化工原料。
(1)NH3是 1754 年研究人员加热氯化铵和石灰的混合物时发现的,反应的化学方程
式是 。
(2)现在依然利用上述原理制取少量 NH3,实验室可用下图所示装置(夹持仪器略)
制备并收集 NH3。
① 将方框中的收集装置补充完整。
② 用湿润的红色石蕊试纸检验 NH3, (填现象),说明检出 NH3。
化学试卷(第 4 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
II.利用下列实验研究铁与浓硫酸的反应(夹持装置已略去,气密性已检验)。
实验 i 实验 ii
尾气吸收
浓硫酸
铁片
浓硫酸 品红溶液
铁片
铁片表面迅速变暗,之后无明显变化 加热后产生大量气体,品红溶液褪色
(3)实验 i 中体现了浓硫酸的 (填“氧化性”或“还原性”)。
(4)下列装置中,能用于实验 ii 中尾气吸收的是 (填序号)。
① ②
(5)实验 ii 中,能够证明生成了 SO2 的证据是 。
(6)实验 i 和 ii 中,实验现象不同的原因是 。
16.(14 分)硫酸铜用可于涂料、农业、电镀等工业领域。由铜制备硫酸铜是工业上采取的
一种制备方法。
(1)铜与浓 H2SO4 反应的方程式是 。
(2)空气氧化法 CuSO4的制备。
I.将铜屑在空气中加热,固体变黑;加入稀 H2SO4溶解,得到蓝色溶液。反应的
化学方程式是 △2Cu + O 2 2CuO、 。
II.生成的 CuO 将 Cu 包裹,Cu 难以被继续氧化。
一种改进的“溶铜”方法:将 Cu 浸泡在稀
H2SO4中,通入空气,加热。温度对铜的反应
速率影响如右图:
①“溶铜”的离子方程式是 。
② T<T1 时,随着温度升高反应速率 (填“增大”或“减小”)。
③ 分析 T>T1 时反应速率下降的可能原因是 。
化学试卷(第 5 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
(3)硫酸-硝酸氧化法制备硫酸铜。
反应原理: 3Cu + 2HNO3 + 3H
△
2SO4 3CuSO4 + 2NO↑ + 4H2O
I.将 Cu 浸于 3 mol/L H2SO4中,再缓缓加入 HNO3,加热。
II.经过滤、蒸发、结晶制得 CuSO4·5H2O 固体。
① HNO3的作用是 (填“氧化剂”或“还原剂”)。
② 制备过程中,产物中往往混有 Cu(NO3)2,其产生的原因是 。
(4)由 CuSO4·5H2O 制备 CuSO4固体,一种方法是控制温度,加热 CuSO4·5H2O 使之
脱水;另一种方法是使 CuSO4·5H2O 与 SOCl2 混合,得到无水硫酸铜。
17.(12 分)探究浓度对化学反应速率的影响。
【实验原理】反应 a:Na2S2O3 + H2SO 4 Na2SO4 + SO2↑ + S↓ + H2O,反应中溶液出
现乳白色浑浊,比较浑浊现象出现的时间长短,判断反应进行的快慢。
【实验用品】0.1 mol/L Na2S2O3 溶液、0.1 mol/L H2SO4溶液、蒸馏水。
试管、烧杯、量筒、胶头滴管、秒表等。
(1)乳白色浑浊的主要成分是 。
(2)已知:Na2S O + 2-2 3 = 2Na + S2O3 。反应 a 的离子方程式是 。
【实验步骤】各组实验数据如下表。
加入 0.1 mol/L 加入水 加入 0.1 mol/L H2SO4
实验 溶液出现浑
Na2S2O3溶液的体积 的体积 溶液的体积(mL)
编号 浊的时间(s)
(mL) (mL)
1 2 0 2 t1
2 1 V1 2 t2
3 t3
(3)实验 1、2 探究 Na2S2O3 溶液的浓度对化学反应速率的影响。
① V1= 。
②“实验 2”中加入 V1 mL 水的主要目的是 。
③“实验 2”中,向试管中加入 Na2S2O3溶液后,再依次加入水、H2SO4溶液。水
与 H2SO4溶液的加入顺序不能颠倒,理由是 。
(4)实验 1、3 探究 H2SO4溶液的浓度对化学反应速率的影响,请将实验 3 的有关数据
填.入.上.表.。
(5)该实验能说明增大反应物的浓度,化学反应速率变快。实验依据是 。
化学试卷(第 6 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
18.(12 分)为消除燃煤烟气中含有的 SO2、NOx,研究者提出了若干烟气“脱硫”、“脱硝”的
方法。
(1)向燃煤中加入适量石灰石,高温时将 SO2 转化为 CaSO4 的化学方程式是 。
(2)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的 NO
进行无害化处理。NH3 还原 NO 的化学方程式是 。
(3)以 NaClO 溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的 pH=5.5,将
烟气中的 SO2、NO 转化为 SO 2 4 、NO 3 ,均为放热反应。
①放热反应:反应物的总能量 生成物的总能量(填“大于、等于、小于”)
②NaClO 溶液吸收烟气中 SO2的离子方程式是 。
③一定时间内,温度对硫、硝脱除率的影响曲线如图 1,SO2 的脱除率高于 NO,可
能的原因是 (写出 1 种即可)。
图 1
④烟气中 SO2和 NO 的体积比为 4∶1,50℃时的脱除率见图 1,则此吸收液中烟气
转化生成的 NO 3 和 Cl 的物质的量之比为 。
19.(12 分)化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀 HNO3的试管中,开始无明显现象,渐有小气泡生
成,该气体是 。液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙: 铜与浓 HNO3 反应,装置、现象如下:
实验装置 实验现象
A 中:最初反应较慢,随后加快,反应剧烈;产生
红棕色气体;溶液呈绿色。
B 中:溶液呈淡蓝色。
化学试卷(第 7 页,共 8 页)
北京工业大学附属中学 2024-2025 学年第二学期月考 高一年级 化学
① A 中铜与浓 HNO3 产生红棕色气体的化学方程式是 。
② 实验现象“最初反应较慢,随后加快”的原因可能是 。
(3)有文献记载:铜与浓 HNO3 反应一旦发生就变快,是因为开始生成的 NO2溶于水
形成 HNO2(弱酸,不稳定),它再和 Cu 反应,反应就加快。实验探究如下:
Ⅰ:向 1 mL 浓硝酸中加入几滴 30% H2O2溶液、铜片,反应较慢,溶液呈蓝色。
Ⅱ:向 1 mL 浓硝酸中加入几滴 30% H2O2溶液,无明显变化。
① Ⅰ中反应变慢的原因是 。
② NO2 与 H2O 反应生成 HNO2 和 。
③ 对生成 HNO2后反应变快的原因进行实验探究。
序号 实验操作 实验现象
取 B 中溶液,加入一定量 立即产生无色气体;液面上方呈
Ⅲ
固体,再加入铜片 红棕色
取 B 中溶液,放置一段时间,溶液 产生无色气体,较Ⅲ慢;液面上
Ⅳ
变为无色后,再加入铜片 方呈浅红棕色
a.Ⅲ中加入的固体为 。
b.Ⅳ中“放置一段时间”的目的是 。
实验Ⅲ、可以说明,HNO2 氧化 Cu 的反应速率比 HNO3氧化 Cu 的反应快。
(4)化学小组同学结合实验甲、乙中 HNO3被还原后的气体产物以及实验Ⅲ的产物,
综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中
温度较低外,另一个重要原因是 。
化学试卷(第 8 页,共 8 页)
高一化学月考答案
题号 1 2 3 4 5 6 7 8 9 10 11
答案 B B D A C B B C C D B
题号 12 13 14
答案 B C B
15.(8 分)
(1) (2 分,不写加热或者没配平扣 1 分)
(2)
① (1 分)
② 试纸变蓝(1 分)
(3)氧化性(1 分)
(4)②(1 分)
(5)品红溶液褪色(1 分)
(6)温度不同(1 分)
16.(14 分)
(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2 分,不写加热或者没配平扣 1 分)
(2)Ⅰ.CuO + H2SO4 = CuSO4 + H2O (2 分)
Ⅱ.① 2Cu + 4H+ + O = 2Cu2+2 + 2H2O (2 分,没配平扣 1 分)
② 增大(2 分)
③ 温度升高,氧气在水溶液中的溶解度下降,溶液中的氧气浓度降低,反应速
率下降。(2 分)
(3)① 氧化剂(2 分)
② 硝酸过量(硝酸浓度大),或硫酸不足量。(2 分)
17.(12 分)
(1)S(硫)(1 分)
(2)S O 2- 2 3 + 2H+ = SO2↑+ S↓+ H2O(2 分)
(3)① V1=1(1 分)
② 变量控制,使实验 1、2 中混合溶液总体积相同(1 分),从而控制混合溶液中
硫酸溶液的浓度相同(1 分)。
③ 若先加入 H2SO4 溶液,则反应开始时,实验 2 混合溶液中 H2SO4溶液的浓度与
实验 1 不同。(2 分)
(4)2,1 ,1(2 分)
(5)t1 < t2(1 分),t1
高温
(1)2CaCO3+2SO2+O2 ===== 2CaSO4+2CO2(2 分,不写条件或者没配平扣 1 分)
催化剂
(2)4NH3+6NO===== 5N2+6H2O (2 分,不写催化剂或者没配平扣 1 分)
(3)①大于(2 分)
②SO +ClO +H O == SO 2 2 2 4 +Cl +2H+ (2 分,没配平扣 1 分)
③SO2 在水中的溶解度大于 NO;SO2在溶液中的还原性强于 NO;SO2 与 NaClO 溶液
的反应速率大于 NO (2 分,写出 1 条即可)
④2∶13(2 分)
19.(12 分)
(1)NO(1 分)
(2)① Cu + 4HNO3 (浓)=== Cu(NO3)2 + 2NO2↑+ 2H2O(2 分,没配平扣 1 分)
② 反应放热,随着反应的进行,体系温度升高(1 分)
(3)① H2O2 与 HNO2 发生反应使 HNO2 浓度降低(1 分)
② HNO3(1 分)
③ a. NaNO2(2 分)
b. 使 HNO2完全分解(2 分)
(4)稀硝酸不能将 NO 氧化为 NO2,体系中不能发生 NO2与 H2O 生成 HNO2 的反应(2
分)
同课章节目录
