北京景山学校2024-2025学年高一下学期第一次月考化学试卷(PDF版,无答案)
文档属性
| 名称 | 北京景山学校2024-2025学年高一下学期第一次月考化学试卷(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 966.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-29 15:56:43 | ||
图片预览


文档简介
2025北京景山学校高一(下)第一次月考
化 学
一、单选题(每道 3 分,共 45 分)
1.部分含硫物质的类别与相应化合价及部分物质间转化关系如图。下列说法正确的是
A.a 在 O2中燃烧可以生成 d
B.b 可存在于火山口附近或地壳的岩层中
C.c 因漂白作用可以使滴有酚酞的 NaOH 溶液褪色,也可使酸性高锰酸钾溶液褪色
D.e 的浓溶液长时间暴露在空气中,质量增大,质量分数增大
2.氨是一种重要的化工原料,根据下图转化判断下列有关表述正确的是
A.浓硝酸见光易分解且易挥发,应用棕色试剂瓶盛放且用胶塞密封
B.戊与丁反应时,氧化剂与还原剂的物质的量之比为 1∶2
C.实验室可以用 Ba(OH)2溶液鉴别乙和 Na2CO3溶液
D.向饱和 NaCl 溶液中依次通入过量的CO2 和NH3,然后过滤可制得乙
3.下列实验装置,不能达到实验目的的是
A.实验室制备 Cl2 B.验证氨气易溶于水 C.用 SO2做喷泉实验 D.吸收尾气 NH3
+ 2 2-
4.某无色溶液 X 可能含有:Na+、Cu2+、NH4 、Mg2+、Ba2+、CO -3 、Cl 、SO4 中的若干种离子,且各离
Δ
+ -
子数目相同,依次进行下列实验(已知NH4 +OH NH3 +H2O ):
第1页/共7页
①取少量溶液 X,加入足量 NaOH 溶液,有沉淀 A 产生;微热闻到刺激性气味。
②过滤①中的混合物,在滤液中加入足量 Ba(OH)2溶液,有白色沉淀 B 产生,再加入足量的稀硝酸,沉
淀不溶解。
根据上述实验,判断以下说法正确的是
NH+ 2+ SO2 2 A.溶液 X 中一定含有 4 、Mg 、 4 ,可能含有CO3
B.溶液 X 中不能确定是否含有 Na+
2
C.溶液 X 中一定没有CO -3 ,但一定含有 Cl
D.沉淀 A 是混合物,沉淀 B 是纯净物
5.常温下,下列各组离子在指定条件下能大量共存的是
2-
A.0.1mol L-1HNO3溶液:Fe2+、Na+、Cl-、SO4
B.使酚酞变红色的溶液:Na+、Cu2+、HCO
- NO-3 、 3
2- -
C.某无色溶液:H+、Na+、SO MnO4 、 4
2- -
D.使紫色石蕊试液呈红色的溶液中:Mg2+、K+、SO4 、NO3
6.将盛有 NO2和 N2混合气体的试管倒立于水中,经过足够长的时间后,试管内气体体积缩小为原体积的
一半,原混合气体中 N2与 NO2的体积比为
A.1:1 B.1:2 C.1:3 D.3:1
7.某学生用如图装置研究原电池原理,下列说法错误的是
A.(3)中 Zn 片增加的质量与 Cu 片减小的质量的比值为 65∶64
B.(2)与(3)中锌电极上发生的反应相同
C.(1)中铜片上没有气体产生
D.当(2)与(3)中正极生成物的质量比为 1∶32 时,通过外电路的电子数相等
8.有一瓶 Na2SO3溶液,可能已部分被氧化,某学生进行如下实验:取少量溶液,滴入 Ba(NO3)2溶液产生
白色沉淀,再加入过量稀硝酸,充分振荡后仍有白色沉淀,结论正确的是(提示:稀硝酸具有强氧化性,可
2 2
将 SO 3 氧化成 SO 4 )
A.Na2SO3溶液已部分被氧化
B.加入 Ba(NO3)2溶液后生成的沉淀中一定含有 BaSO4
C.加硝酸后仍存在的沉淀一定为 BaSO4
D.此实验能确定 Na2SO3溶液是否部分被氧化
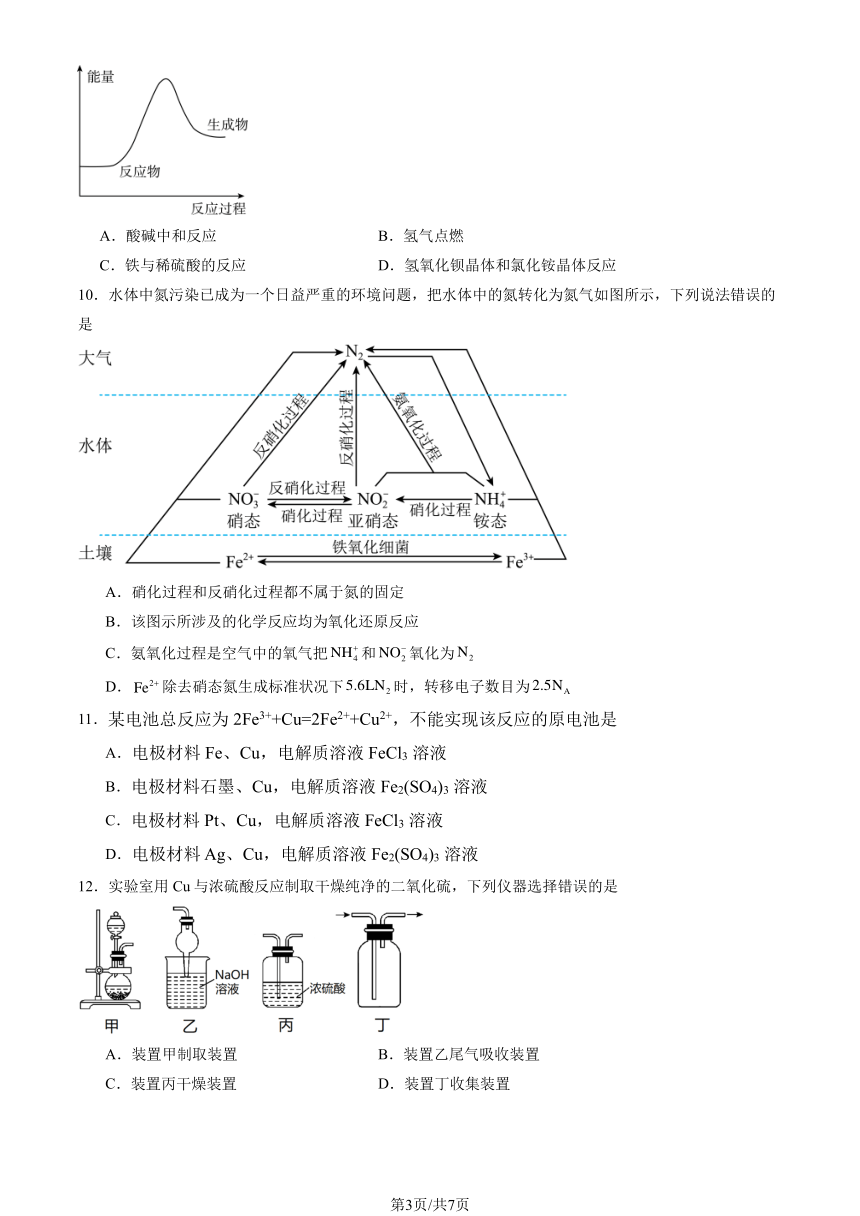
9.下列反应中能量变化与图所示图象一致的是()
第2页/共7页
A.酸碱中和反应 B.氢气点燃
C.铁与稀硫酸的反应 D.氢氧化钡晶体和氯化铵晶体反应
10.水体中氮污染已成为一个日益严重的环境问题,把水体中的氮转化为氮气如图所示,下列说法错误的
是
A.硝化过程和反硝化过程都不属于氮的固定
B.该图示所涉及的化学反应均为氧化还原反应
+
C.氨氧化过程是空气中的氧气把NH N4 和NO2 氧化为 2
D.Fe2+除去硝态氮生成标准状况下5.6LN2 时,转移电子数目为 2.5NA
11.某电池总反应为 2Fe3++Cu=2Fe2++Cu2+,不能实现该反应的原电池是
A.电极材料 Fe、Cu,电解质溶液 FeCl3 溶液
B.电极材料石墨、Cu,电解质溶液 Fe2(SO4)3 溶液
C.电极材料 Pt、Cu,电解质溶液 FeCl3 溶液
D.电极材料 Ag、Cu,电解质溶液 Fe2(SO4)3 溶液
12.实验室用 Cu 与浓硫酸反应制取干燥纯净的二氧化硫,下列仪器选择错误的是
A.装置甲制取装置 B.装置乙尾气吸收装置
C.装置丙干燥装置 D.装置丁收集装置
第3页/共7页
13.近年来,我国科技迅猛发展,下列科技成果中所蕴含的化学知识叙述不正确的是
A.在“人造太阳”中发生核聚变的 3H、2H 是 1H 的同位素
B.华为麒麟芯片的主要成分是单质硅
C.歼-20 战斗机采用大量先进复合材料、石墨烯材料等,其中石墨烯材料属于有机高分子材料
D.“奋斗者”号载人潜水器球壳所使用的钛合金能承受深海高压
14.将1.92gCu 和一定量的浓HNO3反应,随着 Cu 的不断减少,反应生成气体的颜色逐渐变浅,当 Cu 反
应完毕时,共收集到气体 1.12L(标准状况,不考虑 2NO2 N2O4 ),则反应中消耗的HNO3物质的量为
A.1mol B.0.05mol C.1.05mol D.0.11mol
15.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和 NO2、N2O4、NO 的混合气体,这些气体与
1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入 10
mol/LNaOH 溶液至 Cu2+恰好完全沉淀,则消耗 NaOH 溶液的体积是
A.60mL B.45mL C.30mL D.15mL
二、非选择题(共 55 分)
16.(6 分)碳中和作为一种新型环保形式可推动全社会绿色发展。下图为科学家正在研究建立的一种二氧
化碳新循环体系。
TiO2
(1)过程Ⅰ的原理:2H2O 2H2 +O2 ,根据下表数据回答:
太阳能
化学键 H H O = O H—O
(kJ mol 1键能 ) 436 496 463
① 2mol H2O (g)完全分解需 (填“放出”或“吸收”)能量 kJ。
②能正确表示该过程能量变化的示意图是 。
A. B.
第4页/共7页
C. D.
17.(13 分)完成原电池问题。
有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将
电极放入 2 mol/L H2SO4 溶液中,乙同学将电极放入 2 mol/L 的 NaOH 溶液中,如图所示。
请回答:
(1)写出甲池中正极的电极反应式: 。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极: ;
总反应: 。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材
料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论? (填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.上述实验反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”的做法是“不可靠”的
18.(13 分)如图表示 A、B、C、D、E 五种含氮物质相互转化的关系图.其中 A、B、C、D 常温下都是
气体,B 为红棕色.
回答下列问题:3
(1)写出下列物质的化学式:A 为 ;C 为 ;E 为 ;
第5页/共7页
(2) A → D反应常用于人工固氮,写出该反应的化学方程式: ;
(3) D→C是工业制硝酸的重要反应,化学方程式为 ;
(4)B 与一定量的氧气混合通入水中能被完全吸收,则 B 与O2 的物质的量之比为 ,若该反应转移 aNA 个
电子,则参加反应的 B 的物质的量为 mol;
19.(11 分)SO2在生活生产中有重要用途,但不当使用会造成酸雨等环境问题。
(1)大气中的 H2O 能结合 SO2,被氧化后形成硫酸型酸雨。该过程的总化学方程式为 。
(2)该同学用下图所示装置测定空气中的 SO2含量。
反应的离子方程式为:____SO +
- 2-
2 ___ MnO4 + ____ _____=____
2+
Mn + _____SO4 + ____ _____。
①配平以上化学方程式 。(已知:缺项微粒中各元素化合价均不变)
②当注入标准状况下 VmL 空气时,KMnO4酸性溶液的紫红色恰好褪去,则该空气中二氧化硫的体积分数
为 。(用含 V 代数式表示)
(3)通过查阅资料,该同学还发现,化工厂燃煤会产生 SO2,为减少 SO2的排放,他设计了下图的工艺流
程。图中过程Ⅱ的化学方程式为 。
20.(12 分)完成下列问题。
- -
(1)用零价铁(Fe)去除水体中的硝酸盐( NO3 )已成为环境修复研究的热点之一、Fe 还原水体中NO3 的反应原
理如下图所示。
第6页/共7页
①作负极的物质是 。 ②正极的电极反应式是 。
(2)CH4可作为燃料使用,用 CH4和 O2组合形成的质子交换膜燃料电池的结构示意图如下图所示:
电池总反应为 CH4+2O2=CO2+2H2O,则 c 电极是 (填“正极”或“负极”),c 电极的电极反应
式: 。若线路中转移 2mol 电子,则上述 CH4燃料电池消耗的 O2在标准状况下的体积为 L。
第7页/共7页
化 学
一、单选题(每道 3 分,共 45 分)
1.部分含硫物质的类别与相应化合价及部分物质间转化关系如图。下列说法正确的是
A.a 在 O2中燃烧可以生成 d
B.b 可存在于火山口附近或地壳的岩层中
C.c 因漂白作用可以使滴有酚酞的 NaOH 溶液褪色,也可使酸性高锰酸钾溶液褪色
D.e 的浓溶液长时间暴露在空气中,质量增大,质量分数增大
2.氨是一种重要的化工原料,根据下图转化判断下列有关表述正确的是
A.浓硝酸见光易分解且易挥发,应用棕色试剂瓶盛放且用胶塞密封
B.戊与丁反应时,氧化剂与还原剂的物质的量之比为 1∶2
C.实验室可以用 Ba(OH)2溶液鉴别乙和 Na2CO3溶液
D.向饱和 NaCl 溶液中依次通入过量的CO2 和NH3,然后过滤可制得乙
3.下列实验装置,不能达到实验目的的是
A.实验室制备 Cl2 B.验证氨气易溶于水 C.用 SO2做喷泉实验 D.吸收尾气 NH3
+ 2 2-
4.某无色溶液 X 可能含有:Na+、Cu2+、NH4 、Mg2+、Ba2+、CO -3 、Cl 、SO4 中的若干种离子,且各离
Δ
+ -
子数目相同,依次进行下列实验(已知NH4 +OH NH3 +H2O ):
第1页/共7页
①取少量溶液 X,加入足量 NaOH 溶液,有沉淀 A 产生;微热闻到刺激性气味。
②过滤①中的混合物,在滤液中加入足量 Ba(OH)2溶液,有白色沉淀 B 产生,再加入足量的稀硝酸,沉
淀不溶解。
根据上述实验,判断以下说法正确的是
NH+ 2+ SO2 2 A.溶液 X 中一定含有 4 、Mg 、 4 ,可能含有CO3
B.溶液 X 中不能确定是否含有 Na+
2
C.溶液 X 中一定没有CO -3 ,但一定含有 Cl
D.沉淀 A 是混合物,沉淀 B 是纯净物
5.常温下,下列各组离子在指定条件下能大量共存的是
2-
A.0.1mol L-1HNO3溶液:Fe2+、Na+、Cl-、SO4
B.使酚酞变红色的溶液:Na+、Cu2+、HCO
- NO-3 、 3
2- -
C.某无色溶液:H+、Na+、SO MnO4 、 4
2- -
D.使紫色石蕊试液呈红色的溶液中:Mg2+、K+、SO4 、NO3
6.将盛有 NO2和 N2混合气体的试管倒立于水中,经过足够长的时间后,试管内气体体积缩小为原体积的
一半,原混合气体中 N2与 NO2的体积比为
A.1:1 B.1:2 C.1:3 D.3:1
7.某学生用如图装置研究原电池原理,下列说法错误的是
A.(3)中 Zn 片增加的质量与 Cu 片减小的质量的比值为 65∶64
B.(2)与(3)中锌电极上发生的反应相同
C.(1)中铜片上没有气体产生
D.当(2)与(3)中正极生成物的质量比为 1∶32 时,通过外电路的电子数相等
8.有一瓶 Na2SO3溶液,可能已部分被氧化,某学生进行如下实验:取少量溶液,滴入 Ba(NO3)2溶液产生
白色沉淀,再加入过量稀硝酸,充分振荡后仍有白色沉淀,结论正确的是(提示:稀硝酸具有强氧化性,可
2 2
将 SO 3 氧化成 SO 4 )
A.Na2SO3溶液已部分被氧化
B.加入 Ba(NO3)2溶液后生成的沉淀中一定含有 BaSO4
C.加硝酸后仍存在的沉淀一定为 BaSO4
D.此实验能确定 Na2SO3溶液是否部分被氧化
9.下列反应中能量变化与图所示图象一致的是()
第2页/共7页
A.酸碱中和反应 B.氢气点燃
C.铁与稀硫酸的反应 D.氢氧化钡晶体和氯化铵晶体反应
10.水体中氮污染已成为一个日益严重的环境问题,把水体中的氮转化为氮气如图所示,下列说法错误的
是
A.硝化过程和反硝化过程都不属于氮的固定
B.该图示所涉及的化学反应均为氧化还原反应
+
C.氨氧化过程是空气中的氧气把NH N4 和NO2 氧化为 2
D.Fe2+除去硝态氮生成标准状况下5.6LN2 时,转移电子数目为 2.5NA
11.某电池总反应为 2Fe3++Cu=2Fe2++Cu2+,不能实现该反应的原电池是
A.电极材料 Fe、Cu,电解质溶液 FeCl3 溶液
B.电极材料石墨、Cu,电解质溶液 Fe2(SO4)3 溶液
C.电极材料 Pt、Cu,电解质溶液 FeCl3 溶液
D.电极材料 Ag、Cu,电解质溶液 Fe2(SO4)3 溶液
12.实验室用 Cu 与浓硫酸反应制取干燥纯净的二氧化硫,下列仪器选择错误的是
A.装置甲制取装置 B.装置乙尾气吸收装置
C.装置丙干燥装置 D.装置丁收集装置
第3页/共7页
13.近年来,我国科技迅猛发展,下列科技成果中所蕴含的化学知识叙述不正确的是
A.在“人造太阳”中发生核聚变的 3H、2H 是 1H 的同位素
B.华为麒麟芯片的主要成分是单质硅
C.歼-20 战斗机采用大量先进复合材料、石墨烯材料等,其中石墨烯材料属于有机高分子材料
D.“奋斗者”号载人潜水器球壳所使用的钛合金能承受深海高压
14.将1.92gCu 和一定量的浓HNO3反应,随着 Cu 的不断减少,反应生成气体的颜色逐渐变浅,当 Cu 反
应完毕时,共收集到气体 1.12L(标准状况,不考虑 2NO2 N2O4 ),则反应中消耗的HNO3物质的量为
A.1mol B.0.05mol C.1.05mol D.0.11mol
15.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和 NO2、N2O4、NO 的混合气体,这些气体与
1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入 10
mol/LNaOH 溶液至 Cu2+恰好完全沉淀,则消耗 NaOH 溶液的体积是
A.60mL B.45mL C.30mL D.15mL
二、非选择题(共 55 分)
16.(6 分)碳中和作为一种新型环保形式可推动全社会绿色发展。下图为科学家正在研究建立的一种二氧
化碳新循环体系。
TiO2
(1)过程Ⅰ的原理:2H2O 2H2 +O2 ,根据下表数据回答:
太阳能
化学键 H H O = O H—O
(kJ mol 1键能 ) 436 496 463
① 2mol H2O (g)完全分解需 (填“放出”或“吸收”)能量 kJ。
②能正确表示该过程能量变化的示意图是 。
A. B.
第4页/共7页
C. D.
17.(13 分)完成原电池问题。
有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将
电极放入 2 mol/L H2SO4 溶液中,乙同学将电极放入 2 mol/L 的 NaOH 溶液中,如图所示。
请回答:
(1)写出甲池中正极的电极反应式: 。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极: ;
总反应: 。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材
料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论? (填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.上述实验反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”的做法是“不可靠”的
18.(13 分)如图表示 A、B、C、D、E 五种含氮物质相互转化的关系图.其中 A、B、C、D 常温下都是
气体,B 为红棕色.
回答下列问题:3
(1)写出下列物质的化学式:A 为 ;C 为 ;E 为 ;
第5页/共7页
(2) A → D反应常用于人工固氮,写出该反应的化学方程式: ;
(3) D→C是工业制硝酸的重要反应,化学方程式为 ;
(4)B 与一定量的氧气混合通入水中能被完全吸收,则 B 与O2 的物质的量之比为 ,若该反应转移 aNA 个
电子,则参加反应的 B 的物质的量为 mol;
19.(11 分)SO2在生活生产中有重要用途,但不当使用会造成酸雨等环境问题。
(1)大气中的 H2O 能结合 SO2,被氧化后形成硫酸型酸雨。该过程的总化学方程式为 。
(2)该同学用下图所示装置测定空气中的 SO2含量。
反应的离子方程式为:____SO +
- 2-
2 ___ MnO4 + ____ _____=____
2+
Mn + _____SO4 + ____ _____。
①配平以上化学方程式 。(已知:缺项微粒中各元素化合价均不变)
②当注入标准状况下 VmL 空气时,KMnO4酸性溶液的紫红色恰好褪去,则该空气中二氧化硫的体积分数
为 。(用含 V 代数式表示)
(3)通过查阅资料,该同学还发现,化工厂燃煤会产生 SO2,为减少 SO2的排放,他设计了下图的工艺流
程。图中过程Ⅱ的化学方程式为 。
20.(12 分)完成下列问题。
- -
(1)用零价铁(Fe)去除水体中的硝酸盐( NO3 )已成为环境修复研究的热点之一、Fe 还原水体中NO3 的反应原
理如下图所示。
第6页/共7页
①作负极的物质是 。 ②正极的电极反应式是 。
(2)CH4可作为燃料使用,用 CH4和 O2组合形成的质子交换膜燃料电池的结构示意图如下图所示:
电池总反应为 CH4+2O2=CO2+2H2O,则 c 电极是 (填“正极”或“负极”),c 电极的电极反应
式: 。若线路中转移 2mol 电子,则上述 CH4燃料电池消耗的 O2在标准状况下的体积为 L。
第7页/共7页
同课章节目录
