2025年福建高考模拟卷(二)(含解析)
文档属性
| 名称 | 2025年福建高考模拟卷(二)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-30 18:58:34 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025年福建高考模拟卷(二)
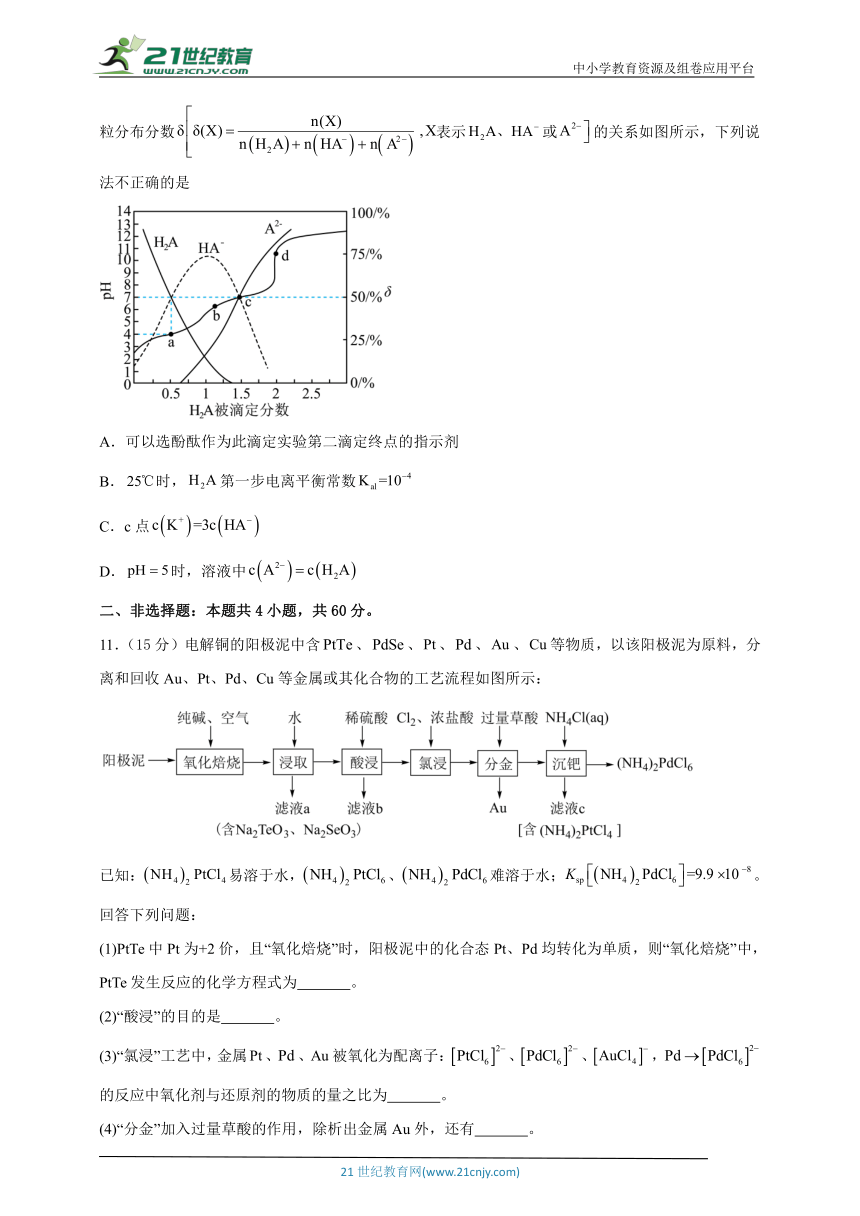
一、选择题:本题共10小题,每小题4分,共40分。每小题只有一项是符合题目要求的。
1.第78届联合国大会一致通过决议,将春节确定为联合国假日。下列春节习俗中,属于化学变化的是
A.燃放爆竹 B.剪纸纳福 C.舞龙舞狮 D.扫尘除旧
2.有机物d可由多步反应合成,反应流程如图。下列说法正确的是
A.有机物b环上的一氯代物有1种 B.有机物d的核磁共振氢谱有4组峰
C.有机物b生成c属于取代反应 D.有机物a、c、d均能与钠反应生成氢气
3.某离子液体的阴离子结构如图所示,、、、、五种短周期元素的原子半径依次增大。常温下的单质能与水反应产生无色气体,、同族。下列说法正确的是
A.第一电离能:
B.简单氢化物的沸点:
C.与、与均可形成、型化合物
D.该阴离子中所有原子最外层都满足8电子稳定结构
4.某学生设计如图装置制备晶体(呈深蓝色)。下列说法错误的是
A.中,提供孤电子对的是中的N原子
B.装置甲中的仪器a和装置乙中的仪器b作用相同
C.当得到深蓝色透明溶液时,滴加乙醇,会有深蓝色晶体析出
D.可用红外光谱仪鉴定是晶体还是非晶体
5.金属镍在制不锈钢、电镀等工艺中有重要用途。以镍废渣(主要成分为,还含有和)为原料制备纯镍的流程如图所示。已知金属镍的化学性质与铁类似。下列说法正确的是
A.滤渣1的主要成分为 B.“酸浸”改用浓硫酸,可省略“氧化”步骤
C.操作X为蒸发浓缩、降温结晶 D.灼烧后的化合物Y为
6.用FeCl2和NaBH4制备纳米零价铁的反应为FeCl2+2NaBH4+6H2O=Fe+2B(OH)3+2NaCl+7H2↑。NA表示阿伏加德罗常数的数值,下列说法错误的是
A.每生成28gFe,转移的电子数为1NA
B.0.5molNaBH4晶体中键的数目为2NA
C.0.5molB(OH)3中sp3杂化的原子数为1.5NA
D.1L0.1mol/LFeCl2溶液中Fe2+的数目小于0.1NA
7.在Ⅰ、Ⅱ、Ⅲ三个容积不同(Ⅰ、Ⅱ、Ⅲ容器的容积分别为、、)的恒容密闭容器中分别充入和,发生反应:,容器Ⅰ、Ⅱ、Ⅲ中的平衡转化率与温度倒数的关系如图所示。下列有关说法正确的是
A.平衡常数K:e>b>d
B.a点压强与d点压强之比为35∶36
C.若e点平衡时,则容器Ⅱ中的平衡转化率为25%
D.容器内气体密度由大到小的关系:a>b>c
8.苯甲酸的熔点为122.13℃,微溶于水,易溶于酒精,实验室制备少量苯甲酸的流程如图:
下列叙述正确的是
A.“操作1”过程中玻璃棒的作用为搅拌
B.“操作2”为酸化过程,可使用稀硫酸
C.“冷凝回流”过程中一定需要直形蒸馏管
D.为提高苯甲酸固体的纯度,可用热水洗涤晶体
9.钠离子电池以其低成本、高安全性等成为锂离子电池的首选“备胎”,其工作原理为。下列说法错误的是
A.放电时,嵌入铝箔电极上,元素被氧化
B.充电时,外电路中每转移,理论上碳基材料质量增加
C.放电时,b极为负极,其电极反应式为
D.该电池在充、放电过程中,依靠钠离子在两极反复脱嵌和嵌入,发生氧化还原反应
10.时,用溶液滴定同浓度的溶液,被滴定分数与、微粒分布分数表示或的关系如图所示,下列说法不正确的是
A.可以选酚酞作为此滴定实验第二滴定终点的指示剂
B.时,第一步电离平衡常数
C.c点
D.时,溶液中
二、非选择题:本题共4小题,共60分。
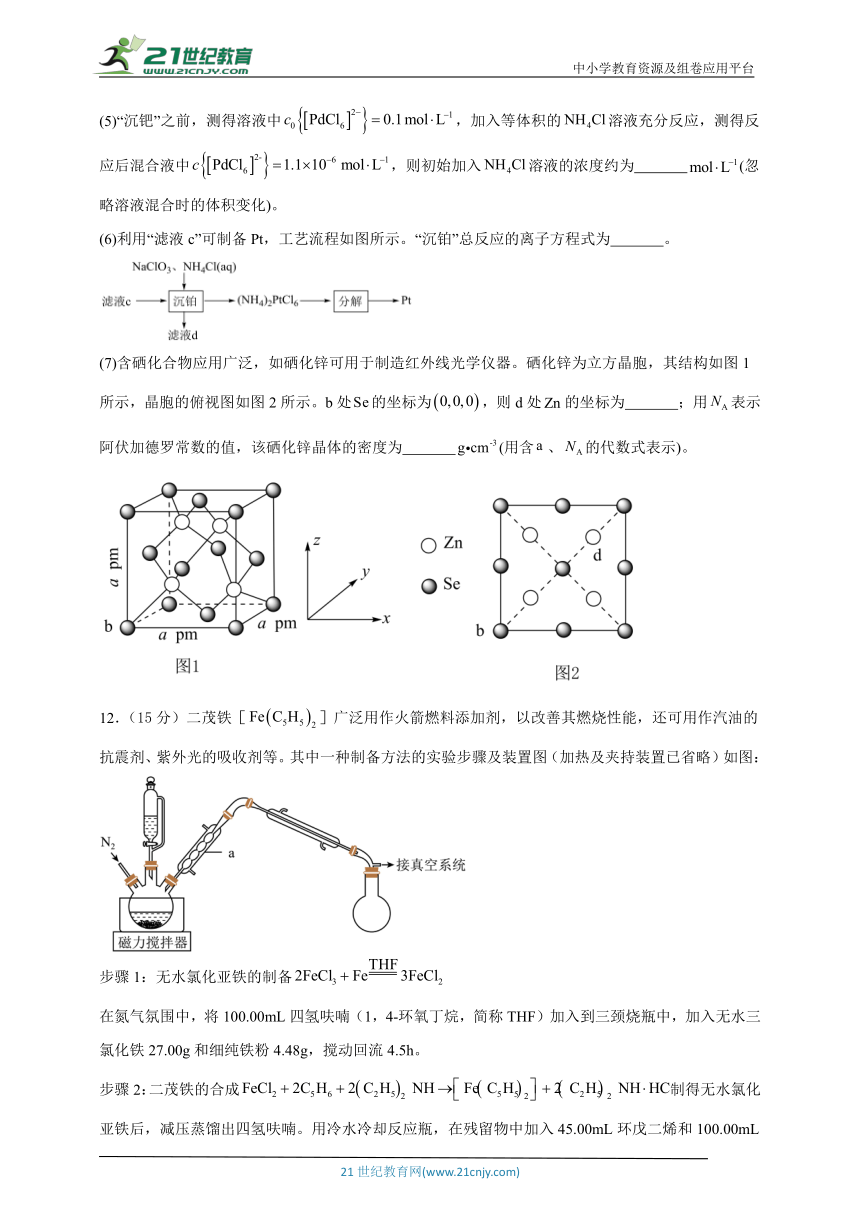
11.(15分)电解铜的阳极泥中含、、、、、等物质,以该阳极泥为原料,分离和回收Au、Pt、Pd、Cu等金属或其化合物的工艺流程如图所示:
已知:易溶于水,、难溶于水;。回答下列问题:
(1)PtTe中Pt为+2价,且“氧化焙烧”时,阳极泥中的化合态Pt、Pd均转化为单质,则“氧化焙烧”中,PtTe发生反应的化学方程式为 。
(2)“酸浸”的目的是 。
(3)“氯浸”工艺中,金属、、被氧化为配离子:、、,的反应中氧化剂与还原剂的物质的量之比为 。
(4)“分金”加入过量草酸的作用,除析出金属Au外,还有 。
(5)“沉钯”之前,测得溶液中,加入等体积的溶液充分反应,测得反应后混合液中,则初始加入溶液的浓度约为 (忽略溶液混合时的体积变化)。
(6)利用“滤液c”可制备Pt,工艺流程如图所示。“沉铂”总反应的离子方程式为 。
(7)含硒化合物应用广泛,如硒化锌可用于制造红外线光学仪器。硒化锌为立方晶胞,其结构如图1所示,晶胞的俯视图如图2所示。b处的坐标为,则d处的坐标为 ;用表示阿伏加德罗常数的值,该硒化锌晶体的密度为 (用含、的代数式表示)。
12.(15分)二茂铁[]广泛用作火箭燃料添加剂,以改善其燃烧性能,还可用作汽油的抗震剂、紫外光的吸收剂等。其中一种制备方法的实验步骤及装置图(加热及夹持装置已省略)如图:
步骤1:无水氯化亚铁的制备
在氮气氛围中,将100.00mL四氢呋喃(1,4-环氧丁烷,简称THF)加入到三颈烧瓶中,加入无水三氯化铁27.00g和细纯铁粉4.48g,搅动回流4.5h。
步骤2:二茂铁的合成制得无水氯化亚铁后,减压蒸馏出四氢呋喃。用冷水冷却反应瓶,在残留物中加入45.00mL环戊二烯和100.00mL二乙胺(环戊二烯、二乙胺均过量),继续通入氮气,强烈搅动4h,蒸出过量的二乙胺。加入石油醚,充分搅拌后趁热过滤,将滤液蒸发得二茂铁粗品,提纯可得精品。
已知:常温下二茂铁为橙黄色晶体,有樟脑气味,熔点173℃,沸点249℃,高于100℃易升华,能溶于苯、乙醚和石油醚等有机溶剂,不溶于水,化学性质稳定。紫外光谱于325nm和440nm处有极大的吸收值。
回答下列问题:
(1)向三颈烧瓶中加液的仪器名称为 。
(2)本实验所使用的三颈烧瓶规格为______。
A.50mL B.100mL C.250mL D.500mL
(3)实验中持续通入氮气的主要目的是 。
(4)二茂铁结构如图,是由环戊二烯负离子()和亚铁离子形成的夹心结构。已知分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为),则中的大π键可表示为 ,二茂铁晶体类型属于 。
(5)如何验证所得晶体为二茂铁,试列举一种方法 ,最终得到29.76g纯二茂铁,则该实验产率w(二茂铁)= %(保留1位小数)。
(6)还可用、环戊二烯()在KOH碱性条件下制备二茂铁,试写出化学方程式 。
13.(15分)化合物H是黄酮醋酸类化合物,有保肝作用。以下是制备化合物H的一种合成路线。
已知:
回答下列问题:
(1)A的名称是 。
(2)一定条件下,最多能与 发生加成反应。
(3)D中所含氧官能团的名称为 。
(4)F的结构简式为 。
(5)A→B的化学方程式为 。
(6)B的同分异构体有多种,其中既能发生水解反应又能发生银镜反应的芳香族化合物有 种(不考虑立体异构);这些同分异构体中,核磁共振氢谱有4组峰,且峰面积比为6:2:1:1的物质的结构简式为 (有几种,写几种)。
(7)以乙醇为原料制备1-丁醇的合成路线如下:
①K→L的化学反应方程式为 。
②M→N的反应类型为 。
14.(15分)为了缓解温室效应与能源供应之间的冲突,CO2的资源化利用已成为研究的热点。
【资源化一:利用CO2制水煤气】
(1)在容积为1L的恒容密闭容器中进行反应,方程式为 。当投料比时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
①初始压强 (填“>”“<”或“=”,下同);当温度为℃、初始压强为时,a点时的 。
②起始时向容器中加入1molCH4和1molCO2,在温度为℃时反应,此时初始压强为,该反应的平衡常数K= 。
【资源化二:利用CO2制天然气】
(2)二氧化碳加氢制甲烷过程中主要发生反应:
反应I:
反应Ⅱ:
在密闭容器中,压强恒为1.01×105Pa、时,CO2平衡转化率、在催化剂作用下反应相同时间所测得的CO2实际转化率随温度的变化如图所示。
①反应I的= kJ·mol-1.
②CO2平衡转化率后升高的主要原因是 。
③CO2制备甲烷过程中,CO2活化的可能途径有两种,如图所示。请从反应速率和反应程度两个角度分析说明CO*是CO2活化的优势中间体的原因是 。
【资源化三:利用CO2制有价值的有机物】
(3)CO2与环氧化合物反应可以转化为有价值的有机物,其转化过程如图所示。Y为五元环状化合物,Y的结构简式为 ;该反应中涉及的第二周期元素中,第一电离能由大到小的顺序为 (用元素符号表示)。
参考答案
1.A
【详解】A.燃放爆竹有新物质生成,同时有发光发热和爆炸现象,属于化学变化,A符合题意;
B.剪纸纳福只有纸张形状的改变,没有新物质生成,不属于化学变化,B不符合题意;
C.舞龙舞狮只有人和他们舞的龙、狮的动作的变化,没有新物质生成,不属于化学变化,C不符合题意;
D.扫尘除旧是用清扫工具扫去家里的灰尘等,没有新物质生成,不属于化学变化,D不符合题意;
选B。
2.B
【详解】A.有机物b环上存在2种氢原子,如图所示:,一氯取代物有2种,故A错误;
B.有机物d为对称结构,存在4种相同环境的氢原子,为标记序号的4个位置:,核磁共振氢谱有4组峰,故B正确;
C.有机物b生成c为过氧化氢与醛基发生加成反应,反应中没有小分子生成不是取代反应,故C错误;
D.羟基可与钠反应生成氢气,只有有机物a、c存在羟基,故D错误;
故答案为B。
3.C
【分析】、、、、五种短周期元素的原子半径依次增大,常温下的单质能与水反应产生无色气体,X只形成1个共价键,则X为F,F2和水反应生成O2,、同族,Y形成2个共价键,W形成6个共价键,Y为O,W为S,Q形成4个共价键,Q为C,Z为N,以此解答。
A.同周期元素从左向右,第一电离能呈增大趋势,但N原子的2p轨道半充满,较稳定,第一电离能比O原子大,所以第一电离能:F>N>O>C,A错误;
B.F、O、S的最简单氢化物分别是HF、H2O、H2S,HF、H2O分子间能够形成氢键,沸点较高,并且H2O分子间形成氢键的数目比HF多,则沸点:H2O>HF>H2S,B错误;
C.N与O、C与O均可形成、型化合物,如NO、NO2、CO、CO2,C正确;
D.该阴离子中S原子形成6个共价键,最外层不满足8电子稳定结构,D错误;
故选C。
4.D
【分析】甲装置中NH3通入CuSO4溶液,生成的蓝色沉淀为Cu(OH)2,后溶解为[Cu(NH3)4]2+,加入乙醇降低的溶解度,析出晶体,乙装置进行尾气处理并防倒吸,据此作答。
A.分子中心N原子含有=1个孤电子对,则中,提供孤电子对的是中的N原子,A正确;
B.氨气极易溶于水,易发生倒吸,仪器a可防止制备过程中发生倒吸现象,倒扣的漏斗与液面相切,液体很难倒吸,因此仪器b也可防止液体倒吸,B正确;
C.在乙醇中的溶解度小于在水中的溶解度,向深蓝色溶液中加入乙醇,深蓝色溶液变浑浊,静置后有深蓝色晶体析出,故C正确;
D.鉴定是晶体还是非晶体需要X射线衍射实验,不能用红外光谱仪鉴定是否为晶体,D错误;
故选:D。
5.D
【分析】镍废渣(主要成分为,还含有和)加入稀硫酸进行酸浸,得到、,不与硫酸反应,微溶,过滤得到滤渣1,滤渣1的主要成分为,向滤液中加入,将氧化为,加入氨水调,和反应生成沉淀和沉淀,滤渣2为和,经过蒸发浓缩、降温结晶、过滤、洗涤,得到,灼烧至恒重,得到镍的氧化物,最后制得纯镍,据此回答。
A.滤渣1的主要成分为,A错误;
B.的化学性质与类似,浓硫酸代替稀硫酸,与浓硫酸会钝化,元素不能回收,B错误;
C.操作X应为蒸发浓缩、降温结晶、过滤、洗涤,C错误;
D.的相对分子质量为281,起始时物质的量为,其中原子守恒,加热至质量不再变化时为氧化物,中,所以,镍、氧的物质的量之比为,故灼烧后对应的氧化物为,D正确;
故选D。
6.A
【详解】A.28gFe物质的量为0.5mol,中Fe由+2价降低为0价,水中有6个H由+1价降低为0价,NaBH4中H的化合价由-1价升至0价,生成转移8mol电子,故生成0.5molFe转移电子数为,A错误;
B.中存在与,为离子键构成的离子化合物,而1个中有4个键,固体中键数为,B正确;
C.分子中,原子采取杂化,原子采取杂化,0.5molB(OH)3中sp3杂化的原子数为1.5NA,C正确;
D.会发生水解,导致亚铁离子浓度减小,溶液中数小于,D正确;
答案选A。
7.C
【详解】A.根据图像可知,温度越高,平衡转化率越小,说明该反应是放热反应,e、b、d三点对应温度逐渐降低,所以平衡常数K:eB.a点与d点体系的温度与体积不同且未知,两者压强比不能确定,故B错误;
C.根据三段式:,由,1-x=3x,x=0.25,的平衡转化率为25%,故C正确;
D.根据图像可知该反应为放热反应,a、b、c三点对应温度逐渐降低,且三点的平衡转化率相同,三个容器体积关系为>>,容器内气体密度,由于三个容器起始均为和,所以总质量相同,但>>,所以a,b,c三点密度关系为a故答案为C。
8.B
【详解】A.生成的苯甲酸钾可溶于水,同时反应中,高锰酸钾与甲苯反应生成的二氧化锰不溶于水,操作1应是过滤操作,所以玻璃棒的作用还有引流作用,A错误;
B.苯甲酸钾加入酸发生取代反应,同时硫酸酸性强于苯甲酸,根据强酸制弱酸原理,可酸化制得苯甲酸,B正确;
C.冷凝回流过程中,为增大接触面积,增强冷凝效果,可以选择球形冷凝管,C错误;
D.苯甲酸微溶于水,但是在热水中,溶解度增大,造成产品损失,应该用冷水洗涤晶体,D错误;
答案选B
9.A
【分析】由题干信息可知,放电过程中碳基材料为负极b,发生的电极反应式为,充电时,b与电源负极相连作阴极,电极反应式为,放电时a极为正极,正极反应式为,充电时,a与电源正极相连作阳极,电极反应式为。
A.放电时,嵌入铝箔电极上,此时锰元素化合价降低,被还原,A项错误;
B.充电时,外电路中转移,得电子由铝箔电极转移到碳基材料上,碳基材料质量增加,B项正确;
C.放电时,b极为负极,其电极反应式为,C项正确;
D.由分析可知,充、放电过程中,依靠钠离子在两极反复脱嵌和嵌入,碳元素和锰元素的化合价发生变化,发生了氧化还原反应,D项正确;
故选A。
10.D
【分析】用0.1mol L-1KOH溶液滴定同浓度的H2A溶液,发生反应H2A+OH-=HA-+H2O,HA-+OH-=A2-+H2O,由图可知,b点为第一滴定终点,此时溶液显酸性,d点为第二滴定终点,此时溶液显碱性,据此作答。
A.根据图示,此滴定实验第二滴定终点溶质为,溶液呈碱性,酚酞的变色范围是,所以可用酚酞作指示剂,A正确;
B.根据图示,时,溶液为4,时,第一步电离平衡常数Ka1==,B正确;
C.由图可知,c点溶液,,根据电荷守恒:,C正确:
D.由a点可知Ka1=,同理由c点可得Ka2=,根据,可知时,溶液,D不正确;
答案选D。
11.(1) (2分)
(2)使转化为,使与其他物质分离(1分)
(3) (2分)
(4)将还原为,便于后续使含物种与含物种分离(2分)
(5)0.8(2分)
(6) (2分)
(7) (2分)(2分)
【分析】阳极泥加入纯碱(碳酸钠)、空气焙烧,然后加入水,浸取过滤得到含Na2TeO3、Na2SeO3滤液a,分离出滤渣,滤渣加入稀硫酸酸浸溶解氧化铜得到含硫酸铜的滤液b,分离出含Au、Pt、Pd的滤渣,加入浓盐酸和氯气氯浸,金属、、被氧化为配离子:、、,加入草酸将还原为金单质、还原为,过滤分离出金单质,滤液加入氯化铵得到含滤液c和沉淀。
(1)PtTe中Pt为+2价,且“氧化焙烧”时,阳极泥中的化合态Pt转化为单质,反应中Pt化合价由+2变为0,空气中氧气参与反应,氧化合价由0变为-2,Te化合价由-2变为+4得到,结合电子守恒、质量守恒,PtTe发生反应的化学方程式为;
(2)稀硫酸能和金属氧化物氧化铜反应,而不和、、反应,故目的为:使转化为,使与其他物质分离;
(3),Pd化合价由0变为+4,为还原剂,氯气中氯化合价由0变为-1,为氧化剂,结合电子守恒存在,氧化剂与还原剂的物质的量之比为2:1;
(4)草酸具有还原性,由分析结合流程,“分金”加入过量草酸的作用,除析出金属Au外,还有将还原为,便于后续使含物种与含物种分离;
(5)反应后混合液中,则此时,结合反应,则初始加入溶液的浓度约为;
(6)“沉铂”总反应为和氯酸根离子发生氧化还原反应生成,反应中Pt化合价由+2变为+4、氯酸根离子中氯化合价由+5变为-1,结合电子守恒、质量守恒,反应为;
(7)由图,d处位于图中红圈处,其在xyz轴的投影坐标分别为、、,坐标为;据“均摊法”,晶胞中含个Se、4个Zn,则晶体密度为。
12.(1)恒压分液漏斗(2分)
(2)C(2分)
(3)防止亚铁离子被氧化,降低二茂铁的产率(2分)
(4) (2分)分子晶体(1分)
(5)测定熔点是否为173℃或测定紫外线光谱是否在325nm和440nm处有极大的吸收值(2分)66.7(2分)
(6) (2分)
【分析】由题意可知,制备二茂铁的实验过程为THF作用下无水氯化铁与铁在氮气氛围中反应制得氯化亚铁,向减压蒸馏出THF的氯化亚铁中加入环戊二烯和二乙胺,继续通入氮气,搅动、蒸出过量的乙二胺,向反应后的溶液中加入石油醚,充分搅拌、趁热过滤,将滤液蒸发得二茂铁粗品,提纯可得精品。
(1)由实验装置图可知,向三颈烧瓶中加液的仪器为恒压滴液漏斗;
(2)由题意可知,三颈烧瓶中加入液体的体积为145mL,由三颈烧瓶装的液体体积不低于容积的三分之一,不高于三分之二可知,实验时使用的三颈烧瓶规格为250mL,故选C;
(3)亚铁离子具有还原性,易被空气中的氧气氧化,所以实验中应持续通入氮气排尽装置中的空气,避免亚铁离子被氧化,降低二茂铁的产率;
(4)环戊二烯负离子中碳原子的杂化方式都为sp2杂化,参与形成大π键的碳原子个数为5、参与形成大π键的电子数为6,大π键可表示为;由题意可知,常温下二茂铁的熔点为173℃、沸点为249℃,高于100℃易升华,能溶于苯、乙醚和石油醚等有机溶剂,不溶于水,所以二茂铁是熔沸点低的分子晶体;
(5)测定晶体的熔点是否为173℃,以及测定紫外线光谱是否在325nm和440nm处有极大的吸收值的方法可以验证所得晶体为二茂铁;27.00g氯化铁的物质的量为≈0.17mol,铁的物质的量为= 0.08mol,则制备氯化亚铁时,铁不足量,完全反应制得氯化亚铁的物质的量为0.24mol,环戊二烯、乙二胺均过量条件下,氯化亚铁完全反应制得二茂铁的质量为29.76g,则二戊铁的产率为×100%≈66.7%,故答案为:测定熔点是否为173℃或测定紫外线光谱是否在325nm和440nm处有极大的吸收值;66.7;
(6)由题意可知,氯化亚铁与环戊二烯和氢氧化钾反应生成二戊铁、氯化钾和水,反应的化学方程式为。
13.(1)对甲基苯酚(或对甲苯酚或4-甲基苯酚) (1分)
(2)4(2分)
(3)酚羟基、酮羰基(1分)
(4) (2分)
(5)++CH3COOH(2分)
(6)14(2分)
(2分)
(7) 2CH3CH2OH+O22CH3CHO+2H2O(2分)加成反应(或还原反应) (1分)
【分析】由流程图可知,A和在浓磷酸存在条件下加热发生取代反应生成B,B与C6H5NO2在AlCl3存在时加热反应生成C,C与HCHO在HCl条件下反应生成D,D与NaCN发生取代反应生成E,根据E、G结构的不同,可知E与F()在碱性条件下发生信息中的反应生成G,G与I2/H2SO4(aq)在DMSC条件下生成H。
(1)根据A分子结构可知:甲基位于酚羟基的对位,所以A物质的名称为对甲基苯酚(或对甲苯酚或4-甲基苯酚);
(2)C分子中的苯环及羰基都可以与H2发生加成反应,则一定条件下,1 mol C最多能与4 mol H2发生加成反应;
(3)根据D物质结构简式可知D物质分子中含氧官能团的名称为酚羟基、酮羰基(或羰基);
(4)根据E、G结构的不同,结构题目已知信息的反应,可知F分子苯环中在Br-对位上连接一个醛基-CHO,其结构简式是:;
(5)根据流程图可知A与在浓磷酸存在条件下加热,发生取代反应,产生B和CH3COOH,该反应的方程式为++CH3COOH;
(6)B分子中除苯环外,含3个碳、2个氧、1个不饱和度,其同分异构体有多种,其中能发生水解反应,说明含有酯基;还能发生银镜反应,说明含有醛基,则分子中含有甲酸的酯基结构。故既能发生水解反应又能发生银镜反应的芳香族化合物有、、、,共有14种不同结构,其中核磁共振氢谱有4组峰,且峰面积比为6∶2∶1∶1的物质的结构简式为。
(7)乙醇与O2在Cu催化下加热,发生氧化反应产生CH3CHO,CH3CHO在碱性条件下发生信息中的反应产生CH3CH=CHCHO,然后该物质与H2在Ni催化下加热,发生还原反应产生CH3CH2CH2CH2OH。
①K→L的化学方程式为:2CH3CH2OH+O22CH3CHO+2H2O;
②M与H2在一定条件下发生加成反应产生N,因此M→N的反应类型是加成反应,物质与氢气的加成反应也属于还原反应,故该反应的类型为加成反应(或还原反应)。
14.(1)< (2分)>(2分)4(2分)
(2)-164.7(2分)反应I为放热反应,温度升高CO2平衡转化率减小;反应Ⅱ为吸热反应,温度升高CO2平衡转化率增大,温度较高时以反应Ⅱ为主,随温度升高CO2平衡转化率增大的幅度大于减小的幅度(2分)生成CO*中间体反应的活化能小,反应速率快;CO*中间体能量低,较稳定,利于生成(或反应放热,利于中间体的生成) (2分)
(3) (2分)N>O>C(1分)
【详解】(1)①是体积增大的反应,℃时,从下到上,二氧化碳平衡转化率升高,平衡正向移动,即减小压强向体积增大的方向移动,因此。当温度为℃、初始压强为时,从a点到平衡点,二氧化碳平衡转化率减小,说明平衡逆向移动,因此a点时的。
②起始时向容器中加入1molCH4和1molCO2,在温度为℃、初始压强为时反应,二氧化碳平衡转化率为50%,列出三段式得:,该反应的平衡常数。
(2)①根据盖斯定律可知,反应的。
②因为反应: ,是放热反应,当温度升高,平衡逆向移动,二氧化碳转化率降低;反应: ,是吸热反应,当温度升高,平衡正向移动,导致二氧化碳转化率增大,当温度升高到移动程度以后,此时反应以反应为主,导致随着温度的升高,反应的二氧化碳转化率增大幅度大于反应的减小幅度。答案为:反应为放热反应,温度升高CO2平衡转化率减小;反应为吸热反应,温度升高CO2平衡转化率增大,温度较高时以反应为主,随温度升高CO2平衡转化率增大的幅度大于减小的幅度。
③从图中可以看出,生成CO*中间体反应的活化能小,反应速率快;CO*中间体能量低,较稳定,利于生成(或反应放热,利于中间体的生成),故CO*是CO2活化的优势中间体。
(3)转化过程中C—N键断裂,CO2中一个C=O键断裂,发生加成反应,形成五元环状化合物的结构简式为。根据同周期第一电离能从左到右呈增大趋势,ⅡA、ⅤA反常,所以第一电离能由大到小的顺序为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025年福建高考模拟卷(二)
一、选择题:本题共10小题,每小题4分,共40分。每小题只有一项是符合题目要求的。
1.第78届联合国大会一致通过决议,将春节确定为联合国假日。下列春节习俗中,属于化学变化的是
A.燃放爆竹 B.剪纸纳福 C.舞龙舞狮 D.扫尘除旧
2.有机物d可由多步反应合成,反应流程如图。下列说法正确的是
A.有机物b环上的一氯代物有1种 B.有机物d的核磁共振氢谱有4组峰
C.有机物b生成c属于取代反应 D.有机物a、c、d均能与钠反应生成氢气
3.某离子液体的阴离子结构如图所示,、、、、五种短周期元素的原子半径依次增大。常温下的单质能与水反应产生无色气体,、同族。下列说法正确的是
A.第一电离能:
B.简单氢化物的沸点:
C.与、与均可形成、型化合物
D.该阴离子中所有原子最外层都满足8电子稳定结构
4.某学生设计如图装置制备晶体(呈深蓝色)。下列说法错误的是
A.中,提供孤电子对的是中的N原子
B.装置甲中的仪器a和装置乙中的仪器b作用相同
C.当得到深蓝色透明溶液时,滴加乙醇,会有深蓝色晶体析出
D.可用红外光谱仪鉴定是晶体还是非晶体
5.金属镍在制不锈钢、电镀等工艺中有重要用途。以镍废渣(主要成分为,还含有和)为原料制备纯镍的流程如图所示。已知金属镍的化学性质与铁类似。下列说法正确的是
A.滤渣1的主要成分为 B.“酸浸”改用浓硫酸,可省略“氧化”步骤
C.操作X为蒸发浓缩、降温结晶 D.灼烧后的化合物Y为
6.用FeCl2和NaBH4制备纳米零价铁的反应为FeCl2+2NaBH4+6H2O=Fe+2B(OH)3+2NaCl+7H2↑。NA表示阿伏加德罗常数的数值,下列说法错误的是
A.每生成28gFe,转移的电子数为1NA
B.0.5molNaBH4晶体中键的数目为2NA
C.0.5molB(OH)3中sp3杂化的原子数为1.5NA
D.1L0.1mol/LFeCl2溶液中Fe2+的数目小于0.1NA
7.在Ⅰ、Ⅱ、Ⅲ三个容积不同(Ⅰ、Ⅱ、Ⅲ容器的容积分别为、、)的恒容密闭容器中分别充入和,发生反应:,容器Ⅰ、Ⅱ、Ⅲ中的平衡转化率与温度倒数的关系如图所示。下列有关说法正确的是
A.平衡常数K:e>b>d
B.a点压强与d点压强之比为35∶36
C.若e点平衡时,则容器Ⅱ中的平衡转化率为25%
D.容器内气体密度由大到小的关系:a>b>c
8.苯甲酸的熔点为122.13℃,微溶于水,易溶于酒精,实验室制备少量苯甲酸的流程如图:
下列叙述正确的是
A.“操作1”过程中玻璃棒的作用为搅拌
B.“操作2”为酸化过程,可使用稀硫酸
C.“冷凝回流”过程中一定需要直形蒸馏管
D.为提高苯甲酸固体的纯度,可用热水洗涤晶体
9.钠离子电池以其低成本、高安全性等成为锂离子电池的首选“备胎”,其工作原理为。下列说法错误的是
A.放电时,嵌入铝箔电极上,元素被氧化
B.充电时,外电路中每转移,理论上碳基材料质量增加
C.放电时,b极为负极,其电极反应式为
D.该电池在充、放电过程中,依靠钠离子在两极反复脱嵌和嵌入,发生氧化还原反应
10.时,用溶液滴定同浓度的溶液,被滴定分数与、微粒分布分数表示或的关系如图所示,下列说法不正确的是
A.可以选酚酞作为此滴定实验第二滴定终点的指示剂
B.时,第一步电离平衡常数
C.c点
D.时,溶液中
二、非选择题:本题共4小题,共60分。
11.(15分)电解铜的阳极泥中含、、、、、等物质,以该阳极泥为原料,分离和回收Au、Pt、Pd、Cu等金属或其化合物的工艺流程如图所示:
已知:易溶于水,、难溶于水;。回答下列问题:
(1)PtTe中Pt为+2价,且“氧化焙烧”时,阳极泥中的化合态Pt、Pd均转化为单质,则“氧化焙烧”中,PtTe发生反应的化学方程式为 。
(2)“酸浸”的目的是 。
(3)“氯浸”工艺中,金属、、被氧化为配离子:、、,的反应中氧化剂与还原剂的物质的量之比为 。
(4)“分金”加入过量草酸的作用,除析出金属Au外,还有 。
(5)“沉钯”之前,测得溶液中,加入等体积的溶液充分反应,测得反应后混合液中,则初始加入溶液的浓度约为 (忽略溶液混合时的体积变化)。
(6)利用“滤液c”可制备Pt,工艺流程如图所示。“沉铂”总反应的离子方程式为 。
(7)含硒化合物应用广泛,如硒化锌可用于制造红外线光学仪器。硒化锌为立方晶胞,其结构如图1所示,晶胞的俯视图如图2所示。b处的坐标为,则d处的坐标为 ;用表示阿伏加德罗常数的值,该硒化锌晶体的密度为 (用含、的代数式表示)。
12.(15分)二茂铁[]广泛用作火箭燃料添加剂,以改善其燃烧性能,还可用作汽油的抗震剂、紫外光的吸收剂等。其中一种制备方法的实验步骤及装置图(加热及夹持装置已省略)如图:
步骤1:无水氯化亚铁的制备
在氮气氛围中,将100.00mL四氢呋喃(1,4-环氧丁烷,简称THF)加入到三颈烧瓶中,加入无水三氯化铁27.00g和细纯铁粉4.48g,搅动回流4.5h。
步骤2:二茂铁的合成制得无水氯化亚铁后,减压蒸馏出四氢呋喃。用冷水冷却反应瓶,在残留物中加入45.00mL环戊二烯和100.00mL二乙胺(环戊二烯、二乙胺均过量),继续通入氮气,强烈搅动4h,蒸出过量的二乙胺。加入石油醚,充分搅拌后趁热过滤,将滤液蒸发得二茂铁粗品,提纯可得精品。
已知:常温下二茂铁为橙黄色晶体,有樟脑气味,熔点173℃,沸点249℃,高于100℃易升华,能溶于苯、乙醚和石油醚等有机溶剂,不溶于水,化学性质稳定。紫外光谱于325nm和440nm处有极大的吸收值。
回答下列问题:
(1)向三颈烧瓶中加液的仪器名称为 。
(2)本实验所使用的三颈烧瓶规格为______。
A.50mL B.100mL C.250mL D.500mL
(3)实验中持续通入氮气的主要目的是 。
(4)二茂铁结构如图,是由环戊二烯负离子()和亚铁离子形成的夹心结构。已知分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为),则中的大π键可表示为 ,二茂铁晶体类型属于 。
(5)如何验证所得晶体为二茂铁,试列举一种方法 ,最终得到29.76g纯二茂铁,则该实验产率w(二茂铁)= %(保留1位小数)。
(6)还可用、环戊二烯()在KOH碱性条件下制备二茂铁,试写出化学方程式 。
13.(15分)化合物H是黄酮醋酸类化合物,有保肝作用。以下是制备化合物H的一种合成路线。
已知:
回答下列问题:
(1)A的名称是 。
(2)一定条件下,最多能与 发生加成反应。
(3)D中所含氧官能团的名称为 。
(4)F的结构简式为 。
(5)A→B的化学方程式为 。
(6)B的同分异构体有多种,其中既能发生水解反应又能发生银镜反应的芳香族化合物有 种(不考虑立体异构);这些同分异构体中,核磁共振氢谱有4组峰,且峰面积比为6:2:1:1的物质的结构简式为 (有几种,写几种)。
(7)以乙醇为原料制备1-丁醇的合成路线如下:
①K→L的化学反应方程式为 。
②M→N的反应类型为 。
14.(15分)为了缓解温室效应与能源供应之间的冲突,CO2的资源化利用已成为研究的热点。
【资源化一:利用CO2制水煤气】
(1)在容积为1L的恒容密闭容器中进行反应,方程式为 。当投料比时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
①初始压强 (填“>”“<”或“=”,下同);当温度为℃、初始压强为时,a点时的 。
②起始时向容器中加入1molCH4和1molCO2,在温度为℃时反应,此时初始压强为,该反应的平衡常数K= 。
【资源化二:利用CO2制天然气】
(2)二氧化碳加氢制甲烷过程中主要发生反应:
反应I:
反应Ⅱ:
在密闭容器中,压强恒为1.01×105Pa、时,CO2平衡转化率、在催化剂作用下反应相同时间所测得的CO2实际转化率随温度的变化如图所示。
①反应I的= kJ·mol-1.
②CO2平衡转化率后升高的主要原因是 。
③CO2制备甲烷过程中,CO2活化的可能途径有两种,如图所示。请从反应速率和反应程度两个角度分析说明CO*是CO2活化的优势中间体的原因是 。
【资源化三:利用CO2制有价值的有机物】
(3)CO2与环氧化合物反应可以转化为有价值的有机物,其转化过程如图所示。Y为五元环状化合物,Y的结构简式为 ;该反应中涉及的第二周期元素中,第一电离能由大到小的顺序为 (用元素符号表示)。
参考答案
1.A
【详解】A.燃放爆竹有新物质生成,同时有发光发热和爆炸现象,属于化学变化,A符合题意;
B.剪纸纳福只有纸张形状的改变,没有新物质生成,不属于化学变化,B不符合题意;
C.舞龙舞狮只有人和他们舞的龙、狮的动作的变化,没有新物质生成,不属于化学变化,C不符合题意;
D.扫尘除旧是用清扫工具扫去家里的灰尘等,没有新物质生成,不属于化学变化,D不符合题意;
选B。
2.B
【详解】A.有机物b环上存在2种氢原子,如图所示:,一氯取代物有2种,故A错误;
B.有机物d为对称结构,存在4种相同环境的氢原子,为标记序号的4个位置:,核磁共振氢谱有4组峰,故B正确;
C.有机物b生成c为过氧化氢与醛基发生加成反应,反应中没有小分子生成不是取代反应,故C错误;
D.羟基可与钠反应生成氢气,只有有机物a、c存在羟基,故D错误;
故答案为B。
3.C
【分析】、、、、五种短周期元素的原子半径依次增大,常温下的单质能与水反应产生无色气体,X只形成1个共价键,则X为F,F2和水反应生成O2,、同族,Y形成2个共价键,W形成6个共价键,Y为O,W为S,Q形成4个共价键,Q为C,Z为N,以此解答。
A.同周期元素从左向右,第一电离能呈增大趋势,但N原子的2p轨道半充满,较稳定,第一电离能比O原子大,所以第一电离能:F>N>O>C,A错误;
B.F、O、S的最简单氢化物分别是HF、H2O、H2S,HF、H2O分子间能够形成氢键,沸点较高,并且H2O分子间形成氢键的数目比HF多,则沸点:H2O>HF>H2S,B错误;
C.N与O、C与O均可形成、型化合物,如NO、NO2、CO、CO2,C正确;
D.该阴离子中S原子形成6个共价键,最外层不满足8电子稳定结构,D错误;
故选C。
4.D
【分析】甲装置中NH3通入CuSO4溶液,生成的蓝色沉淀为Cu(OH)2,后溶解为[Cu(NH3)4]2+,加入乙醇降低的溶解度,析出晶体,乙装置进行尾气处理并防倒吸,据此作答。
A.分子中心N原子含有=1个孤电子对,则中,提供孤电子对的是中的N原子,A正确;
B.氨气极易溶于水,易发生倒吸,仪器a可防止制备过程中发生倒吸现象,倒扣的漏斗与液面相切,液体很难倒吸,因此仪器b也可防止液体倒吸,B正确;
C.在乙醇中的溶解度小于在水中的溶解度,向深蓝色溶液中加入乙醇,深蓝色溶液变浑浊,静置后有深蓝色晶体析出,故C正确;
D.鉴定是晶体还是非晶体需要X射线衍射实验,不能用红外光谱仪鉴定是否为晶体,D错误;
故选:D。
5.D
【分析】镍废渣(主要成分为,还含有和)加入稀硫酸进行酸浸,得到、,不与硫酸反应,微溶,过滤得到滤渣1,滤渣1的主要成分为,向滤液中加入,将氧化为,加入氨水调,和反应生成沉淀和沉淀,滤渣2为和,经过蒸发浓缩、降温结晶、过滤、洗涤,得到,灼烧至恒重,得到镍的氧化物,最后制得纯镍,据此回答。
A.滤渣1的主要成分为,A错误;
B.的化学性质与类似,浓硫酸代替稀硫酸,与浓硫酸会钝化,元素不能回收,B错误;
C.操作X应为蒸发浓缩、降温结晶、过滤、洗涤,C错误;
D.的相对分子质量为281,起始时物质的量为,其中原子守恒,加热至质量不再变化时为氧化物,中,所以,镍、氧的物质的量之比为,故灼烧后对应的氧化物为,D正确;
故选D。
6.A
【详解】A.28gFe物质的量为0.5mol,中Fe由+2价降低为0价,水中有6个H由+1价降低为0价,NaBH4中H的化合价由-1价升至0价,生成转移8mol电子,故生成0.5molFe转移电子数为,A错误;
B.中存在与,为离子键构成的离子化合物,而1个中有4个键,固体中键数为,B正确;
C.分子中,原子采取杂化,原子采取杂化,0.5molB(OH)3中sp3杂化的原子数为1.5NA,C正确;
D.会发生水解,导致亚铁离子浓度减小,溶液中数小于,D正确;
答案选A。
7.C
【详解】A.根据图像可知,温度越高,平衡转化率越小,说明该反应是放热反应,e、b、d三点对应温度逐渐降低,所以平衡常数K:e
C.根据三段式:,由,1-x=3x,x=0.25,的平衡转化率为25%,故C正确;
D.根据图像可知该反应为放热反应,a、b、c三点对应温度逐渐降低,且三点的平衡转化率相同,三个容器体积关系为>>,容器内气体密度,由于三个容器起始均为和,所以总质量相同,但>>,所以a,b,c三点密度关系为a
8.B
【详解】A.生成的苯甲酸钾可溶于水,同时反应中,高锰酸钾与甲苯反应生成的二氧化锰不溶于水,操作1应是过滤操作,所以玻璃棒的作用还有引流作用,A错误;
B.苯甲酸钾加入酸发生取代反应,同时硫酸酸性强于苯甲酸,根据强酸制弱酸原理,可酸化制得苯甲酸,B正确;
C.冷凝回流过程中,为增大接触面积,增强冷凝效果,可以选择球形冷凝管,C错误;
D.苯甲酸微溶于水,但是在热水中,溶解度增大,造成产品损失,应该用冷水洗涤晶体,D错误;
答案选B
9.A
【分析】由题干信息可知,放电过程中碳基材料为负极b,发生的电极反应式为,充电时,b与电源负极相连作阴极,电极反应式为,放电时a极为正极,正极反应式为,充电时,a与电源正极相连作阳极,电极反应式为。
A.放电时,嵌入铝箔电极上,此时锰元素化合价降低,被还原,A项错误;
B.充电时,外电路中转移,得电子由铝箔电极转移到碳基材料上,碳基材料质量增加,B项正确;
C.放电时,b极为负极,其电极反应式为,C项正确;
D.由分析可知,充、放电过程中,依靠钠离子在两极反复脱嵌和嵌入,碳元素和锰元素的化合价发生变化,发生了氧化还原反应,D项正确;
故选A。
10.D
【分析】用0.1mol L-1KOH溶液滴定同浓度的H2A溶液,发生反应H2A+OH-=HA-+H2O,HA-+OH-=A2-+H2O,由图可知,b点为第一滴定终点,此时溶液显酸性,d点为第二滴定终点,此时溶液显碱性,据此作答。
A.根据图示,此滴定实验第二滴定终点溶质为,溶液呈碱性,酚酞的变色范围是,所以可用酚酞作指示剂,A正确;
B.根据图示,时,溶液为4,时,第一步电离平衡常数Ka1==,B正确;
C.由图可知,c点溶液,,根据电荷守恒:,C正确:
D.由a点可知Ka1=,同理由c点可得Ka2=,根据,可知时,溶液,D不正确;
答案选D。
11.(1) (2分)
(2)使转化为,使与其他物质分离(1分)
(3) (2分)
(4)将还原为,便于后续使含物种与含物种分离(2分)
(5)0.8(2分)
(6) (2分)
(7) (2分)(2分)
【分析】阳极泥加入纯碱(碳酸钠)、空气焙烧,然后加入水,浸取过滤得到含Na2TeO3、Na2SeO3滤液a,分离出滤渣,滤渣加入稀硫酸酸浸溶解氧化铜得到含硫酸铜的滤液b,分离出含Au、Pt、Pd的滤渣,加入浓盐酸和氯气氯浸,金属、、被氧化为配离子:、、,加入草酸将还原为金单质、还原为,过滤分离出金单质,滤液加入氯化铵得到含滤液c和沉淀。
(1)PtTe中Pt为+2价,且“氧化焙烧”时,阳极泥中的化合态Pt转化为单质,反应中Pt化合价由+2变为0,空气中氧气参与反应,氧化合价由0变为-2,Te化合价由-2变为+4得到,结合电子守恒、质量守恒,PtTe发生反应的化学方程式为;
(2)稀硫酸能和金属氧化物氧化铜反应,而不和、、反应,故目的为:使转化为,使与其他物质分离;
(3),Pd化合价由0变为+4,为还原剂,氯气中氯化合价由0变为-1,为氧化剂,结合电子守恒存在,氧化剂与还原剂的物质的量之比为2:1;
(4)草酸具有还原性,由分析结合流程,“分金”加入过量草酸的作用,除析出金属Au外,还有将还原为,便于后续使含物种与含物种分离;
(5)反应后混合液中,则此时,结合反应,则初始加入溶液的浓度约为;
(6)“沉铂”总反应为和氯酸根离子发生氧化还原反应生成,反应中Pt化合价由+2变为+4、氯酸根离子中氯化合价由+5变为-1,结合电子守恒、质量守恒,反应为;
(7)由图,d处位于图中红圈处,其在xyz轴的投影坐标分别为、、,坐标为;据“均摊法”,晶胞中含个Se、4个Zn,则晶体密度为。
12.(1)恒压分液漏斗(2分)
(2)C(2分)
(3)防止亚铁离子被氧化,降低二茂铁的产率(2分)
(4) (2分)分子晶体(1分)
(5)测定熔点是否为173℃或测定紫外线光谱是否在325nm和440nm处有极大的吸收值(2分)66.7(2分)
(6) (2分)
【分析】由题意可知,制备二茂铁的实验过程为THF作用下无水氯化铁与铁在氮气氛围中反应制得氯化亚铁,向减压蒸馏出THF的氯化亚铁中加入环戊二烯和二乙胺,继续通入氮气,搅动、蒸出过量的乙二胺,向反应后的溶液中加入石油醚,充分搅拌、趁热过滤,将滤液蒸发得二茂铁粗品,提纯可得精品。
(1)由实验装置图可知,向三颈烧瓶中加液的仪器为恒压滴液漏斗;
(2)由题意可知,三颈烧瓶中加入液体的体积为145mL,由三颈烧瓶装的液体体积不低于容积的三分之一,不高于三分之二可知,实验时使用的三颈烧瓶规格为250mL,故选C;
(3)亚铁离子具有还原性,易被空气中的氧气氧化,所以实验中应持续通入氮气排尽装置中的空气,避免亚铁离子被氧化,降低二茂铁的产率;
(4)环戊二烯负离子中碳原子的杂化方式都为sp2杂化,参与形成大π键的碳原子个数为5、参与形成大π键的电子数为6,大π键可表示为;由题意可知,常温下二茂铁的熔点为173℃、沸点为249℃,高于100℃易升华,能溶于苯、乙醚和石油醚等有机溶剂,不溶于水,所以二茂铁是熔沸点低的分子晶体;
(5)测定晶体的熔点是否为173℃,以及测定紫外线光谱是否在325nm和440nm处有极大的吸收值的方法可以验证所得晶体为二茂铁;27.00g氯化铁的物质的量为≈0.17mol,铁的物质的量为= 0.08mol,则制备氯化亚铁时,铁不足量,完全反应制得氯化亚铁的物质的量为0.24mol,环戊二烯、乙二胺均过量条件下,氯化亚铁完全反应制得二茂铁的质量为29.76g,则二戊铁的产率为×100%≈66.7%,故答案为:测定熔点是否为173℃或测定紫外线光谱是否在325nm和440nm处有极大的吸收值;66.7;
(6)由题意可知,氯化亚铁与环戊二烯和氢氧化钾反应生成二戊铁、氯化钾和水,反应的化学方程式为。
13.(1)对甲基苯酚(或对甲苯酚或4-甲基苯酚) (1分)
(2)4(2分)
(3)酚羟基、酮羰基(1分)
(4) (2分)
(5)++CH3COOH(2分)
(6)14(2分)
(2分)
(7) 2CH3CH2OH+O22CH3CHO+2H2O(2分)加成反应(或还原反应) (1分)
【分析】由流程图可知,A和在浓磷酸存在条件下加热发生取代反应生成B,B与C6H5NO2在AlCl3存在时加热反应生成C,C与HCHO在HCl条件下反应生成D,D与NaCN发生取代反应生成E,根据E、G结构的不同,可知E与F()在碱性条件下发生信息中的反应生成G,G与I2/H2SO4(aq)在DMSC条件下生成H。
(1)根据A分子结构可知:甲基位于酚羟基的对位,所以A物质的名称为对甲基苯酚(或对甲苯酚或4-甲基苯酚);
(2)C分子中的苯环及羰基都可以与H2发生加成反应,则一定条件下,1 mol C最多能与4 mol H2发生加成反应;
(3)根据D物质结构简式可知D物质分子中含氧官能团的名称为酚羟基、酮羰基(或羰基);
(4)根据E、G结构的不同,结构题目已知信息的反应,可知F分子苯环中在Br-对位上连接一个醛基-CHO,其结构简式是:;
(5)根据流程图可知A与在浓磷酸存在条件下加热,发生取代反应,产生B和CH3COOH,该反应的方程式为++CH3COOH;
(6)B分子中除苯环外,含3个碳、2个氧、1个不饱和度,其同分异构体有多种,其中能发生水解反应,说明含有酯基;还能发生银镜反应,说明含有醛基,则分子中含有甲酸的酯基结构。故既能发生水解反应又能发生银镜反应的芳香族化合物有、、、,共有14种不同结构,其中核磁共振氢谱有4组峰,且峰面积比为6∶2∶1∶1的物质的结构简式为。
(7)乙醇与O2在Cu催化下加热,发生氧化反应产生CH3CHO,CH3CHO在碱性条件下发生信息中的反应产生CH3CH=CHCHO,然后该物质与H2在Ni催化下加热,发生还原反应产生CH3CH2CH2CH2OH。
①K→L的化学方程式为:2CH3CH2OH+O22CH3CHO+2H2O;
②M与H2在一定条件下发生加成反应产生N,因此M→N的反应类型是加成反应,物质与氢气的加成反应也属于还原反应,故该反应的类型为加成反应(或还原反应)。
14.(1)< (2分)>(2分)4(2分)
(2)-164.7(2分)反应I为放热反应,温度升高CO2平衡转化率减小;反应Ⅱ为吸热反应,温度升高CO2平衡转化率增大,温度较高时以反应Ⅱ为主,随温度升高CO2平衡转化率增大的幅度大于减小的幅度(2分)生成CO*中间体反应的活化能小,反应速率快;CO*中间体能量低,较稳定,利于生成(或反应放热,利于中间体的生成) (2分)
(3) (2分)N>O>C(1分)
【详解】(1)①是体积增大的反应,℃时,从下到上,二氧化碳平衡转化率升高,平衡正向移动,即减小压强向体积增大的方向移动,因此。当温度为℃、初始压强为时,从a点到平衡点,二氧化碳平衡转化率减小,说明平衡逆向移动,因此a点时的。
②起始时向容器中加入1molCH4和1molCO2,在温度为℃、初始压强为时反应,二氧化碳平衡转化率为50%,列出三段式得:,该反应的平衡常数。
(2)①根据盖斯定律可知,反应的。
②因为反应: ,是放热反应,当温度升高,平衡逆向移动,二氧化碳转化率降低;反应: ,是吸热反应,当温度升高,平衡正向移动,导致二氧化碳转化率增大,当温度升高到移动程度以后,此时反应以反应为主,导致随着温度的升高,反应的二氧化碳转化率增大幅度大于反应的减小幅度。答案为:反应为放热反应,温度升高CO2平衡转化率减小;反应为吸热反应,温度升高CO2平衡转化率增大,温度较高时以反应为主,随温度升高CO2平衡转化率增大的幅度大于减小的幅度。
③从图中可以看出,生成CO*中间体反应的活化能小,反应速率快;CO*中间体能量低,较稳定,利于生成(或反应放热,利于中间体的生成),故CO*是CO2活化的优势中间体。
(3)转化过程中C—N键断裂,CO2中一个C=O键断裂,发生加成反应,形成五元环状化合物的结构简式为。根据同周期第一电离能从左到右呈增大趋势,ⅡA、ⅤA反常,所以第一电离能由大到小的顺序为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
