3.1《水与水溶液》教学课件-(共21张PPT)鲁科版(2019)高中化学选择性必修 1《化学反应原理》
文档属性
| 名称 | 3.1《水与水溶液》教学课件-(共21张PPT)鲁科版(2019)高中化学选择性必修 1《化学反应原理》 |

|
|
| 格式 | pptx | ||
| 文件大小 | 66.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-30 00:00:00 | ||
图片预览








文档简介
(共21张PPT)
第三章
物质在水溶液中的行为
第一节:水和水溶液
第一课时
【任务一】
证明水能否电离?
实
验
探
究
1.向Na2CO3溶液中滴加3滴酚酞试液,观
察现象?
2.电导率实验
资料卡片
电导率能灵敏的表示物质导电的性能。电导率的大小与溶液中的离子浓度大小有关,溶液中离子浓度越大,电导率越大,导电性能越强,反之则越小。
1. 连接电导率仪,打开开关,向小烧杯中加入40ml左右的蒸馏水, 测蒸馏水的电导率,注意示数稳定后读数。
2. 将小烧杯中的蒸馏水加热,观察电导率的变化。
3. 测量氯化钠溶液的电导率,注意示数稳定后读数。
实验完毕,关闭开关装好仪器。
实
验
步
骤
小组
讨论
(2)通过实验现象可以得出哪些结论?
任务一:证明水能否电离
(1)汇报实验现象
结论:
1.水常温下能微弱电离,电离出H+和OH- 。
2.水的电离是一个吸热过程,存在电离平衡。
3.H2O H++ OH-
资料卡片
在水溶液中,H+和OH-都不是单独存在的。例如,1个H+一般与4个水分子结合。为了书写方便,通常仍写成H+和OH-
任务一:证明水能否电离
【任务二】用平衡思想再识水的电离平衡
【问题2-1】影响水的电离平衡的因素有哪些,如何影响的?
【问题2-2】如何定量的描述水的电离程度?写出其电离常数表达式
【问题2-3】温度如何影响KW?
【问题2-1】
影响水的电离平衡的因素有哪些?
概括归纳
升温促进水的电离,加入酸、碱抑制水的电离
任务二:用平衡思想再识水的电离平衡
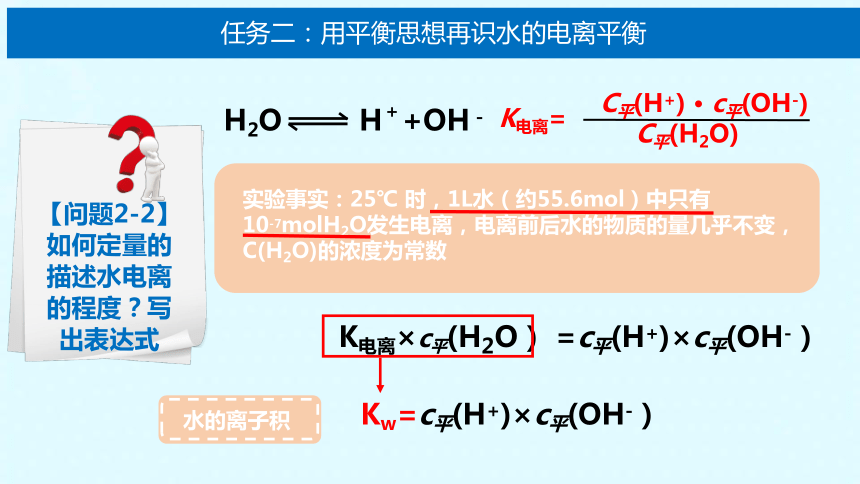
实验事实:25℃ 时,1L水(约55.6mol)中只有
10-7molH2O发生电离,电离前后水的物质的量几乎不变, C(H2O)的浓度为常数
K电离×c平(H2O) =c平(H+)×c平(OH-)
Kw=c平(H+)×c平(OH-)
水的离子积
【问题2-2】
如何定量的描述水电离的程度?写出表达式
H2O H++OH-
K电离=
C平(H+) · c平(OH-)
C平(H2O)
任务二:用平衡思想再识水的电离平衡
t/℃ 0 10 20 25 40 50 90 100
Kw/10-14 0.134 0.292 0.681 1.01 2.92 5.47 38.0 55.0
【问题2-3】温度如何影响KW?
室温下,某盐酸溶液中 c(H+)=0.1mol/L,水电离出的氢氧根浓度是多少?
任务二:用平衡思想再识水的电离平衡
常温(25 ℃)下, Kw =c平(H+) · c平(OH-) =1.0×10-14
(2)KW不仅适合于纯水,也适合于稀的电解质水溶液。Kw=c平(H+)·c平(OH-), c平(H+)和c平(OH-)分别是水溶液中总的H+和 OH-浓度。
【任务三】
探究电解质
在水溶液中的
存在形态
实验探究: 电解质溶液的导电能力一样吗?
实验操作:在五个小水槽中分别加入等体积、等浓度(0.5mol/L)的盐酸、醋酸、氢氧化钠溶液、氨水、氯化钠溶液,连接好仪器并接通电源,观察灯泡的亮度,做好记录。
等体积的溶液 电解质溶液 灯泡亮度 导电能力
0.5mol/L HCl
0.5mol/L CH3COOH
0.5mol/L NaOH
0.5mol/L 氨水
0.5mol/L NaCl
【问题3-1】
浓度相同的五组溶液的灯泡亮度不同的原因是什么?
溶液的导电能力
强弱不同
【问题3-2】
浓度相同的不同电解质的水溶液的导电能力不同,其原因是什么?
溶液中自由移动的阴阳离子浓度大小不同
⑴强电解质:在稀的水溶液里能完全电离的电解质。
包括强酸、强碱、大部分盐
⑵弱电解质:在稀的水溶液里部分电离的电解质。
包括弱酸、弱碱、水、少数盐
任务三:探究电解质在水溶液中的存在形态
【问题3-3】
氯化氢、醋酸它们最终在水溶液中的存在形式如何?
画出HCl、CH3COOH在水溶液中的存在形态
HCl
完全电离
H+
Cl-
存在电离平衡
H+
CH3COO-
CH3COOH
CH3COOH
电离方程式:
任务三:探究电解质在水溶液中的存在形态
电解质溶液中,不论是离子还是分子,都不是单独存在的,而是与水分子相互吸引、相互结合,以“水合离子”或“水合分子”的形态存在
溶剂化作用
溶质分子或离子与溶剂相互吸引的作用
任务三:探究电解质在水溶液中的存在形态
思考讨论
1.室温下,10ml 0.1mol/LHCl(aq)、 10ml 0.1mol/L CH3COOH
(aq)对水的电离平衡的影响程度
2. 室温下,纯水中加入氯化钠对水的电离平衡的有无影响?
你的收获?
回首我们的学习过程
化学平衡移动原理
水的电离
H2O H++OH-
Kw=c(H+)·c(OH-)=1.0×10-14
影响水电离的因素
电解质在水溶液中的存在形式
微弱
25℃时
化学平衡知识应用
模型认知逻辑思维
平衡思想
认识方法
学会学习
只有学会学习,只有这样的理论思维,
才让我们的国家、
我们的民族屹立于科学的最高峰
2.下列关于水的离子积常数的叙述中,正确的是 ( )
A.因为水的离子积常数的表达式是KW=c平(H+)·c平(OH-),
所以KW随着溶液中H+浓度或OH- 浓度的变化而变化
B.水的离子积常数KW与水的电离常数K是同一个物理量
C.水的离子积常数仅仅是温度的函数,随着温度的变化而变化
D.水的离子积常数KW与水的电离常数K是两个没有任何关系的物理量
3.常温下,某溶液中由水电离出的c平(H+)=1.0×10-13 mol·L-1,该
溶液可能是 ( )
A.二氧化硫水溶液 B.氯化钠水溶液
C.硝酸钠水溶液 D.硫酸钠水溶液
4.氨水是实验室中常见的碱之一。
(1)请分析氨水的微粒组成:
(2)下列关于氨水的说法中,不正确的是:
①氨水是碱,其中不含H+
②某瓶氨水的pH=9,说明氨水是弱电解质
③氨水的导电性比NaOH溶液弱
④在室温下的稀氨水中,依然有KW=10-14mol2/L2
第三章
物质在水溶液中的行为
第一节:水和水溶液
第一课时
【任务一】
证明水能否电离?
实
验
探
究
1.向Na2CO3溶液中滴加3滴酚酞试液,观
察现象?
2.电导率实验
资料卡片
电导率能灵敏的表示物质导电的性能。电导率的大小与溶液中的离子浓度大小有关,溶液中离子浓度越大,电导率越大,导电性能越强,反之则越小。
1. 连接电导率仪,打开开关,向小烧杯中加入40ml左右的蒸馏水, 测蒸馏水的电导率,注意示数稳定后读数。
2. 将小烧杯中的蒸馏水加热,观察电导率的变化。
3. 测量氯化钠溶液的电导率,注意示数稳定后读数。
实验完毕,关闭开关装好仪器。
实
验
步
骤
小组
讨论
(2)通过实验现象可以得出哪些结论?
任务一:证明水能否电离
(1)汇报实验现象
结论:
1.水常温下能微弱电离,电离出H+和OH- 。
2.水的电离是一个吸热过程,存在电离平衡。
3.H2O H++ OH-
资料卡片
在水溶液中,H+和OH-都不是单独存在的。例如,1个H+一般与4个水分子结合。为了书写方便,通常仍写成H+和OH-
任务一:证明水能否电离
【任务二】用平衡思想再识水的电离平衡
【问题2-1】影响水的电离平衡的因素有哪些,如何影响的?
【问题2-2】如何定量的描述水的电离程度?写出其电离常数表达式
【问题2-3】温度如何影响KW?
【问题2-1】
影响水的电离平衡的因素有哪些?
概括归纳
升温促进水的电离,加入酸、碱抑制水的电离
任务二:用平衡思想再识水的电离平衡
实验事实:25℃ 时,1L水(约55.6mol)中只有
10-7molH2O发生电离,电离前后水的物质的量几乎不变, C(H2O)的浓度为常数
K电离×c平(H2O) =c平(H+)×c平(OH-)
Kw=c平(H+)×c平(OH-)
水的离子积
【问题2-2】
如何定量的描述水电离的程度?写出表达式
H2O H++OH-
K电离=
C平(H+) · c平(OH-)
C平(H2O)
任务二:用平衡思想再识水的电离平衡
t/℃ 0 10 20 25 40 50 90 100
Kw/10-14 0.134 0.292 0.681 1.01 2.92 5.47 38.0 55.0
【问题2-3】温度如何影响KW?
室温下,某盐酸溶液中 c(H+)=0.1mol/L,水电离出的氢氧根浓度是多少?
任务二:用平衡思想再识水的电离平衡
常温(25 ℃)下, Kw =c平(H+) · c平(OH-) =1.0×10-14
(2)KW不仅适合于纯水,也适合于稀的电解质水溶液。Kw=c平(H+)·c平(OH-), c平(H+)和c平(OH-)分别是水溶液中总的H+和 OH-浓度。
【任务三】
探究电解质
在水溶液中的
存在形态
实验探究: 电解质溶液的导电能力一样吗?
实验操作:在五个小水槽中分别加入等体积、等浓度(0.5mol/L)的盐酸、醋酸、氢氧化钠溶液、氨水、氯化钠溶液,连接好仪器并接通电源,观察灯泡的亮度,做好记录。
等体积的溶液 电解质溶液 灯泡亮度 导电能力
0.5mol/L HCl
0.5mol/L CH3COOH
0.5mol/L NaOH
0.5mol/L 氨水
0.5mol/L NaCl
【问题3-1】
浓度相同的五组溶液的灯泡亮度不同的原因是什么?
溶液的导电能力
强弱不同
【问题3-2】
浓度相同的不同电解质的水溶液的导电能力不同,其原因是什么?
溶液中自由移动的阴阳离子浓度大小不同
⑴强电解质:在稀的水溶液里能完全电离的电解质。
包括强酸、强碱、大部分盐
⑵弱电解质:在稀的水溶液里部分电离的电解质。
包括弱酸、弱碱、水、少数盐
任务三:探究电解质在水溶液中的存在形态
【问题3-3】
氯化氢、醋酸它们最终在水溶液中的存在形式如何?
画出HCl、CH3COOH在水溶液中的存在形态
HCl
完全电离
H+
Cl-
存在电离平衡
H+
CH3COO-
CH3COOH
CH3COOH
电离方程式:
任务三:探究电解质在水溶液中的存在形态
电解质溶液中,不论是离子还是分子,都不是单独存在的,而是与水分子相互吸引、相互结合,以“水合离子”或“水合分子”的形态存在
溶剂化作用
溶质分子或离子与溶剂相互吸引的作用
任务三:探究电解质在水溶液中的存在形态
思考讨论
1.室温下,10ml 0.1mol/LHCl(aq)、 10ml 0.1mol/L CH3COOH
(aq)对水的电离平衡的影响程度
2. 室温下,纯水中加入氯化钠对水的电离平衡的有无影响?
你的收获?
回首我们的学习过程
化学平衡移动原理
水的电离
H2O H++OH-
Kw=c(H+)·c(OH-)=1.0×10-14
影响水电离的因素
电解质在水溶液中的存在形式
微弱
25℃时
化学平衡知识应用
模型认知逻辑思维
平衡思想
认识方法
学会学习
只有学会学习,只有这样的理论思维,
才让我们的国家、
我们的民族屹立于科学的最高峰
2.下列关于水的离子积常数的叙述中,正确的是 ( )
A.因为水的离子积常数的表达式是KW=c平(H+)·c平(OH-),
所以KW随着溶液中H+浓度或OH- 浓度的变化而变化
B.水的离子积常数KW与水的电离常数K是同一个物理量
C.水的离子积常数仅仅是温度的函数,随着温度的变化而变化
D.水的离子积常数KW与水的电离常数K是两个没有任何关系的物理量
3.常温下,某溶液中由水电离出的c平(H+)=1.0×10-13 mol·L-1,该
溶液可能是 ( )
A.二氧化硫水溶液 B.氯化钠水溶液
C.硝酸钠水溶液 D.硫酸钠水溶液
4.氨水是实验室中常见的碱之一。
(1)请分析氨水的微粒组成:
(2)下列关于氨水的说法中,不正确的是:
①氨水是碱,其中不含H+
②某瓶氨水的pH=9,说明氨水是弱电解质
③氨水的导电性比NaOH溶液弱
④在室温下的稀氨水中,依然有KW=10-14mol2/L2
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
