3.1 课时2 烯烃、炔烃的结构及性质 脂肪烃与石油化工 课件 (共29张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3
文档属性
| 名称 | 3.1 课时2 烯烃、炔烃的结构及性质 脂肪烃与石油化工 课件 (共29张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-30 00:00:00 | ||
图片预览






文档简介
(共29张PPT)
烯烃、炔烃的结构及性质
脂肪烃与石油化工
1.认识烯烃、炔烃的结构特征,建立有机物官能团与反应类型关系的思维模型。
2.能从化学键的微观角度理解烯烃、炔烃的化学性质及反应机理,能正确书写相关的化学方程式。
3.从化学角度描述石油化工炼制的基本工艺,从绿色发展视角对石油化工工艺进行评估。
从我们穿的塑料雨衣到用的塑料水杯,从汽车轮胎到建筑用的管材,乙烯的身影贯穿于我们生活的方方面面。它不仅在生活中应用广泛,还是工业生产中的重要原料。乙烯的产量,更是成为衡量一个国家石油化工发展水平的重要标志。
一、烯烃、炔烃及结构特点
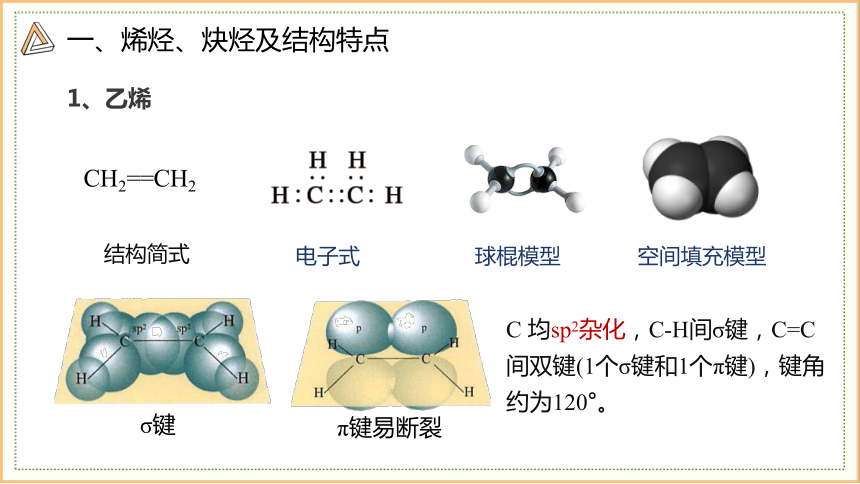
1、乙烯
CH2==CH2
电子式
球棍模型
空间填充模型
结构简式
C 均sp2杂化,C-H间σ键,C=C间双键(1个σ键和1个π键),键角约为120°。
σ键
π键易断裂
一、烯烃、炔烃及结构特点
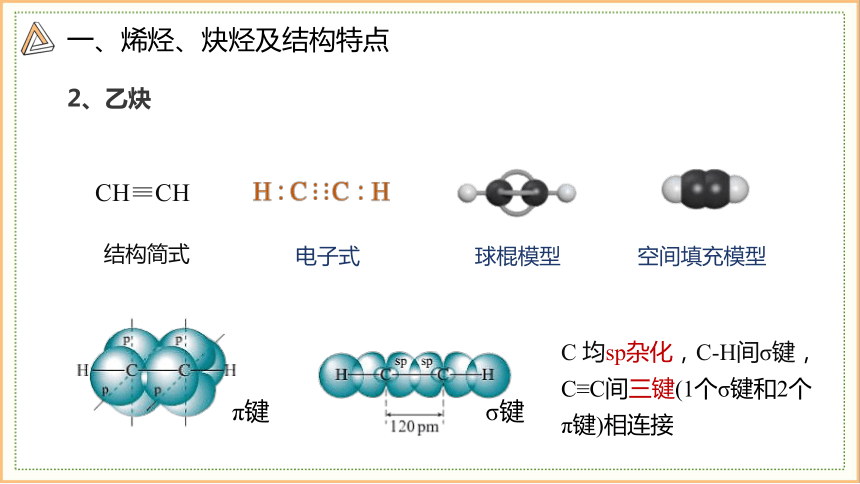
2、乙炔
电子式
球棍模型
空间填充模型
结构简式
CH≡CH
σ键
π键
C 均sp杂化,C-H间σ键,C≡C间三键(1个σ键和2个π键)相连接
二、烯烃、炔烃的物理性质
①乙烯、乙炔是无色、无味的气体,微溶于水,易溶于有机溶剂。
②烯烃、炔烃的物质性质也具有递变性:
随着碳原子数的增加,分子间作用力增大,熔沸点逐渐升高;
③分子式相同的不同烯烃、炔烃,支链越多,熔沸点越低。
三、烯烃、炔烃的化学性质
1、氧化反应
C2H4+3O2 2CO2+2H2O
点燃
甲烷
乙烯
乙炔
O2
4CO2+2H2O
2C2H2+ 5
①燃烧现象为何不同?
一般有机物的燃烧都是不充分的,所以烃类燃烧都会产生黑烟,烃中含碳量越高,被排挤出来的未被燃烧的碳粒也就越多,就形成了“浓烈的黑烟”。
0.75 0.86 0.92
碳元素的
质量分数
三、烯烃、炔烃的化学性质
1、氧化反应
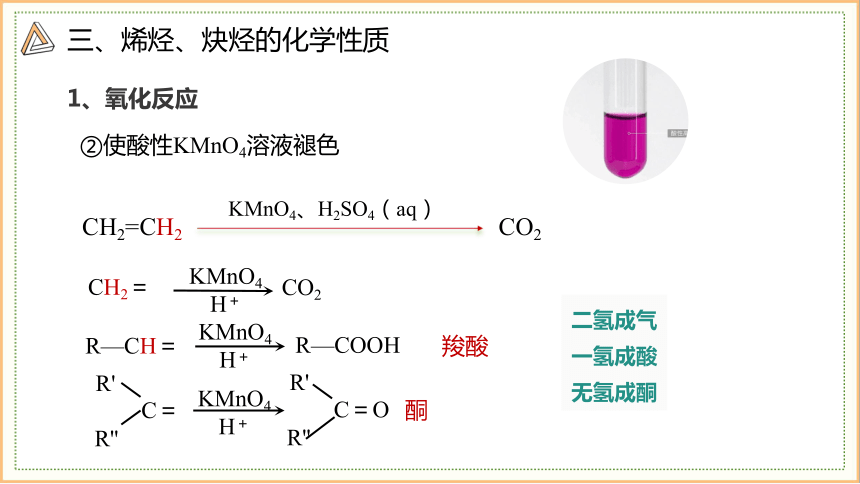
②使酸性KMnO4溶液褪色
CH2=CH2
KMnO4、H2SO4(aq)
CO2
CH2=
CO2
KMnO4
H+
KMnO4
H+
C=O
R'
R''
C=
R'
R''
酮
R—CH=
R—COOH
KMnO4
H+
羧酸
二氢成气
一氢成酸
无氢成酮
三、烯烃、炔烃的化学性质
2、加成反应
①与Br2加成:
CH2=CH2+Br2 CH2BrCH2Br
使溴水褪色
烯烃分子中含有碳碳双键,其中1个键不稳定,炔烃分子中含有碳碳三键,其中2个键易断裂,因此烯烃、炔烃都易发生加成反应。
CH≡CH+Br2―→CHBr==CHBr
CHBr==CHBr+Br2―→Br2CH—CHBr2
碳碳三键发生加成反应时可分步进行,先断裂1个键生成碳碳双键,双键继续发生加成变成碳碳单键。
三、烯烃、炔烃的化学性质
2、加成反应
CH2=CH2 + H2
CH3CH3 (乙烷)
催化剂
②与H2、HX、H2O等加成:
应用
工业上可以将植物油催化氢化,获得固态的人造黄油。
石油加工中对汽油进行加氢处理,可提高汽油的质量。
通过测定被吸收的氢气的物质的量可以计算出所研究的分子中碳碳双键的数目,从而为确定其结构提供依据。
CH3CH2=CH2 + H2
CH3CH2CH3 (丙烷)
催化剂
三、烯烃、炔烃的化学性质
2、加成反应
②与H2、HX、H2O等加成:
CH2=CH2 + H—OH
CH3CH2OH(乙醇)
催化剂
CH2=CH2 + H—Cl
CH3CH2Cl (氯乙烷)
催化剂
乙烯与水的反应也称为乙烯的水化,是工业上制取乙醇的方法之一。烯烃与卤化氢的加成也常用于制备卤代烃。
三、烯烃、炔烃的化学性质
2、加成反应
催化剂
CH3-CH=CH2+HBr CH3CHCH3
Br
1 2 3
CH3-CH=CH2+HBr CH2CH2CH3
催化剂
Br
1 2 3
2-溴丙烷
1-溴丙烷
通常情况下,丙烯与溴化氢反应,主要得到2-溴丙烷。
当不对称烯烃与卤化氢发生加成反应时,通常“氢加到含氢多的不饱和碳原子一侧”,即遵循马尔可夫尼可夫规则(简称马氏规则)
氢上加氢
③共轭二烯烃及其加成反应
共轭二烯烃: 分子中有两个碳碳双键且两个双键只相隔一个单键的烯烃
1,3-丁二烯
1,3-戊二烯
CH2 CH CH CH2
CH2 CH CH CH CH3
三、烯烃、炔烃的化学性质
2、加成反应
+ Cl2
1,2-加成
1,3-丁二烯的1,2-加成和1,4-加成是竞争反应,到底哪一种加成占优势,取决于反应条件。
CH2 CH CH CH2
1 2 3 4
CH2 CH CH CH2
Cl
Cl
+ Cl2
1,4-加成
CH2 CH CH CH2
1 2 3 4
CH2 CH CH CH2
Cl
Cl
1 2 3 4
1 2 3 4
1,3-丁二烯和氯气1:1发生加成反应
1,2-加成
1,4-加成
三、烯烃、炔烃的化学性质
三、烯烃、炔烃的化学性质
1,3-丁二烯和足量的氯气发生加成反应
+ 2 Cl2
1,2,3,4-四氯丁烷
CH2 CH CH CH2
Cl
Cl
Cl
Cl
CH2 CH CH CH2
乙炔与氯化氢在催化剂的条件下发生加成反应,可生成氯乙烯,这是最早生产氯乙烯的方法。氯乙烯分子间发生加聚反应得到聚氯乙烯,简称PVC,PVC曾是世界上产量最大的通用塑料。
三、烯烃、炔烃的化学性质
3、加聚反应
具有不饱和键的有机化合物通过加聚反应得到高分子化合物的反应。
聚丙烯
一定条件
CH3
CH
CH2
n
CH CH2
n
CH3
nCH2=CH2
催化剂
-CH2-CH2-
[
]
n
聚乙烯
注意:聚乙烯、聚丙烯均是混合物。
nCH2=CH2
一定条件
单体
能合成
高分子化合物的小分子物质
链节
高分子
化合物中不断重复的基本结构单元
聚合度
高分子化合物中链节的数目
三、烯烃、炔烃的化学性质
3、加聚反应
写出下列加聚产物的单体
CH3CH==CHCH3
CH2==CH2
CH3CH==CH2
写出下列加聚产物的单体
链节中含多个碳原子的单体的判断方法-一边赶法
去掉[ ]和n,将链节中的一个键从左向右折叠,单变双,双变单,遇到碳超过4价,则断开。
―→
―→CH2==CF2和CF2==CF—CF3。
家用液化气的主要成分为丙烷、丙烯、丁烷和丁烯。下列说法不正确的是( )
A.可用溴水来鉴别丙烷与丙烯
B.丙烯和丁烯均能发生加成反应
C.丁烷中所有碳原子不可能处于同一直线上
D.丙烷的二氯代物有3种
D
四、脂肪烃与石油化工
脂肪烃与现代人类生活的关系非常密切。人类使用的能源中,脂肪烃提供了60%以上,因此,脂肪烃被认为是现代“能源经济”的推进剂。此外,脂肪烃还是最重要的有机化工基础原料。
人类使用石油和天然气的主要目的是获得能源和化工原料。石油是一种黄绿色至黑褐色的黏稠液体,主要是由气态烃、液态烃和固态烃组成的混合物,其中还含有少量不属于烃的物质。
四、脂肪烃与石油化工
注意:
各馏分均为混合物。
1、石油的分馏
根据沸点不同,通过加热汽化,然后冷凝,把石油分成不同沸点范围内的产物。
分类:
常压分馏、减压分馏
四、脂肪烃与石油化工
2、石油的裂化
①原理:由重油获得轻质油,解决石油分馏所得汽油、煤油和柴油等轻质油产量低的问题,该过程称为裂化。
使用催化剂的裂化称为催化裂化,不使用催化剂的裂化称为热裂化。
②目的:为了提高石油分馏产品中低沸点的汽油等轻质油的产量和质量。
C16H34
催化剂
加热、 加压
C8H18
辛烷
+ C8H16
辛烯
裂化汽油中含有不饱和烃
四、脂肪烃与石油化工
3、石油的裂解-深度裂化
①原理:以比裂化更高的温度使石油分馏产物(包括石油气)中的长链烃断裂为乙烯、丙烯等气态短链烃。
②目的:获得乙烯、丙烯等气态短链烃,为石油化工提供原料。
C4H8
2C2H4
催化剂
加热、 加压
C8H18
C4H10 + C4H8
催化剂
加热、 加压
C4H10
C2H4 + C2H6
催化剂
加热、 加压
1.下列说法不正确的是( )
A.石油有固定的沸点,所以可以进行分馏
B.将含有碳原子数较多的烃经过裂化可以得到汽油
C.石油的分馏所得的各馏分是混合物
D.石油裂化的目的是提高汽油等轻质燃料的产量和质量
A
2.下列说法正确的是( )
A.所有的烷烃在光照条件下都能与氯气发生取代反应
B.丙烯分子中所有的原子一定处于同一平面内
C.分子式为C4H8的烃一定能使酸性KMnO4溶液褪色
D.丁烯在一定条件下只能发生加成反应不能发生取代反应
A
3.某高聚物可表示为
下列有关其叙述不正确的是( )
A.该高聚物是通过加聚反应生成的
B.合成该高聚物的单体有3种
C.1 mol该物质能与1 mol H2加成, 生成不含的物质
D.该高聚物能被酸性KMnO4溶液氧化
C
烯烃、炔烃的结构及性质
脂肪烃与石油化工
1.认识烯烃、炔烃的结构特征,建立有机物官能团与反应类型关系的思维模型。
2.能从化学键的微观角度理解烯烃、炔烃的化学性质及反应机理,能正确书写相关的化学方程式。
3.从化学角度描述石油化工炼制的基本工艺,从绿色发展视角对石油化工工艺进行评估。
从我们穿的塑料雨衣到用的塑料水杯,从汽车轮胎到建筑用的管材,乙烯的身影贯穿于我们生活的方方面面。它不仅在生活中应用广泛,还是工业生产中的重要原料。乙烯的产量,更是成为衡量一个国家石油化工发展水平的重要标志。
一、烯烃、炔烃及结构特点
1、乙烯
CH2==CH2
电子式
球棍模型
空间填充模型
结构简式
C 均sp2杂化,C-H间σ键,C=C间双键(1个σ键和1个π键),键角约为120°。
σ键
π键易断裂
一、烯烃、炔烃及结构特点
2、乙炔
电子式
球棍模型
空间填充模型
结构简式
CH≡CH
σ键
π键
C 均sp杂化,C-H间σ键,C≡C间三键(1个σ键和2个π键)相连接
二、烯烃、炔烃的物理性质
①乙烯、乙炔是无色、无味的气体,微溶于水,易溶于有机溶剂。
②烯烃、炔烃的物质性质也具有递变性:
随着碳原子数的增加,分子间作用力增大,熔沸点逐渐升高;
③分子式相同的不同烯烃、炔烃,支链越多,熔沸点越低。
三、烯烃、炔烃的化学性质
1、氧化反应
C2H4+3O2 2CO2+2H2O
点燃
甲烷
乙烯
乙炔
O2
4CO2+2H2O
2C2H2+ 5
①燃烧现象为何不同?
一般有机物的燃烧都是不充分的,所以烃类燃烧都会产生黑烟,烃中含碳量越高,被排挤出来的未被燃烧的碳粒也就越多,就形成了“浓烈的黑烟”。
0.75 0.86 0.92
碳元素的
质量分数
三、烯烃、炔烃的化学性质
1、氧化反应
②使酸性KMnO4溶液褪色
CH2=CH2
KMnO4、H2SO4(aq)
CO2
CH2=
CO2
KMnO4
H+
KMnO4
H+
C=O
R'
R''
C=
R'
R''
酮
R—CH=
R—COOH
KMnO4
H+
羧酸
二氢成气
一氢成酸
无氢成酮
三、烯烃、炔烃的化学性质
2、加成反应
①与Br2加成:
CH2=CH2+Br2 CH2BrCH2Br
使溴水褪色
烯烃分子中含有碳碳双键,其中1个键不稳定,炔烃分子中含有碳碳三键,其中2个键易断裂,因此烯烃、炔烃都易发生加成反应。
CH≡CH+Br2―→CHBr==CHBr
CHBr==CHBr+Br2―→Br2CH—CHBr2
碳碳三键发生加成反应时可分步进行,先断裂1个键生成碳碳双键,双键继续发生加成变成碳碳单键。
三、烯烃、炔烃的化学性质
2、加成反应
CH2=CH2 + H2
CH3CH3 (乙烷)
催化剂
②与H2、HX、H2O等加成:
应用
工业上可以将植物油催化氢化,获得固态的人造黄油。
石油加工中对汽油进行加氢处理,可提高汽油的质量。
通过测定被吸收的氢气的物质的量可以计算出所研究的分子中碳碳双键的数目,从而为确定其结构提供依据。
CH3CH2=CH2 + H2
CH3CH2CH3 (丙烷)
催化剂
三、烯烃、炔烃的化学性质
2、加成反应
②与H2、HX、H2O等加成:
CH2=CH2 + H—OH
CH3CH2OH(乙醇)
催化剂
CH2=CH2 + H—Cl
CH3CH2Cl (氯乙烷)
催化剂
乙烯与水的反应也称为乙烯的水化,是工业上制取乙醇的方法之一。烯烃与卤化氢的加成也常用于制备卤代烃。
三、烯烃、炔烃的化学性质
2、加成反应
催化剂
CH3-CH=CH2+HBr CH3CHCH3
Br
1 2 3
CH3-CH=CH2+HBr CH2CH2CH3
催化剂
Br
1 2 3
2-溴丙烷
1-溴丙烷
通常情况下,丙烯与溴化氢反应,主要得到2-溴丙烷。
当不对称烯烃与卤化氢发生加成反应时,通常“氢加到含氢多的不饱和碳原子一侧”,即遵循马尔可夫尼可夫规则(简称马氏规则)
氢上加氢
③共轭二烯烃及其加成反应
共轭二烯烃: 分子中有两个碳碳双键且两个双键只相隔一个单键的烯烃
1,3-丁二烯
1,3-戊二烯
CH2 CH CH CH2
CH2 CH CH CH CH3
三、烯烃、炔烃的化学性质
2、加成反应
+ Cl2
1,2-加成
1,3-丁二烯的1,2-加成和1,4-加成是竞争反应,到底哪一种加成占优势,取决于反应条件。
CH2 CH CH CH2
1 2 3 4
CH2 CH CH CH2
Cl
Cl
+ Cl2
1,4-加成
CH2 CH CH CH2
1 2 3 4
CH2 CH CH CH2
Cl
Cl
1 2 3 4
1 2 3 4
1,3-丁二烯和氯气1:1发生加成反应
1,2-加成
1,4-加成
三、烯烃、炔烃的化学性质
三、烯烃、炔烃的化学性质
1,3-丁二烯和足量的氯气发生加成反应
+ 2 Cl2
1,2,3,4-四氯丁烷
CH2 CH CH CH2
Cl
Cl
Cl
Cl
CH2 CH CH CH2
乙炔与氯化氢在催化剂的条件下发生加成反应,可生成氯乙烯,这是最早生产氯乙烯的方法。氯乙烯分子间发生加聚反应得到聚氯乙烯,简称PVC,PVC曾是世界上产量最大的通用塑料。
三、烯烃、炔烃的化学性质
3、加聚反应
具有不饱和键的有机化合物通过加聚反应得到高分子化合物的反应。
聚丙烯
一定条件
CH3
CH
CH2
n
CH CH2
n
CH3
nCH2=CH2
催化剂
-CH2-CH2-
[
]
n
聚乙烯
注意:聚乙烯、聚丙烯均是混合物。
nCH2=CH2
一定条件
单体
能合成
高分子化合物的小分子物质
链节
高分子
化合物中不断重复的基本结构单元
聚合度
高分子化合物中链节的数目
三、烯烃、炔烃的化学性质
3、加聚反应
写出下列加聚产物的单体
CH3CH==CHCH3
CH2==CH2
CH3CH==CH2
写出下列加聚产物的单体
链节中含多个碳原子的单体的判断方法-一边赶法
去掉[ ]和n,将链节中的一个键从左向右折叠,单变双,双变单,遇到碳超过4价,则断开。
―→
―→CH2==CF2和CF2==CF—CF3。
家用液化气的主要成分为丙烷、丙烯、丁烷和丁烯。下列说法不正确的是( )
A.可用溴水来鉴别丙烷与丙烯
B.丙烯和丁烯均能发生加成反应
C.丁烷中所有碳原子不可能处于同一直线上
D.丙烷的二氯代物有3种
D
四、脂肪烃与石油化工
脂肪烃与现代人类生活的关系非常密切。人类使用的能源中,脂肪烃提供了60%以上,因此,脂肪烃被认为是现代“能源经济”的推进剂。此外,脂肪烃还是最重要的有机化工基础原料。
人类使用石油和天然气的主要目的是获得能源和化工原料。石油是一种黄绿色至黑褐色的黏稠液体,主要是由气态烃、液态烃和固态烃组成的混合物,其中还含有少量不属于烃的物质。
四、脂肪烃与石油化工
注意:
各馏分均为混合物。
1、石油的分馏
根据沸点不同,通过加热汽化,然后冷凝,把石油分成不同沸点范围内的产物。
分类:
常压分馏、减压分馏
四、脂肪烃与石油化工
2、石油的裂化
①原理:由重油获得轻质油,解决石油分馏所得汽油、煤油和柴油等轻质油产量低的问题,该过程称为裂化。
使用催化剂的裂化称为催化裂化,不使用催化剂的裂化称为热裂化。
②目的:为了提高石油分馏产品中低沸点的汽油等轻质油的产量和质量。
C16H34
催化剂
加热、 加压
C8H18
辛烷
+ C8H16
辛烯
裂化汽油中含有不饱和烃
四、脂肪烃与石油化工
3、石油的裂解-深度裂化
①原理:以比裂化更高的温度使石油分馏产物(包括石油气)中的长链烃断裂为乙烯、丙烯等气态短链烃。
②目的:获得乙烯、丙烯等气态短链烃,为石油化工提供原料。
C4H8
2C2H4
催化剂
加热、 加压
C8H18
C4H10 + C4H8
催化剂
加热、 加压
C4H10
C2H4 + C2H6
催化剂
加热、 加压
1.下列说法不正确的是( )
A.石油有固定的沸点,所以可以进行分馏
B.将含有碳原子数较多的烃经过裂化可以得到汽油
C.石油的分馏所得的各馏分是混合物
D.石油裂化的目的是提高汽油等轻质燃料的产量和质量
A
2.下列说法正确的是( )
A.所有的烷烃在光照条件下都能与氯气发生取代反应
B.丙烯分子中所有的原子一定处于同一平面内
C.分子式为C4H8的烃一定能使酸性KMnO4溶液褪色
D.丁烯在一定条件下只能发生加成反应不能发生取代反应
A
3.某高聚物可表示为
下列有关其叙述不正确的是( )
A.该高聚物是通过加聚反应生成的
B.合成该高聚物的单体有3种
C.1 mol该物质能与1 mol H2加成, 生成不含的物质
D.该高聚物能被酸性KMnO4溶液氧化
C
