1.1 课时1 有机化学的发展与应用、有机化合物的分离、提纯 课件 (共29张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3
文档属性
| 名称 | 1.1 课时1 有机化学的发展与应用、有机化合物的分离、提纯 课件 (共29张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 67.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-30 23:17:06 | ||
图片预览








文档简介
(共29张PPT)
有机化合物的
分离、提纯
1.了解有机化学发展的过程和趋势,认识有机化合物对提高人类生活质量的重要意义,能举例说明有机化合物与生命活动的密切关系。
2.对和有机化学相关的问题能作出科学的判断和评价。
3.通过对蒸馏法、萃取法的实验原理和基本操作的学习,认识科学探究过程的步骤,学会设计科学探究方案。
4.认识分离和提纯有机化合物的常见方法,能根据有机化合物性质的差异选择有机化合物分离、提纯的正确方法。
19世纪初,瑞典化学家贝采里乌斯首先提出“有机化学”和“有机化合物”这两个概念。他极有创意地用“有机”这个词表示来自动植物体的化合物,但他也错误地认为有机化合物得自天成,人类只能提取而不能合成。
一、有机化学的发展
1828年,贝采里乌斯的学生维勒首次在实验室里用无机物合成了尿素[CO(NH2)2]这种有机化合物。
NH4CNO(氰酸铵)
NH2–C–NH2(尿素)
O
△
此后,其他化学家又以无机物为原料合成了醋酸、苹果酸、甲烷、乙炔等有机化合物,使人们彻底抛弃了“生命力论”。维勒的出色工作为有机化学成为一门独立的分支科学奠定了重要基础。
一、有机化学的发展
迄今为止,人类发现和合成的有机化合物已超过1亿种。从1995年开始,每年新发现和新合成的有机化合物超过100万种。
一、有机化学的发展
一、有机化学的发展
随着有机化学的发展,人类对DNA双螺旋结构和功能的认识不断深入,人类对自身的认知越来越清晰,运用基因工程技术治疗疾病已经不再是梦想,基因技术的发展将会对人类的未来产生更直接、更深远的影响。
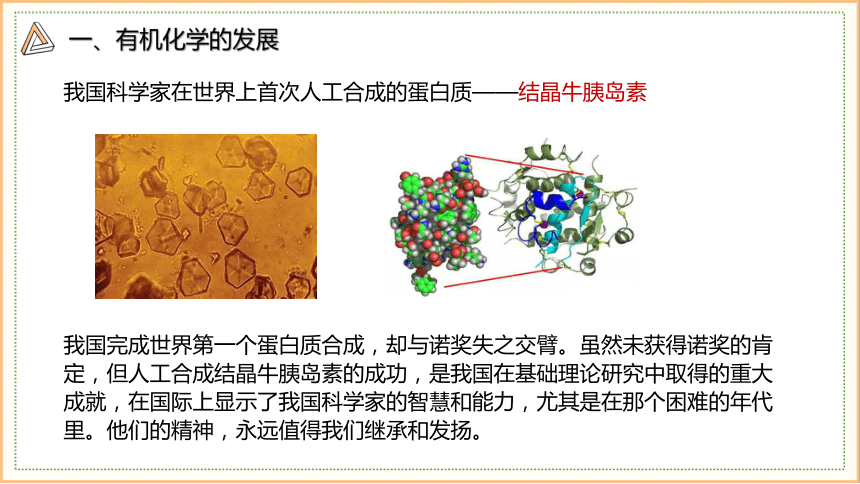
我国科学家在世界上首次人工合成的蛋白质——结晶牛胰岛素
我国完成世界第一个蛋白质合成,却与诺奖失之交臂。虽然未获得诺奖的肯定,但人工合成结晶牛胰岛素的成功,是我国在基础理论研究中取得的重大成就,在国际上显示了我国科学家的智慧和能力,尤其是在那个困难的年代里。他们的精神,永远值得我们继承和发扬。
一、有机化学的发展
一、有机化学的发展
材料科学是一门新兴的交叉学科,是发展众多高科技领域的基础和先导,具有独特物理、化学性质的有机功能材料对人类生产、生活产生了直接而深远的影响。
电视、电脑显示屏由液晶材料制作
耐高温、高强度的碳纤维用于航天服的制作
人工心脏中含有甲基硅橡胶、聚氨酯等多种有机功能材料。
二、有机化合物在生产生活中的应用
环境科学是在人们亟待解决环境问题的社会需求下迅速发展起来的,有机化学为研究和改善环境质量作出了积极贡献。
甲醇汽油、乙醇汽油等含氧燃料的开发和应用在一定程度上应对了石油资源短缺的问题,并且含氧燃料燃烧更加完全,减少了对环境的污染。
二、有机化合物在生产生活中的应用
植物中的纤维素和木质素(非纤维素,一种含有苯环结构的芳香族化合物)结合在一起,在分离出的木质素中加入适量的固化剂后喷洒在沙丘表面,可有效固定表面沙粒和土壤水分,提高沙漠植树的成活率。
二、有机化合物在生产生活中的应用
1.有机化学的发展经历了漫长的过程,21世纪的今天,有机化学已经渗透到我们生活的每个角落和生产、国防及科研的各个领域。下列研究范畴是有机化学学科研究领域的是( )
A.研制攻克癌症的合成药物
B.研制纳米碳管的性质及其应用
C.研制汽车尾气处理系统的开发利用
D.研究探月卫星的运行轨迹
A
三、有机化合物的分离、提纯
主要步骤
分离、提纯有机化合物
研究有机化合物的一般过程
研究有机化合物的组成、结构、性质和应用
对有机化合物分子进行设计和合成。
基本原理都是利用被提纯物与杂质性质的差异达到分离的目的
三、有机化合物的分离、提纯
物理方法:
化学方法:
一般是加入或通过某种试剂进行化学反应
利用有机物与杂质物理性质差异进行分离
原则:
①不增、不减、易分离、易复原
②方法简便易行
③途径最佳(步骤少、转化率高、无副产物等)
有机物分离的常用物理方法
重结晶
萃取
分液
蒸馏
三、有机化合物的分离、提纯
重结晶
概念:将混合物中第一次结晶得到的晶体溶于一定量的溶剂中,再进行蒸发(或冷却)、结晶、过滤,如此的多次操作称为重结晶。
除杂原理:利用被提纯物质与杂质在同一溶剂中的溶解度不同,或在同一溶剂中不同的温度时的溶解度不同,而将杂质除去。
三、有机化合物的分离、提纯
1-选择适当的溶剂
2-溶解固体或加热溶液制得饱和溶液
3-除去杂质,常用热过滤
4-晶体析出
常用冷却结晶
5-晶体的收集与洗涤,抽滤能加快过滤速度,用少量干净的溶剂洗涤
6-干燥晶体:常用的干燥方法有晾干、干燥器干燥、恒温减压干燥等
重结晶法除去杂质“六”步法
三、有机化合物的分离、提纯
三、有机化合物的分离、提纯
称量
加热溶解
趁热过滤
冷却结晶
过滤洗涤、
干燥、称量
为了减少趁热过滤过程中损失的苯甲酸
实验操作中多次使用了玻璃棒,分别起到了哪些作用?
加热溶解——搅拌,加速苯甲酸溶解;
趁热过滤——引流;
冷却结晶后过滤——引流
三、有机化合物的分离、提纯
思考:选择溶剂的条件
被提纯的有机物在此溶剂中的溶解度,受温度的影响较大
杂质在此溶剂中溶解度很小或很大
溶解粗苯甲酸时加热的作用是什么?
如何检验提纯后的苯甲酸中氯化钠已被除净?
增大苯甲酸在水中的溶解度
取最后一次洗涤液少许与试管中,加入硝酸银溶液后,无明显现象,说明氯化钠已经除净。
结晶与重结晶的比较
项目 结晶 重结晶
不同点 含义 物质从溶液中以晶体形式析出的过程 将晶体溶于溶剂,使之重新从溶液中结晶析出的过程
相关操作 先蒸发,然后结晶 先溶解,然后结晶
目的 获得结晶体 使不纯净的物质纯化,或使混合在一起的物质彼此分离
相同点 操作方法相同,需要的仪器相同,均需要加热,都需要过滤 三、有机化合物的分离、提纯
萃取 分液
萃取剂的选择条件
c. 溶质在萃取剂中的溶解度比在原溶剂中的大得多
a. 萃取剂和原溶剂互不相溶
利用有机物在两种互不相溶且密度不同的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂中。
原理:
b. 萃取剂和原溶剂、溶质均不发生化学反应
液-液萃取:
固-液萃取:
用有机溶剂从固体物质中溶解出有机物的过程。
01
02
检漏
装液
振荡(注意放气)
静置分层
分液
萃取步骤 【例】用CCl4从碘水中提取I2
三、有机化合物的分离、提纯
蒸馏
适用范围
有机物热稳定性较高, 与杂质的沸点相差较大
原理
利用沸点差异
蒸馏装置
(一般相差30℃以上)
1
2
3
注意二者的区别
蒸馏时用直形冷凝管
三、有机化合物的分离、提纯
蒸馏
三、有机化合物的分离、提纯
注意事项
a.加热时应垫石棉网
b.烧瓶中放少量沸石或碎瓷片(防止暴沸)
c.烧瓶中所盛放液体不能超过2/3
d.温度计水银球的部位(蒸馏烧瓶支管处)
e.进出水方向(下进上出)
f.用锥形瓶收集馏分
5
物质的性质与分离、提纯方法的选择
根据物质在不同溶剂中溶解度的差异,用萃取的方法把溶质从溶解度小的溶剂中转移到溶解度较大的溶剂中。
根据物质的溶解度差异,可选用结晶、过滤的方法将混合物分离。
根据物质的沸点差异,可选用蒸馏的方法将互溶性液体混合物分离。
根据混合物中各组分的性质不同,可采用加热、调节pH、
加适当的试剂等方法,使某种成分转化,再用物理方法分离而除去。
下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 目的 分离方法 原理
A 分离溶于水的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去苯甲酸固体中混杂的NaCl 重结晶 苯甲酸在水中的溶解度很小
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
D
为提纯下列物质(括号内为杂质),所用除杂试剂和分离方法都正确的是
A.乙酸乙酯(乙酸) 饱和Na2CO3溶液 过滤
B.苯(Br2) NaOH溶液 过滤
C.硝基苯(NO2) NaOH溶液 萃取
D.乙醇(H2O) 新制生石灰 蒸馏
D
为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
选项 不纯物 除杂试剂 分离方法
A CH4(C2H4) 酸性KMnO4溶液 洗气
B 溴苯(Br2) NaOH溶液 分液
C C2H5OH(H2O) 新制生石灰 重结晶
D 乙酸乙酯(乙酸) 饱和Na2CO3溶液 蒸馏
B
有机化合物的
分离、提纯
1.了解有机化学发展的过程和趋势,认识有机化合物对提高人类生活质量的重要意义,能举例说明有机化合物与生命活动的密切关系。
2.对和有机化学相关的问题能作出科学的判断和评价。
3.通过对蒸馏法、萃取法的实验原理和基本操作的学习,认识科学探究过程的步骤,学会设计科学探究方案。
4.认识分离和提纯有机化合物的常见方法,能根据有机化合物性质的差异选择有机化合物分离、提纯的正确方法。
19世纪初,瑞典化学家贝采里乌斯首先提出“有机化学”和“有机化合物”这两个概念。他极有创意地用“有机”这个词表示来自动植物体的化合物,但他也错误地认为有机化合物得自天成,人类只能提取而不能合成。
一、有机化学的发展
1828年,贝采里乌斯的学生维勒首次在实验室里用无机物合成了尿素[CO(NH2)2]这种有机化合物。
NH4CNO(氰酸铵)
NH2–C–NH2(尿素)
O
△
此后,其他化学家又以无机物为原料合成了醋酸、苹果酸、甲烷、乙炔等有机化合物,使人们彻底抛弃了“生命力论”。维勒的出色工作为有机化学成为一门独立的分支科学奠定了重要基础。
一、有机化学的发展
迄今为止,人类发现和合成的有机化合物已超过1亿种。从1995年开始,每年新发现和新合成的有机化合物超过100万种。
一、有机化学的发展
一、有机化学的发展
随着有机化学的发展,人类对DNA双螺旋结构和功能的认识不断深入,人类对自身的认知越来越清晰,运用基因工程技术治疗疾病已经不再是梦想,基因技术的发展将会对人类的未来产生更直接、更深远的影响。
我国科学家在世界上首次人工合成的蛋白质——结晶牛胰岛素
我国完成世界第一个蛋白质合成,却与诺奖失之交臂。虽然未获得诺奖的肯定,但人工合成结晶牛胰岛素的成功,是我国在基础理论研究中取得的重大成就,在国际上显示了我国科学家的智慧和能力,尤其是在那个困难的年代里。他们的精神,永远值得我们继承和发扬。
一、有机化学的发展
一、有机化学的发展
材料科学是一门新兴的交叉学科,是发展众多高科技领域的基础和先导,具有独特物理、化学性质的有机功能材料对人类生产、生活产生了直接而深远的影响。
电视、电脑显示屏由液晶材料制作
耐高温、高强度的碳纤维用于航天服的制作
人工心脏中含有甲基硅橡胶、聚氨酯等多种有机功能材料。
二、有机化合物在生产生活中的应用
环境科学是在人们亟待解决环境问题的社会需求下迅速发展起来的,有机化学为研究和改善环境质量作出了积极贡献。
甲醇汽油、乙醇汽油等含氧燃料的开发和应用在一定程度上应对了石油资源短缺的问题,并且含氧燃料燃烧更加完全,减少了对环境的污染。
二、有机化合物在生产生活中的应用
植物中的纤维素和木质素(非纤维素,一种含有苯环结构的芳香族化合物)结合在一起,在分离出的木质素中加入适量的固化剂后喷洒在沙丘表面,可有效固定表面沙粒和土壤水分,提高沙漠植树的成活率。
二、有机化合物在生产生活中的应用
1.有机化学的发展经历了漫长的过程,21世纪的今天,有机化学已经渗透到我们生活的每个角落和生产、国防及科研的各个领域。下列研究范畴是有机化学学科研究领域的是( )
A.研制攻克癌症的合成药物
B.研制纳米碳管的性质及其应用
C.研制汽车尾气处理系统的开发利用
D.研究探月卫星的运行轨迹
A
三、有机化合物的分离、提纯
主要步骤
分离、提纯有机化合物
研究有机化合物的一般过程
研究有机化合物的组成、结构、性质和应用
对有机化合物分子进行设计和合成。
基本原理都是利用被提纯物与杂质性质的差异达到分离的目的
三、有机化合物的分离、提纯
物理方法:
化学方法:
一般是加入或通过某种试剂进行化学反应
利用有机物与杂质物理性质差异进行分离
原则:
①不增、不减、易分离、易复原
②方法简便易行
③途径最佳(步骤少、转化率高、无副产物等)
有机物分离的常用物理方法
重结晶
萃取
分液
蒸馏
三、有机化合物的分离、提纯
重结晶
概念:将混合物中第一次结晶得到的晶体溶于一定量的溶剂中,再进行蒸发(或冷却)、结晶、过滤,如此的多次操作称为重结晶。
除杂原理:利用被提纯物质与杂质在同一溶剂中的溶解度不同,或在同一溶剂中不同的温度时的溶解度不同,而将杂质除去。
三、有机化合物的分离、提纯
1-选择适当的溶剂
2-溶解固体或加热溶液制得饱和溶液
3-除去杂质,常用热过滤
4-晶体析出
常用冷却结晶
5-晶体的收集与洗涤,抽滤能加快过滤速度,用少量干净的溶剂洗涤
6-干燥晶体:常用的干燥方法有晾干、干燥器干燥、恒温减压干燥等
重结晶法除去杂质“六”步法
三、有机化合物的分离、提纯
三、有机化合物的分离、提纯
称量
加热溶解
趁热过滤
冷却结晶
过滤洗涤、
干燥、称量
为了减少趁热过滤过程中损失的苯甲酸
实验操作中多次使用了玻璃棒,分别起到了哪些作用?
加热溶解——搅拌,加速苯甲酸溶解;
趁热过滤——引流;
冷却结晶后过滤——引流
三、有机化合物的分离、提纯
思考:选择溶剂的条件
被提纯的有机物在此溶剂中的溶解度,受温度的影响较大
杂质在此溶剂中溶解度很小或很大
溶解粗苯甲酸时加热的作用是什么?
如何检验提纯后的苯甲酸中氯化钠已被除净?
增大苯甲酸在水中的溶解度
取最后一次洗涤液少许与试管中,加入硝酸银溶液后,无明显现象,说明氯化钠已经除净。
结晶与重结晶的比较
项目 结晶 重结晶
不同点 含义 物质从溶液中以晶体形式析出的过程 将晶体溶于溶剂,使之重新从溶液中结晶析出的过程
相关操作 先蒸发,然后结晶 先溶解,然后结晶
目的 获得结晶体 使不纯净的物质纯化,或使混合在一起的物质彼此分离
相同点 操作方法相同,需要的仪器相同,均需要加热,都需要过滤 三、有机化合物的分离、提纯
萃取 分液
萃取剂的选择条件
c. 溶质在萃取剂中的溶解度比在原溶剂中的大得多
a. 萃取剂和原溶剂互不相溶
利用有机物在两种互不相溶且密度不同的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂中。
原理:
b. 萃取剂和原溶剂、溶质均不发生化学反应
液-液萃取:
固-液萃取:
用有机溶剂从固体物质中溶解出有机物的过程。
01
02
检漏
装液
振荡(注意放气)
静置分层
分液
萃取步骤 【例】用CCl4从碘水中提取I2
三、有机化合物的分离、提纯
蒸馏
适用范围
有机物热稳定性较高, 与杂质的沸点相差较大
原理
利用沸点差异
蒸馏装置
(一般相差30℃以上)
1
2
3
注意二者的区别
蒸馏时用直形冷凝管
三、有机化合物的分离、提纯
蒸馏
三、有机化合物的分离、提纯
注意事项
a.加热时应垫石棉网
b.烧瓶中放少量沸石或碎瓷片(防止暴沸)
c.烧瓶中所盛放液体不能超过2/3
d.温度计水银球的部位(蒸馏烧瓶支管处)
e.进出水方向(下进上出)
f.用锥形瓶收集馏分
5
物质的性质与分离、提纯方法的选择
根据物质在不同溶剂中溶解度的差异,用萃取的方法把溶质从溶解度小的溶剂中转移到溶解度较大的溶剂中。
根据物质的溶解度差异,可选用结晶、过滤的方法将混合物分离。
根据物质的沸点差异,可选用蒸馏的方法将互溶性液体混合物分离。
根据混合物中各组分的性质不同,可采用加热、调节pH、
加适当的试剂等方法,使某种成分转化,再用物理方法分离而除去。
下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 目的 分离方法 原理
A 分离溶于水的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去苯甲酸固体中混杂的NaCl 重结晶 苯甲酸在水中的溶解度很小
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
D
为提纯下列物质(括号内为杂质),所用除杂试剂和分离方法都正确的是
A.乙酸乙酯(乙酸) 饱和Na2CO3溶液 过滤
B.苯(Br2) NaOH溶液 过滤
C.硝基苯(NO2) NaOH溶液 萃取
D.乙醇(H2O) 新制生石灰 蒸馏
D
为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
选项 不纯物 除杂试剂 分离方法
A CH4(C2H4) 酸性KMnO4溶液 洗气
B 溴苯(Br2) NaOH溶液 分液
C C2H5OH(H2O) 新制生石灰 重结晶
D 乙酸乙酯(乙酸) 饱和Na2CO3溶液 蒸馏
B
