3.2 课时1 苯的结构和性质 课件 (共28张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3
文档属性
| 名称 | 3.2 课时1 苯的结构和性质 课件 (共28张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 47.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-30 23:21:59 | ||
图片预览







文档简介
(共28张PPT)
专题3 石油化工的基础物质—烃
苯的结构和性质
1.苯的分子结构特点,特别是其独特的碳碳键,理解苯分子中不存在单双键交替结构的证据和原理。
2.苯的化学性质,包括取代反应(溴化、硝化)和加成反应的实验现象、反应条件、化学方程式书写及反应机理。
因为橙皮中含有丰富的芳香烃,用手挤压的话会喷出黄酮、柠檬酸和芳香烃。
芳香烃对橡胶(气球)的溶解度很强,这两种物质遇到一片就会发生激烈的化学反应,气球爆炸。
一、芳香烃及苯的结构
分子中含有苯环的碳氢化合物。
芳香烃
分子组成通式:CnH2n-6(n≥6)。
苯的同系物
苯分子中的氢原子被烷基取代后的产物。
分子中只含一个苯环,侧链是一个或多个烷基。
CH2
CH3
多环芳烃
a.多苯代脂肪烃:多个苯环通过脂肪烃基连在一起,如二苯甲烷
b.联苯(联多苯):苯环之间通过碳碳单键直接相连,如联苯
c.稠环芳烃:苯环间通过共用苯环的若干条环边而形成的,如蒽
苯的结构
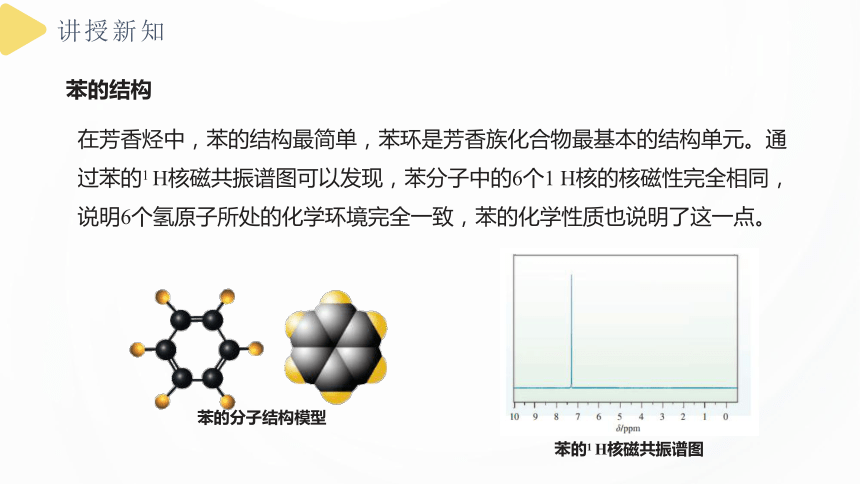
在芳香烃中,苯的结构最简单,苯环是芳香族化合物最基本的结构单元。通过苯的1 H核磁共振谱图可以发现,苯分子中的6个1 H核的核磁性完全相同,说明6个氢原子所处的化学环境完全一致,苯的化学性质也说明了这一点。
苯的分子结构模型
苯的1 H核磁共振谱图
资料
苯分子结构的确定经历了漫长的历史过程。苯最初是在1825年由英国科学家法拉第 对煤气生产过程中得到的一种油状液体进行蒸馏分离后发现 的。后来的化学家又确定了苯的相对分子质量为78,化学式为C6H6。实验研究发现,苯的一取代物只有一种,说明苯分子中的6个C和6个H是相同的。在此实验事实的基础上,1866年,德国化学家凯库勒提出了苯的环状结构,称为凯库勒式,如图所示。
苯的凯库勒式
德国化学家凯库勒
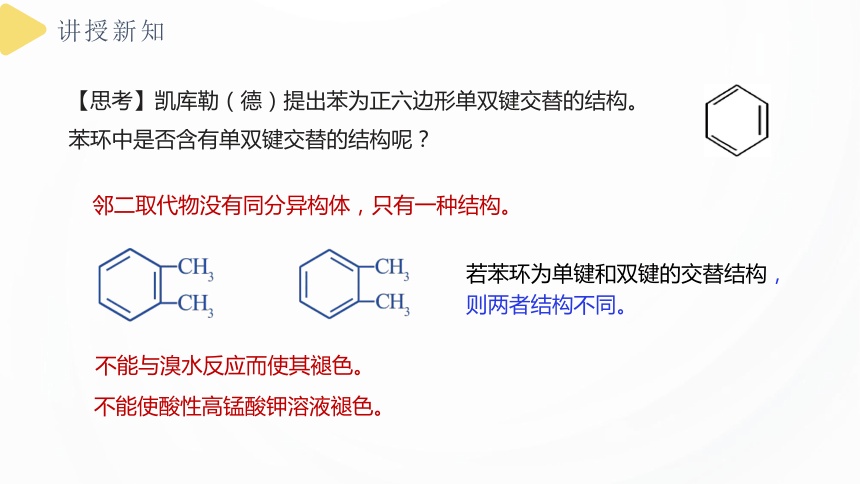
【思考】凯库勒(德)提出苯为正六边形单双键交替的结构。苯环中是否含有单双键交替的结构呢?
邻二取代物没有同分异构体,只有一种结构。
若苯环为单键和双键的交替结构,则两者结构不同。
不能使酸性高锰酸钾溶液褪色。
不能与溴水反应而使其褪色。
苯分子为平面六边形结构,所有的原子共平面,六个碳原子均以 sp2 杂化方式分别与两个碳原子形成碳碳σ键,与一个氢原子形成碳氢σ键。由于 sp2 杂化,所以键角都是120°。而垂直于苯环平面的 p 轨道以肩并肩的形式互相平行重叠,形成大π键,π电子离域分布于苯环两侧,电子云密度完全平均化,苯分子中每个碳碳键的键长相等,其数值介于碳碳单键与碳碳双键之间。
大π键
苯的结构
①苯环中不含碳碳双键,每个碳原子之间均为介于单双键间的特殊键-大π键。
②碳的杂化方式和键角分别为:
sp2杂化,120°
苯环为平面正六边形结构,六个碳碳相同,六个碳六个氢,12原子共平面
下列说法正确的是( )
A.苯分子中有碳氢单键,故能发生取代反应
B.可用苯萃取溴水中的Br2,分液时有机层从分液漏斗下端放出
C.苯分子中,存在碳碳双键能使酸性KMnO4溶液褪色
D.苯不能因反应使溴水褪色,说明苯分子中存在碳碳单键,不存在碳碳双键
A
物理性质
颜色
气味
毒性
水溶性
挥发性
熔点
沸点
密度
无色液体
有特殊气味
有毒
不溶于水
易挥发
80.1℃
5.5℃
0.88g/cm3
苯是一种重要的
化工原料和有机溶剂
对神经系统、造血系统有伤害,会导致白血病
苯的物理性质
二、苯的化学性质
1、氧化反应——可燃性
注意:苯不能被酸性高锰酸钾氧化!
苯可以燃烧氧化
火焰明亮并带有浓烈黑烟
2C6H6 + 15O2 12CO2+6H2O
点燃
二、苯的化学性质
2、苯的溴化
剧烈反应,出现沸腾现象,烧瓶中充满红棕色气体,导管口附近出现白雾,由溴化氢遇水蒸气所形成。反应完毕后,向锥形瓶内的液体里滴入硝酸银溶液,有浅黄色溴化银沉淀生成。所产生的溴苯是密度比水大的无色液体,实验中由于溶解了溴而显褐色。
溴
化
铁
实验现象
二、苯的化学性质
2、苯的溴化
Br2
FeBr3
Br
HBr ↑
断键位置:苯环上的碳氢键。
①Br2为液溴
②催化剂实质为Fe与Br2反应的产物FeBr3
③溴苯为密度大于水的油状液体
注意:
1.长导管的作用 ?
2.导管出口为何不插入到溶液中?
3.导管出口为何出现白雾?
4.锥形瓶中的溶液为何有浅黄色沉淀?
5.能否根据锥形瓶中产生浅黄色沉淀
证明苯与溴发生的一定是取代反应?
导气、冷凝回流
防止倒吸
HBr在空气中形成小液滴
生成了AgBr
不能,液溴易挥发
该实验装置有哪些优缺点?
改进后装置
溴苯的分离提纯
①过滤:除去未反应的铁屑;
②水洗后分液:洗去FeBr3和部分HBr;
③碱洗后分液:洗去HBr和未反应的Br2;
④水洗后分液:洗去NaBr、NaBrO和NaOH;
⑤干燥:加无水氯化钙吸水,再过滤;
⑥蒸馏:除去残留的苯
溴苯:无色液体,密度比水大,因溶有溴单质而显褐色。
二、苯的化学性质
3、苯的硝化
加热几分钟,反应完毕,将混合液倒入盛有水的烧杯中,在烧杯底部出现无色油状液体。
①硝基苯难溶于水,密度比水大,有苦杏仁味。
③水浴加热的原因:
a.使反应物受热均匀,便于控制温度。
b.防止温度过高,导致反应物挥发和硝酸分解。
②长导管作用:平衡气压,冷凝回流挥发的苯和硝酸。
④温度计的放置:温度计应放在水浴中,控制水浴温度。
实验现象
二、苯的化学性质
3、苯的硝化
硝基苯的分离提纯
①水洗后分液:洗去大部分硫酸和硝酸;
②碱洗(用NaOH溶液洗涤)后分液:洗去NO2和残留的酸;
③水洗后分液:洗去NaNO2、NaNO3和过量的NaOH;
④干燥:加无水MgSO4除去水分,并过滤;
⑤蒸馏:除去硝基苯中溶有的苯
硝基苯:无色、有苦杏仁味,密度比水大、难溶于水的油状液体,有毒,常因溶有NO2而显黄色。
加热温度为50~60℃,水浴加热,温度过高会发生副反应。
注意:
+2H2O
+2HNO3
间二硝基苯
二、苯的化学性质
4、加成反应
注意:苯不能与溴水加成!
苯易取代,难加成,原因在于苯分子结构稳定,加成反应需破坏苯环结构,取代反应不需要破坏苯环结构。
环己烷
1、苯环实际上不具有碳碳单键和碳碳双键的简单交替结构,可以作为证据的事实有
①苯的间位二取代物只有一种 ②苯的邻位二取代物只有一种
③苯分子中碳碳键的键长均相等 ④苯不能使酸性KMnO4溶液褪色
⑤苯在加热和催化剂存在条件下,与氢气发生加成反应
⑥苯在FeBr3存在的条件下,与液溴发生取代反应,但不能因化学变化而使溴水褪色
A.①②③④ B.②③④⑥ C.③④⑤⑥ D.全部
B
2、下列关于苯的叙述正确的是
A.反应①为取代反应,有机产物与水混合浮在上层
B.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C.反应③为取代反应,有机产物是一种烃
D.反应④中1mol苯最多与3mol H2发生加成反应,是因为苯分子中含有三个碳碳双键
B
3、在探索苯分子结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图所示),下列说法正确的是
A. 五种物质均能与氢气发生加成反应
B. b、c、e 的一氯代物均有三种
C. 五种物质中,只有 a 分子的所有原子处于同一平面
D. a、b、c、e 能使溴的四氯化碳溶液褪色
C
4、各类烃的性质比较
烃 溴单质 溴水 溴的CCl4溶液 酸性KMnO4溶液
烷烃
烯烃
炔烃
苯
与溴蒸气在光照条件下发生取代反应
不反应,液态烷烃与溴水可以发生萃取从而使溴水褪色
不反应,
互溶不褪色
不反应
加成
加成,褪色
加成,褪色
氧化,褪色
加成
加成,褪色
加成,褪色
氧化,褪色
一般不反应,催化条件下可取代
不反应,发生萃取而使溴水褪色
不反应,
互溶不褪色
不反应
专题3 石油化工的基础物质—烃
苯的结构和性质
1.苯的分子结构特点,特别是其独特的碳碳键,理解苯分子中不存在单双键交替结构的证据和原理。
2.苯的化学性质,包括取代反应(溴化、硝化)和加成反应的实验现象、反应条件、化学方程式书写及反应机理。
因为橙皮中含有丰富的芳香烃,用手挤压的话会喷出黄酮、柠檬酸和芳香烃。
芳香烃对橡胶(气球)的溶解度很强,这两种物质遇到一片就会发生激烈的化学反应,气球爆炸。
一、芳香烃及苯的结构
分子中含有苯环的碳氢化合物。
芳香烃
分子组成通式:CnH2n-6(n≥6)。
苯的同系物
苯分子中的氢原子被烷基取代后的产物。
分子中只含一个苯环,侧链是一个或多个烷基。
CH2
CH3
多环芳烃
a.多苯代脂肪烃:多个苯环通过脂肪烃基连在一起,如二苯甲烷
b.联苯(联多苯):苯环之间通过碳碳单键直接相连,如联苯
c.稠环芳烃:苯环间通过共用苯环的若干条环边而形成的,如蒽
苯的结构
在芳香烃中,苯的结构最简单,苯环是芳香族化合物最基本的结构单元。通过苯的1 H核磁共振谱图可以发现,苯分子中的6个1 H核的核磁性完全相同,说明6个氢原子所处的化学环境完全一致,苯的化学性质也说明了这一点。
苯的分子结构模型
苯的1 H核磁共振谱图
资料
苯分子结构的确定经历了漫长的历史过程。苯最初是在1825年由英国科学家法拉第 对煤气生产过程中得到的一种油状液体进行蒸馏分离后发现 的。后来的化学家又确定了苯的相对分子质量为78,化学式为C6H6。实验研究发现,苯的一取代物只有一种,说明苯分子中的6个C和6个H是相同的。在此实验事实的基础上,1866年,德国化学家凯库勒提出了苯的环状结构,称为凯库勒式,如图所示。
苯的凯库勒式
德国化学家凯库勒
【思考】凯库勒(德)提出苯为正六边形单双键交替的结构。苯环中是否含有单双键交替的结构呢?
邻二取代物没有同分异构体,只有一种结构。
若苯环为单键和双键的交替结构,则两者结构不同。
不能使酸性高锰酸钾溶液褪色。
不能与溴水反应而使其褪色。
苯分子为平面六边形结构,所有的原子共平面,六个碳原子均以 sp2 杂化方式分别与两个碳原子形成碳碳σ键,与一个氢原子形成碳氢σ键。由于 sp2 杂化,所以键角都是120°。而垂直于苯环平面的 p 轨道以肩并肩的形式互相平行重叠,形成大π键,π电子离域分布于苯环两侧,电子云密度完全平均化,苯分子中每个碳碳键的键长相等,其数值介于碳碳单键与碳碳双键之间。
大π键
苯的结构
①苯环中不含碳碳双键,每个碳原子之间均为介于单双键间的特殊键-大π键。
②碳的杂化方式和键角分别为:
sp2杂化,120°
苯环为平面正六边形结构,六个碳碳相同,六个碳六个氢,12原子共平面
下列说法正确的是( )
A.苯分子中有碳氢单键,故能发生取代反应
B.可用苯萃取溴水中的Br2,分液时有机层从分液漏斗下端放出
C.苯分子中,存在碳碳双键能使酸性KMnO4溶液褪色
D.苯不能因反应使溴水褪色,说明苯分子中存在碳碳单键,不存在碳碳双键
A
物理性质
颜色
气味
毒性
水溶性
挥发性
熔点
沸点
密度
无色液体
有特殊气味
有毒
不溶于水
易挥发
80.1℃
5.5℃
0.88g/cm3
苯是一种重要的
化工原料和有机溶剂
对神经系统、造血系统有伤害,会导致白血病
苯的物理性质
二、苯的化学性质
1、氧化反应——可燃性
注意:苯不能被酸性高锰酸钾氧化!
苯可以燃烧氧化
火焰明亮并带有浓烈黑烟
2C6H6 + 15O2 12CO2+6H2O
点燃
二、苯的化学性质
2、苯的溴化
剧烈反应,出现沸腾现象,烧瓶中充满红棕色气体,导管口附近出现白雾,由溴化氢遇水蒸气所形成。反应完毕后,向锥形瓶内的液体里滴入硝酸银溶液,有浅黄色溴化银沉淀生成。所产生的溴苯是密度比水大的无色液体,实验中由于溶解了溴而显褐色。
溴
化
铁
实验现象
二、苯的化学性质
2、苯的溴化
Br2
FeBr3
Br
HBr ↑
断键位置:苯环上的碳氢键。
①Br2为液溴
②催化剂实质为Fe与Br2反应的产物FeBr3
③溴苯为密度大于水的油状液体
注意:
1.长导管的作用 ?
2.导管出口为何不插入到溶液中?
3.导管出口为何出现白雾?
4.锥形瓶中的溶液为何有浅黄色沉淀?
5.能否根据锥形瓶中产生浅黄色沉淀
证明苯与溴发生的一定是取代反应?
导气、冷凝回流
防止倒吸
HBr在空气中形成小液滴
生成了AgBr
不能,液溴易挥发
该实验装置有哪些优缺点?
改进后装置
溴苯的分离提纯
①过滤:除去未反应的铁屑;
②水洗后分液:洗去FeBr3和部分HBr;
③碱洗后分液:洗去HBr和未反应的Br2;
④水洗后分液:洗去NaBr、NaBrO和NaOH;
⑤干燥:加无水氯化钙吸水,再过滤;
⑥蒸馏:除去残留的苯
溴苯:无色液体,密度比水大,因溶有溴单质而显褐色。
二、苯的化学性质
3、苯的硝化
加热几分钟,反应完毕,将混合液倒入盛有水的烧杯中,在烧杯底部出现无色油状液体。
①硝基苯难溶于水,密度比水大,有苦杏仁味。
③水浴加热的原因:
a.使反应物受热均匀,便于控制温度。
b.防止温度过高,导致反应物挥发和硝酸分解。
②长导管作用:平衡气压,冷凝回流挥发的苯和硝酸。
④温度计的放置:温度计应放在水浴中,控制水浴温度。
实验现象
二、苯的化学性质
3、苯的硝化
硝基苯的分离提纯
①水洗后分液:洗去大部分硫酸和硝酸;
②碱洗(用NaOH溶液洗涤)后分液:洗去NO2和残留的酸;
③水洗后分液:洗去NaNO2、NaNO3和过量的NaOH;
④干燥:加无水MgSO4除去水分,并过滤;
⑤蒸馏:除去硝基苯中溶有的苯
硝基苯:无色、有苦杏仁味,密度比水大、难溶于水的油状液体,有毒,常因溶有NO2而显黄色。
加热温度为50~60℃,水浴加热,温度过高会发生副反应。
注意:
+2H2O
+2HNO3
间二硝基苯
二、苯的化学性质
4、加成反应
注意:苯不能与溴水加成!
苯易取代,难加成,原因在于苯分子结构稳定,加成反应需破坏苯环结构,取代反应不需要破坏苯环结构。
环己烷
1、苯环实际上不具有碳碳单键和碳碳双键的简单交替结构,可以作为证据的事实有
①苯的间位二取代物只有一种 ②苯的邻位二取代物只有一种
③苯分子中碳碳键的键长均相等 ④苯不能使酸性KMnO4溶液褪色
⑤苯在加热和催化剂存在条件下,与氢气发生加成反应
⑥苯在FeBr3存在的条件下,与液溴发生取代反应,但不能因化学变化而使溴水褪色
A.①②③④ B.②③④⑥ C.③④⑤⑥ D.全部
B
2、下列关于苯的叙述正确的是
A.反应①为取代反应,有机产物与水混合浮在上层
B.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C.反应③为取代反应,有机产物是一种烃
D.反应④中1mol苯最多与3mol H2发生加成反应,是因为苯分子中含有三个碳碳双键
B
3、在探索苯分子结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图所示),下列说法正确的是
A. 五种物质均能与氢气发生加成反应
B. b、c、e 的一氯代物均有三种
C. 五种物质中,只有 a 分子的所有原子处于同一平面
D. a、b、c、e 能使溴的四氯化碳溶液褪色
C
4、各类烃的性质比较
烃 溴单质 溴水 溴的CCl4溶液 酸性KMnO4溶液
烷烃
烯烃
炔烃
苯
与溴蒸气在光照条件下发生取代反应
不反应,液态烷烃与溴水可以发生萃取从而使溴水褪色
不反应,
互溶不褪色
不反应
加成
加成,褪色
加成,褪色
氧化,褪色
加成
加成,褪色
加成,褪色
氧化,褪色
一般不反应,催化条件下可取代
不反应,发生萃取而使溴水褪色
不反应,
互溶不褪色
不反应
